乙酰普鲁兰纳米粒子BeWo b30细胞毒性及摄取研究
2016-09-09蒋子雯周志敏唐红波张其清代荫梅
蒋子雯 周志敏 唐红波 杜 博 张其清 代荫梅*
(1.首都医科大学附属北京妇产医院妇科, 北京 100026; 2.中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室,天津 300192)
· 更年期与妇科内分泌 ·
乙酰普鲁兰纳米粒子BeWo b30细胞毒性及摄取研究
蒋子雯1周志敏2唐红波1杜博2张其清2代荫梅1*
(1.首都医科大学附属北京妇产医院妇科, 北京 100026; 2.中国医学科学院北京协和医学院生物医学工程研究所,天津市生物医学材料重点实验室,天津 300192)
目的通过乙酰普鲁兰纳米粒子对人绒毛膜癌细胞(BeWo b30)的细胞毒性以及细胞摄取研究,为普鲁兰基纳米药物跨胎盘屏障机制及妊娠期用药提供科学依据。方法以透析法制备异硫氰酸荧光素标记的乙酰普鲁兰纳米粒子(fluorescein isothiocyanate labelled pullulan acetate nanoparticles, PA-FITC NPs),分别利用激光粒度分析仪、扫描电镜、透射电镜考察乙酰普鲁兰纳米粒子粒径、Zeta电位、形貌及结构;用细胞计数试剂盒-8(cell counting kit-8, CCK-8)检测细胞生长曲线,考察不同浓度纳米粒子(0.4~2.0 mg/mL)对BeWo b30细胞的细胞毒性;考察纳米粒子浓度、孵育时间、孵育温度对BeWo b30细胞摄取纳米粒子的影响。结果PA-FITC纳米粒子水合直径为(348.0114.3)nm,Zeta电位为(-26.05.1)mV,呈表面光滑、内部结构规整的球形。PA-FITC纳米粒子在0.4~2.0 mg/mL 浓度范围内细胞存活率为95.0%~100.5%,差异无统计学意义(P>0.05);BeWo b30细胞摄取实验表明:细胞吞噬纳米粒子的量随着PA-FITC NPs的浓度升高和孵育时间延长而增大;当孵育温度从37 ℃降低至4 ℃,PA-FITC NPs的细胞摄取量显著降低(P<0.05)。结论乙酰普鲁兰纳米粒子呈球形,对BeWo b30细胞无明显细胞毒性;BeWo b30细胞摄取PA-FITC 纳米粒子与纳米粒子浓度、孵育时间和孵育温度呈正相关。
普鲁兰; BeWo b30细胞; 纳米药物; 妊娠期用药
由于药物递送系统具有提高疗效、减小不良反应的优点,从而使载体合成及生物学评价成为生物医学研究热点之一[1-2]。普鲁兰(pullulan)是一种水溶性天然多糖,由于良好的生物相容性、易修饰性及肝靶向性在肝癌及妇科肿瘤靶向制剂研究中受到关注[3-5]。然而,由于妊娠期妇女处于特殊生理时期及胎儿易感性,普鲁兰基纳米粒子的孕期用药安全性、纳米药物宫内靶向递送还未见报道。因此,在课题组前期乙酰普鲁兰纳米粒子(pullulan acetate nanoparticles, PA-NPs)制备及抗肿瘤药物递送工作基础上[1,4],本课题组考察其对人绒毛膜癌细胞BeWo b30细胞毒性及细胞对纳米粒子的摄取行为,为妊娠期用药安全性及药物递送提供依据。
1 材料与方法
1.1仪器和材料
恒温磁力搅拌器(HPB220,江苏安丰公司);离心机(KA-1000, 芬兰Thermo公司);激光粒度分析仪(Nano-ZS,英国Malvern公司);扫描电子显微镜(SUPRA 55VP,德国Carl Zeiss公司); 透射电子显微镜(JEM100CXⅡ,日本电子株式会社);二氧化碳培养箱(日本三洋公司);单人双面净化工作台(SW-CJ-1F,苏州净化设备有限公司);倒置显微镜(Elipse Ti,日本Nikon公司);全波长扫描多功能酶标仪(Varioskan Flash3001,芬兰Thermo公司); Milli-Q纯水系统(美国Millipore公司)。
人绒毛膜癌细胞BeWo b30由德克萨斯大学 Erik Ritting 教授惠赠。DMEM-F12培养基、胎牛血清、胰蛋白酶、HBSS缓冲液、PBS缓冲液均购自Gibico公司(美国)。细胞计数试剂盒-8(cell counting kit-8, CCK-8)购自同仁研究所(日本)。
异硫氰酸荧光素标记的乙酰普鲁兰(fluorescein isothiocyanate labelled pullulan acetate, PA-FITC)由本课题组前期合成。二甲基亚砜购自江天化工(天津); 曲拉通、透析袋(截留相对分子质量8 000~14 000)购自索莱宝公司(北京);96孔底透黑板、96孔全黑酶标板购自Corning公司(美国);碳支持膜购自新兴百瑞技术有限公司(北京)。
1.2方法
1)PA-FITC纳米粒子的制备:精密称取10 mg PA-FITC放入2 mL二甲基亚砜/水溶液(9∶1)过夜溶解。将完全溶解的PA-FITC溶液加入透析袋中透析,透析液为Milli-Q超纯水。透析48 h,每2 h换液1次,全程避光。收集透析袋内液体,定容,4 ℃冰箱避光保存、待用。
2)PA-FITC纳米粒子表征:①粒径和Zeta电位测定:取制备的PA-FITC纳米粒子溶液20 μL,以适量超纯水分散后置于粒径样品池,使用粒径分析仪测量纳米粒子的粒径和Zeta电位。②纳米粒子电镜观察: 取制备的纳米粒子溶液20 μL,滴于表面洁净的硅片上,自然干燥后20 mA喷金4 min,扫描电镜下观察;滴注于碳支持膜表面,自然干燥后在透射电镜下观察。
3)细胞培养:人绒毛膜癌细胞BeWo b30使用含有10%(体积分数)胎牛血清和1%(质量分数)青链霉素的DMEM-F12培养基进行培养。细胞培养箱条件为37 ℃、5%(体积分数) CO2。3~4 d细胞生长至80%融合时对细胞进行传代。
4)BeWo b30细胞生长趋势及PA-FITC NPs细胞毒性实验:CCK-8试剂,配制为与培养基体积比为1∶10的检测体系。细胞处于指数生长期时胰蛋白酶消化,离心后重新分散为单细胞悬液并计数,以每孔1万个的密度接种于96孔板,并设置无细胞组进行对照。待接种24 h细胞完全贴壁后吸弃培养液,PBS洗3遍后加入110 μL CCK-8检测体系,每组设置6个复孔。培养箱孵育2 h后,吸取100 μL上清液转移至另一块96孔板,使用酶标仪震摇1 min混匀后450 nm波长处测量吸光度值,连续测量9 d,绘制细胞生长曲线。
以每孔1万个细胞密度将BeWo b30接种于96孔板,24 h贴壁后各组加入100 μL不同质量浓度的纳米粒子溶液(2.0、1.0、0.5、0.25、0.125、0.06、 0.03 mg/mL),并设置0 mg/mL培养基组作为空白对照。孵育48 h后弃上清,加入CCK-8检测体系,2 h后使用酶标仪在450 nm波长处测量吸光度值。
5)纳米粒子细胞摄取实验:取对数生长期BeWo b30细胞,EDTA/胰蛋白酶蛋白消化,调整细胞密度为每孔1万个接种于96孔底透黑板,隔日换液。细胞融合至80%即可进行摄取实验。
取生长至融合的BeWo b30细胞,弃去培养基后用预热的PBS缓冲液冲洗3次。每孔加入100 μL预热的HBSS缓冲液,37 ℃、5% (体积分数)CO2平衡细胞30 min。取出细胞,弃上清后加入HBSS缓冲液稀释的不同质量浓度(400、200、100、50、25 μg/mL)的PA-FITC纳米粒子100 μL,同时设置无细胞HBSS组和有细胞HBSS组作为空白对照,每组设置6个复孔。37 ℃孵育4 h后取出细胞,迅速弃上清,冰冷的PBS缓冲液清洗3次终止吞噬。4 h后裂解细胞,494 nm激发波长处测量荧光值。调整孵育温度为4 ℃,考察温度对纳米粒子摄取的影响。
在时间依赖性摄取研究中,取生长至融合状态的BeWo b30细胞,每孔加入400 μg/mL PA-FITC纳米粒子100 μL,分别孵育0、2、15 min、1、2、4、6 h。每个时间点设置6个复孔,并设置HBSS组作为对照。到达时间点后,迅速吸弃上清,冰冷的PBS洗3次终止吞噬。每孔加入细胞裂解液100 μL,避光4 ℃裂解过夜,裂解液混合均匀,利用酶标仪在494 nm激发波长处测量荧光值。
1.3 统计学方法

2 结果
2.1PA-FITCNPs制备及表征
如图1A所示,扫描电镜显示PA-FITC纳米粒子表面光滑,成均匀球形,粒径约为100 ~ 250 nm。图1A 透射电镜(transmission electron microscope, TEM)表明PA-FITC纳米粒子为实心结构。进一步动态光散射(dynamic light scattering, DLS)结果显示,纳米粒子平均水合直径为348 nm,与电镜检测结果比较,水合直径偏大(图1B)。同时,DLS粒径分布较宽,这与扫描电镜粒径分布不均一致。Zeta电位测定显示PA-FITC NPs电荷分布呈尖峰,带负电荷,为(-26±5.1)mV。
2.2细胞生长曲线及PA-FITC NPs细胞毒性
BeWo b30细胞接种于培养皿中进行体外培养,约24 h贴壁。细胞融合80%时在倒置显微镜下观察,细胞呈铺路石状紧密排列(图2A),细胞计数结果显示(图2B),在接种后第1天至第6天,细胞呈指数生长趋势,第7天细胞密度达到最大值。从第7天之后,细胞数呈现下降趋势,且倒置显微镜下观察细胞出现漂浮和细胞碎片,表明细胞生长进入衰退期。
当细胞贴壁后,取不同质量浓度(0.4~2.0 mg/mL)的PA-FITC NPs与细胞孵育4 h,将未作处理的BeWo b30细胞 (0 mg/mL组) CCK-8吸光度值设为100%,发现不同质量浓度纳米粒子组细胞存活率分别为95% ~ 100.48% (图3),与对照组相比差异无统计学意义(P>0.05)。
2.3乙酰普鲁兰纳米粒子细胞摄取实验
2.3.1时间依赖性摄取
如图4A所示,加入PA-FITC纳米粒子后,随时间延长,细胞对纳米粒子的摄取逐渐增加(P<0.05),其中2 min至15 min,PA-FITC NPs在细胞裂解液中的浓度由0.36 μg/mL上升至2.62 μg/mL,增幅呈最大趋势。15 min、1 h、4 h时间段内细胞仍持续摄取纳

图1 异硫氰酸荧光素标记的乙酰普鲁兰纳米粒子表征
A: BeWo b30 cells under optical microscope; B: size distribution of PA-FITC NPs by dynamic light scattering,dynamic light scattering, the mean diameter of PA-FITC NPs were 348 nm.

图2 BeWo b30细胞生长状态
A: light microscopic images of BeWo b30 grown on culture dish; B: cell growth curve of BeWo b30 (n=6).
米粒子,但升高趋势较2 min至15 min时间段平缓。4 h至6 h时间段细胞对PA-FITC NPs摄取速度较之前呈现升高趋势,纳米粒子在细胞裂解液中的质量浓度由5.22 μg/mL上升至7.66 μg/mL。
2.3.2浓度/温度依赖性摄取
如图4B所示,在不同孵育温度条件下,细胞对纳米粒子的摄取均随质量浓度升高而逐渐增大,但4 ℃组的增幅显著低于37 ℃组(P<0.05)。而且,纳米粒子质量浓度由200 μg/mL升至400 μg/mL时摄取量增幅最大,4 ℃组细胞裂解液中PA-FITC NPs质量浓度由2.70 μg/mL升高至6.27 μg/mL,37 ℃组由0.29 μg/mL升高至0.58 μg/mL。
3 讨论
与游离药物相比,纳米药物递送系统具有独特的优势,如减少给药次数、维持血药浓度、提高药物疗效、
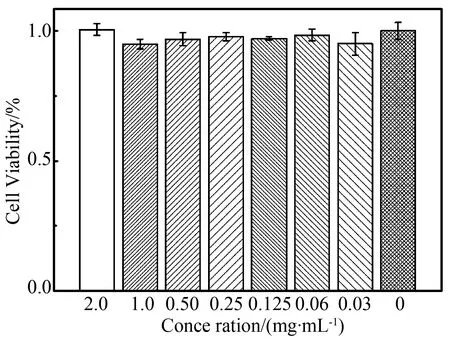
图3 暴露于0.4~2.0 mg/mL PA-FITC NPs 4 h后
Values represent average% of untreated control±SD. No significant cell viability difference were observed between control group and PA-FITC NPs group;n=6; PA-FITC NPs:fluorescein isothiocyanate labelled pullulan acetate nanoparticles.

图4 BeWo b30对PA-FITC NPs的摄取特征
A: cell uptake of PA-FITC NPs in BeWo b30 cells in ranging incubation time (n=6), * each time point data shows significantly difference with other incubation time points; B:dose-effect of PA-FITC NPs to cell uptake under 4 ℃ and 37 ℃ (n=6), * significantly different was observed at each concentration point in the same temperature; #significantly difference was observed beteween two temperature points in the same concentration; PA-FITC NPs:fluorescein isothiocyanate labelled pullulan acetate nanoparticles.
降低不良反应等。通过调控纳米粒子尺寸、形状、表面电荷、拓扑结构以及化学组分,纳米粒子作为药物载体可达到靶向组织或器官,优化药物释放速率,从而提高药效以及患者依从性[5]。普鲁兰是一种水溶性天然多糖,易于功能化改性修饰合成不同种类的两亲性聚合物,从而利用自组装原理制备出载药纳米粒子,并已用于宫颈癌和肝癌等肿瘤的靶向递送研究[5-6]。
本文参照课题组前期方法[4],将普鲁兰进行乙酰化疏水改性为乙酰普鲁兰,并偶联异硫氰酸荧光素合成PA-FITC以便于检测示踪。将PA-FITC完全溶解于二甲基亚砜中放入透析袋透析,在有机溶剂与水的缓慢交换下两亲性高分子自组装为表面光滑的球形纳米粒子,粒径分析仪测得粒径为348 nm,表面电荷为(-26.0±5.1)mV,说明其在中性条件下稳定不易聚集,结合课题组前期工作[4]分析,进一步表明该纳米粒子具有稳定性好,制备重现性好等优势。BeWo b30细胞系来源于人绒毛膜癌组织,表达与滋养层细胞类似的载体蛋白[7],有在多孔膜上形成紧密极化的单层细胞特性,并分泌人绒毛膜促性腺激素等胎盘特异性标志物,因此常用来模拟建立体外胎盘屏障,用于研究各种药物或纳米粒子的胎盘透过性,为妊娠期用药安全提供科学依据。本研究首先绘制了细胞生长曲线并在倒置显微镜下观察细胞生长状态,该细胞在培养4~7 d为快速生长期,具有聚集生长的特性,细胞铺满后呈铺路石状,与文献[8]报道一致。7 d后细胞进入衰退期,细胞内出现空泡,后出现成块浮起。细胞生长曲线结果以及观察生长状态有助于考察细胞在培养环境中的生长情况,对建立胎盘屏障模型中的细胞接种密度以及确立模型最佳使用时间具有指导意义。
纳米粒子在表现出巨大应用价值的同时,其生物安全性,尤其对妊娠期母体和胎儿的正负面影响亟待评估[9]。目前已经有研究[10-11]报道,纳米粒子可穿过大鼠胎盘并进入胎鼠肝、脾和脑,并造成胎鼠发育不良,普鲁兰基纳米粒子对母体或胎儿是否存在毒性和其他影响尚未有研究报道。本文进行的细胞毒性实验结果表明,PA-FITC纳米粒子0.4 ~ 2.0 mg/mL各组细胞存活率与空白组相比差异均无统计学意义(P>0.05),证明PA纳米粒子对滋养层细胞无毒性,体外安全性好,可能适合作为妇产科,尤其妊娠期靶向用药的药物载体。
摄取实验表明,BeWo b30细胞对纳米粒子的摄取具有明显的质量浓度依赖性,在实验浓度范围内细胞对PA的摄取随质量浓度升高而升高,在37 ℃组中纳米粒子的胞内质量浓度随给予质量浓度的升高由0.65 μg/mL 升至6.27 μg/mL,但在本文考察质量浓度范围内,细胞对PA-FITC NPs的摄取并未出现平台期,说明本文考察的质量浓度还未到达细胞吞噬的饱和质量浓度。在考察时间点内(0 min ~ 6 h)细胞对PA-FITC NPs的摄取随着作用时间延长呈现线性升高趋势。Kloet等[12]研究了BeWo b30细胞单层胎盘屏障模型对聚苯乙烯纳米粒子的摄取,Transwell小室下室纳米粒子浓度在0~ h时间段内与孵育时间呈正相关,与本文研究结果一致,在12 h后下室纳米粒子的浓度趋于稳定。Gitrowski等[13]研究了结肠癌细胞Caco-2对二氧化钛纳米粒子的摄取,发现细胞对纳米粒子的摄取在早期急剧升高,之后摄取速度逐渐变缓,24 h时摄取趋于稳定。说明本文所考察的时间点尚未达到BeWo b30细胞的摄取饱和时间点,在胎盘模型研究中,应适当延长考察时间。
通常认为纳米粒子进入细胞具有温度依赖性,常采用37 ℃和4 ℃作为温度依赖性摄取的研究温度[14]。当温度由37 ℃降至4 ℃时,细胞对PA-FITC纳米粒子的摄取显著减少(P<0.05),温度降低后,细胞为低活动状态,说明纳米粒子进入细胞的途径具有显著能量依赖性,而不是单纯的从高质量浓度到低质量浓度的扩散[15]。然而,PA-FITC纳米粒子被摄取后在细胞内的具体位置,以及被摄取的具体途径和机制等问题仍需要进一步探讨[16]。同时,PA-FITC NPs能否通过滋养层细胞,以及PA-FITC NPs通过胎盘屏障的特点需要在体外单层胎盘屏障模型或胎盘离体灌流模型中作进一步的评估。
总之,本研究以普鲁兰作为原料,制备了一种方法简单、安全性好、稳定性高的纳米药物载体,考察了乙酰普鲁兰纳米粒子对BeWo b30细胞的毒性及其在该细胞的摄取特征,为进一步评价普鲁兰基纳米粒子在妊娠期用药安全性和应用潜力提供了科学依据。
[1]Tang H, Feng X, Zhang T, et al. Stability, pharmacokinetics, biodistributionand safety assessment of folate-conjugated pullulan acetate nanoparticles as cervical cancer targeted drug carriers [J]. J Nanosci Nanotechnol, 2015,15(9):6405-6412.
[2] Zhou Z, Anselmo A C, Mitragotri S. Synthesis of protein-based, rod-shaped particles from spherical templates using layer-by-layer assembly [J]. Adv Mater,2013, 25(19):2723-2727.
[3] Singh R S, Kaur N, Kennedy J F. Pullulan and pullulan derivatives as promising biomolecules for drug and gene targeting [J]. Carbohydr Polym, 2015,123:190-207.
[4] Tang H B, Li L, Chen H. Stability and in vivo evaluation of pullulan acetate as a drug nanocarrier [J]. Drug Deliv, 2010,17(7):552-558.
[5] Wang Y, Chen H, Liu Y, et al. pH-sensitive pullulan-based nanoparticle carrier of methotrexate and combretastatin A4 for the combination therapy against hepatocellular carcinoma [J]. Biomaterials, 2013,34(29):7181-7190.
[6]Zhang C, An T, Wang D, et al. Stepwise pH-responsive nanoparticles containing charge-reversible pullulan-based shells and poly (β-amino ester)/poly(lactic-co-glycolic acid) cores as carriers of anticancer drugs for combination therapy on hepatocellular carcinoma [J]. J Control Release, 2016,226:193-204.
[7]Avery M L, Meek C E, Audus K L. The presence of inducible cytochrome P450 types 1A1 and 1A2 in the BeWo cell line [J]. Placenta, 2003,24(1):45-52.
[8]Bode C J, Jin H, Rytting E, et al. In vitro models for studying trophoblast transcellular transport [J]. Methods Mol Med, 2006,122:225-239.
[9]唐红波,周志敏,闫素英,等. 纳米递药系统胚胎毒性研究进展 [J]. 药物不良反应杂志, 2015,17(1):44-45.
[10]Fujitani T, Ohyama K, Hirose A, et al. Teratogenicity of multiwall carbon nanotube (MWCNT) in ICR mice [J]. J Toxicol Sci, 2012,37(1):81-89.
[11]Yamashita K, Yoshioka Y, Higashisaka K, et al. Silica and titanium dioxide nanoparticles cause pregnancy complications in mice [J]. Nat Nanotechnol, 2011,6(5):321-328.
[12]Kloet S K, Walczak A P, Louisse J, et al. Translocation of positively and negatively charged polystyrene nanoparticles in an in vitro placental model [J]. Toxicol In Vitro, 2015,29(7):1701-1710.
[13]Gitrowski C, Al-Jubory A R, Handy R D. Uptake of different crystal structures of TiO2 nanoparticles by Caco-2 intestinal cells [J]. Toxicol Lett, 2014,226(3):264-276.
[14]Benfer M, Kissel T. Cellular uptake mechanism and knockdown activity of siRNA-loaded biodegradable DEAPA-PVA-g-PLGA nanoparticles [J]. Eur J Pharm Biopharm, 2012,80(2):247-256.
[15]黄乾鹏,朱立新,许小亮,等. 免疫金纳米笼子介导热疗诱导人乳腺癌细胞凋亡研究[J]. 中华肿瘤防治杂志,2014,21(15):1129-1133.
[16]郏亚静,陈红丽,唐红波,等. 普鲁兰基肿瘤靶向纳米粒的体外抑瘤效应和细胞摄取途径研究 [J]. 医学研究生学报, 2015(2):127-130.
编辑孙超渊
Cell toxicity and cell uptake study of pullulan acetate nanoparticles to BeWo b30 cells
Jiang Ziwen1, Zhou Zhimin2, Tang Hongbo1, Du bo2, Zhang Qiqing2, Dai Yinmei1*
(1.DepartmentofGynecology,BeijingObstetricsandGynecologyHospital,CapitalMedicalUniversity,Beijing100026,China; 2.TianjinKeyLaboratoryofBiomedicalMaterials,InstituteofBiomedicalEngineering,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Tianjin300192,China)
ObjectiveTo provide evidence for application in obstetrics field of drugs during pregnancy and the mechanism of pullulan-base nanoparticles across the placental barrier by investigating the cell uptake of pullulan acetate nanoparticles and the cell toxicity of pullulan acetate nanoparticles to BeWo b30 cells. MethodsThe fluorescein isothiocyanate labelled pullulan acetate nanoparticles (PA-FITC NPs) were prepared by using dialysis method. The methods to investigate the characteristics involved particle size and distribution, zeta potential and morphology of nanoparticles using dynamic light scattering (DLS) and transmission electron microscopy. The growth curve of BeWo b30 and the cell toxicity of different concentration of PA-FITC NPs were studied by cell counting kit-8. The influence of different NPs concentration, incubation time and incubation temperature on cell up-taking were observed in this study.ResultsThe prepared pullulan acetate nanoparticles are solid and spherical in shape. The mean diameter of PA-FITC NPs by DLS were (348.0±114.3)nm and the Zeta potential was (-26.0±5.1)mV. Cell viability in all concentration groups have no significant difference compared with the control group (P>0.05); higher PA-FITC NPs concentration and longer incubation time showed an increased cell uptake; cell uptake was decreased significantly after the temperature was reduced to 4℃. ConclusionThe results demonstrated that there was no obvious toxic effect of pullulan acetate nanoparticles on BeWo b30 cells; There is a positive correlation between cell uptake and the concentration, incubation time and environment temperature of PA-FITC NPs.
pullulan; BeWo b30; nanomedicine; drug delivery in pregnancy
国家自然科学基金(81301322),天津市应用基础与前沿技术研究计划(15JCQNJC14400)。 This study was supported by National Natural Science Foundation of China (81301322), Tianjin Research Program of Application Foundation and Advanced Technology(15JCQNJC14400).
10.3969/j.issn.1006-7795.2016.04.002]
R 318
2016-06-15)
*Corresponding author, E-mail:fcyydym@163.com
网络出版时间:2016-07-2021∶18网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160714.2118.050.html
