黄连多糖提取工艺的优化及其体外抗氧化作用
2016-09-06王星云邱丽敏长春中医药大学吉林长春307吉林省前卫医院吉林长春300
姜 爽, 李 璐, 王星云, 邱丽敏, 包 杨*(.长春中医药大学,吉林长春307;.吉林省前卫医院,吉林长春300)
黄连多糖提取工艺的优化及其体外抗氧化作用
姜 爽1, 李 璐1, 王星云1, 邱丽敏2, 包 杨1*
(1.长春中医药大学,吉林长春130117;2.吉林省前卫医院,吉林长春130021)
目的 探讨黄连多糖的最佳提取工艺及其体外抗氧化作用。方法 单因素试验考察不同提取及样品处理方法对黄连多糖得率的影响,正交试验确定最佳提取条件,测定其对超氧阴离子自由基、羟自由基和DPPH自由基的清除作用。结果 最佳提取工艺为粉碎过40目筛,回流提取,料液比、提取温度、时间及次数分别为1∶10、100℃、45 min和3次,平均得率为1.52%。同时,黄连多糖对超氧阴离子自由基、羟自由基和DPPH自由基均有一定的清除作用。结论 该方法操作简便,条件温和,适合推广。
黄连多糖;提取工艺;体外抗氧化作用;单因素试验;正交试验;超氧阴离子自由基;羟自由基;DPPH自由基
黄连Coptis chinensis应用历史悠久,为传统中药材,药理作用广泛,涉及抗癌、抗炎、抗糖尿病等[1-3],而黄连多糖为其活性成分之一,主要具有抑制内皮细胞增殖、抗菌和抗糖尿病等活性[4-6]。本课题组前期证实,其具有降低糖尿病模型小鼠的血糖水平以及改善血脂代谢紊乱的作用[7],还发现其降糖机制与提高模型小鼠抗氧化物酶活性、降低脂质过氧化物含有量等密切相关[8]。为了更好地开发和利用黄连多糖,本实验对该成分提取工艺进行优化,同时对其体外抗氧化作用也做了进一步探讨。
1 材料与方法
1.1实验材料 黄连药材购自本地市场,经北华大学生药教研室鉴定为毛茛科植物黄连Coptis chinensis Franch的根茎。D-半乳糖醛酸和D-葡萄糖购自中国食品药品检定研究院;DPPH购自美国Sigma公司。所用试剂均为国产分析纯。2550紫外-可见分光光度计 (日本岛津国际贸易上海有限公司);药材粉碎机 (济南天方机械有限公司);真空干燥箱 (南京帕源机械设备有限公司);恒温水浴箱 (北京医用设备厂)。
1.2实验方法
1.2.1多糖含有量标准曲线 用76%稀硫酸溶解50.00 mg蒽酮,并定容至50mL量瓶中备用。称取干燥至恒重的葡萄糖25.00 mg,加蒸馏水定容至25 mL,配成1 mg/mL标准溶液备用。精密吸取葡萄糖标准液0.5、1.0、1.5、2.0、2.5、3.0 mL,蒸馏水定容至25 mL,分别吸取1 mL,加5mL蒽酮试液,迅速放入冰水浴中摇匀,再置于水浴中煮沸10min,冷却,于624 nm波长处测定吸光度,蒸馏水作为空白对照。以吸光度为纵坐标 (y)、葡萄糖质量浓度为横坐标(x)回归,得回归方程y=0.004 7x+0.032 5(r=0.999 1),线性范围20~120μg/mL。
1.2.2多糖得率测定 按照 “1.2.1”项下方法测定吸光度,根据下述公式计算多糖得率。
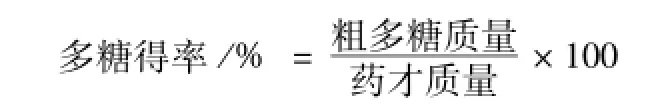
1.2.3不同提取方法比较 取黄连药材5.0 g,置于250 mL圆底烧瓶中,然后加入50 mL蒸馏水,分别采用超声提取法 (1 h)、回流提取法 (1 h)和冷浸提取法 (室温下浸泡过夜)提取。将所得滤液转移至100 mL量瓶中,加水至刻度,测定多糖含有量和得率。
1.2.4不同样品处理方法比较 采用回流提取法,以蒸馏水为提取溶剂,考察药材不同粒度 (过100目筛、40目筛和未粉碎)对多糖提取率的影响。称取样品各5.0 g,加入50 mL蒸馏水,回流取1 h,滤液转移至100 mL量瓶中,加水至刻度,测定多糖含有量和得率。
1.2.5正交试验 取干燥至恒重的黄连药材适量,粉碎后过40目筛,称取5.0 g,置于250 mL圆底烧瓶中,加50mL蒸馏水。按照表1条件分别进行提取,滤液转移至100mL量瓶中,加水至刻度,测定多糖含有量和得率。
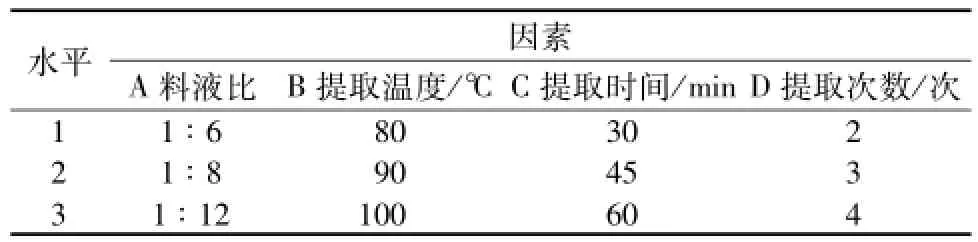
表1 因素水平
1.2.6 优化工艺的验证 按正交试验所得工艺条件提取3次,计算平均得率,考察其可靠性。
1.2.7黄连多糖对超氧阴离子自由基清除作用的测定 吸取不同质量浓度的黄连多糖样品液1 mL,依次加入四唑氮蓝(0.078 mo1/L)和还原型辅酶Ⅰ(0.468 mo1/L)各1 mL,最后加入吩嗪硫酸甲酯(0.06 mo1/L)0.4 mL,反应后室温下静置5m in,在560 nm波长处测定吸光度 (A),蒸馏水取代样品液作为阴性对照,计算清除率,公式为清除率=(1-A样品/A阴性对照)×100%
1.2.8黄连多糖对羟自由基清除作用的测定 吸取不同质量浓度的黄连多糖样品液1 mL,依次加入pH值为7.4的磷酸盐缓冲液(含0.1 mmo1/L FeC13和0.1 mmo1/L EDTA)1.5 mL和20 mmo1/L H2O20.35 mL,37℃下放置40 min后终止反应,在532 nm波长处测定吸光度,蒸馏水取代样品液作为阴性对照,计算清除率,公式同“1.2.7”项。
1.2.9黄连多糖对DPPH自由基清除作用的测定 吸取不同质量浓度的黄连多糖样品液1m L,加入0.004%DPPH甲醇溶液3 mL,反应完全后避光静置20min,517 nm波长处测定吸光度值 (A),阴性对照用蒸馏水替代样品溶液,计算清除率,公式同 “1.2.7”项。
2 实验结果
2.1不同提取及样品处理方法 (表2) 由表可知,回流提取法的多糖得率高于超声及冷浸,故本实验采用回流提取法;粉碎过40目筛后的多糖得率高于粉碎过100目筛和未粉碎,故本实验选取过40目筛粉碎黄连后再进行提取。
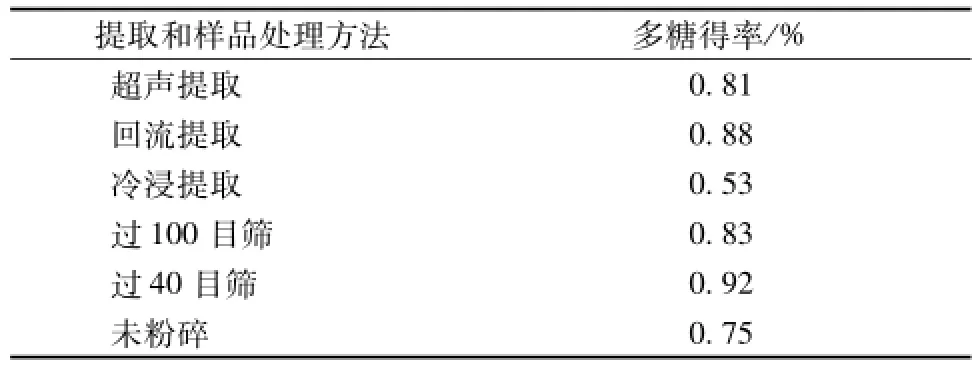
表2 不同提取及样品处理方法的比较
2.2正交试验结果 (表3) 由表可知,最佳提取条件为A2B3C2D3,即料液比1∶10,提取温度100℃,提取时间45min,提取次数3次。
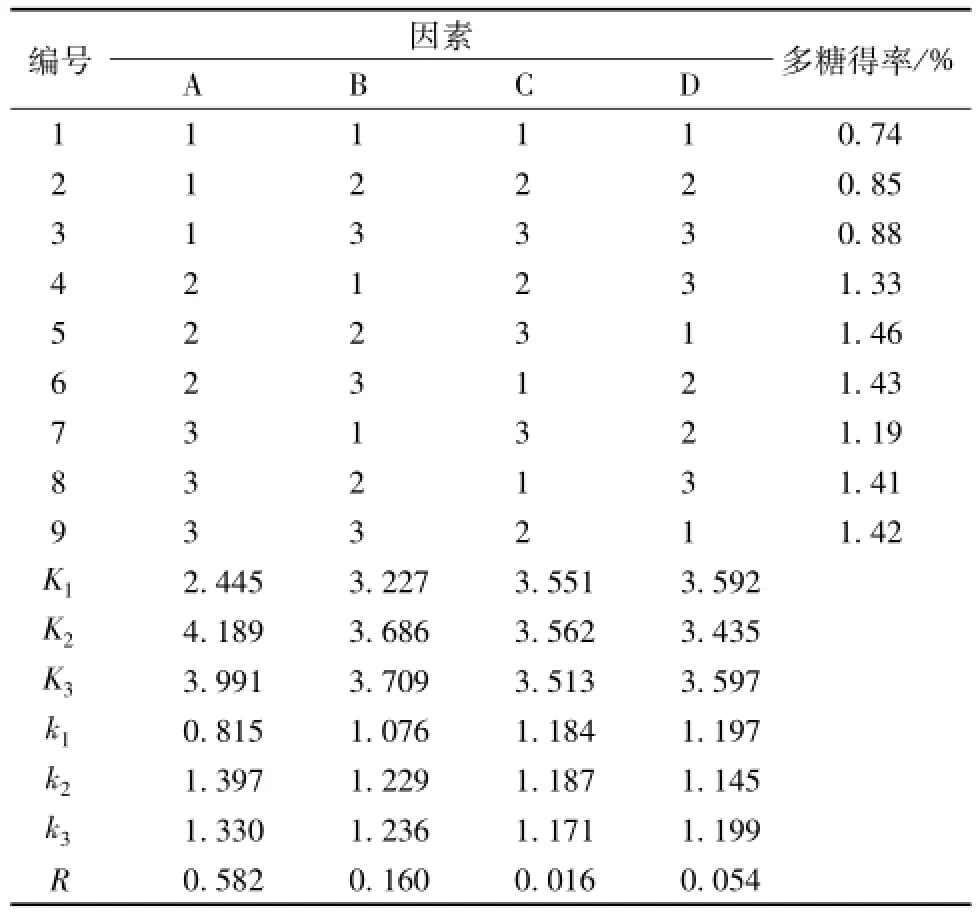
表3 正交试验结果
2.3验证实验 按最佳提取条件平行验证3次,测得黄连多糖的平均得率为1.52% (3次得率分别为1.55%、1.50%和1.52%),高于正交试验各组,表明该工艺重复性较好。
2.4黄连多糖对超氧阴离子自由基清除作用的测定 (图1) 由图可知,随着黄连多糖质量浓度的不断增加,对超氧阴离子自由基的清除率逐步上升,呈现明显的剂量依赖关系。
2.5黄连多糖对羟自由基清除作用的测定 (图2) 由图可知,黄连多糖对羟自由基的清除效果也具有剂量依赖关系,但弱于相同质量浓度的维生素C。
2.6黄连多糖对DPPH自由基清除作用的测定(图3)由图可知,随着黄连多糖质量浓度的不断增加,对DPPH自由基的清除率逐步上升,其清除作用接近同质量浓度的维生素E。
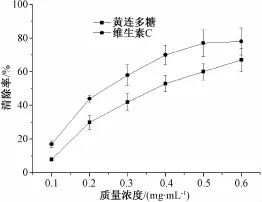
图1 黄连多糖对超氧阴离子自由基的清除作用
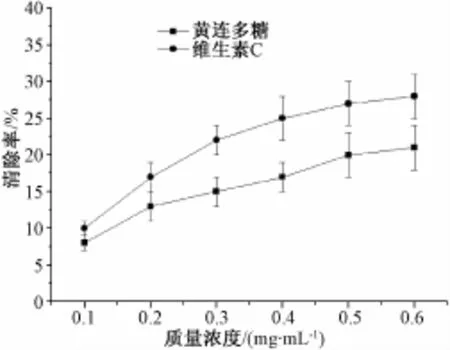
图2 黄连多糖对羟自由基的清除作用
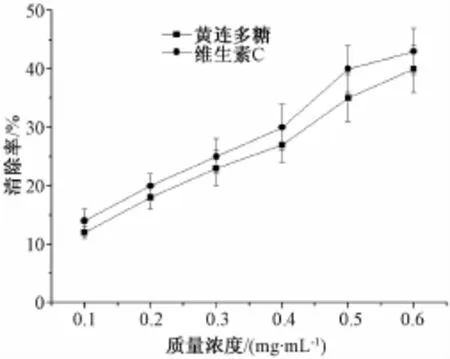
图3 黄连多糖对DPPH自由基的清除作用
3 讨论
多糖为天然大分子物质,是单糖通过糖苷键连接而成的聚合物,由于组成多糖的元素主要为碳和氧,所以多糖又称为 “碳水化合物”,其抗氧化作用被广泛报道[9-11]。本实验通过评价黄连多糖对超氧阴离子自由基、羟自由基和DPPH自由基的清除作用,初步探讨黄连多糖其体外抗氧化作用。超氧阴离子自由基可以作为多种活性氧的前体,虽然其本身氧化性较弱,但它在一定条件下会分解成氧化性很强的单线态氧自由基或羟自由基,均能使DNA单股链断裂,最终造成机体的氧化损伤[12-13]。羟自由基作为体内最活跃的活性氧,可引发多种疾病,故对其的检测也是体外抗氧化活性的重要指标之一[14]。DPPH自由基在517 nm波长处有强吸收峰,它是以氮原子为中心的较稳定的自由基,抗氧化剂可以和其孤对电子配对结合,使其在517 nm波长处的吸收减弱,通过判定其程度的可以评价抗氧化活性[15]。本实验显示,黄连多糖对超氧阴离子自由基、羟自由基和DPPH自由基均有一定清除作用,表明该成分具有体外抗氧化作用。
综上所述,本实验建立了黄连多糖的最佳提取工艺,同时证实了其具有体外抗氧化作用,可为将来更好开发和利用该成分奠定相关的工作基础。
[1]Ning N,He K,Wang Y,etal.Hypo1ipidemic effect andmechanism of pa1matine from Coptis chinensis in hamsters fed high-fat diet[J].Phytother Res,2015,29(5):668-673.
[2]PRIETO JM,Recio M C,Giner R M,et al.Inf1uence of traditiona1Chinese anti-inf1ammatory medicina1 p1ants on 1eukocyte and p1ate1et functions[J].JPharm Pharmacol,2003,55(9):1257-1282.
[3]Yuan L J,Tu DW,Ye X L,et al.Hypog1ycemic and hypocho1estero1emic effects of Coptis chinensis Franch inf1orescence[J].Plant Foods Hum Nutr,2006,61(3):139-144.
[4]吴玉娟,王懿萍,姜延伟,等.黄连多糖含量测定及抗氧化活性研究[J].时珍国医国药,2008,19(8):1906-1908.
[5]姜延伟,王懿萍,吴玉娟,等.黄连多糖抑菌活性初探[J].时珍国医国药,2009,20(1):48-49.
[6]尹登科,杨 晔,陈 松,等.黄连多糖对AGEs诱导内皮细胞增殖及其受体表达的作用研究[J].药物生物技术,2012,19(6):476-479.
[7]姜 爽.黄连多糖的提取、分离及抗大鼠2型糖尿病作用的实验研究[D].长春:吉林大学,2013.
[8]Shuang J,Wang Y,Ren D,et al.Antidiabetic mechanism of Coptis chinensis po1ysaccharide through its antioxidant property invo1ving the JNK pathway[J].Pharm Biol,2015,53(7):1022-1029.
[9]丛媛媛,热娜卡斯木,帕丽达,等.新疆胀果甘草多糖的提取及其体外抗氧化活性[J].中药材,2009,32(9):1435-1438.
[10]甄 攀,王治宝,张万明,等.吴茱萸多糖的提取及其抗氧化作用研究[J].中成药,2005,27(4):491-492.
[11]何念武,杨兴斌,田灵敏,等.黄瓜多糖的体外抗氧化活性[J].食品科学,2011,32(19):70-74.
[12]Tao H,Zhou J,Wu T,etal.High-throughputsuperoxide anion radica1 scavenging capacity assay[J].J Agric Food Chem,2014,62(38):9266-9272.
[13]代 斌,杨建雄,张尊听,等.HAMP的体外抗氧化活性研究[J].陕西师范大学学报:自然科学版,2009,37(3):81-84.
[14]李小定,荣建华,吴谋成.灰树花多糖PGF-1体外对羟基自由基的抑制作用[J].食品科学,2003,24(7):120-130.
[15]Waqas M K,Saqib N U,Rashid SU,et al.Screening of various botanica1 extracts for antioxidant activity using DPPH free radica1method[J].Afr JTradit Complement Altern Med,2013,10(6):452-455.
R284.2
B
1001-1528(2016)06-1405-03
10.3969/j.issn.1001-1528.2016.06.044
2015-10-16
吉林省卫生厅青年科研课题 (2013Q13);吉林省中医药管理局中医药科技项目 (2014-ZC14)
姜 爽 (1982—),男,博士,讲师,从事天然活性产物提取及抗糖尿病作用研究。Te1:18604498616,E-mai1:jiangshuang _2000@163.com
包 杨,女,硕士,副主治医师,从事糖尿病的诊断与治疗工作。Te1:13943188320,E-mai1:17800509@qq.com
