生血宁片对环磷酰胺致贫血小鼠的作用及机制
2016-09-06黄飞鸿朱林杰李迪迪瞿礼萍邹文俊吴建明成都中医药大学药学院四川成都66000西南医科大学药学院四川泸州646000
黄飞鸿, 朱林杰, 李迪迪, 于 娅, 瞿礼萍, 邹文俊*, 吴建明(.成都中医药大学药学院,四川成都66000;2.西南医科大学药学院,四川泸州646000)
[药 理]
生血宁片对环磷酰胺致贫血小鼠的作用及机制
黄飞鸿1, 朱林杰1, 李迪迪1, 于 娅1, 瞿礼萍1, 邹文俊1*, 吴建明2*
(1.成都中医药大学药学院,四川成都616000;2.西南医科大学药学院,四川泸州646000)
目的 考察生血宁片 (铁叶绿酸钠和叶绿素衍生物)对环磷酰胺致骨髓抑制性贫血小鼠的作用及其分子机制。方法 体外实验培养正常小鼠及腹腔注射环磷酰胺小鼠的骨髓有核细胞 (BMC),不同剂量的生血宁片处理这些BMC,采用ATP生物发光法测定生血宁片对其BMC增殖。体内实验,采用腹腔注射环磷酰胺复制贫血模型,以低、中、高剂量的生血宁片进行治疗,给药后第7、10、13天测定外周血白细胞 (WBC)、红细胞 (RBC)、血红蛋白(HGB)、红细胞压积 (HCT)水平,第10天收集小鼠骨髓细胞,检测其白介素 (Il3)、粒细胞-巨噬细胞集落刺激因子(Gm-csf)、干细胞因子(Scf)mRNA表达水平。结果 体外实验显示,生血宁片显著提高两类BMC的增殖率(P<0.05,P<0.01);体内实验显示,生血宁片500、353 mg/kg组可显著升高小鼠外周血WBC、RBC、HGB、HCT水平(P<0.05,P<0.01),生血宁片500、353、250 mg/kg组可显著升高骨髓细胞Il3、Scf mRNA表达水平(P<0.05,P<0.01)。结论 生血宁片促进Scf和Il3 mRNA的表达,从而缓解环磷酰胺引起的骨髓抑制。
生血宁片;骨髓抑制;环磷酰胺;贫血;mRNA表达;IL-3;SCF
生血宁片是以铁叶绿酸钠和叶绿素衍生物为主要活性成分,用于治疗缺铁性贫血的五类中药新药。据临床报道,本品联用重组人促红细胞生成素(rhEPO)治疗肿瘤相关贫血可获得良好的治疗效果[1-2]。现有药理学研究表明生血宁片具有促进正常小鼠、失血性贫血大鼠、溶血性贫血小鼠骨髓造血的作用[3-4],但未见其对骨髓抑制状态下造血功能影响的报道。而放化疗导致的骨髓抑制是肿瘤患者发生贫血的主要因素,生血宁片在临床有着广泛应用,由此本研究为明确单用生血宁片在肿瘤相关贫血的治疗价值,拟采用化疗药物环磷酰胺建立骨髓抑制性贫血模型,观察生血宁片对骨髓抑制性贫血的治疗作用,并从造血干细胞相关生长因子:白介素-3(Il3)、干细胞因子 (Scf)、及粒细胞-巨噬细胞集落刺激因子(Gm-csf)mRNA表达水平初步探讨其分子机制,旨在为生血宁片的合理用药提供一定科学依据与实验支撑。
1 材料
1.1动物 KM小鼠,SPF级,体质量(18~22 g),6~8周龄,雌雄各半,由成都达硕实验动物有限公司提供,生产许可证号:SCXK(川)2013-24。
1.2药品 生血宁片及生血宁片原料药 (铁叶绿酸钠及叶绿素衍生物,武汉联合药业有限责任公司,批号 20150305);重组人促红素-β注射液(rhEPO,上海罗氏制药有限公司分装,批号H0791/01);环磷酰胺 (江苏盛迪医药有限公司,批号15071125)。
1.3仪器与试剂 多功能酶标仪(美国Mo1ecu1ar Devices公司,型号SpectraMax M3);荧光定量PCR仪(美国MJ Research公司,型号CFD-3220 Option 2);血细胞分析仪 (迈瑞南京生物技术有限公司,型号BC-2900);血细胞分析仪稀释液(迈瑞南京生物技术有限公司,批号2015073004);血细胞分析仪溶血剂 (迈瑞南京生物技术有限公司,批号2015063008);Fico11Paque Premium单核细胞分离液(美国GE hea1thcare公司,批号10055781);RPMI 1640培养基 (美国Gibco公司,批号8115384);Ce11Titer-G1oTM试剂盒(美国Promega公司,批号0000153673);逆转录及qPCR试剂盒均购买于北京全式金生物技术有限公司;Il3、Scf、Gm-csf、Gapdh引物均自行设计,于Invitrogen(美国)英潍捷基上海贸易公司合成。
2 方法
2.1生血宁片对正常小鼠骨髓有核细胞增殖的影响 参考文献方法[5],取KM种小鼠10只,雌雄各半,脱颈椎处死,分离双侧股骨,剪去股骨一端,另一端插入1 mL注射器针头,用无菌1640培养基冲洗骨髓至股骨发白,将收集的骨髓悬液转至离心管,待其自然沉降后取上清,将细胞悬液定容至4 mL,轻轻沿离心管壁加入3 mL单核细胞分离液,400×g离心30 min,收集交界面乳白色层骨髓有核细胞 (BMC)细胞,无血清1640培养基洗涤3次,然后加入1640培养基 (含双抗、10% FBS、10%马血清)重悬,即得小鼠BMC悬液,计数并按4×105/孔接种于96孔板中,培养体系为180μL;使用DMSO溶解生血宁片原料药 (由武汉联合药业有限责任公司提供)至1 g/L,临用前用1640培养基稀释,每孔加入生血宁片原料药20μL,起始质量浓度100μg/m L,3倍连续稀释至1.23μg/mL;对照组加入20μL培养基,每组设置3个平行对照孔。常规培养5 d,采用ATP生物发光法测定小鼠BMC增殖[6],按Ce11Titer-G1oTM试剂盒使用说明操作,使用M3多功能酶标仪检测荧光信号,采用相对发光单位 (RLU)表示,通过RLU即可计算细胞增殖率,增殖率=(RLU生血宁片组-RLU对照组)/RLU对照组×100%。
2.2生血宁片对环磷酰胺致骨髓抑制小鼠BMC增殖的影响 取20只KM小鼠,雌雄各半,腹腔注射100 mg/kg环磷酰胺,连续3 d[7],为环磷酰胺处理组;另取6只小鼠腹腔注射等体积生理盐水,为对照组,于第5天脱颈椎处死,按 “2.1”项方法分离与培养两种小鼠BMC,按4×105/孔接种于96孔板中,培养体系为180μL。环磷酰胺处理组小鼠BMC加入20μL生血宁片原料药(按“2.1”项方法配制),根据 “2.1”项测定结果调整初始质量浓度为 60μg/mL,2倍连续稀释至3.75μg/mL;加入20μL培养基设为环磷酰胺处理组;对照组小鼠BMC,加入20μL培养基设为对照组,每组设置3个平行对照孔,常规培养11 d,使用ATP生物发光法测定第3、5、7、9、11天的BMC增殖。
2.3生血宁片对环磷酰胺致骨髓抑制性贫血小鼠的影响
2.3.1分组与给药 小鼠适应性饲养5 d后,取84只SPF级KM小鼠,雌雄各半,按体质量随机分为6组:对照组,模型组,rhEPO组,生血宁片500、353、250 mg/kg剂量组,分别相当于临床给药等效剂量的2、1.4、1倍,每组14只 (每组预留2只,于给药后10 d收集骨髓)。rhEPO组颈部皮下注射rhEPO 1 000 IU/kg,每2 d给药1次,其余组每天灌胃给药1次,连续给药13 d。
2.3.2造模与指标检测 给药第0、2天,除对照组外其余小鼠腹腔注射环磷酰胺100 mg/kg,给药第6、9、12天,腹腔注射环磷酰胺50 mg/kg,给药容量为10 mL/kg;空白组注射等体积生理盐水。分别于给药后第7、10、13天,小鼠眼底静脉丛取血20μL,使用血细胞分析仪检测各组小鼠外周血白细胞 (WBC)、红细胞 (RBC)、血红蛋白(HGB)、红细胞压积 (HCT)等指标。第13天给药1 h后,脱颈椎处死小鼠,取右侧股骨,无菌1640培养基冲洗骨髓至股骨发白,移液器轻轻吹打,形成单个骨髓细胞悬液,定容至1 mL,使用血细胞计数板计数。
2.3.3qPCR测定骨髓细胞中Il3、Scf、Gm-csf mRNA的表达 给药后第10天,根据 “2.3.2”项方法收集骨髓细胞,Trizo1法常规提取总RNA,使用TransScript逆转录试剂盒将总RNA逆转录成cDNA,以Gapdh为内参,进行qPCR检测。Il3引物:正向引物为5′-GCTCCCAGAACCTGAACT-3′,反向引物为5′-TCATTCGCAGATGTAGGC-3′,产物片段180 bp。Scf引物:正向引物为5′-CGGGAATCCTGTGACTGA-3′,反向引物为5′-CTCGGGACCTAATGTTGA-3′,产物片段430 bp。Gm-csf引物:正向引物为5′-TCCTGGGCATTGTGGTCT-3′,反向引物为5′-CCTGGGCTTCCTCATTTT-3′,产物片段415 bp。反应条件均为:55℃,30 min(逆转录);95℃、10 min,95℃,15 s,60℃、1 min(扩增),40个循环,72℃,5 min最后延伸。以2-ΔΔCt表示实验结果,计为与对照组进行比较后的相对值,对照组设为1。
3 结果
3.1生血宁片对正常小鼠BMC增殖的影响 与对照组相比,生血宁片原料药33.3、11.1、3.7、1.23μg/mL对小鼠BMC的增殖率分别为32.01%、41.48%、26.50%、21.85%,相对发光单位值显著高于对照组 (P<0.05,P<0.01),表明生血宁片原料药具有促进正常小鼠BMC增殖的作用。而生血宁片原料药100μg/mL组对正常小鼠BMC表现出抑制作用,提示生血宁片质量浓度太高可引起一定的增殖抑制作用。结果见表1。
表1 生血宁片对正常小鼠BMC增殖的影响(±s,n=3)Tab.1 Effects of Shengxuening Tablets on the proliferation of BMC in normalm ice(±s,n=3)
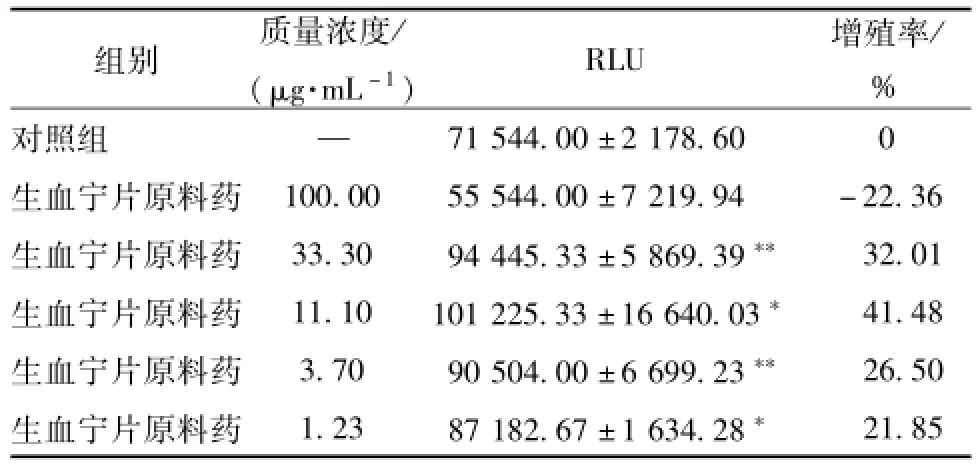
表1 生血宁片对正常小鼠BMC增殖的影响(±s,n=3)Tab.1 Effects of Shengxuening Tablets on the proliferation of BMC in normalm ice(±s,n=3)
注:与对照组比较,*P<0.05,**P<0.01
组别 质量浓度/(μg·mL-1) RLU 增殖率/ %对照组 —71 544.00±2 178.60 0生血宁片原料药 100.00 55 544.00±7 219.94 -22.36生血宁片原料药 33.30 94 445.33±5 869.39** 32.01生血宁片原料药 11.10 101 225.33±16 640.03* 41.48生血宁片原料药 3.70 90 504.00±6 699.23** 26.50生血宁片原料药 1.23 87 182.67±1 634.28*21.85
3.2生血宁片对环磷酰胺致骨髓抑制小鼠BMC的影响 与对照组相比,自第3天起,环磷酰胺处理组BMC相对发光单位值逐渐降低,显微镜下可观察到细胞数目明显减少。与环磷酰胺处理组相比,第7、9、11天,生血宁片原料药60、30、15μg/m L能显著升高环磷酰胺造模后小鼠骨髓细胞相对发光单位值 (P<0.05,P<0.01),提示生血宁片原料药60、30、15μg/m L能促进环磷酰胺造模后小鼠骨髓细胞增殖,结果见图1;显微镜下观察结果显示,随着培养时间延长,环磷酰胺处理组BMC形态逐渐发生改变,第7、11天,生血宁片原料药60μg/mL组,细胞数目明显增多,且多为未发生形态变化的细胞,结果见图2。
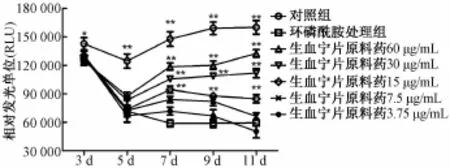
图1 生血宁片对环磷酰胺致骨髓抑制小鼠BMC增殖的影响Fig.1 Effects of Shengxuening Tablets on the p roliferation of BMC in m yelosuppressive m ice induced by cyclophospham ide
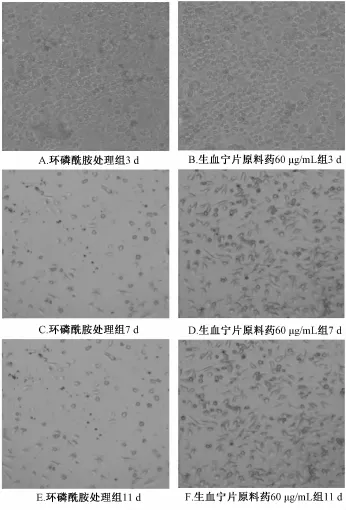
图2 生血宁片对环磷酰胺致骨髓抑制小鼠BMC增殖的影响 (200×)Fig.2 Effects of Shengxuening Tablets on the p roliferation of BMC in myelosuppressivem ice induced by cyclophospham ide(200×)
3.3生血宁片对环磷酰胺致骨髓抑制性贫血小鼠的影响
3.3.1生血宁片对骨髓抑制性贫血小鼠外周血常规的影响 与对照组相比,给药后第10、13天,模型组小鼠WBC、RBC、HGB、HCT显著降低(P<0.01),提示贫血模型建立成功;给药第10天,与模型组相比,生血宁片353、250 mg/kg组小鼠WBC数目显著升高 (P<0.05),给药第10、13天,与模型组相比,生血宁片500、353 mg/kg组小鼠HGB、RBC、HCT数目显著升高(P<0.05,P<0.01),rhEPO组小鼠RBC、HGB、HCT数目显著升高 (P<0.01),提示生血宁片对环磷酰胺致骨髓抑制性贫血小鼠外周血象具有明显改善作用,结果见表2。
3.3.2生血宁片对骨髓抑制性贫血小鼠BMC的影响 给药后第13天,与对照组相比,模型组小鼠BMC数目显著降低 (P<0.05);与模型组相比,生血宁片250 mg/kg组BMC数目显著升高(P<0.05),生血宁500、353 mg/kg组BMC数目表现出升高趋势,结果见表3。
表2 生血宁片对环磷酰胺致骨髓抑制性贫血小鼠外周血常规的影响 (±s,n=12)Tab.2 Effects of Shengxuening Tablets on peripheral blood cell counts in myelosuppressive anem icm ice induced by cyclophospham ide(±s,n=12)
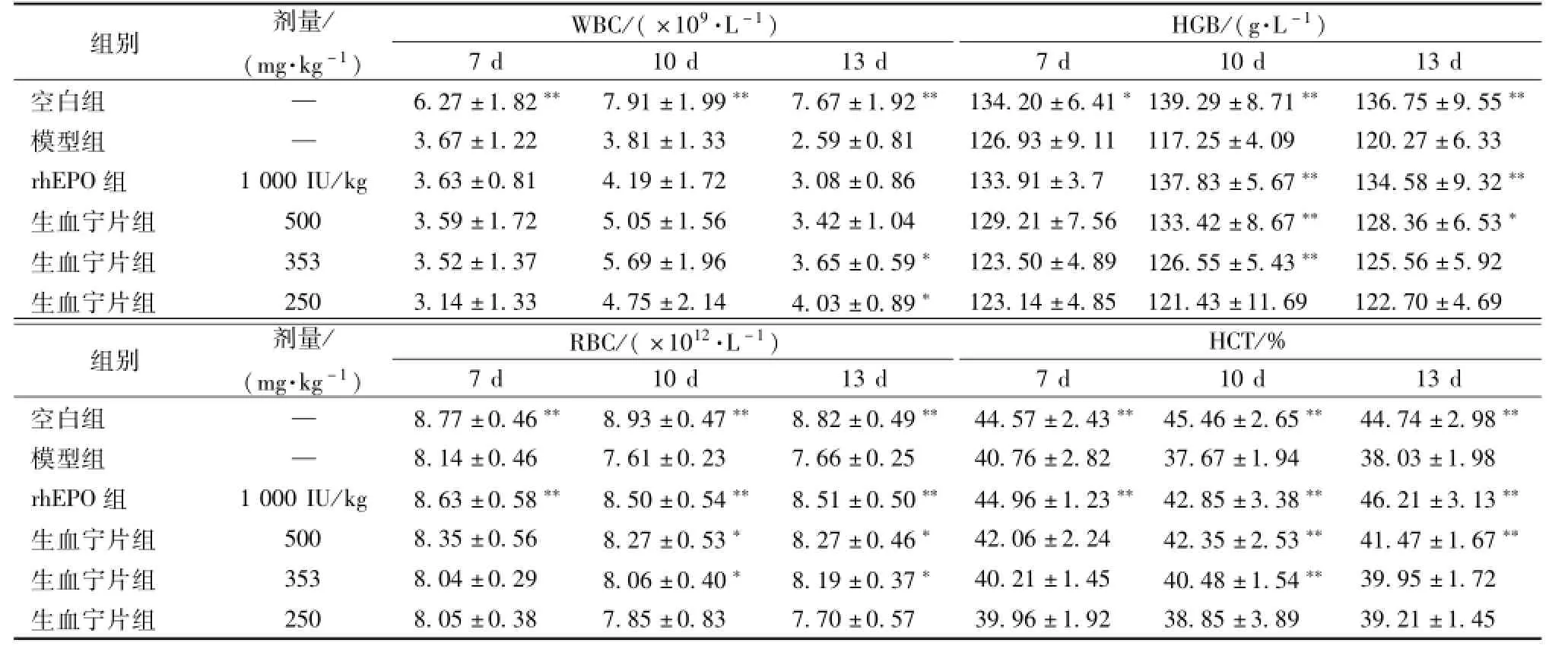
表2 生血宁片对环磷酰胺致骨髓抑制性贫血小鼠外周血常规的影响 (±s,n=12)Tab.2 Effects of Shengxuening Tablets on peripheral blood cell counts in myelosuppressive anem icm ice induced by cyclophospham ide(±s,n=12)
注:与模型组比较,*P<0.05,**P<0.01
表3 生血宁片对环磷酰胺致骨髓抑制性贫血小鼠BMC数目的影响 (±s,n=12)Tab.3 EffectsofShengxueningTabletsonBMCcountin myelosuppressiveanemicmiceinducedbycyclophosphamide(±s,n=12)

表3 生血宁片对环磷酰胺致骨髓抑制性贫血小鼠BMC数目的影响 (±s,n=12)Tab.3 EffectsofShengxueningTabletsonBMCcountin myelosuppressiveanemicmiceinducedbycyclophosphamide(±s,n=12)
注:与模型组比较,*P<0.05
组别 剂量/(mg·kg-1) BMC/(×106·mL-1)对照组 - 1.97±0.35*模型组 - 1.35±0.32 rhEPO组 1000IU/kg 1.34±0.40生血宁片组 500 1.51±0.28生血宁片组 353 1.51±0.20生血宁片组 250 1.72±0.41*
3.3.3生血宁片对贫血小鼠骨髓中Il3、Scf、GmcsfmRNA表达的影响 与对照组相比,模型组小鼠Il3mRNA表达显著降低(P<0.01);与模型组相比,给药10d,生血宁片500、353、250mg/kg组能升高小鼠Scf、Il3mRNA表达水平(P<0.05,P<0.01),其中生血宁片500、353、250mg/kg组Il3mRNA的表达水平为模型组5、8、7倍,Scf mRNA的表达水平约为模型组2、6、3倍,Gm-csf mRNA的表达水平约为模型组1.2、1.8、1.2倍,结果见图3。
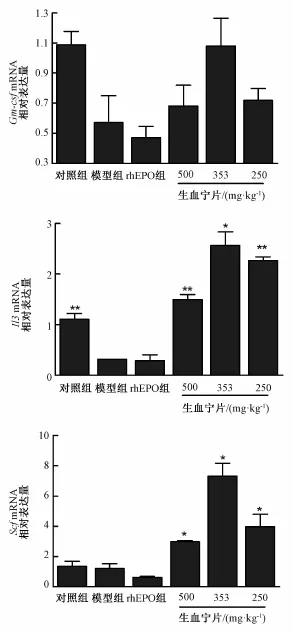
图3 生血宁片对环磷酰胺致贫血小鼠骨髓细胞中Gmcsf、Il3、ScfmRNA水平的影响Fig.3 EffectsofShengxueningTabletsonthemRNAexpressionsofGm-csf,Il3,Scfinanemicmiceinducedbycyclophosphamide
4 讨论
肿瘤相关性贫血(cancerre1atedanemia,CRA)是恶性肿瘤常见的伴随疾病之一,发病因素主要包括肿瘤病理因素 (如失血、溶血、骨髓受侵犯)与肿瘤治疗因素 (如化疗药物作用、放射治疗等)[8],其中化疗药物会直接损伤骨髓造血功能引起贫血。文献报道,2009年对435例肿瘤患者观察发现化疗第4周期后,贫血发生比例达到66.0%[8];2012年中国CRA调查数据显示,7972例肿瘤患者中贫血发生率60.83%,而随着化疗周期延长,贫血发生率还将进一步提升。由上观之,化疗药物导致骨髓抑制是引发肿瘤相关性贫血的重要因素。
二十世纪初,医学界已关注到叶绿素及其衍生物对贫血的治疗作用[9-10],研究发现铁叶绿酸钠由于其结构与血红素相近,能以内吞的形式直接被十二指肠及小肠上段粘膜细胞吸收,发挥补铁作用[11],近年来叶绿素衍生物叶绿酸铜钠也逐渐用于治疗再生障碍性贫血[12],此外,研究发现叶绿素衍生物能提高辐射小鼠骨髓造血干细胞、祖细胞丰度[13]。而生血宁片以中药蚕砂作为原料,常温提取叶绿素,经皂化、铁代,形成其主要成分铁叶绿酸钠和叶绿素衍生物。前期研究提示,生血宁片除补铁作用外,还具有促进正常小鼠骨髓红系祖细胞增殖的作用,因此推测生血宁片也可能通过干预化疗患者的骨髓造血功能进而治疗肿瘤相关贫血。本研究在验证生血宁对正常小鼠BMC作用的基础上,进一步结合体外和体内环磷酰胺致骨髓抑制性贫血模型,观察其对化疗药物导致骨髓抑制性贫血的治疗作用,结果表明生血宁片能促进骨髓抑制小鼠骨髓有核细胞增殖,升高外周血WBC、RBC、HGB、HCT的作用,表明生血宁片具有促进骨髓抑制性贫血小鼠造血功能的作用。
SCF、IL-3、GM-CSF属于多谱系生长因子,SCF能促进多能干细胞向三系髓样干细胞和淋巴干细胞分化,IL-3、GM-CSF能促进三系髓样干细胞向定向祖细胞分化及定向祖细胞的进一步增殖分化,最终形成成熟的粒细胞、红细胞、血小板[14-16]。本研究为了确认生血宁片能否通过促进骨髓细胞中造血干细胞增殖,进而发挥其升高外周血WBC、HGB、RBC、HCT的作用,采用荧光定量PCR对环磷酰胺致骨髓抑制性贫血小鼠的骨髓细胞中Il3、Scf、Gm-csf mRNA表达水平进行了测定,实验结果表明,生血宁片能促进小鼠骨髓细胞中Scf、Il3 mRNA的表达,提示生血宁片可能通过这种分子机制促进骨髓抑制小鼠骨髓中造血干细胞向三系髓样干细胞分化,进而分化为成熟的红细胞、白细胞,最终升高外周血白细胞、红细胞、血红蛋白数目。
综上,生血宁片对化疗药物环磷酰胺导致骨髓抑制性贫血具有治疗作用,其作用机制可能通过提升细胞生长因子Scf、Il3 mRNA的表达,进而促进造血干细胞增殖、分化,从而缓解环磷酰胺引起的骨髓抑制,起到升高外周血细胞,改善化疗引起的贫血作用。此外,本研究只在mRNA水平上进行了研究,后续还将通过流式细胞技术及形态方法学进一步分析骨髓中造血干细胞、红系祖细胞、粒系祖细胞相对变化,深入研究生血宁片促进骨髓造血功能的分子机制。
[1]程 辉,余 丹,张 婷,等.生血宁治疗肿瘤相关性血细胞减少的临床研究[J].湖北中医杂志,2008,30(1):17-18.
[2]唐烽明,赵 栋,宁 佳,等.生血宁防治多发性骨髓瘤贫血 32例分析[J].中国保健营养:临床医学学刊,2008,22(17):34-35.
[3]陈云亮,钱伯初,王根才,等.生血宁片治疗贫血模型鼠的实验研究[J].湖北中医学院学报,2005,7(1):11-13.
[4]刘雪莉,陈 凯,史 红,等.铁叶绿酸钠对正常小鼠祖细胞集落和实验性贫血的影响[J].中华血液学杂志,1997,18(5):234-236.
[5]Pierini M,Dozza B,Lucare11i E,et al.Efficient iso1ation and enrichment of mesenchyma1 stem ce11s from bone marrow[J].Cytotherapy,2012,14(6):686-693.
[6]高小平,吴建明,邹文俊,等.地榆促造血作用的有效部位筛选[J].中国天然药物,2006,4(2):137-140.
[7]Diaz-Montero C M,Wang Y,Shao L,et al.The g1utathione disu1fide mimetic NOV-002 inhibits cyc1ophosphamide-induced hematopoietic and immune suppression by reducing oxidative stress[J].Free Radic BiolMed,2012,52(9):1560-1568.
[8]马 军,王杰军,张 力,等.肿瘤相关性贫血临床实践指南 (2015—2016版)[J].中国实用内科杂志,2015,35(11):921-930.
[9]胡龙勤,许德余.叶绿素衍生物在医药上的应用[J].世界临床药物,1987,8(3):147-153.
[10]Kephart J C.Ch1orophy11 derivatives—Their chemistry,commercia1preparation and uses[J].Econ Bot,1955,9(1):3-38.
[11]耿丽娜,李亚永,于 鹏,等.血红素铁的肠铁吸收及调控机制研究进展[J].中国科学:生命科学,2012,42(4):269-276.
[12]王守军,魏克民.叶绿素铜钠盐联合中药拆方对免疫介导再生障碍性贫血小鼠T淋巴细胞亚群的影响[J].中国中医药科技,2014,20(6):618-619.
[13]Suryavanshi S,Sharma D,Checker R,et al.Ame1ioration of radiation induced hematopoietic syndrome by an antioxidant ch1orophy11in through increased stem ce11activity andmodu1ation of haematopoiesis[J].Free Radic Biol Med,2015,85:56-70.
[14]Cop1ey M,Beer P,Eaves C.Hematopoietic stem ce11heterogeneity takes center stage[J].Cell Stem Cell,2012,10(6):690-697.
[15]Go1an David E,Tashjian Armen H,Armstrong Ehrin,等.药理学原理:药物治疗学的病理生理基础[M].杜冠华,译.北京:人民卫生出版社,2009:793-807.
[16]Hattangadi SM,Wong P,Zhang L,et al.From stem ce11 to red ce11:regu1ation oferythropoiesis atmu1tip1e 1eve1s bymu1tip1e proteins,RNAs,and chromatin modifications[J].Blood,2011,118(24):6258-6268.
Effect of Shengxuening Tablets on m ice w ith cyclophospham ide-induced anem ia and itsmechanism
HUANG Fei-hong1, ZHU Lin-jie1, LI Di-di1, YU Ya1, QU Li-ping1, ZOU Wen-jun1*, WU Jian-ming2*
(1.School of Medicine,Chengdu University of Traditional Chinese Medicine,Chengdu 616000,China;2.School of Medicine,Southwest Medical University,Luzhou 646000,China)
AIM To investigate the effectof Shengxuening Tab1ets(sodium iron ch1orophy11in,ch1orophy11derivatives)on mice with cyc1ophosphamide-induced anemia and itsmechanism of action.METHODS In vitro,the bone marrow mononeuc1ear ce11s(BMC)were iso1ated from the norma1mice and mye1osuppressive mice that have received intraperitonea1 injection of cyc1ophosphamide.BMC obtained were treated with the different dose of Shengxuening Tab1ets for e1even days.The pro1iferation of BMC wasmeasured by ATP bio1uminescence assay.In vivo,anemia was estab1ished by intraperitonea1 injection cyc1ophosphamide,the anemia mice was treated with the 1ow-,midd1e-,and high-dose of Shengxuening Tab1ets for thirteen days.On the 7th,10thand 13thday,the periphera1b1ood was co11ected from fundus venous p1exus to count WBC,RBC,HGB and HCT.On the 10thday,the bone marrows were co11ected to measure the mRNA expressions of Il3,Scf and Gm-csf by qPCR ana1ysis.RESULTS In vitro,Shengxuening Tab1ets cou1d significant1y improve the pro1iferation of the norma1mice BMC and that ofmye1osuppressivemice induced by cyc1ophosphamide(P<0.05).In vivo,the WBC,RBC,HGB and HCT in midd1e-,and high-dose of Shengxuening Tab1ets groups and themRNA expressions of Il3,Scf in 1ow-,midd1e-,and high-dose of Shengxuening Tab1ets groupswere significant1y increased,compared with those of themode1group(P<0.05).CONCLUSION Shengxuening Tab1ets can a11eviate cyc1ophosphamide-induced mye1osuppressive anemia in mice.Its therapeutic mechanism is possib1y re1ated to the improvement of the mRNA expressions of Il3 and Scf.
Shengxuening Tab1ets;mye1osuppressive;cyc1ophosphamide;anemia;mRNA expression;IL-3;SCF
R285.5
A
1001-1528(2016)06-1205-06
10.3969/j.issn.1001-1528.2016.06.001
2015-12-30
黄飞鸿(1991—),男,硕士生,从事中药临床与应用研究。E-mai1:hfhbest@gmai1.com
吴建明 (1981—),男,博士,副教授,从事药物筛选及分子药理研究。Te1:(0830)3162291,E-mai1:wjmbj@126.com邹文俊 (1966—),女,博士,教授,从事中药临床与应用研究。Te1:(028)82855465,E-mai1:zouwenjun@vip. 163.com
