包埋固定化酶降解牛奶αs1-酪蛋白过敏性研究
2016-09-03汝成业堵国成李江华
汝成业, 张 娟, 堵国成,陈 坚,李江华*
(1.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;4.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122;5.江南大学 生物工程学院,江苏 无锡214122)
包埋固定化酶降解牛奶αs1-酪蛋白过敏性研究
汝成业1,2,5, 张娟2,5, 堵国成4,5,陈坚3,5,李江华*2,5
(1.江南大学 食品安全与营养协同创新中心,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;4.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122;5.江南大学 生物工程学院,江苏 无锡214122)
利用海藻酸钠固定化蛋白酶,探求其对牛奶过敏原αs1-酪蛋白的特异性降解。以固定化酶的活力回收率为指标,探究了固定化的条件、固定化酶的部分性质以及固定化酶在去除牛奶过敏原蛋白的应用。结果表明:最优固定化条件为,海藻酸钠质量分数为4.0%,CaCl2的质量分数为3.0%,固定化时间0.5 h,固定化酶量为V(海藻酸钠)∶V(酶液)为1∶3,固定化效率达到67.5%;固定后的酶最适反应温度70℃,最适反应pH 10.0,连续使用6次后剩余酶活达到40.0%以上;将固定化酶作用于2.0%脱脂奶粉溶液中,60℃条件下反应25min过敏原αs1-酪蛋白得到特异性降解。
海藻酸钠;固定化酶;αs1-酪蛋白;过敏原
牛奶是一种营养丰富的全蛋白质,是优质的营养食品。牛奶蛋白主要是由酪蛋白和乳清蛋白组成,其中酪蛋白约占牛乳蛋白的80.0%。而αs1-酪蛋白是牛乳中主要酪蛋白,在脱脂乳中约占全酪蛋白)的38.0%。αs1-酪蛋白由199个氨基酸组成,并可与钙、铁、铜、锌等金属离子结合形成可溶性物质,促进金属离子在体内的吸收[1]。由于母乳中不含有αs1-酪蛋白,使得其成为牛乳中重要的过敏原蛋白之一,而且牛奶过敏婴儿存在着发生哮喘、湿疹、过敏性鼻炎等特应性疾病的风险[2-3]。基于此,寻求合适的降解牛奶过敏原的方法日益重要。目前常用于去除牛奶过敏原蛋白的热处理、糖基化、发酵等方法对牛奶营养和风味具有一定的影响,同时其对过敏原蛋白的降解特异性不强[4]。采用酶法降解具有相对专一性并且作用迅速,但主要集中在对α-乳清蛋白和β-乳球蛋白的降解[5]。作者组前期筛选得到一株优先降解αs1-酪蛋白的菌株,但其游离酶稳定性差,难以回收[6],易混入牛奶溶液中难以去除等,使得应用受到一定的限制。采用固定化酶技术不仅保留了游离酶的优点,而且可以克服游离酶催化反应不连续化以及不易回收的缺点,因而具有更加广阔的前景[7]。
目前固定化酶的制备方法主要有包埋法、交联法、共价键结合法和吸附法等[8],其中包埋法反应条件温和,不需要化学修饰蛋白酶的氨基酸残基,而且对酶分子结构改变少,酶活力损失小等优点。在固定化酶常用的包埋材料中海藻酸钠最为常见,具有固化、成形方便,材料安全等优势。由于Ca2+可与海藻酸钠反应生成海藻酸钙微凝胶,安全无毒并具有有良好的生物相溶性,可以在温和条件下实现对酶的固定,有助于保持酶的生物活性。此外海藻酸钠原材料价格低廉、材料易得等特点[9],因而受到广泛重视,已应用于食品加工、药物缓释、生物工程等领域。
作者利用海藻酸钠为载体对已纯化获得的碱性蛋白酶进行固定化,分析固定化条件对蛋白酶活性的影响,同时对固定化酶的酶学性质进行初步探讨,并研究固定化酶对牛奶过敏原αs1-酪蛋白的特异性降解,为获得低敏牛奶制品提供参考。
1 材料与方法
1.1主要材料与试剂
1.1.1试剂酪蛋白:分析纯,上海生工生物工程技术服务有限公司产品;海藻酸钠:化学纯,中国医药(集团)上海化学试剂公司产品;氯化钙:分析纯,中国医药(集团)上海化学试剂公司产品;三氯乙酸等试剂为国产分析纯。
1.1.2仪器紫外分光光度计(UV2450):日本岛津公司产品;电热恒温水浴锅:江苏省医疗器械厂产品;PHS-3C型酸度计:杭州亚美电子仪器厂产品;电泳仪:美国Bio-Rad公司产品。
1.1.3碱性蛋白酶Bacillus Licheniformis CN1菌
株经发酵后纯化获得。
1.2实验方法
1.2.1蛋白酶的活力测定
1)游离酶活性测定采用福林—酚试剂法测定蛋白酶活力[10]。酶活力单位定义:一个酶活力单位是指在一定实验条件下 (pH 10.0,60℃时,2.0 g/L酪蛋白作底物,反应时间10 min)水解酪蛋白产生lμg酪氨酸时所需要的酶量,单位U/mL。
2)固定化酶活力测定一定体积的酶液经固定化后加入一定体积pH 10.0的硼酸钠缓冲液,使其处于pH 10.0的体系中,方法与游离酶活力测定相同。酶活力回收率=(固定化酶的总活力/游离酶的总活力)×100%。固定化酶的相对酶活是指在同组试验中以活性最高为100%。
1.2.2固定化碱性蛋白酶的制备参照文献[11]制备固定化蛋白酶。首先称取一定量的海藻酸钠溶于一定体积的蒸馏水溶液中,加热完全溶解后放置室温,冷却至35℃左右,加入一定比例的碱性蛋白酶混匀,4℃冰箱静置一段时间至溶液混合均匀,用5 mL注射器滴入到一定浓度的CaCl2溶液中,磁力搅拌一定时间后,用去离子水洗涤3次,滤纸滤干水分。4℃冰箱保存备用。
1.2.3固定化酶在牛奶蛋白中的应用利用蛋白电泳直观检测牛奶过敏原蛋白条带的消失程度。通过在质量分数2.0%的脱脂奶粉溶液里添加一定量的固定化酶,调节脱脂奶粉溶液的pH值以及反应温度,反应不同时间后高温终止反应,然后进行SDS-PAGE电泳[12]。
2 结果与讨论
2.1固定化酶的制备
2.1.1海藻酸钠质量分数的确定将一定量酶液与不同质量分数的海藻酸钠溶液混合,测定固定化酶的活性。

图1 海藻酸钠质量分数对固定化酶活性的影响Fig.1 Effects of sodium alginate concentration on the relative activity of immobilized enzyme
由图l可知,当海藻酸钠质量分数为4.0%时,固定化酶活力最大。当海藻酸钠质量分数达到5.0%后,其黏度很大,难以挤成球状,影响凝胶成型,同时凝胶的孔径也小,影响酶与底物的结合。反之海藻酸钠质量分数太小,凝胶的孔径较大,固定化酶容易流失。因此选择机械强度适宜的凝胶,同时有利于底物和产物从凝胶微孔扩散通过,保证酶促反应速度,结合图1,选择海藻酸钠质量分数为4.0%。
2.1.2CaCl2质量分数的确定CaCl2的质量分数对形成凝胶的机械强度有重要影响。当CaCl2质量分数达到5.0%后,形成的凝胶表面将会分布的Ca2+较多,由于Ca2+会与酶作用位点竞争性结合,从而降低酶活性,若太少又导致凝胶强度太小,包埋不够彻底,使其包埋在内部的部分蛋白酶流失,影响酶的活性。由图2可知,当CaCl2质量分数为3.0%时,固定化酶活性达到最佳。

图2 CaCl2的质量分数对固定化酶活性的影响CaCl2Fig.2 Effects of CaCl2concentration on the relative activity of immobilized enzyme
2.1.3固定化时间的确定固定化时间是指海藻酸钠与固定化酶的混合液滴落到CaCl2溶液中的反应时间。按照上述实验条件,取酶液与海藻酸钠溶液混匀,滴入3.0%的CaCl2溶液中,固定不同时间,测定固定化酶活力,结果如图3所示。随着固定化时间的延长,其回收率逐渐降低,酶在CaCl2溶液中固定化时间的最佳选择为0~1.0 h,以便保证得到较高的固定化酶酶活。固定化时间越长,海藻酸钠与氯化钙的反应就越完全,形成的海藻酸钙凝胶珠就越致密,对固定化蛋白酶的活性起到了部分抑制的作用[13]。

图3 固定化时间对固定化酶活性的影响Fig.3 Effects of immobilized time on the relative activity of immobilized enzyme
2.1.4固定化酶量的确定用于固定化的酶量直接关系到固定化酶的活力,酶的加入量亦有一最佳值,将酶液量与质量分数为4%海藻酸钠溶液按不同体积比进行固定,固定化时间选择为0.5 h,测定固定化酶的活力,结果如图4所示。海藻酸钠与酶液按照体积比1∶3的比例进行固定化,酶活回收率最高,过多的酶液会导致游离酶的浪费,而少量的海藻酸钠则不能与酶液充分结合,造成固定化酶的效率下降。
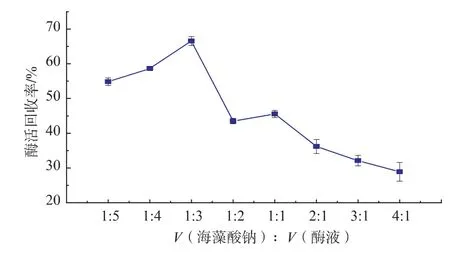
图4 固定化酶量对固定化酶活力的影响Fig.4 Effects of different enzyme amounts on the relative activity of immobilized enzyme
2.2固定化碱性蛋白酶的酶学性质
2.2.1pH对固定化酶和游离酶活力的影响控制反应温度为60℃,在不同pH的磷酸缓冲溶液中测定固定化酶和溶液酶活力,结果如图5所示。图5 中pH对固定化酶和游离酶活力的影响不大,其最适pH均在10.0左右,但固定化酶对pH的稳定性减弱,对pH相对更敏感。将固定化酶放置于不同pH缓冲液中常温1 h后测定其残余酶活,以固定化酶在pH 10.0测定的酶活为100%,固定化酶在不同pH体系中放置1 h后其酶活几乎不变,说明固定化酶具有一定的pH耐受性。

图5 pH对固定化酶和游离酶活力的影响Fig.5 Effects of pH on the relative activity of immobilized and liquid enzyme
2.2.2温度对固定化酶和游离酶活力的影响温度对固定化酶和游离酶活力影响较大,固定化酶的最适反应温度较游离化酶提高10℃,耐热性增强。在较高温度下保持酶活具有一定的优势。对于在中高温条件下进行的反应,固定化酶具有一定的优势。在50、60、70℃下测定固定化酶的热稳定性,在50、60℃的条件下反应1 h后其酶活损失较少,基本保持一致,但在70℃的条件下,酶活在10min后迅速下降,由此可以认定固定化酶的最适反应温度应控制在60℃左右,此温度对于中高温的反应具有一定的优势。结果见图6。

图6 温度对固定化酶和游离酶活力的影响Fig.6 Effects of temperature on the relative activity of immobilized and liquid enzyme
2.2.3固定化酶的低温稳定性将固定化酶放于4℃冰箱中,每隔2 d分别测定酶活,结果见图7。由图7可以看出:固定化酶放置10 d后酶活下降到原来的85.2%,放置20 d后保留78.5%,说明在4℃下,固定化酶相对稳定,有利于进行短期保存,并且相对于游离酶而言具有更久的储存能力。

图7 贮存时间对固定化酶的影响Fig.7 Effects of storage stability on the relative activity of immobilized enzyme
2.2.4固定化酶的操作重复性测定循环使用固定化酶的酶活来计算固定化酶的操作稳定性。将每次反应后的固定化酶利用pH 10.0的缓冲液冲洗干净,并用滤纸吸干其水分后进行后续测定,连续测定7次,结果如图8。随着循环次数的增加,相对酶活力降低,连续使用7次后酶活保留原来的21.0%。造成酶活力损失的原因可能是,载体受到磨损,酶从海藻酸钠载体上脱落,或是酶的作用位点随着水解酪蛋白的不断进行而逐渐暴露,容易遭到破坏。实验结果表示,固定化酶循环使用5次后,酶活力仍可保持原来的53.8%。相对游离酶而言其总酶活得到提高,降低了酶的生产成本。

图8 利用次数对固定化酶的影响Fig.8 Effects of repeat times on the relative activity of immobilized enzyme
2.3固定化酶在降解牛奶αs1-酪蛋白的应用
将固定化的蛋白酶按照一定比例添加到质量分数2.0%脱脂奶粉溶液中进行反应,以未添加的脱脂奶粉溶液作为对照,定时取样进行SDS-PAGE电泳,控制反应温度在不同的温度条件下进行反应,获得其优先性降解牛奶过敏原的最佳温度,使其能够对过敏原蛋白具有最大的降解,同时保留牛奶中其他蛋白营养成分。选取了温度为50、60、70℃进行反应,结果如图9和图10。固定化酶在pH 10.0的碱性条件下对脱脂奶粉溶液的降解能力优于pH 7.0的中性条件,与以酪蛋白为底物测得的最适pH保持一致。在pH 10.0的条件下,固定化酶对酪蛋白的降解顺序为优先降解αs1-酪蛋白和β-酪蛋白,而在pH 7.0的条件下其主要降解β-酪蛋白,对αs1-、αs2-酪蛋白 几乎不降解,说明pH对固定化酶对αs1-酪蛋白的降解具有重要作用。在pH 10的脱脂奶粉溶液中控制反应温度60℃,反应25 min的时间范围内,达到对牛奶αs1-酪蛋白 的优先性降解,达到特异性降解牛奶过敏原αs1-酪蛋白的效果。

图9 50℃下固定化酶对脱脂牛奶蛋白的降解Fig.9 SDS-PAGE profile of skim m ilk hydrolyzed by immobilized enzyme at different pH values under 50℃

图10 70℃下固定化酶对脱脂牛奶蛋白的降解Fig.10 SDS-PAGE profile of skim m ilk hydrolyzed by immobilized enzyme at different pH values under 70℃
3 结语
用包埋法固定此蛋白酶应用于降解牛奶过敏原蛋白中,所用载体海藻酸钠安全无毒,而且价格低廉,同时制备过程简单,成本低,条件温和。将固定化酶应用到牛奶蛋白溶液中,不影响牛奶制品的使用,而且可以实现多次使用并方便回收,并能够达到对牛奶过敏原αs1-酪蛋白的特异性降解,具有较好的应用前景。但是此方法距离工业化应用还具有一段距离,今后将通过分子改造的手段以及与不同的改性技术相结合,以达到更好地特异性降低αs1-酪蛋白致敏性的效果。
[1]岳喜庆,吴超,郭晨.牛乳中主要蛋白过敏原研究现状[J].食品研究与开发,2008,29(10):147-150. YUE Xiqing,WU Chao,GUO Chen.Process review on major protein allergen s of cow milk[J].Food Research and Developent,2008,29(10):147-150.(in Chinese)
[2]Szwajkowska M,Wolanciuk A,Barlowska J,et al.Bovine m ilk proteins as the source of bioactive peptides influencing the consumers’immune system-a review[J].Anim Sci Pap Rep,2011,29:269-280.
[3]罗曾玲,高金燕,陈红兵.牛乳中主要过敏原的研究进展[J].食品科学,2007,28(2):346-350. LUO Zengling,GAO Jinyan,CHEN Hong bin.Process review onmajorallergen sof cow m ilk[J].Food Science,2007,28(2):346-350.(in Chinese)
[4]KUANG H,Bi-yuan G A O,Vissers Y,etal.热处理对食物致敏性的影响及其体外细胞学评价 [J].食品与生物技术学报,2013,32(9). KUANG H,Bi-yuan G A O,Vissers Y,etal.Food allergenicity influenced by thermal processing and in vitro cellular assay[J]. Journal of Food Science and Biotechnology,2013,32(9).(in Chinese)
[5]王淼,范崇东,徐榕榕.转谷氨酰胺酶对牛乳酪蛋白功能性质的影响[J].无锡轻工大学学报,2002,21(5):499-502. WANG M iao,FANG Congdong,XU Rongrong.The effects of transglutaminase on functional properties of casein in m ilk[J]. Journal ofW uxiUniversity of Light Industy,2002,21(5):499-502.(in Chinese)
[6]吴召慧,田亚平.包埋吸附法固定化酒用酸性脲酶的研究[J].食品与生物技术学报,2010,29(3):437-441. WU Zhaohui,TIAN Yaping.Immobilization of acid urease via adsorption and embedded[J].Journal of Food Science and Biotechnology,2010,29(3):437-441.(in Chinese)
[7]Mateo C,Palomo JM,Fernandez-Lorente G,etal.Improvement of enzyme activity,stability and selectivity via immobilization techniques[J].Enzyme and M icrobial Technology,2007,40(6):1451-1463.
[8]张琛,张宽朝,章琛,等.海藻酸钠包埋法制备固定化菠萝蛋白酶[J].生物加工过程,2009,7(6):31-34. ZHANG Chen,ZHANG Kuanchao,ZHANG Chen,et al.Immobilization of bromelain by embedding in sodium alginate[J]. Chinese Joumal of Bioprocess Engineering,2009,7(6):31-34.(In Chinese)
[9]汤鸣强,陈颉颖.海藻酸钠固定化米曲霉产果胶酶及其性质[J].食品研究与开发,2010,31(9):167-170. TANGM ingqiang,CHEN Jieying.Immobilization of pectinase from aspergillusoryaze by sodium alginate[J].Food Research and Developent,2010,31(9):167-170.(in Chinese)
[10]范方宇,吴长苹,刘代现.海藻酸钠固定化碱性蛋白酶的研究[J].农业机械,2013,3:20. FAN Fangyu,WU Changping,LIU Daixian.Study on immobilization ofalkaline protease by sodium alginate[J].Transactions of the Chinese Society for AgriculturalM achinery,2013,3:20.(in Chinese)
[11]王刚强,王维香,赵金梅,等.海藻酸钠固定化胰蛋白酶的研究[J].西华大学学报:自然科学版,2011,30(4):109-112. WANG Gangqiang,WANG Weixiang,ZHAO Jinmei.Immobilization of trypsin on sodium alginate[J].Joumal of Xihua University Natural Science,2011,30(4):109-112.(in Chinese)
[12]El-Ghaish S,Dalgalarrondo M,Choiset Y,et al.Characterization of a new isolate of Lactobacillus fermentum IFO 3956 from Egyptian Ras cheesew ith proteolytic activity[J].European Food Research and Technology,2010,230(4):635-643.
[13]Ma J,Zhang L,Liang Z,etal.Immobilized enzyme reactors in proteomics[J].Trends in Analytical Chem istry,2011,30(5):691-702.
A llergenicity Investigation of Hydrolyzedαs1-Casein in Bovine M ilk by Immobilized Protease
RU Chengye1,2,5, ZHANG Juan2,5, DU Guocheng4,5, CHEN Jian3,5,LIJianghua*2,5
(1.Synergetic Innovation Center of Food Safety and Nutrition,Wuxi 214122,China;2.Key Laboratory of IndustrialBiotechnology,M inistryofEducation,JiangnanUniversity,Wuxi214122,China;3.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;4.The Key Laboratory of Carbohydrate Chemistry and Biotechnology,M inistry of Education,Jiangnan University,Wuxi 214122,China;5.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Proteasewas immobilized using sodium alginate as the carrier.The specific degradation of milk allergen(αs1-casein)was investigated.The immobilization conditions of protease,properties of immobilized enzyme and application inm ilk allergen removalwere studied using the immobilized enzyme activity recovery rate as an index.The immobilization efficiency reached up to 67.5%under the optimal condition of immobilization achieved w ith 4.0%sodium alginate(ratio of mass to volume),3%CaCl2(ratio ofmass to volume),the volume of sodium alginate and protease of1∶3 and 0.5 h for immobilization reaction at pH 10.0 under 70℃.The activity of immobilized enzymewas retained over 40%used after six cycles.Them ilk allergenαs1-casein was specifically degraded when the immobilized protease adding to 2.0%w t skim m ilk solution at pH 10.0 under 60 ℃for25m inute.
sodium alginate,immobilized enzyme,αs1-casein,allergy
TS 252
A
1673—1689(2016)04—0387—06
2014-11-25
国家863计划项目(2011AAl00905);国家973计划项目(2013CB733902);国家自然科学基金项目(31470160);江苏省自然科学基金项目(BK2012553);中国博士后科学基金项目(114957)。
李江华(1966—),男,江西九江人,工学博士,教授,主要从事酶技术、发酵过程优化与控制研究。E-mail.lijianghua@jiangnan.edu.cn
