舞毒蛾LdGSTe1基因的克隆及表达
2016-08-10问荣荣王步勇马玲
问荣荣,王步勇,马玲
(东北林业大学林学院,黑龙江 哈尔滨 150040)
舞毒蛾LdGSTe1基因的克隆及表达
问荣荣,王步勇,马玲*
(东北林业大学林学院,黑龙江 哈尔滨 150040)
从舞毒蛾(Lymantria dispar)3龄幼虫转录组文库中鉴定获得舞毒蛾谷胱甘肽S-转移酶基因全长cDNA,命名为 LdGSTe1。该基因全长 651 bp,编码 216个氨基酸。序列分析显示,LdGSTe1蛋白氨基酸序列含有GST_C_Delta_Epsilon与GST_N_Delta_Epsilon 2个保守结构域,属于类硫氧还蛋白和谷胱甘肽S-转移酶2个超家族。系统进化树分析表明,舞毒蛾LdGST蛋白属于GST Epsilon家族。蛋白结构显示,LdGSTe1蛋白包含一个N端和一个C端结构,α-螺旋与β-折叠为主要结构元件。实时荧光定量PCR结果表明,在4.0、10.0 mg/L鱼藤酮药剂处理下,舞毒蛾3龄幼虫LdGSTe1基因表达先下降后上升,推测该基因参与舞毒蛾解毒应答。
舞毒蛾;谷胱甘肽S-转移酶(GST)基因;克隆;基因表达
投稿网址:http://xb.ijournal.cn
谷胱甘肽S-转移酶(glutathione S-transferase,GST)是由多个基因编码的具有转运、信号传导、解毒功能的超家族酶系,广泛存在于动物、植物和微生物体内[1-2]。依据细胞定位,GSTs可分为微粒体型、线粒体型和胞质型。基于分布广泛和功能重要的特点,胞质GSTs成为研究最为广泛和深入的类型。昆虫胞质GSTs 的主要功能是催化谷胱甘肽的巯基和一些毒亲电子类物质(如杀虫剂、醌类化合物、α,β-不饱和羰基化合物及过氧化物等)进行轭合反应,以及作为配体结合蛋白以俘获有毒物质,行使解毒功能,参与杀虫剂抗药性的形成[3]。Chelvanayagam 等[4]将昆虫胞质 GSTs 分为3类:第Ⅰ类为 Delta 亚族;第Ⅱ类分别为 Sigma、Omega、Theta 和 Zeta 4 个亚族;第Ⅲ类为 Epsilon亚族,其中Delta和Epsilon为昆虫所特有,且 Delta亚族存在于所有昆虫中,而 Epsilon 亚族仅在双翅目、鞘翅目、鳞翅目昆虫中出现。Robert[5]认为Epsilon 亚族是从 Delta 亚族进化来的,而不是由于基因丢失造成的。已有研究表明,Delta和Epsilon 类GSTs能够催化谷胱甘肽化合物与外源的多种有害物质进行氧化还原反应,从而保护蛋白质和核酸免受损伤[6],参与昆虫抗药性形成过程[7]。该两类GSTs在杀虫剂抗性中起到的重要作用得到广泛关注[8-10]。
舞毒蛾(Lymantria dispar Linnaeus)是分布范围较广、周期性发生的农林食叶害虫,可取食数百种植物[11],严重危害农林业生产。对舞毒蛾的防治以化学防治为主。随着分子生物学的发展,利用基因工程技术防治农林害虫成为研究的热点。通过调节参与机体至关重要功能的基因表达来干扰害虫正常的生理功能已成为防治害虫的新策略[12],因此,对昆虫抗药性形成相关的 GST基因进行研究具有重要意义。谷胱甘肽S-转移酶基因已在黑腹果蝇[13]、大劣按蚊[14]、小菜蛾[15]、红火蚁[16]中被报道。笔者对舞毒蛾3龄幼虫转录本文库进行分析,获得舞毒蛾谷胱甘肽 S-转移酶 Epsilon类基因(LdGSTe1)cDNA全长,并通过RT-PCR技术克隆验证。通过生物信息学分析,初步了解其结构与功能。进一步利用实时荧光定量PCR技术分析该基因对植物源杀虫剂鱼藤酮的胁迫响应模式,现将结果报道如下。
1 材料与方法
1.1供试昆虫
于小兴安岭凉水自然保护区(黑龙江省伊春市带岭区境内,地理坐标为128°53′20″E,47°10′50″N)采集舞毒蛾卵块。卵块于(25±1) ℃、相对湿度75%、每天光照14 h、黑暗10 h条件下进行孵化。幼虫以相同条件进行培养。人工饲料由中国林业科学研究院森林生态环境与保护研究所提供。收集长势健康一致的舞毒蛾 3龄幼虫,经 0.1%焦碳酸二乙酯(DEPC)溶液冲洗后,-80 ℃冰箱存储,备用。
1.2方法
1.2.1舞毒蛾LdGSTe1基因的克隆
采用Invitrogen Trizol Reagent RNA提取试剂盒,提取舞毒蛾 3龄幼虫总 RNA。经 DNase I(Promega)消化去除DNA,紫外分光光度计和1.0%凝胶电泳检测RNA质量。取10 μg 总RNA用于合成第一链cDNA(TaKara反转录试剂盒),-20 ℃冰箱存储,用于PCR扩增模板。从转录组文库中获得编号为Unigene 27032的序列,对其进行BLAST分析,根据功能注释结果查找获得LdGSTe1基因。
利用Primer 5.0设计引物LdGSTe1-F (5'-CGGT GTATAAATTGAATGCTAGTC-3')和LdGSTe1-R(5'-ATAGAGAAACGAATGAACCAGG-3'),以舞毒蛾3龄幼虫总RNA合成的第一链cDNA为模板进行基因RT-PCR扩增,测序验证LdGSTe1基因序列。25 μL RT-PCR扩增体系:cDNA 0.5 μL、dNTP Mix 2 μL、10×Buffer 2.5 μL、LdGSTe1-F 1 μL、LdGSTe1-R 1 μL、rTaq 0.5 μL、ddH2O 17.5 μL。反应条件:94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。PCR扩增产物经 1.0%凝胶检测后,采用切胶回收试剂盒(Omega公司产品)回收目的片段,经pMD18-T连接、DH5α转化,挑取阳性单克隆菌落测序。
1.2.2舞毒蛾LdGSTe1基因的生物信息学分析
利用 NCBI ORF-Finder翻译编码蛋白氨基酸序列,并对开放阅读框进行分析。利用 ExPASy ProtParam对编码蛋白的相对分子质量、等电点进行分析[17]。采用SignalP 4.1分析编码蛋白信号肽。用在线工具NetPhos 2.0 Server对蛋白潜在磷酸化位点进行分析[18]。用Conserved Domains在线工具对蛋白保守区域进行预测。用 Bioedit进行多序列比对分析,用MEGA 6.0进行发育树构建分析。利用 SWISS-MODEL自动建模方式构建三维模型[19-21]。
1.2.3舞毒蛾LdGSTe1基因的表达
采用点滴触杀法对舞毒蛾3龄幼虫进行致毒处理:用DMSO溶液将鱼藤酮母液分别配制成4、10 mg/L的药液,用微量点滴仪将稀释液滴于舞毒蛾3龄幼虫的前胸背板,每头试虫点滴3 μL药液,每组处理30头试虫,对照组点滴DMSO溶液,分别于处理后12、24、36、48、60 h随机收集5头活泼试虫,提取总RNA,DNase I消去DNA,采用TaKara反转录试剂盒合成cDNA,-20 ℃冰箱保存。实时荧光定量 PCR试剂盒为 KOD SYBR qPCR Mix (TOYOBO)。根据LdGSTe1基因序列设计荧光定量PCR引物LdGSTe1-qF(5'-TTGGGACAGTCACGCA ATAG-3')和 LdGSTe1-qR(5'-CCAGCCATGGAGAT GTGAATAA-3');以舞毒蛾Actin基因为内参基因,引物为Action-qF(ATGTTAGTATGATCGAGCGTAT CG)和Action-qR(GCATGATCTGAGGAGCATCTT))。实时荧光定量PCR反应程序:95 ℃预变性2 min;95 ℃变性15 s,58 ℃退火15 s,72 ℃延伸45 s,40循环;95 ℃变性15 s,60 ℃延伸1 min,95 ℃变性15 s,进行溶解曲线反应。设置3个重复,采用文献[22]的方法计算目的基因的相对表达量。
2 结果与分析
2.1舞毒蛾LdGSTe1基因的克隆结果
对舞毒蛾3龄幼虫转录组数据进行分析,获得了 1个舞毒蛾 GST基因(转录组文库中编号为Unigene 27032)的全长cDNA序列。以舞毒蛾3龄幼虫的cDNA为模板,通过RT-PCR扩增,电泳检测为单一条带,经测序验证,所得序列与预期基因的全长cDNA序列大小一致。BLAST分析显示其属于GST家族Epsilon类基因,故命名为LdGSTe1。LdGSTe1基因开放阅读框(ORF)长为651 bp,编码216个氨基酸(图1)。
2.2舞毒蛾LdGSTe1基因的生物信息学

图2 舞毒蛾LdGSTe1蛋白保守区预测Fig.2 Conserved domains of LdGSTe1 protein in L. dispar
ProtParam预测编码蛋白基本理化特性,推测LdGSTe1分子式为C1101H1735N285O318S9,相对分子质量为24 340,理论等电点为6.90,不稳定系数(II)为28.10,为稳定性蛋白,总平均疏水指数为-0.156,为亲水性蛋白。TMpred和SignalP 4.1预测显示该蛋白无信号肽和跨膜区。PSORT Prediction预测该蛋白位于细胞核内。NetPhos 2.0 Server显示,LdGSTe1蛋白含有4个丝氨酸磷酸化位点和2个苏氨酸磷酸化位点及 4个络氨酸磷酸化位点。NCBI 的CDD对LdGSTe1蛋白保守结构域预测显示,LdGSTe1蛋白属于GST家族蛋白(图2),在第3~77位为保守的N端结构域GST_N_Delta_Epsilon,在第91~207位为C端结构域GST_C_Delta_Epsilon。
通过NCBI BLASTP对舞毒蛾LdGSTe1蛋白进行在线比对,选出与其同源性较高(52%~58%)的其他昆虫的14种GST蛋白,并利用Bioedit进行多序列比对分析。结果(图3)显示,LdGSTe1蛋白在进化上高度保守,属于GST家族 Epsilon蛋白,预测这些物种间存在共同起源。

图3 舞毒蛾LdGSTe1蛋白与其他昆虫GST Epsilon蛋白的多序列比对Fig.3 Multiple sequence alignment of LdGSTe1 with GST Epsilon proteins in other inserts
应用SWISS-MODEL软件,于PBD库中寻找LdGSTe1蛋白的同源蛋白,构建三维模型(图4)。结果显示,舞毒蛾LdGSTe1蛋白包含1个N端结构域和1个C端结构域。N端结构域为谷胱甘肽的结合区域,含有7个α-螺旋和4个β-折叠;C端为识别并结合底物区域,含有9个α-螺旋和4个β-折叠。α-螺旋和β-折叠是其主要结构元件。

图4 舞毒蛾LdGSTe1蛋白的三维结构模拟Fig.4 Protein three-dimensional structure of LdGSTe1
利用MEGA 6.0软件进行系统进化树分析,来研究昆虫间GST蛋白的进化关系。图5结果表明,Delta和Epsilon家族处于同一分支,再与Theta家族聚为一族;Omega和Zeta家族聚类在一起,再与Delta、Epsilon及Theta家族聚为一族。Sigma家族与其他5个家族距离较远,独立成族,这与张学尧等[23]对飞蝗 LmGST的进化树分析结果一致。LdGSTe1与家蚕、稻纵卷叶螟中Epsilon家族GST聚为一族,因此推测该基因属于舞毒蛾GST Epsilon家族。
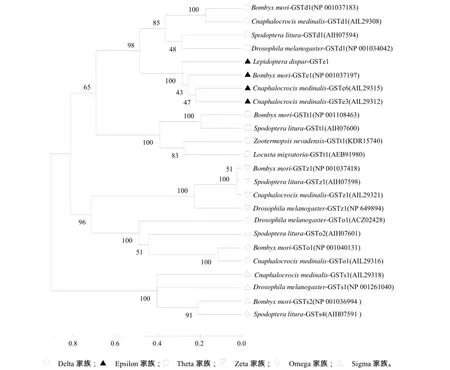
图5 舞毒蛾LdGSTe1蛋白系统进化树Fig.5 Phylogenetic tree analysis of LdGSTe1 protein in L. dispar
2.3鱼藤酮胁迫对舞毒蛾LdGSTe1基因表达的影响
为研究植物源杀虫剂鱼藤酮对舞毒蛾3龄幼虫LdGSTe1基因表达的影响,采用实时荧光定量PCR法,分析LdGSTe1基因在质量浓度分别为4.0、10.0 mg/L的鱼藤酮处理不同时间后的表达差异,结果表明,在4.0 mg/L和10.0 mg/L的鱼藤酮处理下,舞毒蛾3龄幼虫LdGSTe1基因表达均先下降后上升。4.0 mg/L鱼藤酮处理12、24、36、48 h,LdGSTe1基因表达量均下降,处理12 h基因表达量最低,为对照的11%;处理60 h,LdGSTe1基因表达量上升,为对照的3.81倍。10.0 mg/L的鱼藤酮处理12、24、36 h,LdGSTe1基因表达量均下降,处理24 h时基因表达量最低,为对照的 9%;处理 48、60 h,LdGSTe1基因表达量上升,处理 60 h时LdGSTe1基因表达量最大,为对照的3.6倍。

图6 鱼藤酮处理的舞毒蛾3龄幼虫LdGSTe1基因的相对表达量Fig.6 LdGSTe1 gene expression in 3rdinstar larvae of L. dispar under rotenone stress
3 讨论
本研究通过转录组分析和RT-PCR扩增,获得1个舞毒蛾GST Epsilon家族基因,命名为LdGSTe1,该基因编码一个由216个氨基酸组成的多肽,这与已报道的鳞翅目昆虫烟夜蛾(Helicoverpa assulta)HaGSTe1编码区推导表达217个氨基酸残基[24]较为一致。烟夜蛾 HaGST 与其他物种 Epsilon 家族GSTs 结构一样,在 N端由 β-α-β-α-β-β-α的结构基序组成,C端主要有5个α螺旋构成,而舞毒蛾LdGSTe1蛋白N端结构域含有4个β-折叠和7 个α-螺旋,C端含有9个α-螺旋和4个β-折叠,推测其结合的底物存在特异性。NCBI对LdGST蛋白保守结构域预测显示,第3~77位为保守的N端结构域GST_N_Delta_Epsilon,在第91~207位为C端结构域GST_C_Delta_ Epsilon,同源氨基酸比对和系统发育分析显示,舞毒蛾GST属于Epsilon家族,这可能是由于Epsilon 亚族是从Delta 亚族进化而来的缘故[5]。
昆虫GST家族中Delta和Epsilon家族已被证实参与昆虫抗药性形成[7]。已有研究发现,双翅目昆虫中埃及伊蚊 AaGSTe2和冈比亚按蚊 AgGSTe2 对DDT、有机磷农药和拟除虫菊酯类农药均具有代谢作用[25];黑腹果蝇DmGSTe6和DmGSTe7基因对甲基对硫磷具有代谢作用[26];鳞翅目昆虫中家蚕GST Epsilon家族具有过氧化酶活性和抗氧化压力的功能[27-28]。研究[29]表明,GSTs 参与抗药性的机制是由于其表达量的提高。本研究通过实时荧光定量PCR检测显示,舞毒蛾3龄幼虫经鱼藤酮触杀后,LdGSTe1基因相对表达量在后期出现上升,推测其过量表达参与了解毒反应。
[1] Qin G H,Jia M,Liu T,et al.Heterologous expression and characterization of a sigma glutathione S-transferase involved in carbaryl detoxification from oriental migratory locust,Losusta migratoria manilensis(Meyen)[J]. J Insect Physiol,2012,58(2):220-227.
[2] Sheehan D,Meade G,Foley V M,et al.Structure,function and evolution of glutathione transferases:implications for classification of non-mammalian members of an ancient enzyme superfamily[J].Biochem J,2001,360:1-16.
[3] Li X,Schuler M A,Berenbaum M R.Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J].Annu Rev Entomol, 2007,52:231-253.
[4] Chelvanayagam G,Parker M W,Board P G.Fly fishing for GSTs:a unified nomenelature for mammalian and insect glutathione transferases[J].Chem Biol Interact,2001,133:256 - 260.
[5] Robert F.Genomic organization of the glutathione S-transferase family in insects[J].Mol Phylogen Evol,2011,61(3):924 - 932.
[6] Enayati A A,Ranson H,Hemingway J.Insert glutathione transferases and insecticide resisirance[J].Insect Mol Biol,2005,14(1):3-8.
[7] Yang M L,Zhang J Z,Zhu K Y,et al. Mechanisms of organophosphate resistance in a field population of oriental migratory locust,Locusta manilensis (Meyen) [J]. Arch Insect Biochem Physiol,2009,71(1):3-15.
[8] Ranson H,Rossiter L,Ortelli F,et al.Identification of a novel class of insert glutathione S-transferases involved in resistance to DTT in the malaria vector Anopheles gambiae[J].Biochem J,2001,359(Pt 2):295-304.
[9] Syvanen M,Zhou Z H,Wang J Y.Glutathione transferase gene family from the housefly Musca domestica[J].Mol Gen Genet,1994,245(1):25-31.
[10] Rauch N,Nauen R.Characterization and molecule cloning of a glutathione S-transferase from the whitefly Bemisia tabaci(Hemiptera:Aleyrodidae)[J].Insect Biochem Mol Biol,2004,34(4):321-329.
[11] Lazarevic J,Peric V,Ivanovic J,et al.Host plant effects on the genetic variation and correlations in the individual performance of the gypsy moth [J].Funct Ecol,1998,12(1):141-148.
[12] 曹传旺,孙丽丽,问荣荣,等.舞毒蛾LdOA1基因克隆分析及对3种杀虫剂胁迫的响应[J].林业科学,2014,50(8):102-106.
[13] Toung Y P,Hsieh T S,Tu C P.The glutsthione S-transferase D genes.A divergently organized,intronless gene family in Drosophila melanogaster[J].J Biol Chem,1993,268(13):9737-9746.
[14] Prapanthadara L,Ranson H,Somboon P,et al.Cloning,expression and characterization of an insert class I glutathione S-transferase from Anopheles dirus spscies B[J].Insect Biochem Mol Biol,1988,28(5/6):321-329.
[15] Sonoda S,Ashfaq M,Tsumuki H.Genomic organization and developmental expression of glutathione S-transferase genes of the diamondback moth,Plutella xylostella[J].J Insect Sci,2006,6:1-9.
[16] Valles S M,Perera O P,Strong C A.Purification,biochemical characterization,and cDNA cloning of a glutathione S-transferase from the red imported fire ant,Solenopsis invicta[J].Insect Biochem Mol Biol,2003,33(10):981-988.
[17] Walker J M.The proteomic protocols handbook[M].New York:Humana Press,2005.
[18] Blom N,Gammeltoft S,Brunak S.Sequence and structure-based prediction of eukaryotic protein phosphorylation sites[J].J Mol Biol,1999,294(5):1351-1362.
[19] Arnold K,Bordoli L,Kopp J,et al.The SWISS-MODEL Workspace:a web-based environment for protein structure homology modelling[J].J Bioinformatics,2006,22(2):195-201.
[20] Bordoli L,Schwede T.The SWISS-MODEL Repository and associated resources[J].J Nucleic Acids Research,2009,37:387-392.
[21] Peitsch M C.Protein modeling by E-mail[J].J Bio/ Technology,1995,13:658-660.
[22] Pfaffl M W,Horgan G W,Dempfle.Relative expression software tool(REST) for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J].Nucleic Acids Research,2002,30(9):e36.
[23] 张学尧,王建新,郭艳琼,等.飞蝗谷胱甘肽S-转移酶基因克隆、序列分析及表达特征[J].昆虫学报,2012,55(5):520-526.
[24] 杨新影,李亮,安世恒,等.烟夜蛾谷胱甘肽S-转移酶基因的克隆、序列分析与表达[J].昆虫学报,54(6):648-656.
[25] Ortelli F,Rossiter L C,Vontas J,et al.Heterologous expression of four glutathione transferase genes genetically linked to a major insecticide-resistance locus from the malaria vector A–nopheles gambiae [J]. Biochemical Journal,2003,373:957-963.
[26] Alias Z,Clark A G.Adult Drosophila melanogaster glutathione S-transferases:effects of acute treatment with methyl parathion[J]. Pesticide Biochemistry and Physiology,2010,98:94-98.
[27] Yamamoto K,Aso Y,Yamada N C.Catalytic function of an Epsilon-class glutathion S-transferase of the silkworm[J]. Insect Molecular Biology,2013,22(5):523-531.
[28] Ma B,Chang F N.Purification and cloning of a delta class glutathione transferase displaying high peroxidase activity isolated from the German cockroach Blattella germanica[J].FEBS Journal,2007,274:1793-1803.
[29] Grant D F.Evolution of glutathione S-transferase subunits in culicidae and related nematocera:electrophoretic and immunological evidence for conservedenzyme structure and expression[J]. Insect Biochem,1991,21(4):435-445.
责任编辑:罗慧敏
英文编辑:罗 维
Cloning and functional analysis of GSTe1 gene from Lymantria dispar
Wen Rongrong, Wang Buyong, Ma Ling*
(School of Forestry, Northeast Forestry University, Harbin 150040, China)
Accroding to the transcriptome of the 3rdinstar larva of Lymantria dispar(L. dispar), a Glutathione S-transferase gene was determined and obtained, which named LdGSTe1. The open reading frame (ORF) of LdGSTe1 was 651 bp encoding a protein of 216 amino acid residues. Sequence analysis showed that the amino acid sequences of LdGSTe1 protein contained two conserved domains, namely GST_C_Delta_Epsilon and GST_N_Delta_Epsilon,belonging to the thioredoxin-like superfamily and glutathione S-transferase superfamily. Phylogenetic tree analysis indicated that the LdGST belonged to GST Epsilon family. Protein structure showed LdGSTe1 contains an N-terminal and C-terminal, and organized mainly into α-helix and β-sheet. The expression of LdGSTe1 in 3rdinstar larvae L. Dispar under 4.0, 10.0 mg/L rotenone treatment was investigated using real-time fluorescence quantitative PCR. The results showed that the expression of LdGSTe1 in L. dispar was first down-regulated and then up-regulated. Therefore, LdGSTe1 gene was speculated to participate in the detoxification response of L. dispar.
Lymantria dispar; Glutathione S-transferase gene; cloning; gene expression analysis
问荣荣(1987—),女,山西大同人,博士研究生,主要从事森林害虫防治研究,wenrongrong87@163.com;*通信作者,马玲,博士,教授,主要从事昆虫生态学研究,maling63@163.com
S763.42;Q785
A
1007-1032(2016)04-0386-07
2015-12-13 修回日期:2016-04-05
国家“863”计划项目(2013AA102701);黑龙江省自然科学基金项目(ZD201404);中央高校基本科研业务专项(2572016AA09)
