NaCl胁迫对祁连山野生黄瑞香叶片光合叶绿素荧光特性的影响
2016-08-06王勤礼郭有燕张亚娟侯梁宇
闫 芳,王勤礼,郭有燕,张亚娟,侯梁宇
(1 甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000;2 河西学院 河西走廊设施蔬菜工程技术研究中心,甘肃张掖 734000)
NaCl胁迫对祁连山野生黄瑞香叶片光合叶绿素荧光特性的影响
闫芳1,2,王勤礼1,2,郭有燕2,张亚娟2,侯梁宇2
(1 甘肃省高校河西走廊特色资源利用省级重点实验室,甘肃张掖 734000;2 河西学院 河西走廊设施蔬菜工程技术研究中心,甘肃张掖 734000)
摘要:以4片真叶黄瑞香幼苗为材料,设置不同浓度(0、50、100、150、200 mmol·L-1)NaCl胁迫处理,采用温室砂培实验系统考察了其幼苗叶绿素含量、叶绿素荧光参数及气体交换参数等光合生理指标的变化。结果表明:(1)在正常环境条件下(对照),黄瑞香叶片净光合速率(Pn)、气孔导度(Gs)的日变化曲线呈双峰型,蒸腾速率(Tr)日变化曲线呈单峰型;较高浓度(>100 mmol·L-1)NaCl胁迫改变了黄瑞香叶片光合特性日变化曲线,导致其Pn、Tr、 Gs日变化曲线整体下降,而胞间CO2浓度(Ci)日变化曲线整体上升。(2)低浓度(50 mmol·L-1)NaCl胁迫对黄瑞香叶片叶绿素含量及其比值无显著影响,但较高浓度(>100 mmol·L-1)NaCl胁迫则使叶绿素含量显著下降,其比值下降则较平缓。(3)较高浓度(>100 mmol·L-1)NaCl胁迫使得黄瑞香叶片最大荧光(Fm)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ光下最大捕光效率(Fv′/Fm′)、光化学荧光猝灭系数(qP)、PSⅡ实际光化学效率(ΦPSⅡ)均显著下降,却使其初始荧光(F0)和非光化学猝灭(NPQ)显著上升。研究发现,随着盐胁迫浓度的增加,引起黄瑞香光合速率下降的主要原因是非气孔因素;在轻度NaCl胁迫下黄瑞香有较强的忍耐性,而重度NaCl胁迫则显著降低了叶片的光合机构活性,加剧了光抑制程度,从而严重限制了其叶片的光合作用效率。
关键词:黄瑞香;NaCl胁迫;叶绿素荧光;光合作用
黄瑞香(DaphnegiraldiiNitsche)为瑞香科瑞香属小灌木,植株高40~120 cm,胸径可达80 cm,分布在中国甘肃、青海等海拔2 000~2 600 m的山坡灌丛、林缘、沟谷地带[1]。黄瑞香适应性强,较喜冷凉湿润气候,也耐寒耐热,其叶片墨绿有光泽,花清香淡雅,果色鲜红,具有较高的观赏价值,对改善西北地区的大地面貌和生态保护具有重要的开发价值[2]。同时,黄瑞香的茎皮也是中国治疗风湿和止痛的常用中药,具有祛风除湿、止痛散瘀、抗肿瘤活性等作用[3]。随着人们对黄瑞香应用价值认识的深入,其需求量与日俱增,导致黄瑞香野生种质资源植株数量越来越少,现已被国家列为三级保护植物[4]。目前黄瑞香人工栽培技术尚未成熟,相关的基础研究较少,多集中在其茎皮的化学成分和活性成分[5-8]等方面,而对其人工栽培方面关于盐胁迫对黄瑞香幼苗光合生理与叶绿素荧光方面的研究未见报道。
土壤盐渍化是农业栽培生产中主要障碍之一,在土壤盐分较高的地区常规农作物很难正常生长,若能种植抗盐性强且能适应地区气候的耐盐经济植物,不仅能增加加工产品农业资源,还可有助于区域内土地的水土保持、盐土土壤改良和生物治理[9]。盐胁迫会诱发植物体内某些功能和结构发生改变而适应新环境,也会明显影响植物的光合等生理特性,植物耐盐的重要机理之一就是维持光合功能[10]。随着盐胁迫和光抑制对植物生长发育的限制作用日益突出,许多学者围绕盐胁迫对不同作物组织光合机构的影响进行了广泛研究,大多集中在农作物或草本植物上[11-12],而对西北地区灌木类植物研究较少[13],且迄今围绕盐胁迫对不同植物种类、植物组织的光系统和光化学效率的影响有许多报道,但结论并不一致[14-15]。本研究通过盆栽实验,考察了中性盐(NaCl)胁迫下黄瑞香幼苗光合作用、荧光参数与叶绿素含量的变化,了解盐胁迫对其生长的影响,旨在为黄瑞香大面积的引种驯化和规模化栽培提供理论基础和实践指导。
1材料和方法
1.1试验材料与设计
供试黄瑞香种子采自武威市天祝县祁连乡布尔草原(103°33′26″E,38°43′31″N),坡向东西,坡位中下部,坡度约为25°,土壤为山地沙壤黑钙土。将种子清水浸泡12 h,去除外果皮与湿沙混合后藏于5 ℃冰箱中层积3个月,后再播种于装有蛭石的穴盘中,于25 ℃光照培养箱中育苗,光强1 200 lx,相对湿度50%,保持基质湿润。在第9天,挑选生长一致的幼苗,移栽河西学院温室进行砂培,每处理重复3次,每盆3株。采用1/2Hoagland培养液浇灌,温室自然光照。培养至4片真叶时开始在营养液中加入NaCl进行胁迫处理,浓度分别为50、100、150、200 mmol·L-1,以不加NaCl溶液的1/2Hoagland营养液作为对照。每2 d灌1次相同体积的培养液,灌前用去离子水充分淋洗石英砂基质。胁迫5 d后开始进行各项指标的测定。
1.2测定指标与方法
1.2.1光合作用气体交换参数选择晴朗无风的天气,采用英国产CIRAS-2型光合测定仪对每个处理的植株顶部3片叶子进行测定,每片叶子记录3个值。试验于2015年7月18日8:00~18:00进行,每隔2 h测定1轮,测得净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)的日变化。测定当天(7月18日)甘肃省张掖市光合有效辐射和叶片温度如图1所示。
1.2.2叶绿素含量叶绿素含量采用乙醇和丙酮混合液浸提法提取,用分光光度法测定浸提液在645和663 nm处的吸光度值A645和A663,按Lichtenchaler 公式计算叶绿素a(mg·g-1)和叶绿素b(mg·g-1)含量。材料取每个处理分属不同植株顶部的3片叶子。
1.2.3叶绿素荧光参数在早10:00测定完光合作用气体交换参数后,立即用便携式荧光仪(Handy-PEA,英国Hansatech公司)对相同叶片进行叶绿素荧光参数的测定。测定前首先将叶片暗适应30 min,照射检测光后测得初始荧光(F0),在F0之后用强饱和脉冲光(3 000 μmol·m-2·s-1)激发,使原初电子受体QA全部处于还原状态,测得最大荧光值(Fm),并计算可变荧光Fv(Fv=Fm-F0)。Fv/Fm代表PSⅡ最大量子效率,F表示作用光下任一时间的荧光值。在施加作用光的同时用饱和脉冲光闪光,使QA处于瞬时最大还原状态,得到荧光值Fm′和稳态荧光Fs,其他叶绿素荧光参数计算公式如下:
PSⅡ开放反应中心转化效率Fv′/Fm′= (Fm′-F0′)/Fm′
光化荧光猝灭系数qP= (Fm′-Fs)/(Fm′-F0′)
PSⅡ实际光化学效率ΦPSⅡ= (Fm′-Fs)/Fm′非光化学猝灭系数NPQ=Fm/Fm′-1
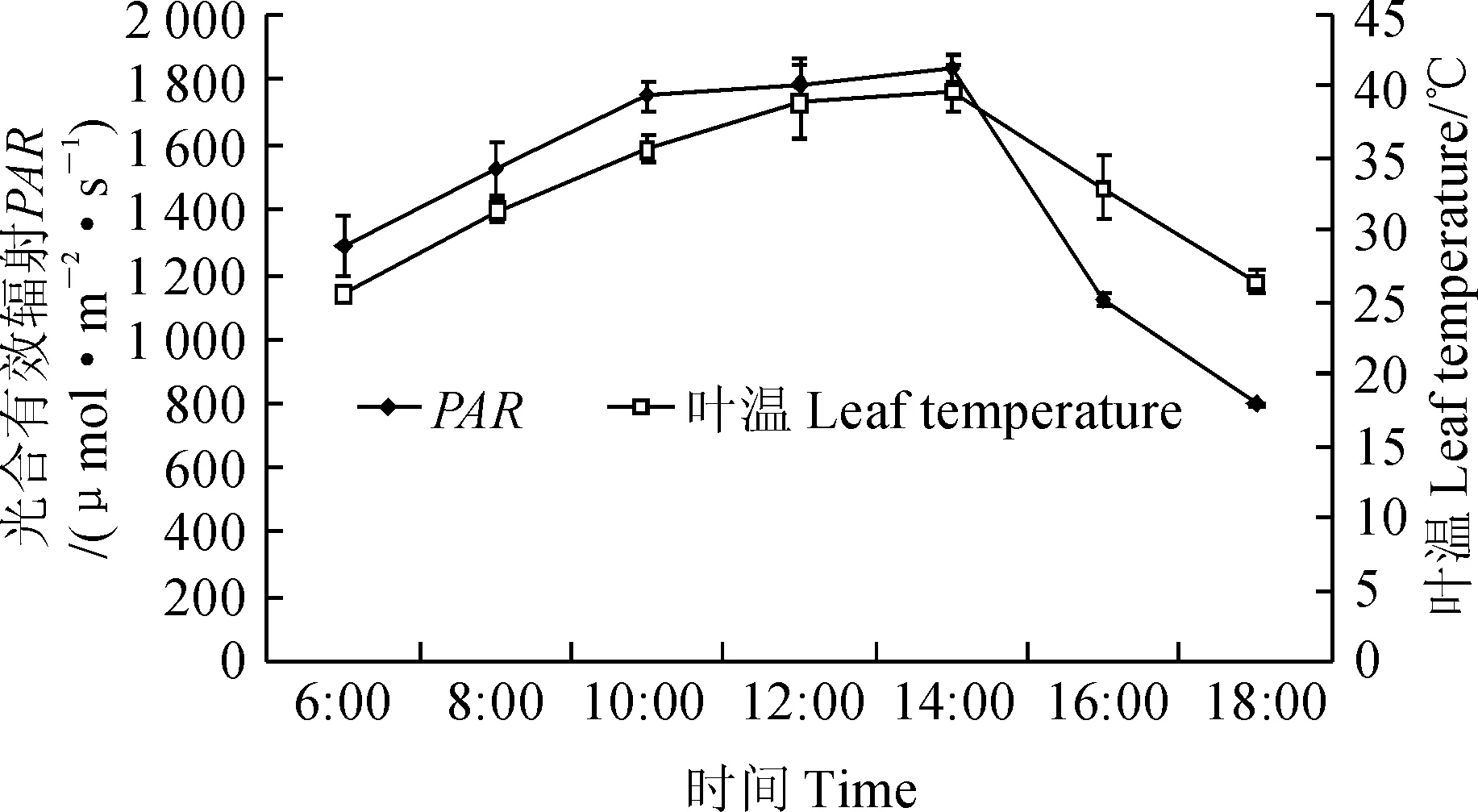
图1 2015年7月18号张掖市光合有效辐射和叶片温度日变化Fig. 1 Diurnal fluctuations of photosynthetically active radiation (PAR)and leaf temperature in full sunlight on July 18,2015 in Zhangye
1.3数据处理
试验数据利用Origin 8.5做图,采用SPSS 19.0进行统计分析,计算各处理性状的平均值、标准误,并进行相关性分析。
2结果与分析
2.1盐胁迫对黄瑞香幼苗叶绿素含量的影响
外部环境的改变可以引起植物叶片叶绿素含量和比例的变化,进而会引起植物光合功能的改变[16]。表1显示,黄瑞香幼苗叶片叶绿素总量[Chl(a+b)]、叶绿素a(Chl a)和叶绿素b(Chl b)含量在低度盐胁迫(50 mmol·L-1)下均与对照(CK)无显著差异(P>0.05);叶绿素含量在中度盐胁迫(100~150 mmol·L-1)时已比对照显著下降(P<0.05),但中度盐胁迫处理之间没有显著差异;叶绿素含量在重度盐胁迫(200 mmol·L-1)时降至最低值,且显著低于对照和其余盐胁迫处理(P<0.05)。同时,叶绿素a与叶绿素b 的比例(Chl a /Chl b)随着各叶绿素含量的变化而改变。受Chl a和Chl b在各盐胁迫条件下不同下降程度的影响,Chl a /Chl b只在中重度盐胁迫处理(150~200 mmol·L-1)显著小于对照(P<0.05),而150和200 mmol·L-1浓度处理间无显著差异;虽然黄瑞香幼苗叶片叶绿素相对含量在盐胁迫下皆呈明显递减趋势,但Chl a/Chl b值变化相对平缓,即使在重度盐胁迫条件下也能保持相对稳定。
2.2盐胁迫对黄瑞香幼苗光合作用参数日变化的影响
2.2.1净光合速率(Pn)日变化不同浓度盐胁迫对黄瑞香幼苗净光合速率(Pn)日变化影响较大(图2,A)。其中,对照叶片Pn的日变化呈双峰曲线,第1个较高峰值出现在12:00,第2个较低的峰值出现在16:00。黄瑞香叶片的Pn值在各浓度的盐处理下均不同程度地下降,但其在低盐胁迫处理下与对照差异不大,而随着盐浓度的进一步升高,Pn下降的幅度越来越大,峰值降低而出现时间提前,尤其是150~200 mmol·L-1NaCl处理使得叶片的光合午休由对照和中低浓度处理的14:00提前至12:00。

表1 盐胁迫下黄瑞香叶绿素含量及比值的变化
注: 表中测定值均以鲜质量为基础,数据为3次测定均值±标准误;同列中不同字母表示处理间差异达到0.05显著水平。
Note: The values in the table were tested by fresh weight, and the data were 3 times of the mean value±standard error, Different letters in the same column indicate significant differences among treatments at 0.05 level.
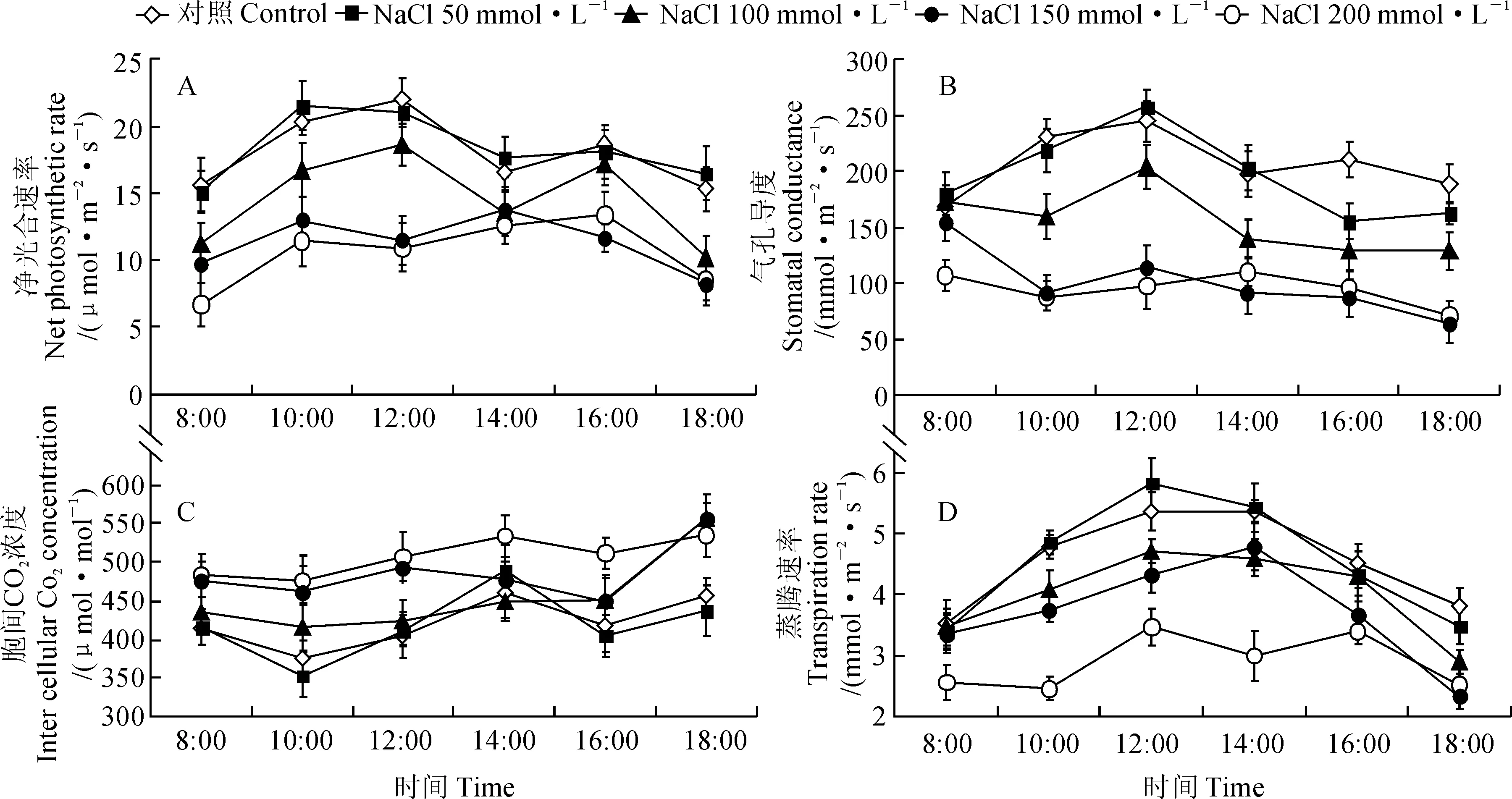
图2 不同浓度盐胁迫下黄瑞香叶片 Pn、 Gs、 Ci和 Tr 的日变化曲线Fig. 2 Diurnal changes of Pn, Gs, Ci and Tr in D. giraldii leaves under different NaCl stress treatments
2.2.2气孔导度(Gs)日变化如图2,B所示,在无盐胁迫条件(对照)下,黄瑞香幼苗的气孔导度(Gs)日变化趋势与Pn相一致,其叶片的Gs日变化呈双峰曲线,最高值出现在12:00,且8:00与18:00的值相差不大。低浓度盐胁迫处理Gs与对照相比递减的顺序也与相应的Pn变化规律相似,特别是NaCl浓度为50 mmol·L-1时的Gs值与对照差异不大;随着盐胁迫程度的加剧,幼苗Gs值呈下降趋势,且下降幅度随着盐浓度的增大而增大;重度盐处理条件下Gs值下降幅度最大,其自12:00达到峰值后一路降低,日变化曲线也发生了改变,总体呈单峰曲线。
2.2.3胞间CO2浓度(Ci)日变化由图2,C可以看出,正常情况下(对照),黄瑞香的胞间CO2浓度(Ci)于10:00下降至最低值,而在14:00达最高值。各浓度盐胁迫幼苗叶片Ci的变化趋势基本相同,表现为低度和中度盐胁迫下Ci值小幅度高于对照,但在重度盐胁迫下Ci值上升幅度较大,且低盐胁迫的黄瑞香叶片Ci值变化与对照较为一致;中低度盐胁迫Ci值的峰值和最低值出现的时间点变化较为一致,而重度盐胁迫的峰值已不明显。
2.2.4蒸腾速率(Tr)日变化图2,D表明,各浓度盐胁迫后黄瑞香幼苗叶片的蒸腾速率(Tr)全日均表现为单峰型的变化趋势,最高值出现在12:00~14:00左右;各浓度盐胁迫条件下黄瑞香叶片的Tr与对照相比整体呈下降趋势,且随着盐浓度的增大下降幅度逐渐增大,尤以高盐胁迫表现最为明显;低中度盐胁迫处理的Tr值变化趋势与对照基本相似,且相互之间差异也不明显,但在重度盐胁迫处理叶片Tr值的日变化趋于平缓且峰值不如对照明显。
2.2.5影响光合速率的因素对不同浓度盐胁迫下黄瑞香主要光合作用参数与叶绿素指标进行相关分析结果(表2)表明,叶片Pn与Gs和Tr均呈极显著正相关(P<0.01),而与叶绿素指标相关不显著(P>0.05);Ci与Pn呈极显著负相关,而与Gs、Tr均呈显著负相关(P<0.05),与叶绿素指标也呈负相关但不显著。这种负相关说明黄瑞香幼苗净光合速率随光强增加而增高是由于其叶肉细胞光合活性增大的结果,而非Ci降低的结果,但不能由这种负相关就得出Ci越低则光合速率越高的结论。说明在盐胁迫条件下,黄瑞香幼苗叶片光合作用强度降低可能是受到其叶片气孔的关闭及胞间CO2浓度的影响,而与光合色素的含量关系不大。
2.3盐胁迫对黄瑞香幼苗叶绿素荧光参数的影响
叶绿素荧光参数能在一定程度上反映光合机构内部一系列重要的调节过程[17]。F0(初始荧光)、Fm(最大荧光)分别指光系统Ⅱ(PSⅡ)反应中心处于完全开放和完全关闭时的荧光水平,而F0的升高与PSⅡ反应中心的D1蛋白失活有关[18]。其中,黄瑞香幼苗受到不同程度盐胁迫后,其叶片F0均有所增加,尤以重度盐胁迫增加幅度最大,而中度盐处理间差异不显著,但各盐胁迫处理与对照间均达到显著差异水平(P<0.05),这说明盐胁迫使PSⅡ反应中心可逆失活或受损(图3,A);同时,随盐胁迫浓度的升高,黄瑞香幼苗叶片Fm值呈下降趋势,尤以低度盐胁迫下降幅度最大,且各盐浓度处理与对照间差异均达到了显著水平(P<0.05),表明PSⅡ反应中心的电子传递能力在低盐胁迫时已明显减弱(图3,B)。
另外,Fv(可变荧光)为Fm与F0的差值,代表原初电子受体(QA)的还原状态[19];而Fv/F0、Fv/Fm则均可反映PSⅡ最大量子效率。图3,C、D显示,随着盐胁迫浓度的升高,黄瑞香幼苗叶片Fv/F0和Fv/Fm值均有所减小,且各浓度处理与对照相比均呈显著下降趋势(P<0.05)。这说明黄瑞香幼苗叶片PSⅡ反应中心已因盐胁迫而受到了伤害,其潜在活性和原初光能转换效率明显减弱,因此植物体内发生了光合作用的光抑制。
与此同时,各浓度NaCl胁迫对黄瑞香叶片PSⅡ实际光化学效率(ΦPSⅡ)、开放的PSⅡ反应中心捕获激发能转化效率(Fv′/Fm′)、光化荧光猝灭系数(qP)和反映热耗散变化的非光化荧光猝灭系数(NPQ)均具有显著性影响(图4)。其中,Fv′/Fm′是PSⅡ有效光化学量子产量,反映开放的 PSⅡ反应中心原初光能捕获转化效率;qP是对原初电子受体质体醌QA氧化态的一种量度,可以反映光合电子链的电子传递速率;NPQ是 PSⅡ天线色素吸收的不能用于光合电子传递而以热能的形式耗散掉的光能部分,反映光系统对过剩光能的耗散能力。在低盐浓度(50 mmol·L-1)胁迫条件下,黄瑞香叶片Fv′/Fm′比对照有所下降,ΦPSⅡ、qP、NPQ与对照相比无显著性差异;在100~200 mmol·L-1浓度的盐胁迫条件下,叶片Fv′/Fm′、qP和ΦPSⅡ均随着盐浓度的增大而显著下降,而NPQ则随之显著上升。可见,在中高浓度盐胁迫条件下,黄瑞香幼苗叶片 PSⅡ过剩光能通过非光化学途径以热的形式耗散的比例增加,以减小胁迫条件下过剩光能对其光系统的破坏。
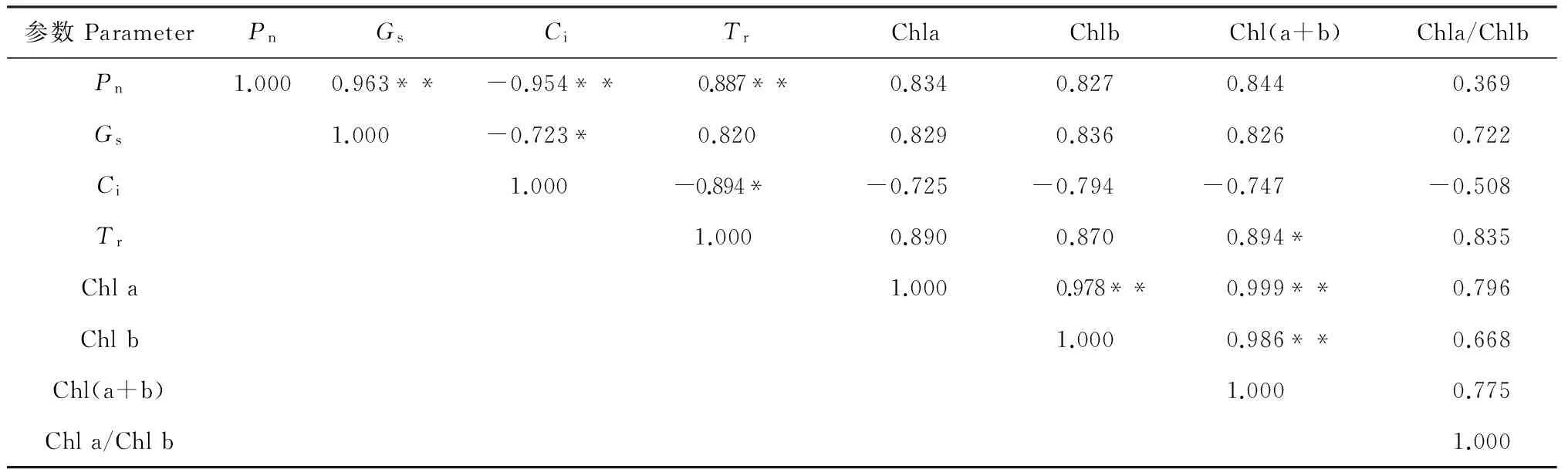
表2 黄瑞香主要光合参数与叶绿素指标的相关矩阵
注:* 表示显著相关(P<0.05);** 表示极显著相关(P<0.01)
Note: *indicates a significant dependence(P<0.05);** indicate a very significant dependence(P<0.01)
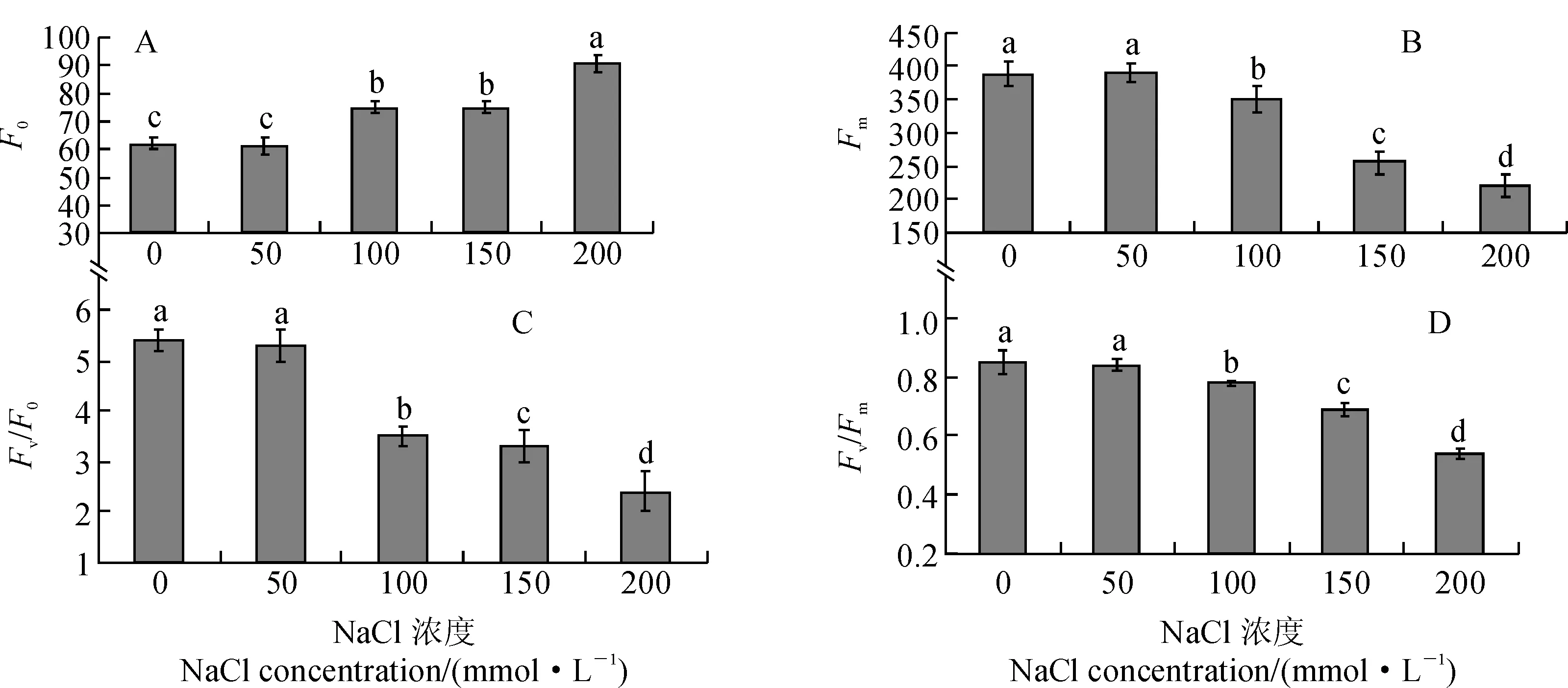
不同字母表示处理间差异达到0.05显著水平;下同图3 盐胁迫下黄瑞香叶片F0、Fm、Fv/F0和Fv/Fm的变化Different letters indicate significant differences among treatments at 0.05 level.The same as below.Fig. 3 Impacts of NaCl stress on F0, Fm, Fv/F0 and Fv/Fm of D. giraldii leaves
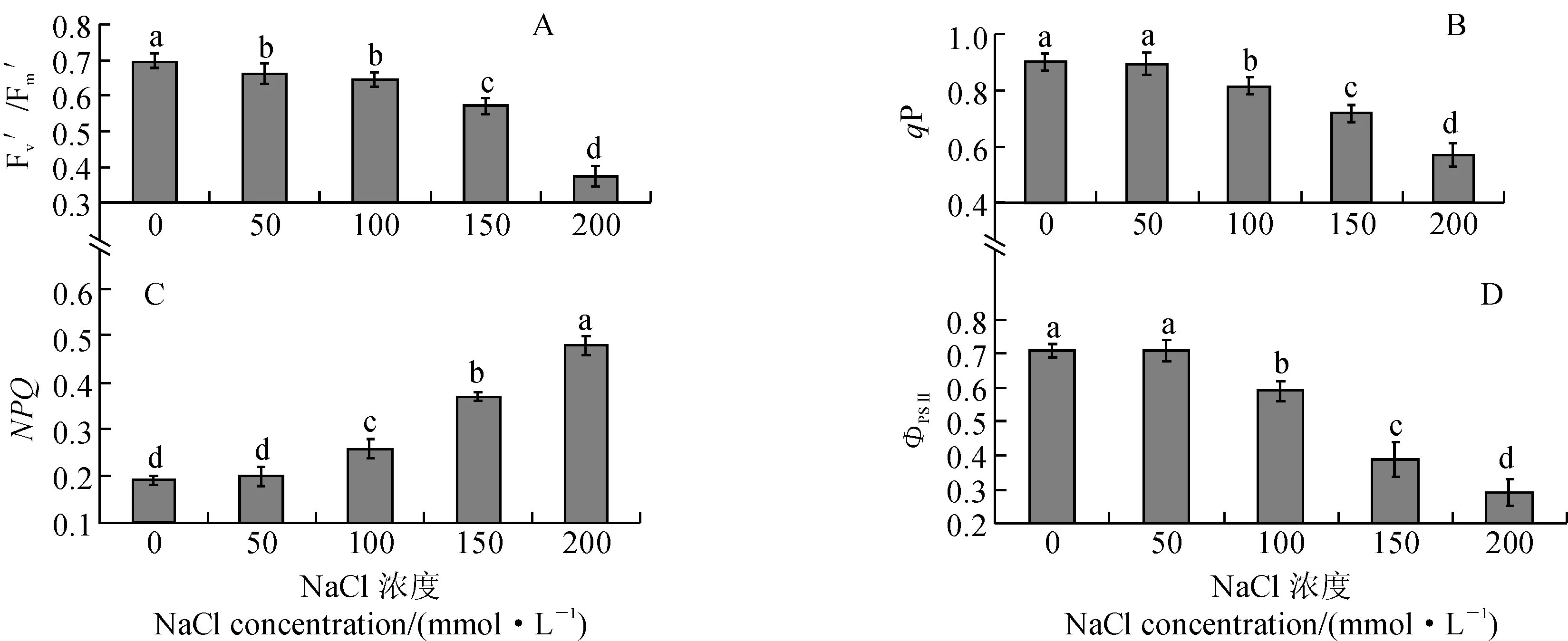
图4 盐胁迫下黄瑞香叶片Fv′、 Fm′、 qP 、 NPQ 和 ΦPSⅡ的变化Fig. 4 Impacts of NaCl stress on Fv′, Fm′, qP , NPQ and ΦPSⅡ of D. giraldii leaves
3讨论
盐胁迫对植物生长代谢的影响机理是一个非常复杂的问题,在植株的生长受到胁迫而产生一系列生理反应的过程中,光合特性和叶绿素荧光特性的变化尤为明显[20]。本试验结果表明,随着盐胁迫浓度的升高,黄瑞香幼苗的净光合作用速率(Pn)逐渐减小,但其在轻度盐胁迫并没有明显下降,而重度盐胁迫降低幅度较大,这表明黄瑞香幼苗光合作用受重度土壤盐胁迫的影响较大,进而会干扰植株的正常生长。影响Pn大小的因素主要有Gs、Tr和Ci等,它们在植物光合作用的顺利进行过程中协同发挥作用[21]。依据Farquhar[22]的理论,盐胁迫下叶片气孔收缩,气孔导度降低,从而限制了CO2向叶绿体的输送,使光合速率降低,气孔导度减小和叶片胞间CO2浓度逐渐升高,说明光合速率下降逐渐以非气孔因素限制为主,即叶肉细胞光合活性下降。本试验中各浓度盐胁迫处理下黄瑞香幼苗叶片Pn、Gs、Tr均较对照有所降低,而Ci则呈上升趋势,Gs、Tr和Ci的日变化趋势基本相似。这说明盐胁迫下黄瑞香光合速率的下降主要原因是由于叶肉细胞光合活性的下降导致的非气孔限制造成的[23],同时也说明在盐胁迫下植株可能通过降低Gs来减少水分蒸腾以适应盐胁迫,Tr在盐胁迫条件下呈下降趋势也证实了这点,并且Pn的下降与Ci之间并没有此消彼长的关系,这与薛焱等对长叶红砂的研究结果相似[24]。此外,本试验中重度盐胁迫不仅使黄瑞香幼苗的Pn全都低于对照,并且使其日变化曲线发生改变,体现为其幼苗叶片的“午休现象”较对照提前,与此现象有关的影响因素有生态、生理和生化因子,具体原因还有待进一步的研究。
叶绿素作为光合色素中重要的色素分子,一方面摄取外界光源保证植物叶片顺利进行光合作用,另一方面还参与光合作用中光能的吸收、传递和转化。叶绿素a、全部叶绿素b为聚光色素,具有收集、传递光能给少数反应中心色素叶绿素a分子的作用[25]。本试验结果显示,黄瑞香幼苗叶片中叶绿素a与叶绿素b的含量及其比值在轻度盐胁迫条件下与对照没有显著差异,但高浓度盐胁迫下却比对照显著减少,这可能主要是由于随着盐浓度提高,叶绿素水解酶活性增大,叶绿素合成减少,分解增加,从而影响光能吸收、转化,导致光合速率下降[26-27]。
从叶绿素荧光的变化可以了解光合作用过程中光系统对光能的吸收、分配和耗散等一系列反应,能反映出植物受胁迫的情况[28]。叶绿素荧光参数Fv/Fm和Fv/F0是研究植物光合生理状态的重要指标,植株进行光合作用时由于胁迫而受伤害的最初部位与PSⅡ关系密切,盐胁迫会导致叶绿体光合机构的破坏,从而降低PSⅡ原初光能转换效率并抑制PSⅡ潜在活性[29]。本研究结果显示,随着盐浓度的增大黄瑞香叶片初始荧光(F0)显著升高,最大荧光(Fm)、Fv/Fm和Fv/F0在盐胁迫条件下均显著降低,这表明黄瑞香叶片在中高度盐胁迫条件下已经发生了光抑制,致使PSⅡ潜在活性中心受到损伤,PSⅡ的光化学活性受抑制,光合电子在由PSⅡ反应中心向QA、QB及PQ库传递的过程中受到了影响,从而不利于激发捕光色素蛋白复合体(LHC)向PSⅡ进行电子传递[30],进而导致光能转换率降低。在较高浓度的盐胁迫条件下,黄瑞香叶片Fv′/Fm′、qP和ΦPSⅡ均有所下降,而NPQ显著高于对照,说明高盐胁迫下黄瑞香幼苗叶片光合电子传递活性降低,而且越来越多的吸收光能通过非光化学的途径被耗散,表现出黄瑞香幼苗叶片的自我保护机制。光化学效率的下降使NPQ升高,多余的光能无法用于光合电子传递及热散热,吸收的光能在光系统局部大量积累,引发PSⅡ结构的破坏和反应中心的光化学活性降低,这与很多前人的研究结果基本一致[31-33]。
综上所述,光合作用是植物一切生理代谢和生长的基础,光合参数和叶绿素荧光参数可作为快速准确的判断黄瑞香幼苗耐盐程度的重要指标。由以上试验结论我们进一步推断盐胁迫可能是通过破坏黄瑞香叶片PSⅡ机构、影响降低叶绿素含量等非气孔限制因素来影响碳同化速率[34],使光反应速率降低,进一步导致光合速率的下降。低浓度的NaCl胁迫对黄瑞香幼苗影响不显著,可见其对盐环境表现出了一定的适应性和耐受能力。
参考文献:
[1]张勇,刘贤德,李鹏,等.甘肃河西地区微管植物检索表[M].兰州:兰州大学出版社,2001:124-126.
[2]李耀阶.青海木本植物志[M].西宁:青海人民出版社, 1987:222-224.
[3]周光雄, 杨永春, 石建功. 祖师麻活性化学成分研究[J]. 中国中药杂志,2006,31(7): 555-557.
ZHOU G X, YANG Y C, SHI J G. The study of the active components onDaphnegiraldiiseed[J].ChineseJournalofTraditionalChineseMedicine,2006,31(7): 555-557.
[4]李银,王凤林,李书慧, 等. 黄瑞香愈伤组织培养及其二次代谢产物的研究[J].北京中医药大学学报,2008,31(3):199-123.
LI Y, WANG F L, LI S H,etal. Study on callus culture ofDaphnegiraldiiand its secondary metabolites[J].JournalofBeijingUniversityofTraditionalChineseMedicine,2008,31(3):199-123.
[5]KIMURA Y. Inhibition of the formation of 5-hydroxy-6,8,11,14-eicosatetranenoic acid from arachidonic acid in polymorphonuclear leukocytes by various comarins[J].Biochem.Biophys.Acta.1985,834:224-247.
[6]LI S H,WU L J,GAO Y H. A new dicoumarinoid glycoside fromDaphnegiraldii[J].J.Asian.Nat.Prod.Res., 2005,7(6): 839-842.
[7]王成瑞,李士敏,周炳南,等.黄瑞香生物活性二萜的研究[J].化学学报,1987,45(10):993-996.
WANG C R.LI S M, ZHOU B N,etal. The studies on the Bioactive Diterpenes fromDaphneGiraldii[J].ActaChimicaSinica,1987,45(10):993-996.
[8]FENG Y L, ZHAN P G, XIAO C M. Preparative isolation and purification of two phenyl-propanoids fromDaphnegiraldiiNitsche. by HSCCC[J].Chromatographia, 2010, 71: 480-485.
[9]贾亚雄,李向林,袁庆华,等.披碱草属野生种质资源苗期耐盐性评价及相关生理机制研究[J].中国农业科学,2008,41(10): 2 999-3 007.
JIA Y X,LI X L,YUAN Q H,etal. Evaluation of salt-tolerance and the related physiological characteristics of wildElymus[J].ScientiaAgriculturaSinica,2008,41(10): 2 999-3 007.
[10]BRUGNOLI E, LAUTERI M. Effects of salinity on stomatal conductance, photosynthetic capacity, and carbon isotope discrimination of salt-tolerant (GossypiumhirsutumL.) and salt-sensitive (PhaseolusvulgarisL.) C3non-halophytes[J].PlantPhysiology, 1991, 95: 628-635.
[11]孙景宽,陆兆华,夏江宝,等. 盐胁迫对二色补血草光合生理生态特性的影响[J].西北植物学报,2013,33(5):992-997.
SUN J K,LU Z H,XIA J B,etal. Photosynthetic characteristics ofLimoniumbicolorunderSaltstress[J].ActaBotanicaBoreali-OccidentaliaSinica,2013, 33(5):992-997.
[12]孙璐,周宇飞,李丰先,等.盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学,2012,45(16):3 265-3 272.
SUN L,ZHOU Y F,LI F X,etal. Impacts of salt stress on characteristics of photosynthesis and chlorophyll fluorescence of sorghum seedlings[J].ScientiaAgriculturaSinica,2012,45(16):3 265-3 272.
[13]毛桂莲,许兴,梁文裕, 等. 碱性盐胁迫对3种灌木碳同位素分辨率、光合参数及矿质元素的影响[J].核农学报,2015,29(3):521-527.
MAO G L,XU X,LIANG W Y,etal. Effects of Alkali stress on carbon isotope discrimination,photosynthetic gas exchange parameters and mineral element of three shrubs[J].JournalofNuclearAgriculturalSciences,2015,29(3):521-527.
[14]YANG X, LU C. Photosynthesis is improved by exogenousGlycineBetainein salt-stressed maize plants[J].PhysiologiPlantarum,2005,124(3):43-352.
[15]OUERGHI Z,CORNIC G,ROUDANI M,etal. Effect of NaCl on photosynthesis of two wheat species (TriticumdurumandT.aestivum) differing in their sensitivity to salt stress[J].JournalofPlantPhysiology, 2000, 156: 335-340.
[16]张继澍.植物的光合作用[M]//张继澍.植物生理学.北京:高等教育出版社, 2005:105-142.
[17]ZHANG B B, JING W B, WENG M L,etal. Research progress on photosynthetic characteristics of horticulture and landscape tree species under shading condition[J].NonwoodForestResearch, 2009, 27(3):115-119.
[18]YANG X H, WANG W, ZOU Q. Photoinhibition in shaded cotton leaves after exposing to high light and the time course of its restoration[J].ActaBotanicaSinica, 2001,43:1 255-1 259.
[19]张守仁. 叶绿素荧光参数及其意义讨论[J].植物学通报,1999,16(4):444-448.
ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J].ChineseBulletinofBotany,1999,16(4):444-448.
[20]KURBAN H, SANEOKA H, NEHIRA K,etal. Effect of salinity on growth, photosynthesis and mineral composition in leguminous plantAlhagipseudoalhagii(Bieb.)[J].SoilCcienceandPlantNutrition, 1999,(45): 851-862.
[21]刘全吉,孙学成,胡承孝,等. 砷对小麦生长和光合作用特性的影响[J].生态学报, 2009, 29(2): 854-859.
LIU Q J,SUN X C,HU C X,etal. Growth and photosynthesis characteristics of wheat (TriticumaestivumL.)under arsenic stress condition[J].ActaEcologicaSinica, 2009, 29(2): 854-859.
[22]FARQUHAR GD, SHARKEY TD. Stomatal conductance and photosyn-thesis[J].Annu.Rev.Plant.Physio1., 1982, 33: 317-345.
[23]YANG X H, CHEN X Y, GE Q Y,etal. Tolerance of photosynthesis to photoinhibition, high temperature and drought stress in flag leaves of wheat: a comparison between a hybridization line and its parents grown under field condition[J].PlantScience, 2006, 171(3): 389-397.
[24]薛焱,王迎春,王同智. 濒危植物长叶红砂适应盐胁迫的生理生化机制研究[J].西北植物学报,2012, 32(1): 136-142.
XUE Y,WANG Y C,WANG T Z. Physiological and biochemical mechanisms of an endemic halophyteReaumuriatrigynaMaxim. under saltstress[J].ActaBotanicaBoreali-OccidentaliaSinica,2012, 32(1): 136-142.
[25]刘国富,陶宗娅.光合作用[M]//王宝山.植物生理学.北京:科学出版社,2007: 66-106.
[26]李海波, 陈温福, 李全英. 盐胁迫下水稻叶片光合参数对光强的响应[J].应用生态学报,2006,17(9): 1 588-1 592.
LI H B,CHEN W F,LI Q Y. Responses of rice leaf photosynthetic parameters to light intensity under NaCl stress[J].ChineseJournalofAppliedEcology, 2006,17(9): 1 588-1 592.
[27]HOSHIDA H, TANAKA Y, HIBINO T,etal. Enhanced tolerance to salt stress in transgenic rice that overexpresses chloroplast glutamine synthetase[J].PlantMolecularBiology, 2000, 43(1): 103-111.
[28]ANNICK M, ELISABETH P, GERARD T. Osmotic adjustment, gas exchanges and chlorophyll fluorescence of abexaploid triticale and its parental species under salt stress[J].PlantPhysiology,2004,161: 25-33.
[29]LU C M, ZHANG J H. Effects of water stress on photosystemⅡ photochemistry and its thermostability in wheat plants[J].JournalofExperimentalBotany, 1999, 50(336): 1 199-1 206.
[30]XU C C, LI D Q, ZOU Q,etal. Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages[J].ActaPhytophysiologicaSinica, 1999, 25(1): 29-37.
[31]MISHRA S K, SUBRAHMANYAM D, SINGHAL G S. Interactionship between salt and light stress on the primary process of photosynthesis[J].PlantPhysiology, 1991,138: 92-96.
[32]杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J].中国农业科学, 2010,42(8):1 585-1 593.
YANG S P,WEI C Z,LIANG Y C. Effects of NaCl stress on the characteristics of photosynthesis and chlorophyll fluorescence at seedlings stage in different sea island Cotton genotypes[J].ScientiaAgriculturaSinica, 2010,42(8):1 585-1 593.
[33]史庆华,朱祝军, KHALIDAL-AGHABARY,等. 等渗Ca(NO3)2和NaCl胁迫对番茄光合作用的影响[J].植物营养与肥料学报,2004,10(2): 188-191.
SHI Q H,ZHU Z J, KHALIDAAL-AGHABARY,etal. Effects of iso-osmotic Ca(NO3)2and NaCl treatment on photosynthesis in leaves of tomato[J].PlantNutritionandFertilizerScience,2004,10(2): 188-191.
[34]FOYER C H, NOCTOR G. Oxygen processing in photosynthesis: a molecular approach[J].NewPhytologist, 2000, 146: 359-388.
(编辑:裴阿卫)
文章编号:1000-4025(2016)06-1182-08
doi:10.7606/j.issn.1000-4025.2016.06.1182
收稿日期:2016-01-15;修改稿收到日期:2016-06-02
基金项目:甘肃省高校河西走廊特色资源利用省级重点实验室面上项目(XZ1404);甘肃省自然科学基金(1506RJZG052)
作者简介:闫芳(1980-),女,硕士,副教授,在读博士研究生,主要从事中草药资源与利用研究。E-mail:lgod_forever@163.com
中图分类号:Q945.79
文献标志码:文章编码:
Effect of NaCl Stress on the Leaf Photosynthesis and Chlorophyll Fluorescence Parameters ofDaphnegiraldiiNitsche
YAN Fang1,2, WANG Qinli1,2, GUO Youyan2, ZHANG Yajuan2, HOU Liangyu2
(1 Key Laboratory of Hexi Corridor Resources Utilization of Gansu University, Zhangye, Gansu 734000, China;2 Research Center of Vegetable Engineering and Technology of Hexi University, Zhangye, Gansu 734000, China)
Abstract:With four true leaves of Daphne giraldii Nitsche as the material, we investigated the effects of various NaCl stress(50,100,150 and 200 mmol·L-1)on photosynthetic physiological indexes as seedling photosynthetic pigment content, chlorophyll fluorescence parameters and gas exchange parameters of D. giraldii Nitsche. based on the pots experiments in sand culture systematically. The result showed that: (1) Under a proper environmental condition(Control), the daily variation of Pn and Gs are both illustrated by double-peak curve while the daily variation of Tr is represented by a single peak one, thus the daily variation of D. giraldii Nitsche.’s leaves is changed by a higher-concentrated NaCl stress(>100 mmol·L-1) that causes an overall decline to the daily variation curves of Pn, Tr, as well as Gs, and an overall rise of Ci’s daily variation curve; (2) A lower-concentrated NaCl stress(50 mmol·L-1) has little effects on the leaf chlorophyll content and the ratio of D. giraldii Nitsche and its chlorophyll content declined significantly by a higher-concentrated NaCl stress(>100 mmol·L-1)when the ratio had a slight decrease. (3)Fm,Fv/Fm, Fv′/ Fm′, qP, ΦPSⅡare all declined significantly by a higher-concentrated NaCl stress(>100 mmol·L-1), while F0 and NPQ are both raised significantly. The research shows that with the increasing of NaCl concentration, the reason for leading to the decrease of photosynthetic rate was mainly caused by the no-stomatal factors; D. giraldii Nitsche is fairly resistible of less NaCl stress but a worse NaCl stress may damage the activity of photosynthetic apparatus, thereby surging photo-inhibition and restricting photosynthesis.
Key words:Daphne giraldii; NaCl stress; chlorophyll fluorescence; photosynthesis
