青叶胆开花动态及有性生殖特征的解剖学研究
2016-08-06张爱丽黄衡宇
李 鹂,龙 华,张爱丽,黄衡宇*
(1 吉首大学 植物资源保护与利用湖南省高校重点实验室,湖南吉首 416000;2 云南中医学院 中药材优良种苗繁育工程研究中心,昆明 650500)
青叶胆开花动态及有性生殖特征的解剖学研究
李鹂1,龙华1,张爱丽2,黄衡宇2*
(1 吉首大学 植物资源保护与利用湖南省高校重点实验室,湖南吉首 416000;2 云南中医学院 中药材优良种苗繁育工程研究中心,昆明 650500)
摘要:对中国云南区域性特色药用植物青叶胆(Swertia mileensis)单花开放、雌雄配子体形成、胚胎发育过程进行了观察研究。结果显示:(1)青叶胆繁殖生长始于每年8月底9月初,蕾期较长,一般为35 d左右;花期较短,2~3 d即完成开花;果实期最长,为40~45 d。(2)青叶胆具有一系列机制来保证其异花授粉,如:花药为丁字着药;雌雄异熟,雄蕊比雌蕊早熟23 h左右,在性成熟时间上二者仅有1~2 h的重叠期;此外,发现一种新的避免自花授粉机制,即雄蕊与雌蕊在空间上位置的变化,花药正面由最先与雌蕊紧贴,倒转180°后,变成背面面对雌蕊,同时花丝发生30°的偏移,导致花药位置最后发生了210°的变化。(3)解剖学观察显示:青叶胆花药4室,花药壁发育为基本型,分化完全的花药壁由5 层细胞组成;绒毡层单层,2型起源,为腺质绒毡层,药室内的“类胎座”或“横格”是早期该层细胞有丝分裂凸入药室中央并原位退化形成的;中层2层;药室内壁退化;表皮宿存,纤维状加厚。小孢子母细胞减数分裂为同时型,四分体排列方式主要为四面体形;成熟花粉为2-细胞或3-细胞类型。子房上位,2心皮,1室;侧膜胎座,薄珠心,单珠被;倒生胚珠;大孢子母细胞减数分裂形成4个大孢子直线形排列,合点端的大孢子具功能,雌配子体发育为蓼型。3个反足细胞宿存,每个细胞均多核和异常膨大,反足吸器明显,并在胚乳之外形成染色较深的类似“外胚乳”的结构。珠孔受精,属有丝分裂前类型。胚乳发育为核型;胚胎发育为茄型。果实成熟时,种子发育至早心形胚阶段,具发达的胚柄。发达的反足细胞和胚柄结构对青叶胆种子的后熟具有重要的生殖适应与进化意义。
关键词:青叶胆;开花;胚胎学;獐牙菜属;生态适应
青叶胆(SwertiamileensisT. N. Ho & W. L. Shi)为獐牙菜属多枝组多枝系一年生草本[1],主要分布于云南红河州的弥勒、开远等地,生于海拔1 300~1 650 m的荒坡稀疏小灌木丛或黄茅草丛间,生长在沙地的阳性山坡或向阳石灰岩坡地上。青叶胆在云南红河哈尼族、彝族地区用于治疗肝炎等疾病具有悠久的历史[2-3],是中国药典历版(1977~2010)收载品种。青叶胆自20世纪70年代从云南省开远、弥勒等地民间发掘出来后,即作为新的药物资源被1974年版的《云南省药品标准》以及1977~2010版的《中华人民共和国药典》所收载。
近年来,国内学者对青叶胆的化学成分以及药理活性进行了一些研究,研究结果[4-5]表明青叶胆具有保肝、抗菌、降血糖、抗胆碱及解痉等多种药理活性。由青叶胆水提取物开发研制的青叶胆片,广泛应用于临床治疗急性病毒性肝炎,疗效显著,能够明显降低患者体内转氨酶(ALT和AST)水平[6]。随着对青叶胆研究的愈加深入,市场对其的需求量也不断扩大,而毁灭性的采挖行为致使野生种群已不多见,同时由于各种人类活动因素的影响,使其生境不断遭到破坏,分布范围日益缩减,野生资源量锐减,遗传多样性大量丧失,趋于渐危状态[7]。因此,对青叶胆开展保护性研究工作已势在必行。导致植物渐濒、濒危的原因很多,在众多的致濒因素中,植物的繁殖过程显得特别重要,已成为当今植物保护生物学领域的一个热点问题[8-9]。另一方面,由于植物胚胎学性状通常受外部环境因素影响较小,具有相对较大的遗传稳定性,一直是系统学研究的重要依据,特别在属以上的系统发育研究中更具重要意义[10-11]。龙胆科的胚胎学性状常被用于讨论该科下的系统位置及科下系统发育[12],獐牙菜属植物的胚胎学研究已有一些报道[12-21],但尚未见青叶胆有关有性生殖方面的报道。本研究对青叶胆单花开放过程、大小孢子发生、雌雄配子体形成以及胚胎发育进行研究,旨在为青叶胆的生殖生物学和保护生物学提供新资料,并为探讨龙胆科内各属间的系统进化关系提供有性生殖方面的证据。
1材料和方法
1.1材料
观察样地设于云南省弥勒县小苍窝(24°15′32″ N,103°29′60″ E及附近,Alt: 1 620 m),标本经云南中医学院黄衡宇教授鉴定为青叶胆(SwertiamileensisT. N. Ho & W. L. Shi)。
1.2方法
2013年8月25日~12月20日,间隔15 d至观察样地进行定株观察记录。其中,10月15~20日、11月5~10日2次进行单花开放记录。
按单花标记时期,在同一种群内分别取相应时期的花芽和花朵固定于改良的FAA固定液中(50%乙醇∶冰乙酸∶甲醛=89∶6∶5)。固定48 h后的材料经50%乙醇冲洗后,爱氏苏木精整染7 d,经10个不同浓度乙醇梯度脱水,5个不同浓度二甲苯透明和渗透,切片石蜡包埋,Leitz切片机切片,切片厚度5~8 μm,中性树胶封片。ZEISS-AxioskopⅡ型显微镜下观察并摄影。
2结果与分析
2.1单花开放过程
青叶胆花基数为4(图版Ⅰ,A)。每年8月底9月初开始繁殖生长,9月10日开始出现幼小花序(图版Ⅰ,B),花原基基本形成,此时苞片与其它部分相比生长较快。15 d后,即9月25日左右,幼小花蕾出现,其顶部略显紫色,其他大部分呈现浅绿色(图版Ⅰ,C);花蕾出现第5 d,即9月30日,花蕾逐渐长大至花萼1/3处,上部由绿转紫,且向下扩展(图版Ⅰ,D);10 d后,即10月10日,花蕾长至几与花萼平齐,紫色区域加深,螺纹明显(图版Ⅰ,E);5 d后,即10月15日,花蕾基部膨大,萼片展开,花瓣即将解螺旋开放(图版Ⅰ,F),此时雄蕊花丝已生长至与雌蕊柱头平齐,花药正面相对花柱并与之平行紧邻(图版Ⅰ,G)。至此,青叶胆繁殖期内的花蕾期结束,历时约35 d左右。
青叶胆开花时期较短,约2~3 d,单花开放时间不固定,大多数集中在上午6:30~8:30间。以1朵花为例,10月16日7:05开花时,花瓣从外向内解旋,先是1个花瓣打开(图版Ⅰ,H),5 min后,即7:10,其余3个花瓣同时展开(图版Ⅰ,I);8:10在完成解旋后的60 min内,花药完成了与柱头由最初正面相对翻转至垂直并略高于柱头(图版Ⅰ,J);30 min后,即8:40,花药完成了与柱头背面相对的另一个90°翻转,同时花丝逐渐偏移柱头约30°,此时花药开始散粉,但柱头处于不可授状态(图版Ⅰ,K),这一时期持续时间较长,可达23 h;第2天,即10月17日7:40,花药处于散粉高峰期,花药、药丝颜色逐渐加深,而柱头仍处于不可授状态(图版Ⅰ,L);4 h后,即11:40,花药进入散粉末期,颜色变黑并开始萎缩,宿存于淡蓝色花丝上,偶见脱落,此时柱头进入可授期(图版Ⅰ,M);2 h后,即13:40,柱头进入最佳可授期,同时子房持续膨大呈宝瓶状(图版Ⅰ,N),这一时期持续约5 h。授粉完成后,柱头颜色逐渐加深变黑,子房进一步膨大(图版Ⅰ,O)。2~3 d后,花萼花瓣逐渐以雌蕊为中心,紧紧向内包拢,花瓣纸质化皱缩,进入果期。青叶胆果实期较长,约40~45 d,以后蒴果从上部裂开,散出种子。青叶胆单花繁殖期从花序出现至蒴果成熟约需80~90 d,期间完成了生活史中最重要的两个过程——减数分裂和受精作用。整个种群花期约120 d。
此外,对青叶胆进行繁育系统检测时发现,种群在盛花期中大约有5%花朵雄蕊在发育早期败育,在花瓣解螺旋打开时雄蕊即已枯萎死亡。这样的小花在以后的发育中,雌蕊生长极好,蒴果内的种子数明显高于平均种子数,表明雄蕊败育不仅是异花授粉的保障之一,同时能将更多的能量资源分配给雌蕊。
2.2小孢子发生和雄配子体形成
青叶胆每枚雄蕊具4个小孢子囊(图版Ⅱ,A),每个小孢子囊的4个角隅处分化出的孢原细胞平周分裂向外产生初生壁细胞,向内产生初生造孢细胞(图版Ⅱ,B),初生壁细胞继续平周分裂产生外层和内层;外层细胞分裂形成药室内壁和中层,内层细胞分裂形成中层和绒毡层(图版Ⅱ,C),至小孢子母细胞时期,分化完全的花药壁由5层细胞组成,由外向内依次为:表皮、药室内壁、2层中层和绒毡层(图版Ⅱ,D)。中层由外层和内层分裂产生的细胞共同组成,按Davis[22]的划分,青叶胆花药壁发育属于基本型。而绒毡层主要来源于初生壁内层,部分来自药隔细胞,为二型起源。
外观大多为多边形的次生造孢细胞经过生长发育,体积进一步增大,变为圆形的小孢子母细胞。青叶胆小孢子母细胞时期较为短暂,一经形成即进行减数分裂,减数分裂大约经历10 d,花朵外形如图版Ⅰ,D。小孢子母细胞进入减数分裂期时,中层细胞开始退化,而起源于药隔部分的绒毡层细胞在发育过程中进行平周分裂凸入药室腔内,形成“类胎座”或“横格”(图版Ⅱ,E)。小孢子母细胞经减数分裂(图版Ⅱ,F~I)后形成小孢子四分体(图版Ⅱ,J),其胞质分裂为同时型,四分体排列方式主要为四面体形,花朵外形如图版Ⅰ,F;此时,绒毡层细胞强烈解体,原位退化,药室内具有的退化绒毡层核是早期该层细胞有丝分裂凸入药室中央并原位退化形成的(图版Ⅱ,J),而非周缘的绒毡层细胞退化后流动进入所致。刚从四分体释放出来的小孢子核位于中央,细胞质中只有一些小液泡,壁较薄(图版Ⅱ,K);随着生长发育,小孢子原生质开始出现许多小液泡(图版Ⅱ,L),后汇集成一大液泡,位于细胞中央,原生质遂分布于细胞壁的周边,其核随着细胞的液泡化由中央随机地移到靠壁的一侧(图版Ⅱ,M),这一过程大约需1.5 h,花朵外形如图版Ⅰ,H~J。在花药以与花丝相连“关节”处进行翻转时(图版Ⅰ,J、K),靠边小孢子核进行有丝分裂,产生大小悬殊的2个核,随后进行胞质分裂,形成大小悬殊的2个细胞(图版Ⅱ,N)。大的为营养细胞,包含着原先小孢子的大液泡和大部分原生质,其核含有1个显著的大核仁;贴壁的是生殖细胞,只含有少量的原生质,这一时期可以称为2-细胞花粉粒早期。以后,生殖细胞侧边脱离花粉壁向心突出,逐渐从花粉壁上脱落,细胞壁渐渐溶解,其核也不断增大,最终游离在营养细胞的原生质中,生殖细胞在散粉前分裂一次形成成熟的3-细胞花粉粒(图版Ⅱ,O)。由于小孢子发育的不同步,少量花粉粒在花药完成翻转后即从药隔断裂处逸出,23 h后绝大多数小孢子始发育成熟,达到散粉高峰。此时,花药壁仅宿存带状加厚的表皮。

图版 Ⅰ 青叶胆单花开放过程A.花基数4;B.花序出现;C~F.花蕾期,约为20 d;G.尚未开放花朵雄蕊位置;H.初开放花朵;I.花药开始翻转;J.随后60 min内,花药与柱头由最初正面相对翻转至垂直并略高于柱头;K.30 min后,花药完成了与柱头背面相对的另一个90°翻转,并开始散粉,此时柱头不可授;L.23 h后,花药处于散粉高峰,而柱头仍不可授;M.4 h后,花药进入散粉末期,柱头进入可授期;N.2 h后,柱头进入最佳可授期;O.完成授粉后的子房形态。PlateⅠ The duration of the single flowerA. Tetramerous flower; B. Inflorescence emergence; C-F. The bud time, which lasts for about 20 days; G. The position of stamens in unopened flower; H. The flower bud opens; I. The anthers turn outwards; J. The anther position is vertical to pistil and higher than stigma for 60 minutes; K. After 30 minutes, the anther keep on turning outwards 90° to face against the pistil, the pollen begin falling while the stigma is still unreceptive; L. The shedding of pollen peaks at 23 hours after it starts while the stigma is still unreceptive; M. 4 hours later the anthers are in the late stage of pollen shedding while the stigma is receptive; N. The stigma is optimal for pollination 2 hours later; O. Ovary shape after pollination
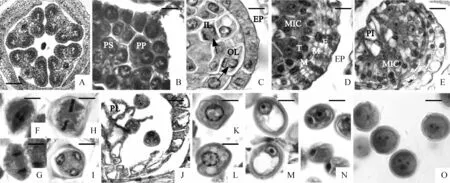
图版 Ⅱ 小孢子发生和雄配子体形成(标尺:A=100 μm;B~E、J=20 μm;F~I、K~O=10 μm)A. 4枚花药;B. 初生壁细胞(PP)和初生造孢细胞(PS);C. 次生造孢细胞时期的花药壁:表皮(EP)、外层(OL)和内层(IL)及分裂相(箭头);D. 小孢子母细胞(MIC)时期分化完全的花药壁:表皮(EP)、药室内壁(EN)、中层(M)、绒毡层(T);E. 绒毡层细胞凸入药室内形成“类胎座”(PL);F. 减Ⅰ中期;G. 减Ⅰ后期;H.减Ⅱ中期;I.减Ⅱ末期;J. 四分体时期由绒毡层细胞形成的“类胎座”(PL);K. 刚从四分体释放出来的小孢子;L. 小孢子中出现小液泡;M. 小孢子中出现大液泡; N. 2-细胞花粉粒早期,可见明显的细胞壁;O. 成熟的3-细胞花粉粒Plate Ⅱ Microsporegenesis and development of the male gametophyte (Scale Bar: A =100 μm; B-E, J=20 μm; F-I, K-O=10 μm)A. The transection of anther, showing four anthers; B. Primary parietal cells (PP) and primary sporogenous cells (PS); C. Anther wall in the time of secondary sporoginous cell: epidermis (EP), out layer (OL) and inner layer (IL) with its division phase; D. Anther wall in the time of microspore mother cells: epidermis (EP), endothelium (EN), middle layer (M), tapetum (T); E. “Placentoid (PL)” from the tapetum; F. Meiosis metaphaseⅠ; G. Meiosis anaphaseⅠ; H. Meiosis metaphaseⅡ; I. Meiosis telophase Ⅱ; J. “Placentoid (PL)” from the tapetum in the time of tetrads; K. Microspore had just formed from microspore tetrads; L. Some small vacuoles appear in the microspore; M. Vacuolate period of uninucleate microspore; N. Early 2-celled pollens, showing obvious cell wall; O. Mature 3-celled pollens
2.3大孢子发生和雌配子体形成
青叶胆为圆锥状聚伞花序,多花,子房上位,2心皮,1室。雌蕊膨大成囊状,心皮没有愈合的部分分化为柱头,不闭合。子房横切面具多列胚珠,侧膜胎座(图版Ⅲ,A)。在珠心顶端表皮下一层细胞中分化出单个孢原细胞(图版Ⅲ,B)。 孢原细胞不分裂,体积增大并伸长直接发育为大孢子母细胞,其质浓厚,具大而显著的细胞核(图版Ⅲ,C)。可见,青叶胆大孢子母细胞与珠心表皮细胞间无周缘细胞层,故属薄珠心胚珠。珠被始发生于孢原细胞晚期,由珠心基部细胞衍生而成,生长速度较快,由于两侧生长不均匀,至大孢子母细胞时期,胚珠处于倒生的位置(图版Ⅲ,C)。
大孢子母细胞持续时间较长,约15~20 d,花朵外形如图版Ⅰ,E。大孢子母细胞经减Ⅰ分裂(图版Ⅲ,D)形成大孢子二分体(图版Ⅲ,E);大孢子二分体经减Ⅱ分裂形成直线形大孢子四分体(图版Ⅲ,F)。四分体中,珠孔端3个退合,合点端大孢子体积增大,发育为功能大孢子,此时可见退化大孢子痕迹(图版Ⅲ,G)。这一发育时间也较长,持续至花药完成翻转并开始散粉,花朵外形如图版Ⅰ,J、K。
功能大孢子体积继续增大,在珠孔端出现小液泡,发育为单核雌配子体(图版Ⅲ,H);单核雌配子体经2次有丝分裂形成二核雌配子体(图版Ⅲ,I)和四核雌配子体(图版Ⅲ,J),四核雌配子体再经一次有丝分裂形成八核雌配子体,随即细胞化产生七细胞八核雌配子体(图版Ⅲ,K~L),此过程约持续24 h。此时,花药散粉进入末期,柱头进入可授期。成熟雌配子体中,珠孔端3个细胞形成卵器,卵细胞和2个助细胞呈“品”字形排列,卵细胞略小于助细胞,核位于合点端,珠孔端为一大液泡;2个助细胞大小几乎相等,极性与卵细胞相反。合点端的3个反足细胞非常发达,在形成后不久,体积便迅速增大,几占整个胚囊的1/3(图版Ⅲ,M)。在以后的发育中,反足细胞体积进一步增大,核多次分裂形成内源多倍体,其形成的反足吸器明显,形成一个十分类似“外胚乳”的结构。反足细胞宿存时间较长,2-细胞原胚时还很发达,到6-细胞原胚时期才开始退化。
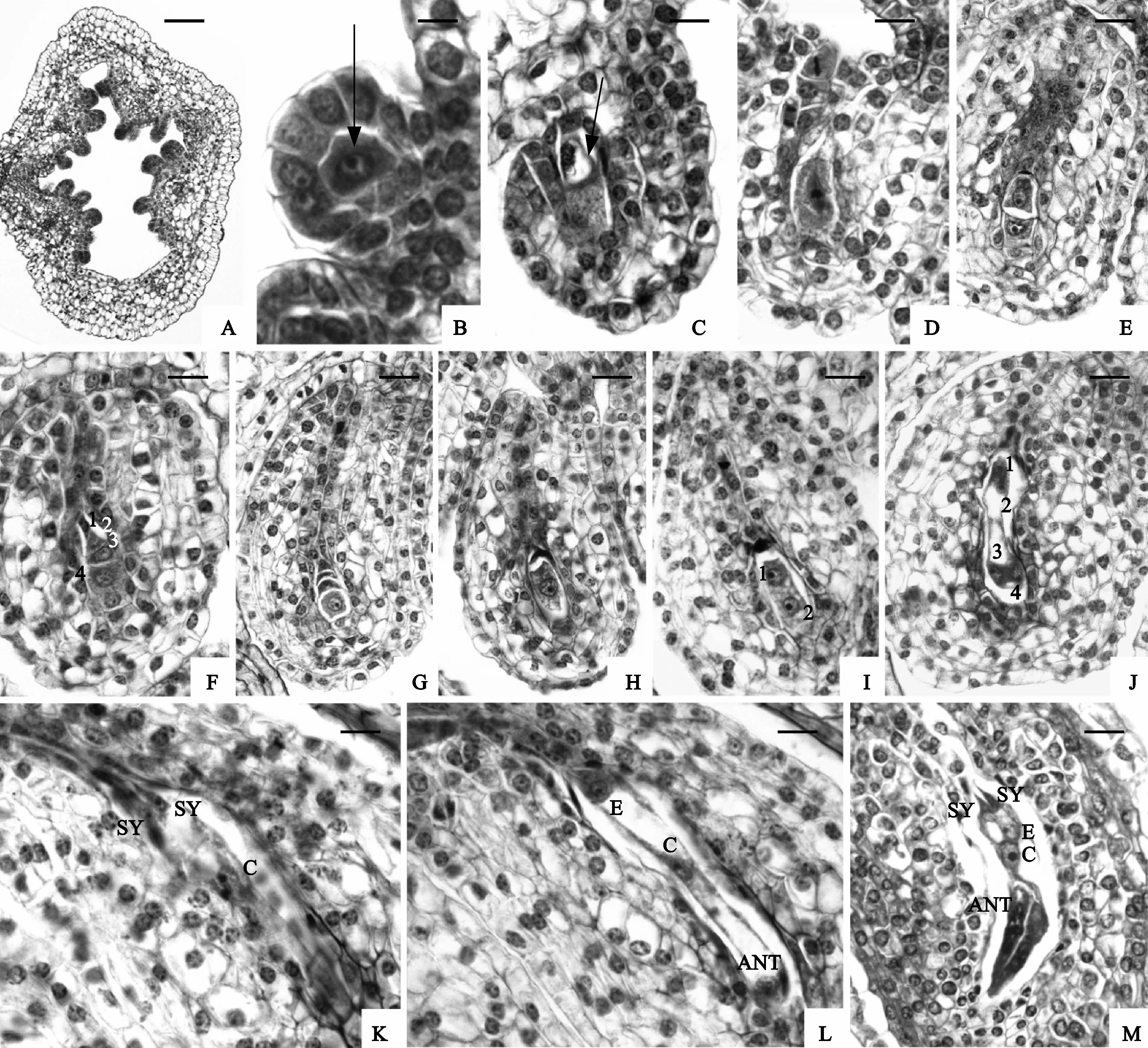
图版 Ⅲ 大孢子发生和雌配子体形成(标尺:A=100 μm; B=20 μm;C=30 μm;D~M=50 μm)A. 侧膜胎座;B. 大孢子孢原(箭头);C. 大孢子母细胞(箭头);D. 大孢子母细胞减Ⅰ中期; E. 大孢子二分体;F. 直线形大孢子四分体;G. 功能大孢子(F)和退化的3个大孢子(箭头);H. 单核雌配子体;I. 二核雌配子体;J. 四核雌配子体;K~M. 七细胞雌配子体,示2个助细胞(SY)、卵细胞(E)、中央细胞(C)和反足细胞(ANT)Plate Ⅲ Megasporogenesis and development of the female gametophyte (Scale Bar: A=100 μm ; B=20 μm; C=30 μm; D-M=50 μm)A. Parietal placenta; B. A female archesporium is hypodermal (arrow); C. Megasporocyte (arrow); D. Meiosis metaphaseⅠ; E. Megaspore dyad; F. Linear tetrad of megaspores; G. Functional megaspore (F) and the three degenerated megaspores (arrow); H. Mononucleate megagametophyte; I. Two-nucleated megagametophyte; J. Four--nucleated megagametophyte; K-M. Seven-celled megagametophyte, showing two synergids (SY), egg (E), central cell (C) and three antipodal cells (ANT)
2.4受精、胚和胚乳的发育
青叶胆成熟花粉粒在散粉前开始萌发出花粉管,经媒介传送至柱头后,花粉管即在花柱中沿着通道细胞表面的粘液前进。到达子房后,经珠孔进入胚珠,属珠孔受精类型。花粉管进入雌配子体囊腔时释放出2个精子分别与卵细胞和中央细胞融合,产生合子及初生胚乳核,受精属有丝分裂前类型。
初生胚乳核的分裂早于合子的分裂,在合子第一次丝分裂前,胚乳核已在囊腔内达到了一定数目(图版Ⅳ,A),胚乳发育为核型。合子第一横分裂(图版Ⅳ,B)形成1个顶细胞CA和1个基细胞CB(图版Ⅳ,C);顶细胞先分裂产生L、L′,随后基细胞进行分裂,最后产生一直线形4-细胞原胚L、L′、M和Ci(图版Ⅳ,D);细胞L和L′在基细胞CB分裂结束后不久分别再进行一次横分裂,产生L1、L2和L1′、L2′,与M、Ci构成直线形的6-细胞原胚(图版Ⅳ,E),这一时期,反足细胞开始呈现退化的迹象;以后L1、L2、L1′、L2′再分裂数次和M、Ci一起构成球形原胚,此时胚乳核开始细胞化(图版Ⅳ,F)。青叶胆胚的发育过程中,由基细胞CB衍生而来的细胞在胚体建成中不起重要作用,因而胚的发育属于茄型。
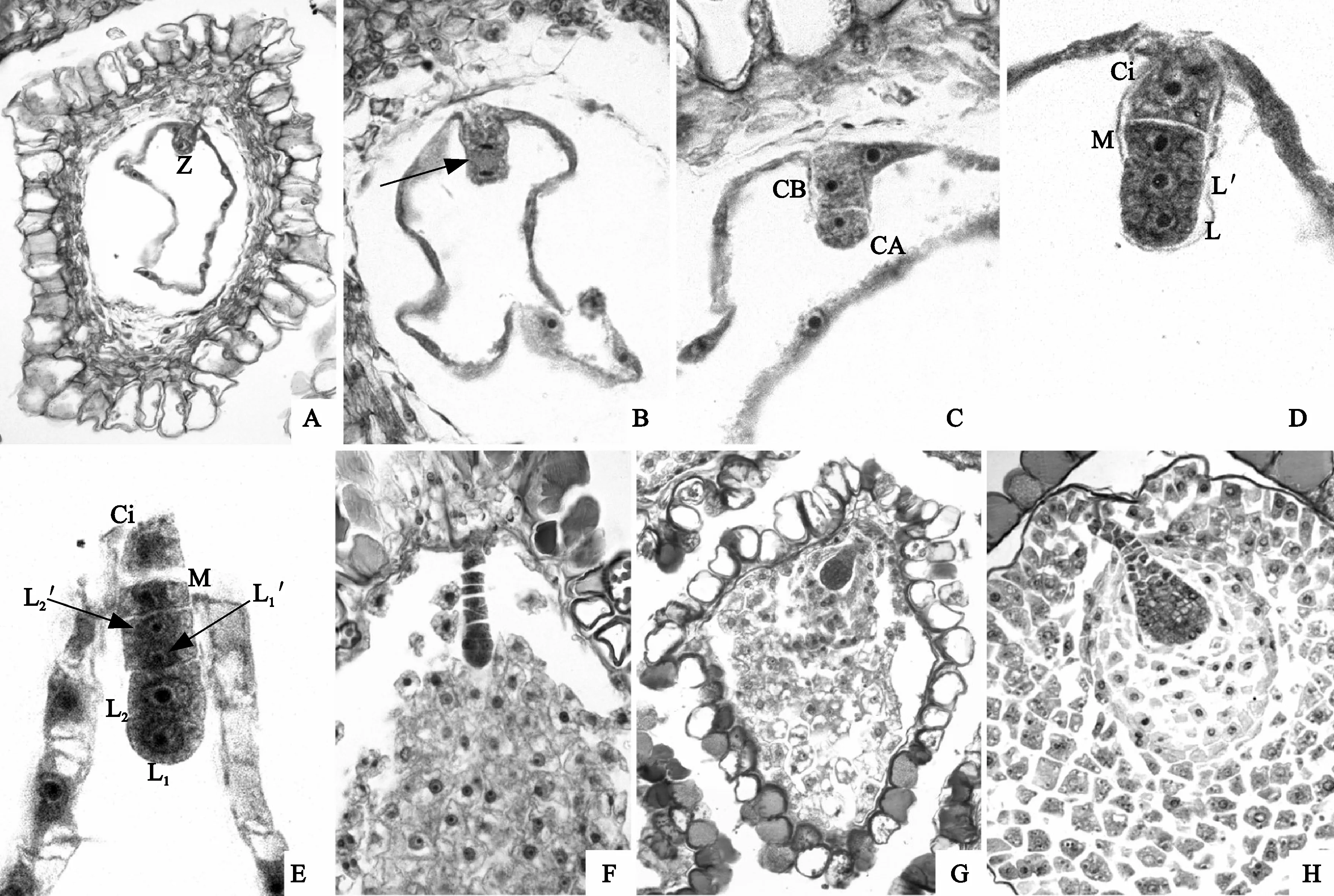
图版 Ⅳ 受精、胚和胚乳的发育(标尺:A、F~H=50 μm;B、C=30 μm;D、E=20 μm)A. 合子(Z)和胚乳核;B.合子横分裂相(箭头);C. 2-细胞原胚,顶细胞(CA)和基细胞(CB);D. 4-细胞(L、L′、M、Ci)原胚;E. 6-细胞(L1、L2、L1′、L2′、M、Ci)原胚;F. 球形原胚早期,示细胞化胚乳和胚柄细胞;G. 球形胚;H. 球形胚时期发达的胚柄吸器Plate Ⅳ Fertilization and development of embryo and endosperm (Scale Bar: A, F-H=50 μm; B, C=30 μm; D, E=20 μm)A. The zygote (Z) and endosperm nucleus; B. The dividing zygote (arrow); C. At the time of 2-celled proembryo, showing the apical cell (CA) and the base cell (CB); D. Liner 4-celled pro-embryo (L, L′, M, Ci); E. Liner 6-celled pro-embryo (L1, L2, L1′, L2′, M, Ci); F. Early globular embryo; G. Globular embryo; H. Developed suspensor haustorium at the time of globular embryo
在胚体形成后,由基细胞CB衍生的细胞加速分裂形成胚柄结构,至球形胚时期可见发达的胚柄,而胚体附近细胞化的胚乳强烈解体,为胚的发育提供养料(图版Ⅳ,G)。种子离开母体时,胚的分化不完全,大部分处于早心形胚阶段,少数仍处于球形胚时期,此时胚柄高度发达,可以看到明显的吸器结构(图版Ⅳ,H)。从受精到蒴果成熟,约需40~45 d。
3讨论
3.1青叶胆对异花授粉的适应
通过对单花开放过程的观察,青叶胆具有一系列机制来保证其异花授粉。从花部形态上看,花药为丁字形着药,散粉时背向雌蕊裂开。从雌雄蕊空间位置上的变化来看,花药从发育早期处于与雌蕊相对位置到散粉时的背对位置,花药要经历一个180°倒转的过程,同时花丝也要偏离雌蕊近30°的向外偏转,这样花药的位置几乎发生了210°的变化,散粉时相对远离雌蕊柱头。在这一过程中,花丝顶部与花药相连处的“关节”部位是一个特殊结构。花药正是通过这一结构才能够完成其180°的倒转,最终花药处于与雌蕊相背的位置。与其近缘种川东獐牙菜S.davidii.不同的是,花药发生180°倒转是S.davidii.散粉的一个重要前提,否则便会在散粉前枯萎死亡。对青叶胆来说,如果花药由于某些外力原因未能发生180°倒转,花药的发育就会滞后,略显畸形,其花粉活力则低于正常花粉而并不导致其死亡。
雌、雄蕊发育的相关性来看,雄蕊的发育早于雌蕊,当花药成熟散粉时,雌配子体仅发育至功能大孢子时期;27 h后,雌配子体发育成熟,而花药已进入散粉末期,两者仅有1~2 h的重叠期。这样,在发育时间上保证了青叶胆的异花授粉。
3.2青叶胆绒毡层类型
有学者[23]曾报道龙胆科植物的绒毡层有腺质和变型两种类型,并提到绒毡层发育早期具有结构上的各种变化,如进行各种分裂凸入药室腔内形成“横格”和“类胎座”。与S.davidii.的研究结果类似[24],本研究认为它们是一种类型,是由于对绒毡层发育早期结构变化所引起的退化具有不同认识所造成的。青叶胆绒毡层2型起源,其细胞在发育早期就纵向伸长,并挤入药室腔内,使绒毡层看上去似乎有2层至多层,特别是起源于药隔的绒毡层细胞有时还形成“横格”和“类胎座”结构;随着花粉的发育,这些进入药室腔内的绒毡层细胞原位解体,存在于小孢子周围,以至于很容易从表象上误认为是边缘绒毡层“流动”进入药室腔内的;本文未观察到青叶胆绒毡层细胞解体时有融合现象,直到消失之前,绒毡层细胞始终是单个存在的,没有形成周原质团。
3.3青叶胆有性生殖过程中的重要特征
一般认为,反足细胞为胚囊的成熟与受精提供营养,特别是那些具次生增殖的反足细胞[25];此外,反足细胞有可能产生和释放控制邻近胚乳发育的成长物质[26]。与龙胆科多数一年生植物相似[14-19,21,23-24],青叶胆反足细胞存在次生增殖,在双受精至胚乳形成前,具有显著的吸器结构,并宿存至4-细胞原胚或更久。而龙胆科多年生植物反足细胞则无显著的反足吸器,少发生次生增殖,受精后就普遍开始消失[27]。
胚柄在胚胎发育过程中是一个暂时性结构,在胚胎发育过程中,胚柄将胚体推入胚乳组织中,并从母体组织吸收营养物质向胚体运输,或者胚柄本身合成特殊物质(如赤霉素),为早期发育的胚胎提供营养物质和生长调节物质[28]。与其他一些獐牙菜属植物不同[12,15-18,20,24],青叶胆在4-细胞原胚后,并不产生8-细胞原胚而产生6-细胞原胚,基细胞的分裂晚于顶细胞。至原胚体形成时,胚柄结构才开始出现。至蒴果成熟种子散出时,胚柄高度发达并形成吸器结构。在其他獐牙菜属植物中,未见类似报道。
3.4青叶胆有性生殖特征的生态适应意义
胚胎学上的特定特征是与其功能相一致的,并在一定程度上反映了该物种的生活史与生殖策略[27]。青叶胆在原生境为每年9月初花序出现,单花开放期2~3 d左右;果期较长,约40~45 d。种子从蒴果中散落时,大多只发育至早心形胚阶段,种子必须经过后熟才能萌发。在漫长的后熟期中(4个月左右),种子一方面可以休眠或后熟的方式避开不良生长季节,但另一方面,种子在母体时须贮存足够养料以满足离开母体后胚的继续发育,而后熟期的养料犹显重要。从种子的切片来看,发达的胚乳组织即为胚后熟养料的重要保证,这样在早期胚的发育中,胚乳就不能被过度利用。可以推测,青叶胆发达的反足细胞可能是完成这一策略的主要载体:雌配子体成熟时期吸收珠被的营养,转运并储存于反足细胞内;受精后,发达的反足细胞不仅促进胚乳的发育和养分积累,而且有可能在胚发育的早期代替胚乳为合子及胚提供营养。此外,青叶胆发达的胚柄结构也具有重要意义。在胚的发育早期,由于胚柄的不断伸长,将胚体逐渐向囊胚中推进,使之处于营养有利的环境中;而到了早心形胚,即种子脱离母体时,胚柄产生明显的吸器结构,从珠孔端伸入珠被组织,从珠被组织中转移营养物质至胚,进一步提供胚后熟过程中需要的养份;同时,发达的胚柄也有可能为胚体提供生长调节因子以保证种子中胚的正常发育[29]。
参考文献:
[1]中国科学院中国植物志编辑委员会. 中国植物志(62卷)[M]. 北京: 科学出版社, 1988: 392.
[2]聂瑞麟, 何仁远. 青叶胆植物中的红白金花内酯和青叶胆内脂的结构[J]. 云南植物研究, 1984, 6(3): 325-328.
NIE R L, HE R Y. The Erythrocentaurin and Swermirin fromSwertiamileensis[J].ActaBotanicaYunnanica, 1984, 6(3): 325-328.
[3]宋万春. 龙胆科[M]// 吴征镒. 新华本草纲要 (第2册) [M]. 上海: 上海科学技术出版社, 1991: 387-402.
[4]程淑敏, 周干南. 青叶胆胶囊治疗急性肠炎120例报告[J]. 中药材, 1990, 13(8): 37-38.
CHENG S M, ZHOU G N.Swertiamileensiscapsule in the treatment of acute enteritis (a report of 120 cases) [J].JournalofChineseMedicinalMaterials, 1990, 13(8): 37-38.
[5]杨永红, 杨林福, 范建, 等. 青叶胆可持续利用策略研究[J]. 中国民族民间医药杂志, 2003, 61: 107-109.
YANG Y H, YANG L F, FAN J,etal. Strategy on persistent utilization ofSwertiamileensis[J].ChineseJournalofEthnomedicineandEthnopharmacy, 2003, 61: 107-109.
[6]杜光明, 李国源. 青叶胆治疗急性病毒性肝炎422例疗效观察[J]. 云南中医杂志, 1981, 3: 35-37.
DU G M, LI G Y.Swertiamileensisin the treatment of acute virus hepatitis (an analytic report of 422 cases) [J].YunnanJournalofTraditionalChineseMedicineandMateriaMedica, 1981, 3: 35-37.
[7]黄衡宇, 黄骥, 王美蓉, 等. 青叶胆组织培养条件优化及不同交配方式子代植株再生能力比较研究[J]. 中草药, 2016, 47(3): 480-487.
HUANG H Y, HUANG J, WANG M R,etal. Comparison on progeny regeneration capacity among different mating patterns and optimization of cultivation condition inSwertiamileensis[J].ChineseTraditionalandHerbalDrugs, 2016, 47(3): 480-487.
[8]何亚平, 刘建全. 植物繁育系统研究的最新进展与评述[J]. 植物生态学报, 2003, 27(2): 151-163.
HE Y P, LIU J Q. A review on recent advances in the studies of plant breeding system[J].ActaPhytoecologicaSinica, 2003, 27(2): 151-163.
[9]高江云, 任盘宇, 李庆军. 姜科、闭鞘姜科植物繁育系统与传粉生物学的研究进展[J]. 植物分类学报, 2005, 43(6): 574-585.
GAO J Y, REN P Y, LI Q J. Advances in the study of breeding system and pollination biology of gingers (Zingiberaceae and Costaceae) [J].ActaPhytotaxonomicaSinica, 2005, 43(6): 574-585.
[10]THORNE R F. Proposed new realignments in the angiosperms [J].NordicJournalofBotany, 1983, 3:85-117.
[11]THORNE R F. An updated phylogenetic classification of flowing plants [J].Aliso, 1992, 13(2): 365-389.
[12]XUE C Y, HO T N, LI D Z. Embryology ofSweria(Gentianaceae) relative to taxonomy [J].BotanicalJournaloftheLinneanSociety, 2007, 155: 383-400.
[13]SHAMROV I I. The ovule ofSwertiaiberica(Gentianaceae):structural and functional aspects [J].Phytomorphology, 1991, 41(3 & 4 ): 213-229.
[14]SHAMROV I I. Ovule development and significance of its features for Gentianaceae systematics [J].OperaBotanicaBelgica, 1996, 7: 113-118.
[15]刘建全, 薛春迎, 何廷农. 藏药抱茎獐牙菜的胚胎学研究[J]. 西北师范大学学报(自然科学版), 1988, 34(4): 59-66.
LIU J Q, XUE C Y, HE T N. Embryology ofSwertiafranchitiana, a famous Tibetan medicine [J].JournalofNorthwestNormalUniversity(Natural Science), 1988, 34(4): 59-66.
[16]何廷农, 薛春迎, 刘建全. 红直獐牙菜的胚胎学[J]. 西北植物学报, 1999, 19(1): 76-80.
HE T N, XUE C Y, LIU J Q. Embryology ofSwertiaErythrostictaMaxim [J].ActaBotanicaBoreali-OccidentaliaSinica, 1999, 19(1): 76-80.
[17]薛春迎, 何廷农, 刘建全. 四数獐牙菜的胚胎学及其系统学意义[J]. 植物分类学报, 1999, 37(3): 259-263.
XUE C Y, HE T N, LIU J Q. Embryology ofSwertiatetrapteraMaxim.(Gentianaceae) and its systematic implication[J].ActaPhytotaxonomicaSinica, 1999, 37(3): 259-263.
[18]薛春迎, 何廷农, 李德铢. 西南獐牙菜的胚胎学及其系统学意义[J]. 云南植物研究, 2002, 24(1): 75-81.
XUE C Y, HE T N, LI D Z. Embryology ofSwertiacincta(Gentianaceae) and its systematic value [J].ActaBotanicaYunnanica, 2002, 24(1): 75-81.
[19]李鹂, 黄衡宇. 川东獐牙菜小孢子发生和雄配子体形成[J]. 植物研究, 2006, 26(4): 452-460.
LI L, HUANG H Y. The genesis of microspore and the formation of male gametophyte inSwertiadavidiiFranch [J].BulletinofBotanicalResearch, 2006, 26(4): 452-460.
[20]黄衡宇, 龙华, 易婷婷, 等. 獐牙菜的胚胎发生[J]. 植物研究, 2009, 29(6): 665-673.
HUANG H Y, LONG H, YI T T,etal. Embryogenesis ofSwertiabimaculata[J].BulletinofBotanicalResearch, 2009, 29(6): 665-673.
[21]黄衡宇, 龙华, 易婷婷, 等. 獐牙菜小孢子发生和雄配子体形成[J]. 广西植物, 2010, 30(5): 584-593.
HUANG H Y, LONG H, YI T T,etal. Microsporogenesis and the development of male gametophyte inSwertiabimaculata[J].Guihaia, 2010, 30(5): 584-593.
[22]DAVIS G L. Systematic Embryology of the Angiosperm [M]. New York: John Wiley and Sons I Incorporated, 1966: 70-71.
[23]SAMKARA R K, NAGARA J M. Studies in Gentianaceae: embryology ofSwertiaminor(Gentianaceae) [J].CanadianJournalofBotany, 1982, 60: 141-151.
[24]李鹂, 黄衡宇. 川东獐牙菜(龙胆科)的胚胎学研究[J]. 广西植物, 2015, 35(5): 631-640.
LI L, HUANG H Y. Embryology ofSwertiadavidii(Gentianaceae) [J].Guihaia, 2015, 35(5): 631-640.
[25]CAMERON B G, PTAKSH N. Occurrence of giant antipodals in the female Gametophyte of Australian Bossiaceae, Indigofereae and Mitbelieae (Leguminosae) [J].AustralianJournalofBotany, 1990, 38(4): 395-401.
[26]WILLEMSE M T, WENT J L. The Female Gametophyte[M]// Johri B N. Embryology of angiosperms . Berlin, Heidelberg, New York: Springer, 1984: 88-91.
[27]AKHALKATS M, WAGNER J. Comparative embryology of three Gentianaceae species from the Caucasus and the European Alps [J].PlantSystematicsandEvolution. 1997, 204: 29-48.
[28]SCHWARTZ B W, YEUNG E C, MEINKE D W. Disruption of morphogenesis and transformation of the suspensor in abnormal suspensor mutants ofArabidopsis[J].Development, 1994, 120: 3 235-3 245.
[29]SONG G Q, WANG X G, LI A Q,etal. Research progress in suspensor of angiosperms [J].ChineseBulletinofBotany, 2012, 47: 188-195.
(编辑:潘新社)
文章编号:1000-4025(2016)06-1146-09
doi:10.7606/j.issn.1000-4025.2016.06.1146
收稿日期:2016-03-24;修改稿收到日期:2016-06-08
基金项目:国家自然科学基金(31260077,31260102);湖南省重点学科建设项目(JSU071301)
作者简介:李鹂(1973-),女,博士,教授,主要从事植物生态与分子生物学教学和科研工作,E-mail: lilyjsu@126.com *通信作者:黄衡宇,博士,教授,主要从事植物发育生物学研究。E-mail: hhyhhy96@163.com
中图分类号:Q944.58
文献标志码:A
Study on Floral Dynamic and Sexual Reproduction ofSwertiamileensis,a Rare and Endemic Medicinal Plant
LI Li1, LONG Hua1, ZHANG Aili2, HUANG Hengyu2*
(1 Key Laboratory of Plant Resources Conservation and Utilization of College of Hunan Province, Jishou University,Jishou, Hunan 416000, China;2 Engineering Research Center for Reproducing Fine Varieties of Chinese Medicinal Plants, Yunnan University of Chinese Traditional Medicine, Kunming 650500, China)
Abstract:The blooming of the single flower, the development of microsporangium, male gametophyte, megasporogenesis, female gametophyte and embryogeny of Swertia mileensis, a special herb endemic to Yunnan, were studied in this article. (1) The reproductive growth of S. mileensis begins at late August or early September and the bud stage is last for approximately 35 days, flowering time is last for only 2-3 days while fruit stage is the longest, approximately 40-45 days. (2) There are a series of mechanism to guarantee the cross pollination in S. mileensis, such as the versatile anther; the dichogamy in which the maturity of stamen was about 23 hours earlier than the maturity of pistil, that means the overlapping time of the mature stamen and pistil is only 1-2 hours. Furthermore a new mechanism was observed in which the stamen and pistil would change their position in space to avoid self-pollination. At first anther clings to stamen and then turn around on the back of the pistil after a 180° reversion, while filament deviate lead to the anther bent down with 210°. Section shows: anthers are tetrasporangiate. The development of anther walls conforms to the basic type and comprises of epidermis, endothecium, two middle layers and tapetum at the mature stage. The tapetum cells have dual origin and belong to the glandular type. The anther locules have degenerating tapetum nuclei in the middle which are from the early dividing and intruding of the tapetum. Two middle layers are ephemeral; endothecium reduces and epidermis persists and develops to become fibrous-thickening. The cytokinesis of the microspore mother cell in meiosis is of the simultaneous type. Most of the microspore tetrads are tetrahedral and pollen grains are 2-celled and 3-celled when shed. The ovary is bicarpellate, unilocular with some series of ovules located at the parietal placentation. The ovule is unitegmic, enuinucellar and anatropous. The one chalazal megaspore in linear tetrad becomes the functional megaspore and the development of female gametophyte is the polygonum type. Three antipodal cells have multiseriate nuclei and distinct haustorium, and persist like a layer of “outer endosperm” just out of the endosperm nucleus layer. Fertilization is porogamous and of premitotic syngamy type. The development of endosperm conforms to nuclear type and the embryogeny corresponds to the solanum type. The embryo is at the late early heart-shaped stage when seeds released from the capsule. The developed antipodal cells and suspensor structure has magnificent significance for the reproductive adaptation and evolution of the seed after-ripening of S. mileensis.
Key words:Swertia mileensis; flowering; embryology; Swertia; ecological adaptation
