小麦TaDRLea3-2基因的克隆及胁迫诱导表达分析
2016-08-06梁雅珺于正阳强智全朱维宁张大鹏张林生
梁雅珺,于正阳,强智全,杜 娅,朱维宁,张大鹏,张林生*
(1 西北农林科技大学 生命科学学院, 陕西杨陵712100;2 西北大学 生命科学学院, 西安 710069)
小麦TaDRLea3-2基因的克隆及胁迫诱导表达分析
梁雅珺1,于正阳1,强智全1,杜娅1,朱维宁2,张大鹏1,张林生1*
(1 西北农林科技大学 生命科学学院, 陕西杨陵712100;2 西北大学 生命科学学院, 西安 710069)
摘要:胚胎发育后期丰富蛋白(late embryogenesis abundant protein,LEA蛋白) 是植物体中广泛存在的一类与渗透调节相关的家族蛋白,植物受非生物胁迫会大量表达。该研究采用同源克隆技术,从干旱诱导的小麦品种‘郑引1号’ (Triticum aestivum L.)中获得1个新的LEA3家族基因( TaDRLea3-2),该基因全长668 bp,编码区为570 bp,编码189个氨基酸。生物信息学分析表明该蛋白为亲水性蛋白,二级结构以α-螺旋为主,含有9个由11个氨基酸组成的保守结构域,为典型的LEA3蛋白,存在3个磷酸化位点,无信号肽结构域及跨膜结构域,可能定位于细胞质中;实时定量PCR结果表明, TaDRLea3-2基因受干旱、高盐、低温诱导表达,同时也受外源ABA诱导,推测 TaDRLea3-2为ABA依赖型 LEA3基因,以不同机制参与小麦对非生物胁迫的应答过程,为深入分析小麦LEA3家族蛋白的抗逆机制奠定了基础。
关键词:小麦; TaDRLea3-2;同源克隆;序列分析;实时定量PCR
植物在自然环境下生长常会受到干旱、盐渍、低温、高温等逆境胁迫的影响,降低产量。为了抵抗和适应各种胁迫,植物在长期的进化过程中,形成了各种不同的生理生化机制[1]。当植物受到逆境胁迫后,自身会产生一系列具有保护功能的蛋白来维持其正常代谢活动,胚胎发育晚期丰富蛋白(late embryogenesis abundant proteins,LEA蛋白)就是其中的一类[2-4]。自Dure等[5]首次在棉花中发现LEA蛋白以来,相继在小麦[6]、大豆[7]、番茄[8]、玉米[9]等几十种高等植物,以及苔藓[10]和线虫[11]中均检测到LEA蛋白。LEA蛋白是胚胎发育后期种子中大量积累的脱水保护蛋白,是一类亲水性蛋白,具有较高的热稳定性,受干旱、低温、脱落酸(ABA)等逆境信号的调节,可在许多植物的营养器官中被诱导而表达。大多数LEA蛋白缺乏半胱氨酸和酪氨酸残基,但富含赖氨酸和甘氨酸,无明显的二级结构[12]。根据LEA蛋白的氨基酸序列同源性和特定的基元序列,可将其分为6族,其中第3族LEA蛋白是当前植物逆境分子生物学的研究热点,受到广泛重视[13]。
LEA3蛋白含有多拷贝的11个氨基酸组成的基元序列(TAQAAKEKAGE)。该族LEA蛋白大小差异很大,基元序列的拷贝数从1个到几十个不等[14-15]。根据多变的11个氨基酸重复基序可将LEA3蛋白分为2个亚族:3A和3B[16]。在干旱脱水过程中,LEA3蛋白的11个氨基酸残基组成的基元序列可形成兼性α-螺旋结构,在植物脱水时提供一个具疏水条区的亲水表面,带电的亲水性表面能够螯合高浓度的离子,如Na+和PO43-[12]。此外,该族蛋白序列中多数氨基酸残基是碱性、亲水性氨基酸,无半胱氨酸和色氨酸。如小麦的PMA2005、棉花的D7、大麦的HVA1和大豆的pGmPM2等均属于此类LEA蛋白[17-19]。
近年研究表明,LEA3基因的表达在植物抵御环境胁迫过程中发挥重要作用。俞嘉宁等[20]初步证实小麦LEA3基因TaLEA3的表达与所测品种的耐旱性呈正相关;Liu等[14]将鹰嘴豆LEA3家族的PM2基因转入大肠杆菌中提高了大肠杆菌的耐盐性;Xu等[21]将大麦HAV1基因导入燕麦、水稻中, 获得了抗旱、耐盐的转基因植株。已有的报道证实在非生物胁迫下,LEA3基因的大量表达对细胞具有重要的保护作用,但是其保护机制依然不明确。小麦作为世界上最主要的粮食作物之一,关于其LEA3家族基因的克隆及其抗逆功能的报道还不多见。本研究通过同源克隆,从‘郑引1号’小麦中成功克隆了小麦LEA3家族基因TaDRLea3-2,对其进行生物信息学分析,并研究在不同非生物胁迫下TaDRLea3-2的表达模式,为深入研究LEA3蛋白在小麦中的抗逆机制提供理论依据。
1材料与方法
1.1实验材料
供试小麦品种为‘郑引1号’,由西北农林科技大学生命学院实验室提供。选取颗粒饱满的小麦种子用75%酒精消毒2 min, 蒸馏水浸泡6 h,置于培养皿中。培养条件为:光/暗培养16 h/8 h,昼/夜温度25 ℃/19 ℃,相对湿度80%,当小麦长到两叶一心期时,分别进行干旱(20%PEG6000)、低温(4 ℃培养箱)、盐(500 mmol·L-1NaCl 溶液)和外源ABA(100 μmol·L-1ABA溶液)处理。在胁迫处理0、12、24、36、48、60和72 h后剪取叶片,液氮速冻后保存于-80 ℃。
1.2方法
1.2.1小麦幼苗总RNA提取和TaDRLea3-2基因克隆按照RNAiso Plus试剂(TaKaRa公司)的操作说明提取干旱处理48 h后的小麦叶片总RNA,再用TaKaRa公司PrimeScript®RT reagent Kit(Perfect Real Time)试剂盒,将RNA反转录合成cDNA第一链,以合成的第一链为模板进行PCR扩增。根据GenBank中大麦NIASHv2076L18基因序列(GenBank登录号AK368600)设计引物TF(5’- GAGATTTACAGTGATTTCAGTTCGT-3’)和TR(5’-CGACTAAAGGAGATCAAATT-3’)。反应体系20 μL,包含cDNA 2 μL,上下游引物各 1 μL,2×EasyTaq®PCR SuperMix 10 μL(北京全式金公司),灭菌双蒸水6 μL。PCR扩增条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃延伸10 min。PCR产物用1.2%琼脂糖凝胶进行电泳检测,Takara凝胶回收试剂盒回收纯化目的基因。获得的目的片段与pMD19-T载体连接,并转化大肠杆菌JM109,利用Amp抗性、蓝白斑筛选阳性克隆菌,提质粒做PCR检测并测序。
1.2.2TaDRLea3-2基因的生物信息学分析运用NCBI中ORF Finder查找目的基因的开放阅读框;Premier 5.0软件将目的基因编码框翻译成蛋白质;利用DNAMAN软件对目的基因序列及蛋白序列进行分析;使用MEGA5.1软件进行氨基酸序列比对,并基于ML方法,通过500次bootstrap检测构建系统进化树;运用ProtScale工具预测亲/疏水性;NetPhos软件对磷酸化位点进行分析;应用SignalP 3.0 Server工具进行信号肽预测;PSORT在线分析亚细胞定位;TMHMM工具预测跨膜结构域;并利用SOPMA软件进行二级结构分析,以及swissmodel软件对其三级结构预测。
1.2.3不同胁迫处理下TaDRLea3-2表达实时定量PCR分析按照Trizol试剂(Invitrogen公司)的操作说明,提取不同胁迫处理后的小麦叶片总RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒反转录成单链cDNA,之后进行实时荧光定量表达分析。根据已克隆的TaDLea3-2基因序列,设计1对特异引物TaDRLea3-2-F(5’-GAGCGGCAAGCATAAAGTGTAAAGCC-3’)和TaDRLea3-2-R(5’-TGCCAGTTGTTTCGTTGT-3’),以小麦β-actin为内参基因,引物为actin-F(5’-TCCAATCTAGGGATACACGC-3’)和actin-R(5’-TCTTCATTAGATTATCCGTGA-GGTC-3’)。反应体系为25 μL,包含模版2 μL,2×SYBR Premix 12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。反应程序为95 ℃预变性30 s;95 ℃ 5 s,55 ℃ 20 s,39 个循环。获得的数据用Microsoft Excel软件分析。
2结果与分析
2.1小麦 TaDRLea3-2基因克隆
以cDNA第一链为模板,以特异引物TF和TR进行PCR扩增,1.2%琼脂糖凝胶电泳结果表明,有一大小约为700 bp的条带,与预期结果相符(图1,A)。将目的片段连接于pMD19-T载体,转入大肠杆菌JM109中,利用Amp抗性、蓝白斑筛选阳性克隆菌,提质粒做PCR检测并测序(图1,B)。测序结果比对后表明,该基因与其他物种的LEA3基因同源,全长为668 bp,包含一个完整的开放阅读框(570 bp),命名为TaDRLea3-2(GenBank登录号为KU198998)。利用DNAMAN分析TaDRLea3-2基因编码的蛋白序列,结果表明,TaDRLea3-2基因编码的蛋白由189个氨基酸组成,其相对分子质量为19.2 kD,等电点为8.9,该蛋白含有9个由11个氨基酸组成的保守结构域,属于典型的LEA蛋白第三家族的A亚族成员(图2)。
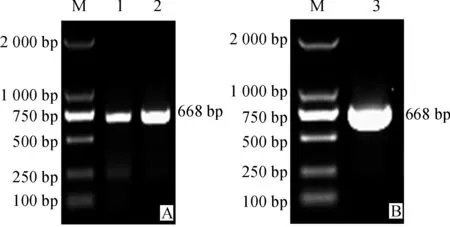
M. DNA marker; 1、2. 以小麦cDNA为模板扩增目的片段; 3. PCR鉴定阳性质粒pMD19-T- TaDRLea3-2图1 TaDRLea3-2基因PCR电泳结果M. DNA Marker; 1,2. PCR products of TaDLea3-2 gene; 3. PCR identification of positive plasmid pMD19-T- TaDRLea3-2Fig. 1 Clone and identify of TaDRLea3-2

9个由11个氨基酸组成的保守序列用下画线和数字标注图2 TaDRLea3-2基因编码的氨基酸序列Nine repeating 11-mer amino acid motifs are underlined and numberedFig. 2 The amino acid sequence of TaDRLea3-2
2.2小麦 TaDR L ea3-2基因的序列分析
2.2.1TaDRLea3-2基因系统进化的分析运用MEGA5.1软件对TaDRLea3-2蛋白及几种植物的LEA蛋白进行序列比对并构建系统进化树,结果表明,该蛋白N端存在LEA蛋白特有的高度保守结构域(图3)。在maximum likelihood方法构建的发育树中,该蛋白与旱麦草(Eremopyrumtriticeum)(禾本科)的LEA3蛋白亲缘关系最近,而与双子叶植物芜菁(Brassicarapa)和拟南芥(Arabidopsisthaliana)的遗传距离最远(图4)。
2.2.2TaDRLea3-2基因编码蛋白的亲水性分析用ProtScale预测亲/疏水性,结果显示该蛋白有很强的亲水性,在多个位点形成亲水性高峰,并具有一定的周期性(图5),有利于形成兼性α-螺旋结构,从而达到结合水分子以保护细胞免受水分亏缺时的伤害[22]。计算总平均亲水性(Grand Average of Hydropathy, GRAVY)值为-0.960,进一步表明了该蛋白为亲水性蛋白。
2.2.3TaDRLea3-2蛋白的信号肽及跨膜结构域分析运用SignalP信号肽预测软件分析显示,该蛋白不含信号肽结构域。同时利用TMHMM工具分析该蛋白的跨膜结构域发现,该蛋白无跨膜螺旋区,为非膜蛋白。
2.2.4TaDRLea3-2蛋白的潜在磷酸化位点分析利用NetPhos软件分析该蛋白质序列潜在的磷酸化位点,结果表明(图6),TaDRLea3-2蛋白有3个磷酸化位点,分别为丝氨酸、苏氨酸和酪氨酸。
2.2.5TaDRLea3-2蛋白的亚细胞定位预测利用PSORT软件对小麦TaDRLea3-2蛋白进行定位,结果表明,该蛋白分布于细胞质中的分值最大,其作用场所可能是在细胞质中。
2.2.6小麦TaDRLea3-2基因编码蛋白质的二级结构和三级结构预测通过SOPMA工具对小麦TaDRLea3-2蛋白二级结构分析表明,TaDRLea3-2蛋白的α-螺旋、延伸链、β转角和无规则卷曲的比例分别为71.96%、6.35%、4.23%及17.46%,二级结构以α-螺旋为主(图7,A)。采用Swissmodel软件分析其三级结构如图7,B所示, 表明该蛋白的三维结构是以α-螺旋为主的紧凑结构。Woods等[23]研究认为在胁迫条件下,LEA3蛋白形成的两亲性α-螺旋可能有利于其行使功能,对细胞具有保护作用。

AFO85387. 高粱;ADF36679. 金发草;NP_001146945. 玉米;NP_001056195. 水稻;AEJ88291; 冰草. BAD22767. 无芒雀草;ACH89913. 大麦; XP_003567984. 二穗短柄草;AEY78063. 南极发草;AIZ11400. 旱麦草;TaDRLea3-2. 小麦;ADC55280. 贵州悬竹.;BAB88878. 芜菁; XP_002891707. 琴叶拟南芥; 黑色框内为N端保守区图3 小麦TaDRLea3-2蛋白与其他几种植物LEA蛋白的序列比对AFO85387. Sorghum bicolor; ADF36679. Pogonatherum paniceum; NP_001146945. Zea mays;NP_001056195. Oryza sativa;AEJ88291 . Agropyron cristatum; BAD22767. Bromus inermis;ACH89913. Hordeum vulgare;XP_003567984. Brachypodium distachyon;AEY78063. Deschampsia antarctica; AIZ11400. Eremopyrum triticeum;TaDRLea3-2. Triticum aestivum L.;ADC55280. Ampelocalamus calcareus;BAB88878. Brassica rapa; XP_002891707. Arabidopsis lyrata; The black box for N conservative areaFig. 3 Sequence alignment of wheat TaDRLea3-2 protein and other LEA proteins
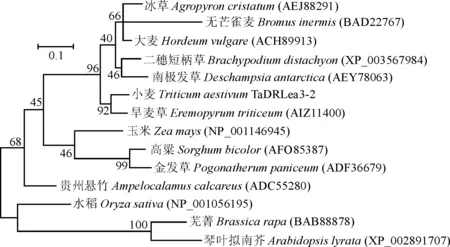
图中各节点处数字表示重复500次Bootstrap值; 标尺代表遗传距离图4 小麦TaDRLea3-2蛋白及其它植物LEA蛋白系统进化分析The numbers at nodes represent the bootstrap values based on 500 replicates; The scale represents genetic distanceFig. 4 Phylogentic tree of wheat TaDRLea3-2 protein and other LEA proteins
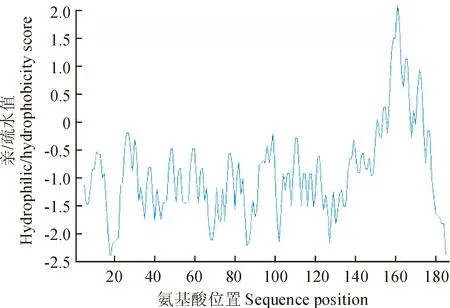
图5 小麦TaDRLea3-2蛋白的亲水/疏水性预测Fig. 5 Hydrophilic/hydrophobicity analysis of wheat TaDRLea3-2 protein
2.3实时定量PCR分析不同胁迫处理下 TaDRLea3-2表达情况
利用实时定量PCR分析不同胁迫条件下小麦叶片中TaDRLea3-2基因的表达量,结果表明,在干旱胁迫下TaDRLea3-2基因的表达量持续增加,在48 h达到峰值,约为对照的5.8倍。冷胁迫下TaDRLea3-2基因表达量增加缓慢,直到60 h才显著上升达峰值,而后降低,说明TaDRLea3-2基因对干旱胁迫较低温胁迫更敏感,响应更强烈。在盐胁迫及施加外源ABA处理后,TaDRLea3-2基因的表达量逐渐上调,分别在72 h及60 h达到最高(图8)。推测TaDRLea3-2基因属于ABA依赖型的响应高盐、冷、渗透、干旱胁迫的LEA3基因。
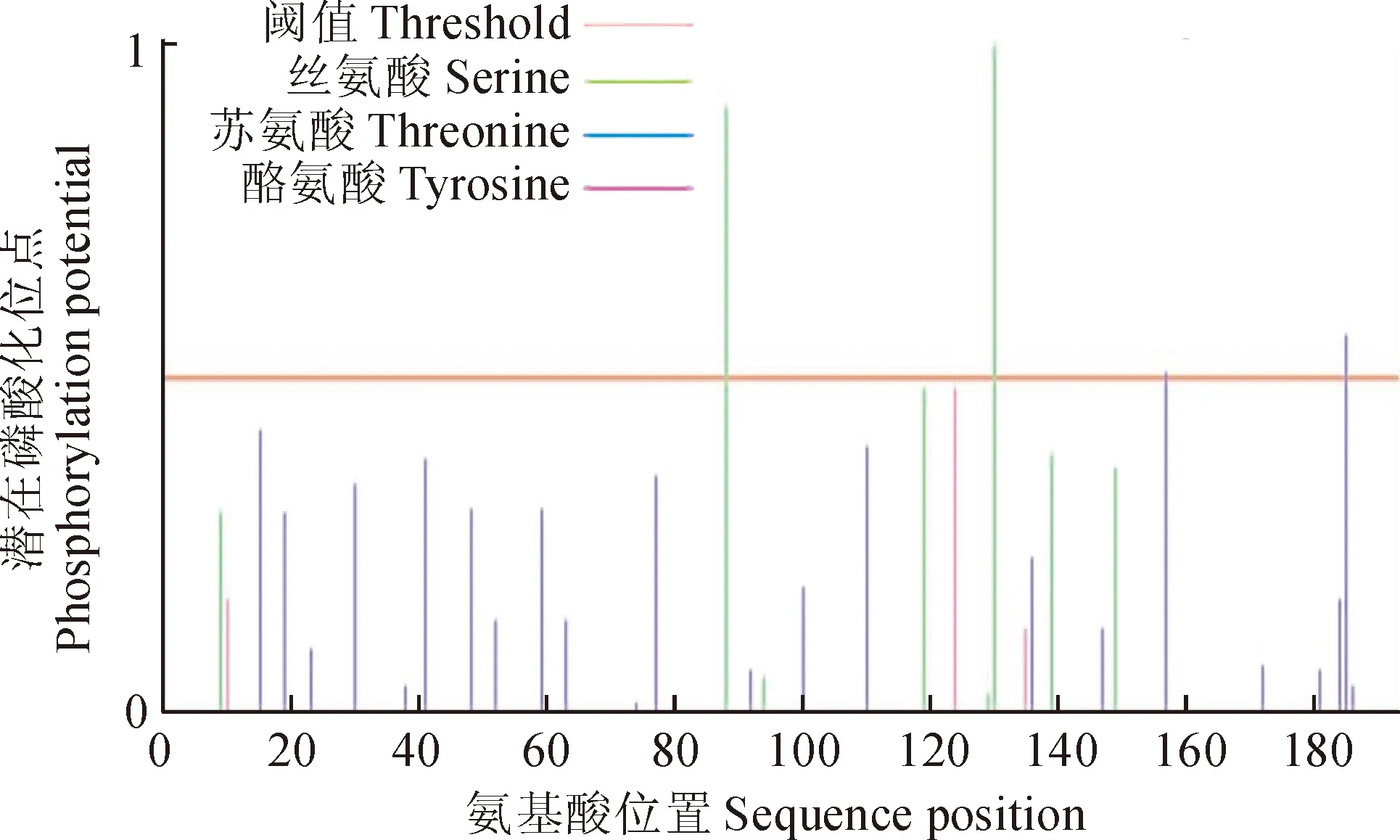
图6 小麦TaDRLea3-2蛋白的磷酸化位点Fig. 6 Phosphorylation sites of wheat TaDRLea3-2 protein
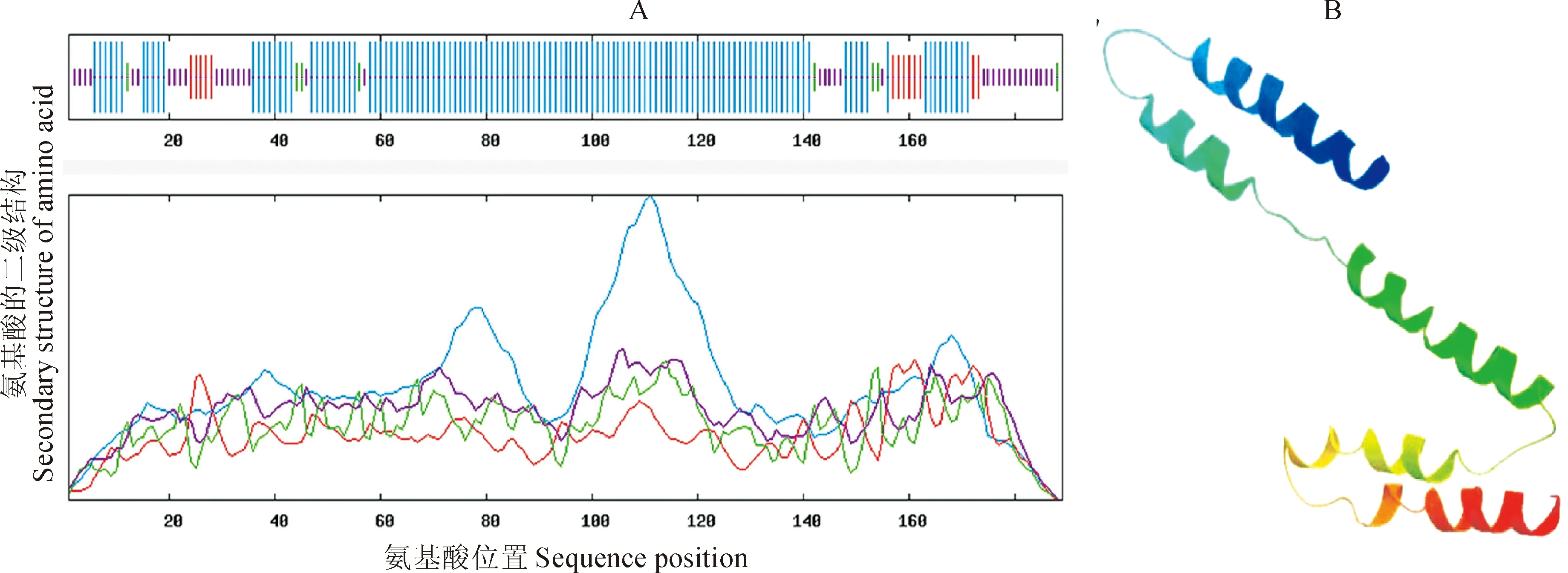
A. 小麦TaDRLea3-2蛋白质的二级结构分析. 图中蓝线、红线、绿线和紫线各代表α-螺旋、延伸链、β转角和无规则卷曲; B. 小麦TaDRLea3-2蛋白的三级结构预测图7 小麦TaDRLea3-2蛋白的二级结构(A)和三级结构(B)预测示意图A. Secondary structure of wheat TaDRLea3-2 protein. The blue, red, green and purple lines represent the alpha helix, extended strand, beta turn and random coil, respectively; B. Tertiary structure of wheat TaDRLea3-2protein.Fig. 7 Secondary structure (A) and tertiary structure (B) prediction of wheat TaDRLea3-2 protein
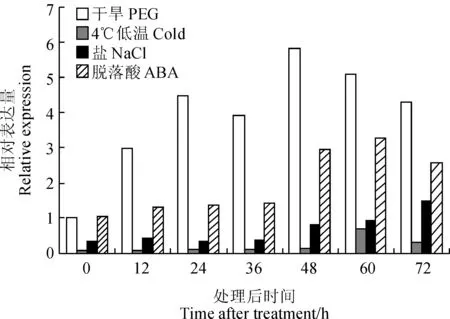
图8 小麦叶片 TaDRLea3-2基因在不同非生物胁迫下的表达模式Fig. 8 Expression pattern of TaDRLea3-2 in wheat leaves under various abiotic stresses
3讨论
植物遭受干旱、低温等逆境胁迫后会引起代谢变化和低分子量保护物质的积累,同时也会诱导植物其它基因的表达。LEA基因就是其中之一,其蛋白产物具有较强的亲水性,在干旱及其它不良环境下具有保护细胞免受脱水伤害、抗氧化、离子缓冲剂和稳定细胞膜等多种功能。因此对未知LEA基因的克隆和功能分析对解析生物细胞在逆境条件下的可塑性非常重要[24]。
本研究利用同源克隆技术,从‘郑引1号’小麦中获得了1个新的LEA3家族基因TaDRLea3-2。其编码蛋白相对分子量较小,富含碱性、亲水性氨基酸,具有9个由11个氨基酸组成的基元序列,属于LEA蛋白第3家族A亚族成员。运用生物信息学软件对其结构进行预测,结果表明TaDRLea3-2蛋白与其他LEA3蛋白结构特征相似,二级结构以α-螺旋为主,不含跨膜结构域和信号肽序列,可能定位于细胞质中。第3族LEA蛋白虽有共同的结构特征,但其所含11个氨基酸基序的拷贝数相差较大,少则5个(如棉花的LeaD7)[25], 多则几十个(如大豆pGmPM10)[7],Ingram等[26]对LEA3蛋白这11个氨基酸的保守结构域分析认为,该肽段以α-螺旋形式存在,可以使LEA蛋白间形成二聚体结构。红外光谱分析发现,在溶解状态下LEA3蛋白是高度无序的,呈无规则卷曲状,而在快速脱水后多以α-螺旋结构存在,缓慢脱水致使其呈α-螺旋和分子间β折叠结构[27]。许多研究还发现,干旱和复水条件下,LEA3蛋白结构的无序化与螺旋化之间的转变有利于其在细胞中行使多种功能[28]。还有一种假说认为LEA3蛋白含有的11个氨基酸重复基序可以形成氨基酸盐桥,稳固蛋白质结构,提高细胞中的离子强度,从而抵御干旱胁迫对植物细胞造成的伤害[13]。但是关于该保守序列的拷贝数与抗旱性强弱之间是否存在相关性还尚无实验证据,有待后续深入研究论证。
已有实验证明第3族LEA蛋白与植物抗旱能力相关。本研究对小麦TaDRLea3-2基因的表达模式分析显示,在低温、干旱、高盐胁迫处理下,该基因表达均有上调,表明该基因在小麦中可响应多种非生物胁迫,但是该基因对于各胁迫的敏感程度并不一致。在干旱胁迫48 h时,TaDRLea3-2基因表达量达到峰值,约为对照的5.8倍;在低温胁迫条件下,TaDRLea3-2基因的表达量增加缓慢,60 h表达量最大;盐胁迫处理后,TaDRLea3-2基因表达量逐渐上调,72 h时为峰值。表明不同逆境条件下,小麦LEA3家族基因TaDRLea3-2的响应表达较为复杂。植物响应非生物胁迫依赖于一系列的信号途径,包括ABA依赖型和非ABA依赖型途径。本研究中获得的小麦TaDRLea3-2基因在ABA处理小麦幼苗后其表达量逐渐上升,为ABA依赖型的表达基因。综上所述,推测TaDRLea3-2基因以不同机制帮助小麦抵御多种逆境胁迫,本研究结果为小麦耐逆基因功能探讨提供了依据。
参考文献:
[1]山仑, 陈培元. 旱地农业生理生态基础[M]. 北京:科学出版社, 1998: 6-18.
[2]SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Gene networks involved in drought stress response and tolerance[J].JournalofExperimentalBotany, 2007, 58(2): 221-227.
[3]HUNDERMARK M, HINCHA DK. LEA (late embryogenesis abundant) proteins and their encoding genes inArabidopsisthaliana[J].BMCGenomics, 2008, 9: 118.
[4]黄发平, 张林生, 王路平, 等. 小麦脱水素基因WZY2的克隆及其序列分析[J]. 西北农林科技大学学报(自然科学版), 2009, 37(2): 93-99.
HUANG F P, ZHANG L S, WANG L P,etal. Cloning and sequence analysis of a new dehydrin gene (WZY2)from wheat[J].JournalofNorthwestA&FUniversity(Natural Science Edition), 2009, 37(2): 93-99.
[5]DURE L, GREENWAY S C, GALAU G A. Developmental biochemistry of cotton seed embryogenesis and germination: changing messenger ribonucleic acid populations as shown byinvitroandinvivoprotein synthesis[J].Biochemistry, 1981, 20(14): 4 162-4 168.
[6]RIED J L, WALKER-SIMMONS M K. Group 3 late embryogenesis abundant proteins in desiccation-tolerant seedlings of wheat (TriticumaestivumL.)[J].PlantPhysiology, 1993, 102(1): 125-131.
[7]HSING Y C, CHEN Z Y,etal. Unusual sequences of group 3 LEA mRNA inducible by maturation or drying in soybean seeds [J].PlantMolecularBiology, 1995, 29(4): 863-868.
[8]ZEGZOUTI H, JONES B,etal. ER5, a tomato cDNA encoding an ethylene-responsive LEA-like peotein: characterization and expression in response to drought, ABA and wounding[J].PlantMolecularBiology, 1997, 35(6): 847-854.
[9]CAMPBELL S A, CRONE D E,etal. A ca.40 kDa maize(ZeamaysL.)embryo dehydrin is encoded by the dhn2 locus on chromosome 9[J].PlantMolecularBiology, 1998, 38(3): 417-423.
[10]MINAMI A, NAGAO M,etal. Cold acclimation in bryophytes: low temperature-induced freezing tolerance inPhyscomitrellapatensis associated with increases in expression levels of stress-related genes but not with increase in level of endogenous abscisic acid[J].Planta, 2005, 220(3): 414-423.
[11]TUNNACLIFFE A, LAPINSKI J, MCGEE B. A putative LEA protein, but no trehalose, is present in anhydrobiotic bdelloid rotifers[J].Hydrobiologia, 2005,546(1): 315-321.
[12]孙立平, 李德全. LEA蛋白的分子生物学研究进展[J]. 生物技术通报, 2003, (6): 6-13.
SUN L P, LI D Q. Progress in molecular biology of LEA protein[J].BiotechnologyBulletin, 2003, (6): 6-13.
[13]赵咏梅, 杨建雄, 等. 第3族LEA蛋白及其基因研究进展[J]. 西安文理学院学报(自然科学版), 2006, 9(4): 27-30.
ZHAO Y M, YANG J X,etal. Progress in research of group 3 LEA protein and gene[J].JournalofXi’anUniversityofArts&Science(Natural Science Edition), 2006, 9(4): 27-30.
[14]LIU Y, ZHENG Y Z. PM2, a group 3 LEA protein from soybean, and its 22-mer repeating region confer salt tolerance in Escherichia coli[J].BiochemicalandBiophysicalResearchCommunications, 2005, 331(1): 325-332.
[15]陈雷, 李磊, 李金花, 等. 植物LEA蛋白及其功能[J]. 中国农学通报, 2009, 25(24): 143-146.
CHEN L, LI L, LI J H,etal. Plant LEA Proteins and their functions[J].ChineseAgriculturalScienceBulletin, 2009, 25(24): 143-146.
[16]BATTAGLIA M, OLVERA-CARRILLO Y, GARCIARRUBIO A,etal. The enigmatic LEA proteins and other hydrophilins[J].PlantPhysiology, 2008, 148(1): 6-24.
[17]刘昀, 李冉辉, 等. 植物抗逆蛋白(LEA3)22-氨基酸耐盐结构域在酵母细胞中的鉴定[J]. 植物研究, 2009, 29(1): 74-79.
LIU Y, LI R H,etal. Functional identification of plant stress-resistant protein(LEA3) and its 22-mer motifs in yeast[J].BulletinofBotanicalResearch, 2009, 29(1): 74-79.
[18]HSING Y I, CHEN Z Y, CHOW T Y. Nucleotide sequences of a soybean complementary DNA encoding a 50-kilodalton late embryogenesis abundant protein[J].PlantPhysiology, 1992, 99(1): 354-355.
[19]WANG L, LI X, CHEN S,etal. Enhanced drought tolerance in transgenicLeymuschinensisplants with constitutively expressed wheat TaLEA3[J].BiotechnologyLetters, 2009, 31(2): 313-319.
[20]俞嘉宁, 张林生, 等. 小麦耐逆基因-TaLEA3的克隆及在酵母中的功能分析[J].生物工程学报, 2004, 20(4): 832-838.
YU J N, ZHANG L S,etal. Cloning of a novel stress-tolerant gene-TaLEA3 from wheat and the functional analysis in yeast[J].JournalofBiotechnology, 2004, 20(4): 832-838.
[21]XU D, DUAN X, WANG B,etal. Expression of a late embryogenesis abundant protein gene, HVA1, from barley confers tolerance to water deficit and salt stress in transgenic rice[J].PlantPhysiology, 1996, 110(1): 249-257.
[22]DURE L. A repeating 11-mer amino acid motif and plant desiccation[J].Plant, 1993, 3(3): 363-369.
[23]WOODS W S, BOETTCHER J M, ZHOU D H,etal. Conformation-specific binding of alpha-synuclein to novel protein partners detected by phage display and NMR spectroscopy[J].BiologicalChemistry, 2007, 282(47): 34 555-34 567.
[24]闵东红, 赵月, 等. 小麦胁迫相关基因TaLEAL3的克隆及分子特性分析[J]. 作物学报, 2012, 38(10): 1 847-1 855.
MIN D H, ZHAO Y, CHEN Y,etal. Isolation and Molecular characterization of stress-relatedTaLEAL3 gene in wheat[J].ActaAgronomicaSinica, 2012, 38(10): 1 847-1 855.
[25]DURE L, CROUCH M,etal. Common amino acid sequence demains among the LEA proteins of higher plants[J].PlantMolecularBiology, 1989, 12(5): 475-486.
[26]INGRAM J, BARTELS D. The molecular basis of dehydration tolerance in plants[J].AnnualReviewofPlantPhysiologyandPlantMolecularBiology, 1996, 47: 377-403.
[27]WOLKERS W F, MCCREADY S, BRANDT W F,etal. Isolation and characterization of a D-7 LEA protein from pollen that stabilizes glassesinvitro[J].BiochimicaetBiophysicaActa, 2001, 1544(1-2): 196-206.
[28]SUN X, RIKKERINK E H A, JONES W T,etal. Multifarious roles of intrinsic disorder in proteins illustrateits broad impact on plant biology[J].PlantCell, 2013, 25(1): 38-55.
(编辑:宋亚珍)
文章编号:1000-4025(2016)06-1091-07
doi:10.7606/j.issn.1000-4025.2016.06.1091
收稿日期:2016-03-31;修改稿收到日期:2016-06-05
基金项目:高等学校博士学科点专项科研基金(201202041100 33);旱区作物逆境生物学国家重点实验室资助课题(CSBA2015007)
作者简介:梁雅珺(1989-),女,在读硕士研究生,主要从事植物分子生物学研究。E-mail :liangyajun0921@126.com *通信作者:张林生,教授,博士生导师,主要从事植物抗逆分子机理研究。E-mail :linszhang@nwsuaf.edu.cn
中图分类号:Q785;Q786
文献标志码:A
Cloning of a New GeneTaDRLea3-2 from Wheat and Its Expression under Different Stresses Treatments
LIANG Yajun1, YU Zhengyang1, QIANG Zhiquan1, DU Ya1, ZHU Weining2,ZHANG Dapeng1, ZHANG Linsheng1*
(1 College of Life Sciences, Northwest A&F University, Yangling, Shaanxi 712100, China; 2 College of Life Sciences, Northwest University, Xi’an 710069, China)
Abstract:Late embryogenesis abundant protein(LEA) are a suite of important family proteins found in organisms, which are generally involved in osmoregulation and are expressed abundantly when subjected to environmental stresses. In this study, we isolated a novel LEA3 gene TaDRLea3-2 from wheat‘Zhengyin No.1’. The full length of TaDRLea3-2 is 668 bp, whose ORF is 570 bp, encoding 189 amino acids, and consists of 9 conserved 11-mer repeating motifs; Protein prediction shows that the protein is highly hydrophilic and located in the cytoplasm, with three phosphorylation sites and has no transmembrane domain or signal peptide; Secondary structure analysis shows that the main structure is alpha helix; Homology comparison and regenerating phylogenetic tree were carried out by MEGA5.1. Expression analyses revealed that TaDRLea3-2 gene was induced by drought, low-temperature, high-salt stress and also moreover, can be induced by ABA treatment. These results suggested that TaDRLea3-2 is an ABA-dependent LEA3 gene, participating in the response process of wheat under the abiotic stresses in different mechanisms and can lay a foundation for elucidating LEA3 gene protection mechanism under abiotic stresses in wheat.
Key words:wheat; TaDRLea3-2; homological cloning; sequence analysis; real-time PCR
