小麦Ven型胞质雄性不育植株与可育植株花药蛋白质组差异研究
2016-08-06张艳霞蔺艳丽吴盼盼张卫东高庆荣
汪 月,张艳霞,蔺艳丽,吴盼盼,张卫东*,高庆荣,张 凯,赵 睿
(1 山东农业大学 农学院 / 国家作物生物学重点实验室, 山东泰安 271018; 2 山东省滨州市农业局, 山东滨州 256600)
小麦Ven型胞质雄性不育植株与可育植株花药蛋白质组差异研究
汪月1,张艳霞2,蔺艳丽2,吴盼盼2,张卫东1*,高庆荣1,张凯1,赵睿1
(1 山东农业大学 农学院 / 国家作物生物学重点实验室, 山东泰安 271018; 2 山东省滨州市农业局, 山东滨州 256600)
摘要:普通小麦具有偏凸山羊草(Ae. ventricosa)细胞质的不育系为Ven型胞质雄性不育系(Ven-cytoplasmic male sterility, Ven-CMS),是粘类小麦CMS的一种类型。该研究对小麦Ven型雄性不育系冀5418A及其同型保持系冀5419B的单核期和二核期的花药进行差异蛋白质组学分析,探讨小麦质核互作雄性不育的分子机制。通过双向电泳分离花药蛋白,基质辅助激光解析飞行时间串联质谱(MALDI-TOF-TOF)对差异表达蛋白进行质谱鉴定,利用生物信息学进行差异表达蛋白鉴定和功能注释分析。结果表明,在分子量19.0~100.0 kD、等电点4~7线性范围内,共检测到约2 000个蛋白点。2个时期共检测到差异蛋白98个,其中两个时期差异表达变化一致的蛋白点56个;数据库搜索获得鉴定的蛋白点41个,其中18个蛋白的表达量在冀5418A 中显著下调,23个在冀5418B 中明显下调。在不育系和可育系中均有参与能量代谢、活性氧代谢、核糖体合成、花粉物质合成的差异蛋白。GO分析预测差异蛋白生物学过程多涉及电子传递和能量代谢、核糖体代谢、活性氧代谢等,细胞组成主要是在膜区域和线粒体,分子功能主要是DNA和RNA结合功能和水解酶等。KEGG分析表明,较多蛋白分布于碳水化合物代谢、活性氧代谢和蛋白组装和折叠途径。推测不育系冀5418A 的雄性不育性除了涉及能量代谢、活性氧清除过程,核糖体蛋白、伴侣蛋白等也有重要作用,雄性不育性可能还与蛋白质加工、物质合成过程的紊乱有关。
关键词:小麦;质核互作雄性不育;差异蛋白质组学;双向凝胶电泳;基质辅助激光解析飞行时间串联质谱
植物雄性不育是指植物雄性生殖器官不能产生正常功能的雄配子的现象,无花粉、花粉败育和花药不开裂等均属雄性不育。细胞质雄性不育(cytoplasmic male sterility,CMS)广泛存在于高等植物,这种雄性不育性可被核恢复基因恢复育性。利用CMS培育不育系进行杂交制种,可节省大量人力物力,提高杂交种子纯度,增加农作物产量,已经成为国际制种业的主要趋势。在杂交种选育过程中经常遇到不育系胞质单一、配合力低及不育性不稳定等问题,这些问题的解决需要足够的理论依据[1]。长期以来人们对植物CMS不育机制,从形态学、细胞学、生理生化学及分子生物学方面进行了大量研究[2]。
蛋白质组学是大规模研究表达蛋白质的特征,通过对正常个体及不育个体间的蛋白质组比较分析,找到某些与育性相关的特异性蛋白质分子,在蛋白质水平上获得不育发生、发展过程的整体轮廓。水稻(Yunnan ZidaoA)是一种无花粉CMS系,该不育系与其保持系单核期花药蛋白质组分析表明在不育系中许多参与碳水化合物代谢和应激反应的蛋白表达下调,说明能量供给不足可能阻碍了花粉正常发育[3];杂种柚(G1+HBP系)具有HBP系柚的核基因组和G1系柚的线粒体基因组,表现为雄性不育,G1+HBP系不育性表现为花粉外壁和孢粉素形成缺陷,与保持系HBP系柚相比,G1+HBP系柚中发生明显表达变化的蛋白质主要参与碳水化合物合成、能量代谢、蛋白质合成和降解[4]。小麦质核互作型雄性不育系(S)-1376A及其保持系(A)-1376B在花药发育的单核期、二核期的蛋白质组学研究表明,5个差异蛋白可能参与了物质能量代谢、细胞程序化死亡及花发育调控等过程,推测不育系(S)-1376A的雄性不育性可能与这些生理生化代谢过程有关[5];此外,幼穗单核期线粒体差异蛋白质组分析表明,(S)-1376A雄性不育可能涉及到锰超氧化物歧化酶的表达差异[6]。
普通小麦具有粘果山羊草(Ae.kotschyi)、易变山羊草(Ae.variabilis)、二角山羊草(Ae.bicornis)或偏凸山羊草(Ae.ventricosa)细胞质的不育系分别被称为K、V、B、Ven型胞质类型CMS, 统称粘类小麦CMS (SvCMS)。粘类小麦CMS恢复源广,恢复度高,种子饱满,在杂种小麦中具有广阔的应用前景[7]。基于生产应用目的,不同研究者研究了粘类小麦CMS恢复规律、杂种优势和细胞质效应特征[7],调查了国内外不同地区的普通小麦品种对粘类小麦CMS系的育性恢保关系,研究了粘类小麦CMS育性基因的地区分布规律[8]。在育性机理方面,进行了粘类小麦线粒体DNA的RAPD分析,克隆育性相关片段[9];以中国春和T型小麦CMS系的不育相关基因片段作探针,对粘类小麦不育系、保持系、恢复系进行Northern杂交分析,推测atp6或cox3基因可能参与了粘类小麦CMS的形成[10]。
为了进一步在蛋白质水平了解粘类小麦CMS育性的相关机制,本研究室以普通小麦和偏凸山羊草(Ae.ventricosa)的同核异质的不育系(Ven-CMS)和保持系为材料,进行了花粉发育早期,即单核期和二核期花药的差异蛋白质组学研究,以期了解Ven型小麦CMS雄性不育的分子机制。
1材料与方法
1.1材料
供试小麦雄性不育系Ven-冀5418A(Ven代表具有偏凸山羊草细胞质)来自国家作物学重点实验室、山东农业大学农学院小麦作物杂种优势研究组。采用具有偏凸山羊草 (Ae.ventricosa)不育细胞质的普通小麦(T.aestivumL.)不育系与普通小麦栽培品种冀5418B通过多代核置换回交育成的稳定不育系,目前回交世代已在20代(BC20)以上,多年多点试验表明不育系性状稳定,综合农艺性状优良,该不育系和保持系多年来成为本重点实验室用来进行小麦杂种优势理论研究与实践应用的重要骨干亲本种质[11,12]。
不育系冀5418A和保持系冀5418B,于2013年10月种植于山东农业大学农场试验田(山东,泰安)。细胞学观察表明,不育系冀5418A花粉明显败育的主要集中在二核期,但也有少量花粉在单核期和二核期后期发生败育。本研究于2014年4月中旬,剥取幼穗,进行形态学观察和细胞学镜检,适当时期分别采集小孢子发育至单核期、二核期的花药,3个重复,液氮速冻后存储于-80℃冰箱备用。
1.2方法
1.2.1蛋白提取蛋白提取方法基本采用Damerval等的丙酮/三氯乙酸沉淀法(TCA)[13],稍有改动。约 0.5 g 花药匀浆处理,孵育于5.0 mL,20 ℃的沉淀液(含 10% TCA 和 0.07% 2-巯基乙醇的丙酮),2 h。沉淀蛋白用10% TCA/丙酮液体清洗2次,冷丙酮清洗2次,去除其它非蛋白组分。吸净上清液,真空干燥沉淀,重溶于等电聚焦(IEF)提取液(7 mol·L-1尿素,2 mol·L-1硫脲,4% CHAPS, 20 mmol·L-1DTT 和 0.2% pp~10 pharmalytes)。室温孵育30 min。15 000 g离心40 min。吸取上清液进行IEF。蛋白浓度测定依据Bradford法[14],以牛血清白蛋白作为标准物。
1.2.2双向电泳(2-DE)蛋白质双向电泳依据 O’Farrel 方法[15],稍有修改。分析胶和制备胶上样量分别为 120 μg和1.5 mg。使用固化pH梯度(IPG)胶条(17 cm,pH 4~7线性胶条,BioRad, USA),350 μL蛋白溶液,石蜡油覆盖胶条。IEF 使用 PROTEAN IEF 系统(BioRad,USA)。胶条复水时电压 50 V,16 h;随后250 V 1 h,500 V 1h,1 000 V 1 h,8 000 V 5 h,8 000 V 10 h,IEF期间,保持恒温 20 ℃ 和每胶条电流 50 μA。在蛋白第二向分离之前,依据Chivasa等[16]的方法平衡胶条,用DTT、碘乙酰胺先后处理。采用PROTEAN II XL(BioRad, USA)双向电泳仪,12% SDS-PAGE凝胶蛋白进行第二向分离。电泳设置每个胶条 20 ℃,1 W,30 min,随后8 W,5 h 40 min,直到溴酚蓝染料前缘到达凝胶末端。SDS-PAGE电泳后,凝胶用ddH2O清洗3次,每次15 min;蛋白质检测采用硝酸银染色[17]。制备凝胶胶体采用考马斯亮蓝染色[18]。
1.2.3图像与统计分析2-DE图像与统计分析使用GS-800扫描仪(BioRad,USA)和PDQuest ver.8.0软件(BioRad, USA)。图像分析包括图像过滤,蛋白点检测和测定,背景消减与蛋白点匹配。所有凝胶与选定的参考凝胶比较,蛋白点自动匹配,手工添加未匹配的斑点。分子量的确定依据共同电泳的标准蛋白(Amersham Pharmacia Biotech),蛋白质等电点确定是依据蛋白质点在17 cm胶条的偏移程度(pH 4~7, 线性)。蛋白点表达量由该点蛋白体积表示。归一化蛋白点体积,蛋白点表达为占凝胶中所有点体积的百分比,具有统计上差异显著性的蛋白点为差异表达蛋白(P<0.05)。
1.2.4斑点切除与凝胶酶切手工切除差异表达点,切碎成块。凝胶胰蛋白酶处理基于稍有改动的 Parker 方法[19]。采用含有 30% 乙腈(ACN)的 100 mmol·L-1碳酸氢铵溶液,小块凝胶脱色至无色,室温下碳酸氢铵溶液中孵育 15 min,用乙腈将凝胶脱水 10 min。37 ℃ 胰蛋白酶(10 ng·μL-1)处理 20 h。凝胶浸于 60% 乙腈/0.1% 氟乙酸(TFA)溶液,超声处理 15 min,提取上清液;重复1次,混合上清液,真空干燥。
1.2.5质谱分析及数据库检索多肽悬浮液点板到 MALDI 靶板上,使用 CHCA 基质。质谱分析使用 4 800 蛋白质组分析仪 MALDI-TOF/TOF 质谱仪(AB SCIEX公司,USA)。蛋白鉴定使用蛋白质序列数据库,从国家生物技术中心下载(http://www.ncbi.nlm.nih.gov),使用 Mascot程序搜索。搜索参数如下:完全的半胱氨酸 carbamidomethylation 化,蛋氨酸部分氧化,肽质量耐受度±100 mg/kg,片段质量耐受度±0.4 Da,错误断裂为1。蛋白质鉴定标准为:蛋白质评分必须超过显著阈值水平(P<0.05)和高于50分,至少2个序列匹配。
1.2.6蛋白质功能的生物信息学分析差异蛋白功能注释首先依据非冗余蛋白质数据库(NR;NCBI),使用Blast2go程序进行(http://www.blast2go.com/b2ghome/about-blast2go);根据蛋白质GO分析的生物过程、分子功能和细胞定位进行分类(http://www.geneontology.org/)。此外,依据京都基因与基因组百科全书(KEGG)数据库(http://www.genome.jp/kegg/pathway.html)进行归类。
1.2.7统计分析全部统计分析使用SPSS v. 17软件。蛋白质丰度分析中,不育系和可育系各在单核期和二核期,3次生物学重复取样,每个重复提取蛋白在双向电泳后进行丰度分析。蛋白相对表达量为3次重复的平均值。蛋白质丰度数据比较,采用单因素方差分析(ANOVA)。差异显著性使用 Duncan 氏多重检测(DMRT),P<0.05。结果表示为3次重复的平均值±SE。
2结果与分析
2.1小麦Ven型细胞质雄性不育系及其保持系的蛋白质图谱、差异表达蛋白质分析
选用 pH 4~7、17 cm IPG 胶条和 12% SDS-PAGE 建立了冀5418A 和冀5418B 的单核期和二核期花药蛋白质电泳体系,获得了较高分辨率和重复性的 2-DE 图谱(图1)。图中可见冀5418A 和冀5418B 的蛋白分布模式图非常相似,但通过软件分析 2 种材料的 2-DE 银染电泳图谱,发现花药中表达的总蛋白质点数在 2 000 个左右,蛋白质斑点多分布于等电点为pI 5~7、分子量为40~80 kD范围。在同一时期,冀5418A 和冀5418B 两者存在明显的量和质的差异表达蛋白点。采用 PDQuest8.0 软件进行斑点检测,发现冀5418A 在小孢子发育的单核期和二核期的花药总蛋白质斑点数分别为2 125和2 120;冀5418B 在小孢子发育的单核时期和二核时期的花药总蛋白质斑点数分别为2 219 和2 217。同一时期,将2个材料表达量差异大于1.5倍的蛋白点视为差异点,两个时期共获得差异表达蛋白点98个,其中56个在两个时期都表现出同样的变化趋势(上升或者下降)。在冀5418A和冀5418B表达显著下调的分别是18个和23个。
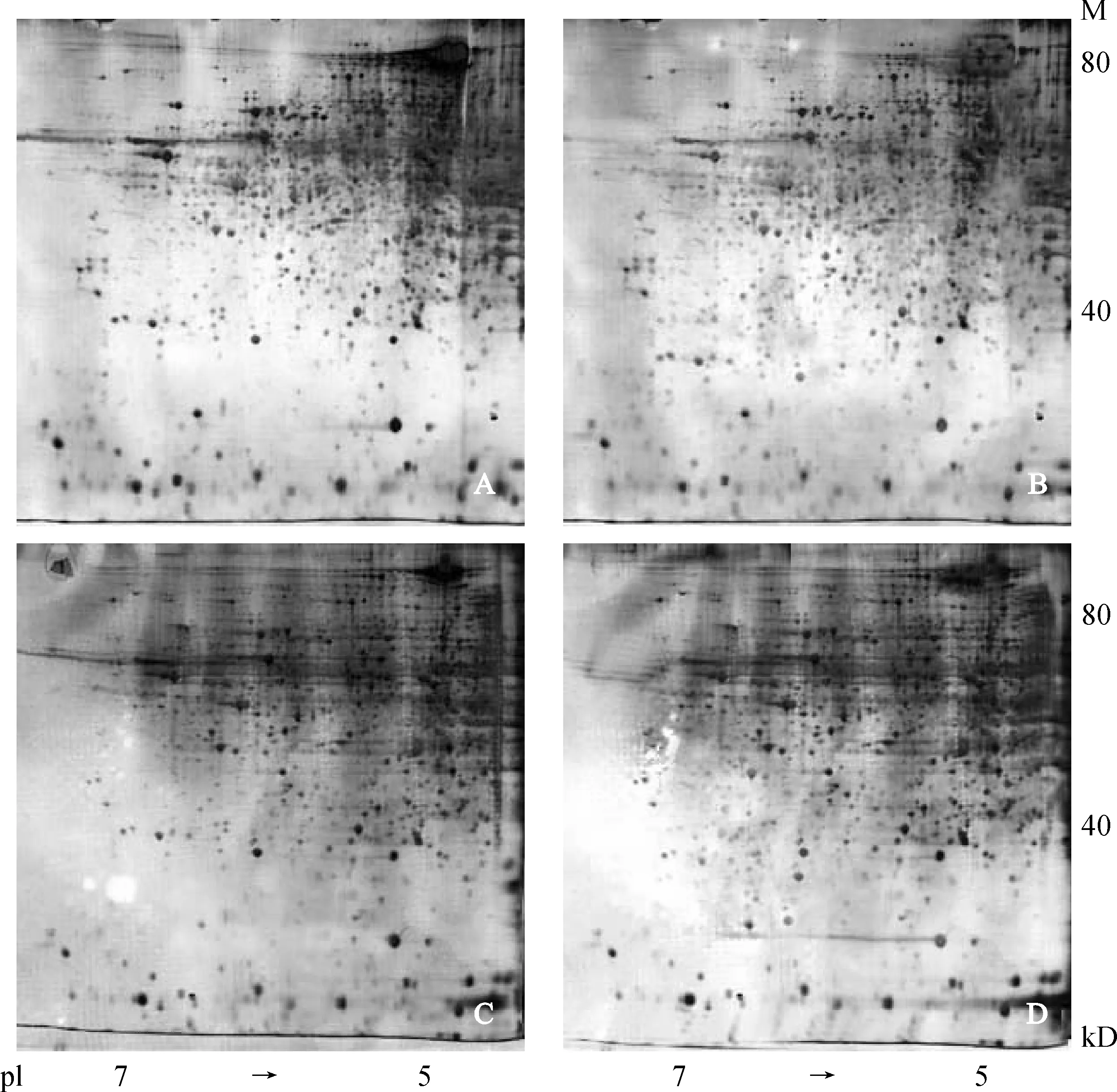
A.冀5418A单核时期花药;B.冀5418B单核时期花药;C.冀5418A二核时期花药;D.冀5418B二核时期花药;M.分子量Mark图1 冀5418A与冀5418B小孢子发育单核期和二核期花药的总蛋白质 2-DE 电泳图A. Uninucleate stage of JI-5418A; B. Uninucleate stage of JI-5418B; C. Binuleate stage of JI-5418A; D. Binuleate stage of JI-5418B; M. Molecular weight markFig. 1 2-DE images of anther proteins at uninucleate and binucleate stage from the sterile JI-5418A and its maintainer JI-5418B
2.2差异表达蛋白质斑点的质谱鉴定与分析
根据软件分析结果,对考马斯亮蓝染色的冀5418A 和冀5418B 幼穗蛋白分离图谱上可重复显著变化的56个差异蛋白质点用 ABI4800 串联质谱(MALDI-TOF-TOF-MS)进行了鉴定。所得质谱鉴定结果经 Mascot 搜索 NCBInr数据库,41个蛋白点(82.9%)被成功鉴定(表1)。结果表明:在不育系中表达下调的蛋白质有BAHD酰基转移酶DCR、6-磷酸蔗糖磷酸水解酶SPP3、锰超氧化物歧化酶、S-腺苷甲硫氨酸合成酶3、己糖激酶、磷酸烯醇式丙酮酸羧化酶、转醛酶、假定类PDI蛋白、L-抗坏血酸氧化酶类蛋白、腺苷高半胱氨酸酶、蛋白酶体亚基β类2、真核翻译起始因子1A、L-抗坏血酸过氧化物酶2、T-复合蛋白1α亚基、内质网素类蛋白、蔗糖合成酶1;另外有3个未知蛋白产物、3个预测蛋白。
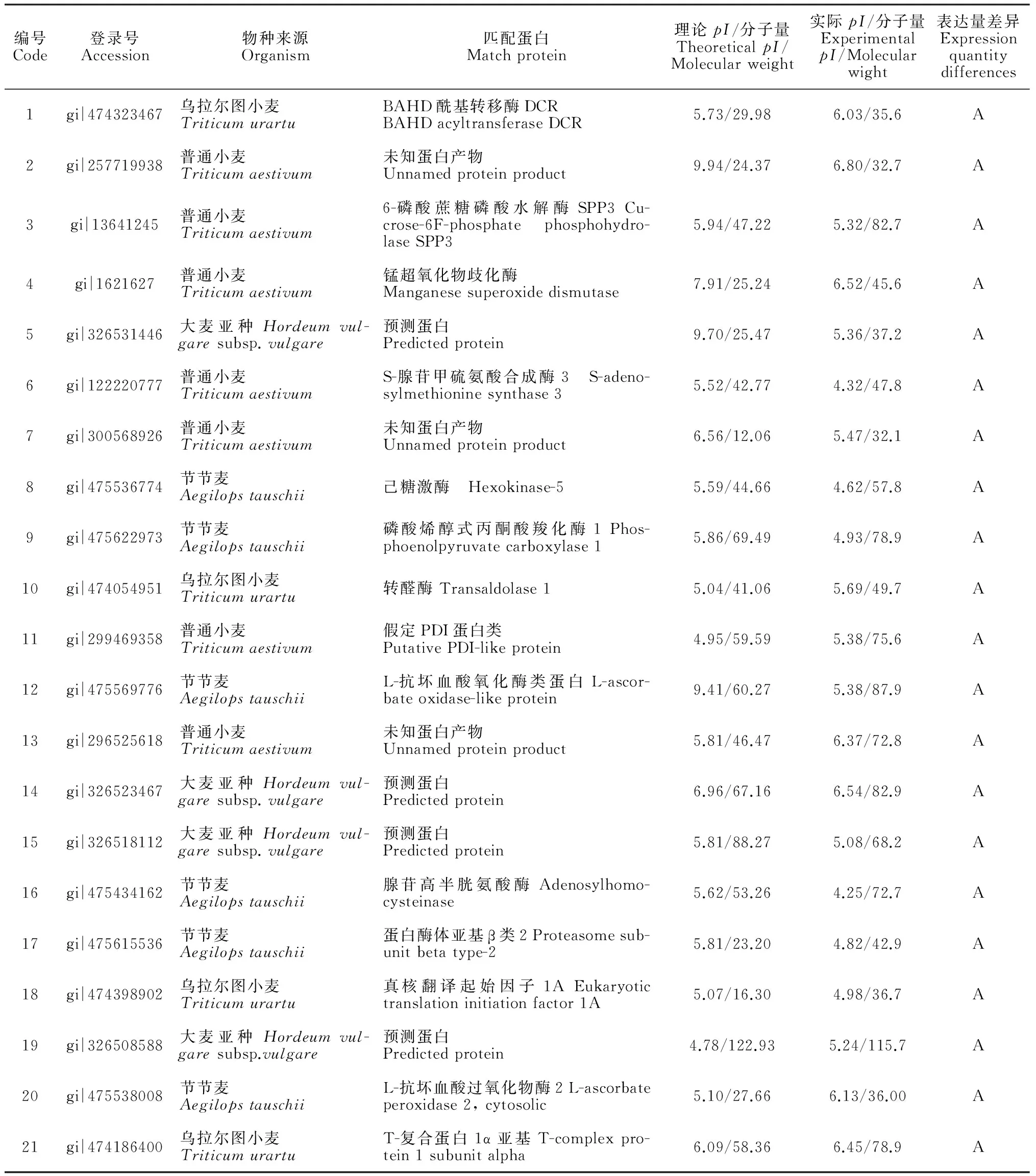
表1 差异表达蛋白质的质谱鉴定
续表1Table 1Continued
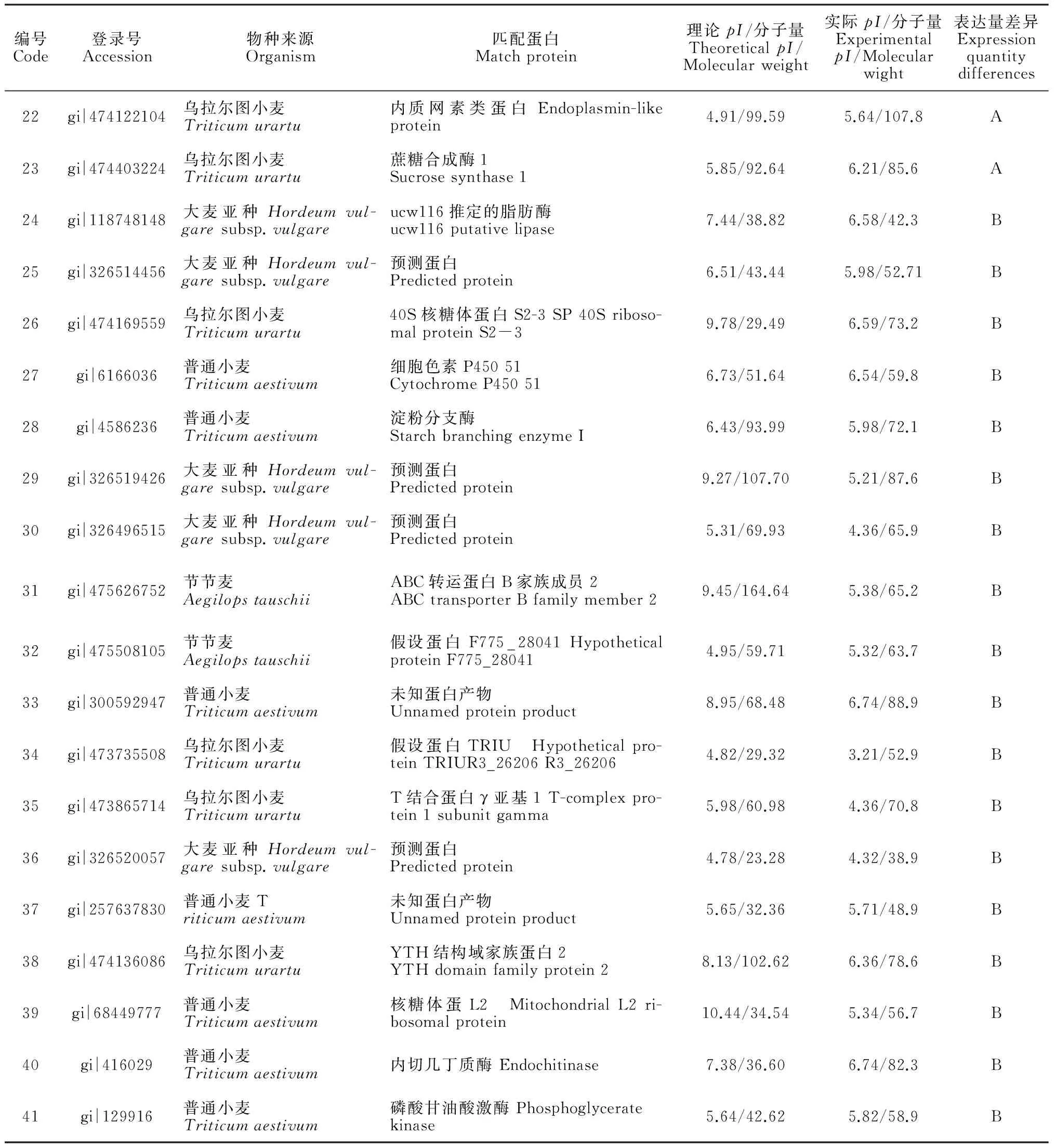
编号Code登录号Accession物种来源Organism匹配蛋白Matchprotein理论pI/分子量TheoreticalpI/Molecularweight实际pI/分子量ExperimentalpI/Molecularwight表达量差异Expressionquantitydifferences22gi|474122104乌拉尔图小麦Triticumurartu内质网素类蛋白Endoplasmin-likeprotein4.91/99.595.64/107.8A23gi|474403224乌拉尔图小麦Triticumurartu蔗糖合成酶1Sucrosesynthase15.85/92.646.21/85.6A24gi|118748148大麦亚种Hordeumvul-garesubsp.vulgareucw116推定的脂肪酶ucw116putativelipase7.44/38.826.58/42.3B25gi|326514456大麦亚种Hordeumvul-garesubsp.vulgare预测蛋白Predictedprotein6.51/43.445.98/52.71B26gi|474169559乌拉尔图小麦Triticumurartu40S核糖体蛋白S2-3SP40Sriboso-malproteinS2-39.78/29.496.59/73.2B27gi|6166036普通小麦Triticumaestivum细胞色素P45051CytochromeP450516.73/51.646.54/59.8B28gi|4586236普通小麦Triticumaestivum淀粉分支酶StarchbranchingenzymeI6.43/93.995.98/72.1B29gi|326519426大麦亚种Hordeumvul-garesubsp.vulgare预测蛋白Predictedprotein9.27/107.705.21/87.6B30gi|326496515大麦亚种Hordeumvul-garesubsp.vulgare预测蛋白Predictedprotein5.31/69.934.36/65.9B31gi|475626752节节麦AegilopstauschiiABC转运蛋白B家族成员2ABCtransporterBfamilymember29.45/164.645.38/65.2B32gi|475508105节节麦Aegilopstauschii假设蛋白F775_28041HypotheticalproteinF775_280414.95/59.715.32/63.7B33gi|300592947普通小麦Triticumaestivum未知蛋白产物Unnamedproteinproduct8.95/68.486.74/88.9B34gi|473735508乌拉尔图小麦Triticumurartu假设蛋白TRIU Hypotheticalpro-teinTRIUR3_26206R3_262064.82/29.323.21/52.9B35gi|473865714乌拉尔图小麦TriticumurartuT结合蛋白γ亚基1T-complexpro-tein1subunitgamma5.98/60.984.36/70.8B36gi|326520057大麦亚种Hordeumvul-garesubsp.vulgare预测蛋白Predictedprotein4.78/23.284.32/38.9B37gi|257637830普通小麦Triticumaestivum未知蛋白产物Unnamedproteinproduct5.65/32.365.71/48.9B38gi|474136086乌拉尔图小麦TriticumurartuYTH结构域家族蛋白2YTHdomainfamilyprotein28.13/102.626.36/78.6B39gi|68449777普通小麦Triticumaestivum核糖体蛋L2 MitochondrialL2ri-bosomalprotein10.44/34.545.34/56.7B40gi|416029普通小麦Triticumaestivum内切几丁质酶Endochitinase7.38/36.606.74/82.3B41gi|129916普通小麦Triticumaestivum磷酸甘油酸激酶Phosphoglyceratekinase5.64/42.625.82/58.9B
注:A表示不育系冀5418A中显著下调蛋白;B表示保持系冀5418B显著下调蛋白。
Note: A means that the sterile Ji5418A is significantly down-regulated; B means that the maintainer Ji5418B is significantly down-regulated
在可育系中表达下调的有:ucw116推定的脂肪酶、40S核糖体蛋白S2~3、钝叶醇14α-去甲基化酶、淀粉分支酶、ABC转运蛋白B家族成员2 、假设蛋白f775_28041、假设蛋白TRIUR3_26206、T-复合蛋白1γ亚基、预测蛋白、未知蛋白产物、YTH结构域家族蛋白2、线粒体核糖体蛋白L2 、内切几丁质酶、磷酸甘油酸激酶。另外有1个未知蛋白产物、3个预测蛋白。
2.3差异表达蛋白质的功能分析
对所获得的差异表达蛋白质进行Gene Ontology分析(图2)和KEGG 功能注释(图3)。
GO 注释成功的蛋白质在GO分析的三大类群(生物学过程BP、细胞组分CC 和分子功能MF)下进行进一步分类(图2),图中列出来注释成功的蛋白质的个数及其所占的总的百分比数。通过分析发现,生物学过程中涉及到的蛋白质多是参与电子传递和能量代谢、核糖体代谢、活性氧代谢、生物和非生物胁迫反应和发育过程等;在细胞中主要存在于膜区域、线粒体和其他细胞器区域等;分子功能主要归于DNA和RNA结合、水解酶、蛋白结合、转运活性等。
为了确定活跃在单核期和二核期差异蛋白的主要参与的生物途径,使用KEGG数据库进一步研究发现这些蛋白主要涉及的途径有碳水化合物代谢(14.25%)、氨基酸代谢(12.96%)、脂质代谢(3.85%)、核苷酸代谢(3.70%)、次生代谢(7.69%)、活性氧代谢(14.63%)、能量代谢(3.70%)等(图3),代谢途径中涉及的主要酶为连接酶、羧化酶、还原酶、脱氢酶、差向异构酶、磷酸酶等。
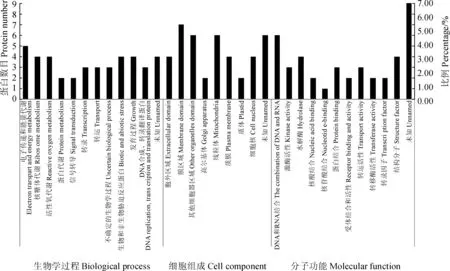
图2 差异表达蛋白 Gene Ontology 分析.Fig. 2 Histogram showing Gene Ontology analysis of differentially expressed protein.
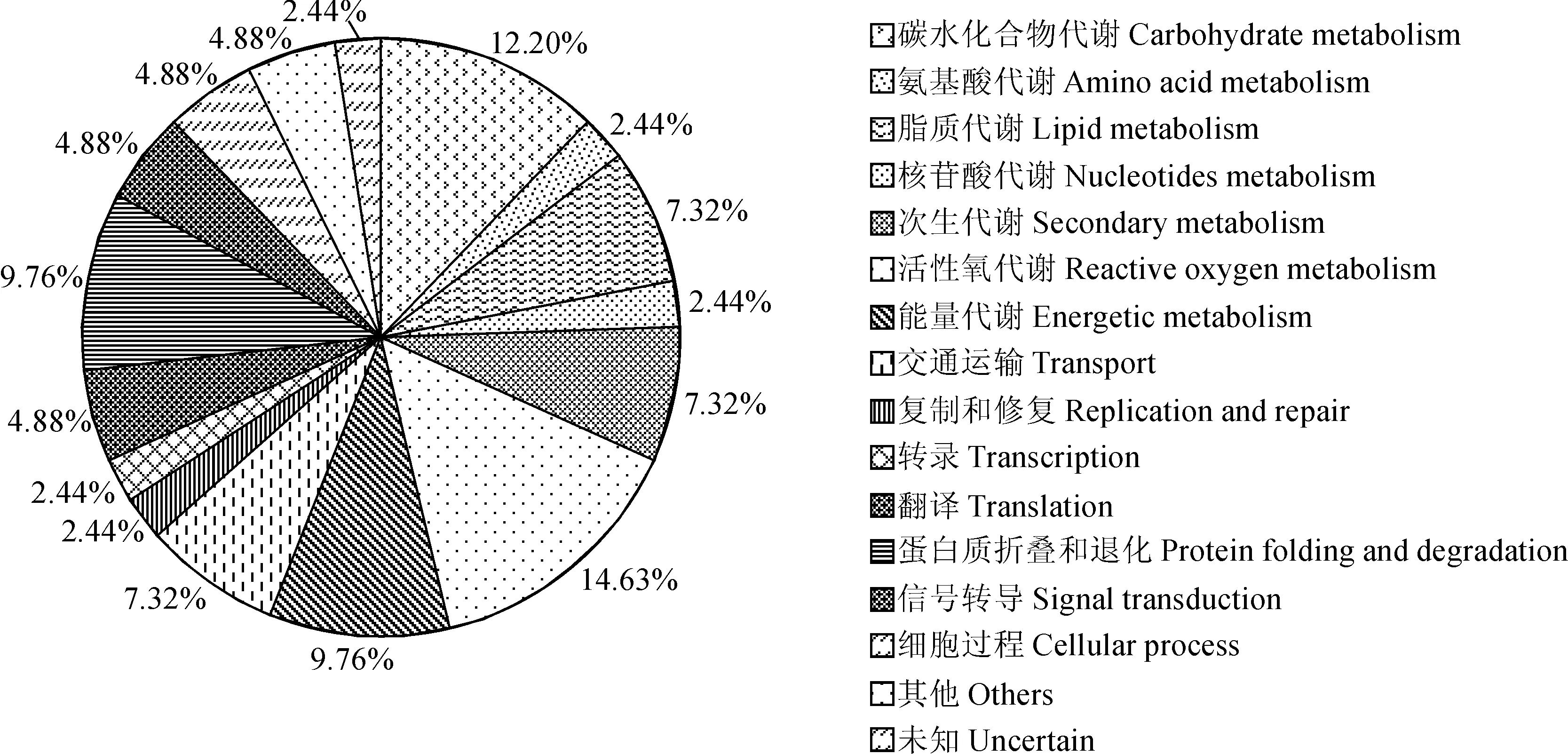
图3 差异表达蛋白 KEGG 分类图Fig. 3 Pie chart showing KEGG pathway analysis of differentially expressed protein
3讨论
以小麦Ven型质核互作雄性不育系冀5418A及其同型保持系冀5418B的单核期和二核期花药为材料,进行差异蛋白质组比较、数据库检索后发现,56个差异表达蛋白点中有41个被鉴定出来,这些差异蛋白质主要参与能量代谢、活性氧代谢、蛋白质加工、物质合成等生物学过程,可能影响冀5418的育性。
3.1能量代谢与植物雄性不育
能量代谢保证植物正常生长发育,包括花粉正常发育。植物能量代谢主要包括呼吸底物降解、呼吸链的运转和氧化磷酸化三个过程,其中呼吸基质的降解包括糖酵解、三羧酸循环、无氧呼吸、磷酸戊糖途径等多条途径。本研究发现在不育系和可育系中出现多个参与能量代谢的差异表达蛋白。
前人研究表明ATP 合成酶基因或细胞色素氧化酶基因表达下降导致植物细胞质雄性不育,粘类小麦CMS的形成可能涉及atp6 或cox3 基因[11]。胡椒保持系中atp6-2基因沉默会导致线粒体中F1FO -ATP 合酶的水解活性提高,伴随性状是胡椒花粉败育,说明atp6-2参与维持花粉的正常育性[20]。在茄属植物中,atp和cox基因的转录模式和花粉的育性表型具有相关性,这两个基因过量表达诱导了茄子的雄性不育[21]。这些都说明参与ATP合成酶和细胞色素氧化酶有关的基因的不正常表达会导致两种酶含量失衡,从而可能会影响到花粉的育性。此外,磷酸烯醇式丙酮酸羧化酶 (phosphoenolpyruvate carboxylase, PEPC)催化磷酸烯醇式丙酮酸与二氧化碳反应,生成草酰乙酸,主要功能为三羧酸循环提供草酰乙酸,PEPC的表达有利于提高植物的光合作用,提高能量的供应[22]。玉米中PEPC受到转录因子Zmdof1的调节与控制,Zmdof1的表达有助于提高PEPC活性,并提高玉米花粉活力[22]。本研究表明小麦不育系中ATP 合成酶和PECP 蛋白表达下调,己糖激酶、6-磷酸果糖激酶和转醛醇酶等参与能量代谢的蛋白也显著降低表达。值得指出的是,可育系中也有一些参与能量代谢的蛋白表现下调,包括葡萄糖苷酶、3-磷酸甘油酸激酶和一个假定的依赖于NADP的氧化还原酶。这些结果说明在小麦Ven-CMS的形成过程中,能量匮缺可能是花粉发育不良的原因之一,造成能量匮缺的原因则可能是相关酶类表达下降,也可能是由于能量代谢途径中的相关酶类表达不协调、不匹配。
3.2活性氧代谢与雄性不育
在植物中,线粒体与细胞质雄性不育性、程序性细胞死亡(PCD)和氧化应激密切相关。水稻红莲(HL)型细胞质雄性不育广泛应用于杂交水稻生产,HL-CMS可能是慢性氧化胁迫引发的组织特异性的PCD,进而导致小孢子败育[23],也可能是线粒体慢性氧化损伤直接诱导HL-CMS 早期发展阶段的小孢子败育[24]。在辣椒细胞质雄性不育系的花粉败育阶段(花粉母细胞减数分裂期),不育系花药中有较高的超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)表达,花药中过氧化物酶基因、锰超氧化物歧化酶基因、CAT2和CAT3 的转录水平也比较高[25]。蛋白质组学表明番茄7B-1突变体的花粉败育发生在小孢子母细胞减数分裂之前,此时,不育系中的超氧化物歧化酶表达量上调[26]。本研究结果显示在Ven-CMS小麦的单核期和二核期,锰超氧化物歧化酶和CAT表达下调,但在可育系中过氧化物酶表达下调,说明Ven-CMS不育系花粉形成早期,清除活性氧的酶系统表达紊乱,氧化胁迫影响花粉发育,导致发育紊乱,雄性不育。
3.3核糖体蛋白与植物雄性不育
核糖体蛋白质(ribosomal protein,RP)是参与构成核糖体的所有蛋白质的统称。在真核细胞中发现的核糖体蛋白有80种,广泛分布于各种组织中,它们与核糖核酸共同组成核糖体,在蛋白质的生物合成中起重要作用。
本研究表明在Ven CMS小麦中,叶绿体核糖体蛋白 L19、核糖体蛋白L1、核糖体蛋白S3的表达下调,而核糖体蛋白L2在可育系中表达下调。
前人同位素编码亲和标签分析表明红莲水稻雄性不育系在花粉发育单核期,保持系中核糖体蛋白 L3B相对于不育系过量表达[27]。野败型水稻CMS系统中,可育系中ribosomalproteingenerpl5有转录表达,而不育系中没有转录表达[28]。RT102A是野生稻与水稻的同核异质细胞质雄性不育系,RT102C是其保持系,RT102C使得RT102A的orf352与核糖体蛋白基因rpl5共转录,产生有活力的花粉,转录本缺失rpl5,则花粉不育,说明可育基因orf352,必须有核糖体蛋白基因rpl5的参与才能有育性恢复作用[29]。本研究表明核糖体蛋白可能参与了花粉育性的发生。鉴于核糖体结构复杂、精细,亚基组成匹配严格,在不育系中也有个别核糖体蛋白表达上调,说明各个亚基的表达差异也可能造成核糖体组成的紊乱,导致蛋白合成异常,花粉败育。
3.4花粉粒的物质合成与植物雄性不育
本研究表明在不育系中BAHD酰基转移酶DCR、6-磷酸蔗糖水解酶、S-腺苷甲硫氨酸合成酶表达下调,可育系中淀粉分枝酶、葡聚糖酶、糖基转移酶和细胞色素P450等表达下调。
不育系中表达下调的BAHD脂酰转移酶DCR是属于BAHD家族成员的脂酰转移酶。前人报道酰基转移酶参与了植物的育性发育,多是在花粉发育后期,参与花粉角质的发育过[30-31]。拟南芥中,BAHD脂酰转移酶DCR的主要作用是将脂质单体掺入脂质聚合物结构,形成花角质,该基因的缺失突变体为角质层发育不完善,表皮细胞分化改变,产生雄性不育[30]。另一种乙酰转移酶GPAT6,是一种甘油-3-磷酸乙酰转移酶(Glycerol-3-phosphate acyltransferase,GPAT),萼片和花瓣角质生物合成的关键酶,表达降低使得绒毡层发育出现缺陷,花粉外壁发育不全,导致花粉粒败育;GPAT6还参与到小孢子从四分体中的释放[31]。本研究表明在花粉发育的早期,单核期和二核期,BAHD酰基转移酶DCR可能已经开始具有表达差异。此外,可育系中有1个下调的P450家族蛋白,欧洲油菜中的BnCYP704B1是细胞色素P450家族的成员,该蛋白参与绒毡层特定的代谢途径,与花粉外壁形成有关,该基因与其同源基因的双突变花药中不能产生花粉[32]。本研究表明花粉发育晚期,影响花粉发育、花粉育性的基因在发育早期就有了表达差异。其他花药物质合成差异蛋白对Ven CMS的形成作用则有待于进一步分析。
3.5蛋白加工和降解与植物雄性不育
本研究表明参与蛋白加工和降解的差异蛋白比较多,不育系中下调的蛋白有FKBP型肽基脯氨酰顺反异构酶1(FKBP-type peptidyl-prolyl cis-trans isomerase)、酯酰转移酶、二硫键异构酶、伴侣蛋白、Chaperonin GroEL (HSP60 family) 、Chaperonin GroEL (HSP60 family)和亲环素A,可育系中上调蛋白有类泛素蛋白和谷胱甘肽硫转硫酶,以及一种含有几丁质结合域类型3的未知蛋白。
不育系中表达下调的FKBP型肽基脯氨酰顺反异构酶1是催化肽酰脯氨基顺反异构化的酶,它能够加速蛋白自身折叠、体内新生肽链折叠及变性蛋白质体外折叠[33]。小麦FKBP73转化水稻,转基因结果表明FKBP73全长表达产生可育的水稻植株,而肽基脯氨酰顺反异构酶域单独表达导致雄性不育,说明该基因与花粉育性相关[33]。热激蛋白或者伴侣蛋白是指协助其他大分子结构折叠/退褶、组装/解体的蛋白质,热激蛋白可以防止不正确折叠中间体的形成,防止没有组装的蛋白亚基的错误聚集,协助多肽链跨膜转运以及大的多亚基蛋白质的组装和解体[34]。拟南芥的温敏雄性不育系1,TMS1基因,编码一种热激蛋白Hsp40的同系物,该基因突变导致热敏配子体雄性不育[34]。在高粱中,反义RNA研究显示HSP70表达降低花粉育性[35],热激蛋白在多种不育系中均有表达异常现象,包括热诱导的雄性不育[36]、化杀诱导的雄性不育[37]和自然突变体重的雄性不育[26]。植物雄性育性发育需要多种蛋白加工酶参与,在水稻中,抽穗前冷处理导致水稻花粉活力降低,伴随花粉活力降低,是FKBP65基因和HSP基因的表达下降,说明了FKBP和HSP在花粉发育中的育性保持作用[38-39]。本研究表明蛋白加工和降解与植物雄性不育具有显著相关性,参与蛋白可能还有酯酰转移酶、二硫键异构酶、伴侣蛋白、Chaperonin GroEL (HSP60 family) ,Chaperonin GroEL (HSP60 family)、亲环素A、后加工类泛素和谷胱甘肽硫转硫酶等。
此外,还有一些差异表达蛋白,在不育系中表达下调的有驱动蛋白-like蛋白、微管蛋白、氨基酸氧化酶、腺苷高半胱氨酸酶、脂肪酶、转录因子1、Karyopherin和糖基转移酶,可育系中表达下调的有磷脂酶、神经氨酸酶、RNA结合蛋白、丝氨酸/苏氨酸激酶。但是目前为止没有报道说明这些蛋白直接与植物育性相关,本研究仅说明这些蛋白在植物雄性育性发育过程中有显著的表达差异,可能参与了植物雄性不育,为进一步的研究提供线索。
参考文献:
[1]CHEN L T, LIU Y G. Male sterility and fertility restoration in crops[J].AnnualReviewofPlantBiology, 2014, 65: 579-606.
[2]HU J, HUANG W C, HUANG Q,etal. Mitochondria and cytoplasmic male sterility in plants[J].Mitochondrion, 2014, 19: 282-288.
[3]YAN J J, TIAN H, WANG S Z. Pollen developmental defects in ZD-CMS rice line explored by cytological: molecular and proteomic approaches[J].JournalofProteomics, 2014, 108: 110-123.
[4]ZHENG B B, FANG Y N, PAN Z Y,etal. ITRAQ-based quantitative proteomics analysis revealed Aaterations of carbohydrate metabolism pathways and mitochondrial proteins in a male sterile cybrid pummelo[J].JournalofProteomResearch, 2014, 13(6): 2 998-3 015.
[5]陈蕊红, 叶景秀, 张改生, 等. 小麦质核互作型雄性不育系及其保持系花药差异蛋白质组学分析[J]. 生物化学与生物物理进展, 2009, 36(4): 431-440.
CHEN R H, YE J X, ZHANG G S,etal. Differential proteomic analysis of anther proteins between cytoplasmic-nuclear male sterility line and its maintainer in wheat(TriticumaestivumL.)[J].ProgressinBiochemistryandBiophysics, 2009, 36(4): 431-440.
[6]CHEN R H, LIU W, ZHANG G S,etal. Mitochondrial proteomic analysis of cytoplasmic male sterility line and its maintainer in wheat (TriticumaestivumL.)[J].AgriculturalSciencesinChina, 2010, 9(6): 771-782.
[7]李建超, 张改生, 孙瑞, 等. 粘类小麦细胞质雄性不育系恢复性能及其杂种优势和细胞质效应的研究[J]. 麦类作物学报, 2012, 32(2): 203-208.
LI J C, ZHANG G S, SUN R,etal. The fertility restoration performance, heterosis and cytoplasm effect of nian-type male sterile wheat lines[J].JournalofTriticeaeCrops, 2012, 32(2): 203-208.
[8]郭艳萍, 程海刚, 张改生, 等. 粘类小麦CMS育性基因分布区研究[J].麦类作物学报, 2011, 31(6): 1 007-1 013.
GUO Y P, CHENG H G, ZHANG G S,etal. Studies on distribution of fertility genes for male sterile lines with aegilops cytoplasm in wheat[J].JournalofTriticeaeCrops, 2011, 31(6): 1 007-1 013.
[9]孙兰珍, 姚方印, 李传友, 等. 小麦T、K、V型胞质不育系和种mtDNA的 RAPD分析及育性相关片段的克隆[J]. 作物学报, 2001, 27(2): 144-148.
SUN L Z, YAO F Y, LI C Y,etal. RAPD analyzing of CMS-T, K, V mtDNAs and cloning of mtDNA fragments associated with CMS-K in wheat[J].ActaAgronomicaSinica, 2001, 27(2): 144-148.
[10]王军卫, 王小利, 张改生, 等. 粘类小麦细胞质雄性不育基因的初步研究[J].西北植物学报, 2009, 29(5): 867-873.
WANG J W, WANG X L, ZHANG G S,etal. Study on male sterile gene in Svtype CMS wheat[J].ActaBotanicaBoreali-OccidentaliaSinica, 2009, 29(5): 867-873.
[11]牟秋焕, 李鹏, 石运庆, 等. V型小麦细胞质雄性不育“三系”及杂交种线粒体DNA的比较研究[J]. 中国农学通报, 2006, 22(5): 38-42.
MOU Q H, LI P, SHI Y Q,etal. Comparative studies of mtDNAs from the three lines and their hybrid of wheat V-CMS[J].ChineseAgriculturalScienceBulletin, 2006, 22(5): 38-42.
[12]吴世文, 高庆荣, 孙哲, 等. 腺苷二磷酸葡萄糖焦磷酸化酶活性对小麦K、T、V型不育系育性及籽粒形成的影响[J]. 作物学报, 2010, 36(6): 995-1002.
WU S W, GAO Q R, SUN Z,etal. Effects of ADP-glucose pyrophosphorylase activity on sterility and development of grain in K, V, and T-cytoplasmic male sterile lines in wheat[J].ActaAgronomicaSinica, 2010, 36(6): 995-1 002.
[13]DAMERVAL C, VIENNE D D, ZIVY M,etal. Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis, 1986, 7: 52-54.
[14]BRADFORD M M. A rapid and sensitive method for quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry, 1976, 72: 248-254.
[15]O’FARREL P H. High resolution two-dimensional electrophoresis of proteins[J].JournalofBiologicalChemistry, 1975, 250: 4 007-4 021.
[16]CHIVASA S, NIDMBA B K, SIMON W J,etal. Proteomic analysis of theArabidopsisthalianacell wall[J].Electrophoresis, 2002, 23(11): 1 754-1 765.
[17]BLUM H, BEIER H, GROSS H J. Improved silver staining of plant proteins, RNA and DNA in polyacrylamide gels[J].Electrophoresis, 1987, 8(2): 93-99.
[18]CANDIANO G, BRUSCHI M, MUSANTE L,etal. Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis[J].Electrophoresis, 2004, 25(9): 1 327-1 333.
[19]PARKER R, FLOWERS T J, MOORE A L,etal. An accurate and reproducible method for proteome profiling of the effects of salt stress in the rice leaf lamina[J].JournalofExperimentalBotany, 2006, 57(5): 1 109-1 118.
[20]JI J J, HUANG W, LI D W,etal. A CMS-related gene, ψatp6-2, causes increased ATP hydrolysis activity of the mitochondrial F1Fo-ATP synthase and induces male sterility in pepper (CapsicumannuumL.)[J].PlantMolecularBiologyReporter, 2014, 32(4): 888-899.
[21]YOSHIMI M, KITAMURA Y, ISSHIKI S,etal. Variations in the structure and transcription of the mitochondrial atp and cox genes in wildSolanumspecies that induce male sterility in eggplant (S.melongena)[J].TheoreticalandAppliedGenetics:InternationalJournalofBreedingResearchandCellGenetics, 2013, 126(7): 1 851-1 859.
[22]张边江, 凌丽俐, 周峰, 等. 转PEPC基因水稻花粉株系不同发育期的光合生理表现[J]. 华北农学报, 2012, 27(1): 183-184.
ZHANG B J, LING L L, ZHOU F,etal. Photosynthetic performance of transgenic rice with phosphoenolpyruvate carboxylase gene during different developmental stages[J].ActaAgriculturaeBoreali-Sinica, 2012, 27(1): 183-184.
[23]CHEN X Y, WANG D X, LIU C,etal. Maize transcription factor Zmdof1 involves in the regulation of Zm401 gene[J].PlantGrowthRegulation:AnInternationalJournalonNaturalandSyntheticRegulators, 2012, 66(3): 271-284.
[24]LI S Q, WAN C X, KONG J,etal. Programmed cell death during microgenesis in a Honglian CMS line of rice is correlated with oxidative stress in mitochondria[J].FunctionalPlantBiology, 2004, 31(4): 369-376.
[25]WAN C X, LI S Q, WEN L,etal. Damage of oxidative stress on mitochondria during microspores development in Honglian CMS line of rice[J].PlantCellReports, 2007, 26(3): 373-382.
[26]DENG M H, WEN J F,HUO J L,etal. Relationship of metabolism of reactive oxygen species with cytoplasmic male sterility in pepper (CapsicumannuumL.)[J].ScientiaHorticulturae, 2012, 134: 232-236.
[27]SHEORAN I S, ROSS A R.S, OLSON D J H,etal. Differential expression of proteins in the wild type and 7B-1 male-sterile mutant anthers of tomato (Solanumlycopersicum): A proteomic analysis[J].JournalofProteomics, 2009, 71(6): 624-636.
[28]SUN Q Q, HU C F, HU J,etal. Quantitative proteomic analysis of CMS-related changes in Honglian CMS rice anther[J].TheProteinJournal, 2009, 28(7-8): 341-348.
[29]LIU Z L, XU H, GUO J X,etal. Structural and expressional variations of the mitochondrial genome conferring the wild abortive type of cytoplasmic male sterility in rice[J].JournalofIntegrativePlantBiology, 2007, 49(6): 908-914.
[30]OKAZAKI M, KAZAMA T, MURATA H,etal. Whole mitochondrial genome sequencing and transcriptional analysis to uncover an RT102-type cytoplasmic male sterility-associated candidate gene derived fromOryzarufipogon[J].PlantandCellPhysiology, 2013, 54(9): 1 560-1 568.
[31]PANIKASHVILI D, SHI J X, SCHREIBER L,etal. TheArabidopsisDCR encoding a soluble BAHD acyltransferase is required for cutin polyester formation and seed hydration properties[J].PlantPhysiology, 2009, 151(4): 1 773-1 789.
[32]LI X C, ZHU J, YANG J,etal. Glycerol-3-phosphate acyltransferase 6 (GPAT6) is important for tapetum development in arabidopsis and plays multiple roles in plant fertility[J].MolecularPlant, 2012, 5(1): 131-142.
[33]YI B, ZENG F Q, LEI S L,etal. Two duplicate CYP704B1-homologous genesBnMs1 andBnMs2 are required for pollen exine formation and tapetal development inBrassicanapus[J].ThePlantJournal, 2010, 63(6): 925-938.
[34]KUREK I, DULBERGER R, AZEM A,etal. Deletion of the C-terminal 138 amino acids of the wheat FKBP73 abrogates calmodulin binding, dimerization and male fertility in transgenic rice[J].PlantMolecularBiology, 2002, 48(4): 369-381.
[35]YANG K Z, XIA C, LIU X L,etal. A mutation in Thermosensitive male sterile 1, encoding a heat shock protein with DnaJ and PDI domains, leads to thermosensitive gametophytic male sterility inArabidopsis[J].ThePlantJournal, 2009, 57(5): 870-882.
[36]CHEN J N, FU H Y, LU Z X,etal. Effect of HSP70 antisense RNA on normal sorghum pollen formation[J].ChineseScienceBulletin, 1997, 42(23): 1 990-1 994.
[37]LUCAS M R, EHLERS J D, HUYNH B L,etal. Markers for breeding heat-tolerant cowpea[J].MolecularBreeding, 2013, 31(3): 529-536.
[38]LIU H Z, ZHANG G S, ZHU W W,etal. Differential proteomic analysis of polyubiquitin-related proteins in chemical hybridization agent-induced wheat (TriticumaestivumL.) male sterility[J].ActaPhysiologiaePlantarum, 2014, 6(6): 1 473-1 489.
[39]SUZUKI K, AOKI N, MATSUMURA H,etal. Cooling water before panicle initiation increases chilling-induced male sterility and disables chilling-induced expression of genes encoding OsFKBP65 and heat shock proteins in rice spikelets[J].Plant,Cell&Environment, 2015, 38(7): 1 255-1 274.
(编辑:宋亚珍)
文章编号:1000-4025(2016)06-1135-11
doi:10.7606/j.issn.1000-4025.2016.06.1135
收稿日期:2016-01-19;修改稿收到日期:2016-05-23
基金项目:山东省自然科学基金重点基金(ZR2012CZ001;ZR2013CZ001)
作者简介:汪月(1990-),女,在读硕士研究生,主要从事小麦遗传育种与种业科学方面的研究。E-mail:757777876@qq.com *通信作者:张卫东,副教授,硕士生导师,主要从事小麦遗传育种和生物技术研究。E-mail:zhangwd@sdau.edu.cn
中图分类号:Q343.3+4;Q342
文献标志码:A
Comparative Proteomics Analysis of Anther Proteins between Ven Cytoplasmic Male Sterile and Fertile Plants on the Early Stages of Pollen Development in Wheat
WANG Yue1, ZHANG Yanxia2, LIN Yanli2, WU Panpan2, ZHANG Weidong1*,GAO Qingrong1, ZHANG Kai1, ZHAO Rui1
(1 Agronomy College Shandong Agricultural University/ National Key Laboratory of Crop Biology, Taian, Shandong, 271018 China; 2 Agricultural Bureau of Binzhou City, Shandong Binzhou, Shangdong 256660, China)
Abstract:The sterile line of common wheat (Triticum aestivum) with the cytoplasm of Ae. ventricosa is Ven cytoplastmic male sterile (Ven CMS), and it is one type of Sv CMS in wheat. To better understand the molecular mechanism on nucleus-cytoplasmic interaction male sterility in wheat, we analyzed differential proteomics at uninucleate and binucleate stages in sterile line JI5418A and its maintainer line JI5418B. Another proteins were separated by two dimensional electrophoresis. Differential protein spots were identified by matrix-assisted laser desorption /ionization tandem time-of-flight mass spectrometry (MALDI-TOF-TOF). Identification and function annotation and analysis of these proteins were analyzed by bioinformatics methods. About 2000 reproducibly protein spots could be visualized on these 2D-gels within M 19.0-100.0 kD and pI 4-7. Ninety eight differentially expressed proteins were found between JI5418A and JI5418B, and among these proteins 56 showed same differences at both stages. Forty one proteins were successfully identified in NCBI database. Eighteen and 23 proteins were significantly down-regulated expressed in JI5418A, and JI5418B, respectively. The differentially expressed proteins involving in energy metabolism, active oxygen scavenge, ribosome synthesis and pollen wall formation existed in both sterile and fertile lines. GO analysis predicted many differential expressed proteins involved in electron transport and energy metabolism, ribosome metabolism, and active oxygen metabolism, etc. in biological process, distributed in membrane region and mitochondria in cellular component, DNA and RNA binding function and hydrolytic enzymes in molecular function. KEGG pathways analysis indicated that more proteins involved in carbohydrate metabolism, active oxygen metabolism and protein assembly and folding than other pass ways. It is speculated that male sterility in JI5418B might be related to energy metabolism, active oxygen scavenging process. Ribosomal protein and chaperone protein also have great roles in controlling its fertility. Male sterility in Ven CMS might be related to the regulation disorders in protein processing and material synthesis.
Key words:Triticum aestivum; cytoplasmic nuclear male sterility; differential proteomics; two-dimensional gel electrophoresis; MALDI-TOF-TOF
