弓形虫ROP18重组腺病毒载体的构建及其对神经干细胞C17.2凋亡的影响
2016-07-27甘小凤程正阳罗庆礼沈继龙
张 贤,甘小凤,程正阳,都 建,罗庆礼,沈继龙,余 莉
弓形虫ROP18重组腺病毒载体的构建及其对神经干细胞C17.2凋亡的影响
张贤1,2,甘小凤1,2,程正阳1,2,都建3,罗庆礼1,2,沈继龙1,2,余莉1,2
1.安徽医科大学病原生物学教研室,合肥230032;2.人兽共患病安徽省重点实验室,合肥230032;3.安徽医科大学生物化学教研室,合肥230032
摘要:目的构建弓形虫棒状体蛋白ROP18重组腺病毒载体,研究其对神经干细胞C17.2凋亡的影响。方法将弓形虫ROP18从PEGFP-G2-ROP18重组质粒上亚克隆至腺病毒载体pHBAd-MCMV-GFP,重组腺病毒载体pHBAd-MCMV-GFP- ROP18经PCR、测序鉴定正确后,与骨架质粒pHBAd-BHG共转染HEK293细胞进行包装,收获、扩增重组腺病毒并对其滴度进行测定。以MOI=70的重组腺病毒感染神经干细胞C17.2,转染不同时间荧光显微镜观察基因的表达情况。转染48 h用CCK-8法检测C17.2的增殖情况;转染24 h采用Annexin V-APC/PI双染流式细胞术检测细胞凋亡情况;Western blot法检测半胱天冬氨酸蛋白酶3(caspase-3)的蛋白水平。结果重组ROP18过表达腺病毒在C17.2神经干细胞内能有效表达。转染48 h,与空载体对照组相比,C17.2细胞增殖活性明显降低(P<0.05);转染24 h,流式细胞术检测结果显示,ROP18基因转染组C17.2细胞凋亡率明显增加(P<0.001);Western blot检测显示caspase-3活性片段的表达明显增加(P<0.05)。结论成功构建了弓形虫ROP18重组腺病毒并在神经干细胞C17.2中表达,ROP18重组腺病毒能诱导C17.2神经干细胞凋亡。
关键词:刚地弓形虫;棒状体蛋白18;神经干细胞C17.2;重组腺病毒;细胞凋亡
刚地弓形虫(Toxoplasmagondii)简称弓形虫,是顶复门的专性细胞内寄生原虫,宿主范围广泛[1],严重危害人类健康及畜牧业的发展。弓形虫是人类重要的生物致畸因子之一,先天性感染可侵犯脑、眼、心、肺和肌肉等器官组织,引起婴儿小头畸形、脑积水和脉络膜视网膜炎等严重症状[2]。在上述器官中,中枢神经系统是最易受侵犯的部位,先天性弓形虫病的神经病理主要表现为大脑皮质发育不全[3-4]。神经干细胞(neural stem cells,NSCs)经过增殖和分化后,形成具有各种功能的神经细胞,在大脑皮质形成的过程中发挥重要作用,任何干扰NSCs正常增殖的因素均可阻碍大脑皮质的正常发育[5]。因此,研究弓形虫对NSCs的影响对于揭示弓形虫脑病的发病机制及制定相应的防治策略,具有重要意义。
棒状体是顶复合门原虫一种重要的分泌器,在入侵宿主细胞过程中分泌的棒状体蛋白(rhoptry proteins,ROPs)[6]对感染至关重要。弓形虫棒状体蛋白18(ROP18)为ROP2蛋白家族成员,具有丝氨酸-苏氨酸蛋白激酶活性,是弓形虫重要的毒力决定因子,定位于宿主纳虫泡膜(parasitophorous vacuole membrane,PVM)上[7],参与控制弓形虫在细胞内的增殖。
我们在前期的研究中发现,弓形虫与C17.2神经干细胞共培养或以弓形虫排泄分泌抗原(excreted/secreted antigens,ESAs)[8-9]刺激C17.2神经干细胞,均能诱导C17.2细胞的凋亡。而弓形虫ROP18作为虫体的一个具有激酶活性的重要毒力分子,是否会对神经干细胞的增殖和凋亡产生影响尚不明确。鉴于此,我们构建了ROP18重组腺病毒,研究其对神经干细胞的影响。
1材料与方法
1.1实验动物、虫株、细胞株与质粒清洁级5周龄昆明小鼠,雌雄不限,由安徽医科大学实验动物中心提供;弓形虫RH株速殖子由本室液氮保种,复苏后腹腔接种昆明小鼠传代;C17.2神经干细胞系由Dr. Evan Y. Snyder馈赠(The Burnham Institute for Medical Research; La Jolla, CA, USA);293A人胚肾细胞由本室保存;PEGFP-G2-ROP18质粒由安徽医科大学都建教授馈赠。
1.2主要试剂和仪器载体pHBAd-MCMV-GFP(Hanbio公司);DMEM培养基(美国Hyclone公司);胎牛血清(杭州四季青生物工程有限公司);马血清(美国Gibco 公司);转染试剂Lipofiter2000(美国life公司);CCK-8细胞增殖及细胞毒性检测试剂盒(上海贝博bestbio公司);Annexin V-APC/PI细胞凋亡检测试剂盒(凯基KeyGEN BioTECH公司);兔抗人半胱天冬氨酸蛋白酶3(cysteine aspartate specific protease3,Caspase-3)抗体(美国Cell Signaling Technology公司);小鼠抗人β-actin 抗体(美国Cell Signaling Technology公司);BCA蛋白定量试剂盒、Western一抗稀释液(江苏碧云天公司);流式细胞仪(美国BD公司);化学发光成像系统(上海欧翔科学仪器有限公司)。
1.3ROP18重组腺病毒的构建
1.3.1ROP18基因扩增设计1对针对ROP18基因的特异性引物并加入酶切位点(pHBAd-MCMV-GFP载体用NotI和NsiI双酶切),以PEGFP-G2-ROP18质粒作为扩增模板扩增ROP18全长。引物序列:上游引物:5′-ATTAGCGGCCGCATGTTTTCGGTACAGCGGCCA-3′,下游引物:5′-ACACATGCATTTATTCTGTGTGGAGATG-3′,反应参数为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,3步组成25个循环,最后72℃延伸10 min。PCR产物用1.5%琼脂糖凝胶电泳鉴定,而后用Axygen公司回收试剂盒回收,紫外测定浓度。
1.3.2产物定向连接到pHBAd-MCMV-GFP载体的鉴定pHBAd-MCMV-GFP载体和ROP18-PCR产物分别用NotI和NsiI双酶切,切胶回收后,以载体100-200 ng、目的片段20 μL的比例在16 ℃连接过夜,然后转化DH5a感受态细胞,涂布于氨苄青霉素抗性的LB平板,挑可疑菌落先行PCR鉴定,再送上海桑尼生物技术有限公司测序。
1.3.3ROP18重组腺病毒的包装、扩增和纯化将293A细胞接种于60 mm培养皿,置37 ℃含5% CO2的培养箱中培养过夜。待细胞生长至底面积的70%~80%时,将pHBAd-MCMV-GFP-ROP18重组腺病毒载体质粒与骨架质粒pHBAd-BHG共转染至293A细胞。转染6 h,更换新鲜的细胞培养液,待细胞大部分病变后(约2~3 d)并从底部脱落进行收毒。将60 mm培养皿中所有细胞及培养液收于15 mL离心管中。打开恒温水浴锅至37 ℃,将15 mL离心管在液氮及37 ℃水浴反复冻融3次。于离心机离心3 000 r/min 5 min,收集含病毒的上清液,弃沉淀。该上清即为ROP18重组腺病毒,放于-80 ℃保存备用。
1.3.4ROP18重组腺病毒的滴度测定采用改良的TCID50进行测定:在96孔细胞培养板中以1×105/mL的浓度接种293A细胞,100 μL每孔,12孔为一组,共8组,重复一次。待24 h细胞贴壁以后,将病毒稀释液从1×106加到1×1013,共8个稀释度,每个稀释度加10孔,其余2孔为阴性对照, 37 ℃ CO2培养箱中培养10 d,逐日观察细胞状况,并在第10 d用显微镜观察每孔CPE情况,记录每排样品的阳性孔数。对于100 μL样品,滴度T=101+d(s-0.5),其中d=log10稀释度,s=阳性比率之和(即从第一个10倍稀释度算起有CPE出现的阳性孔数)。再将TCID50/mL转换成PFU/mL:TCID50/mL=0.7PFU/mL,两次重复实验得到的滴度值应相差≤100.7。
1.4C17.2神经干细胞的培养C17.2神经干细胞的培养参照Evan Y. Snyder教授实验室所用标准操作流程[10]。用含10%胎牛血清,5%马血清,100 U/mL青/链霉素的DMEM完全培养液(培养液使用一周后补加1%谷氨酰胺)培养,细胞融合至90%左右传代。PBS洗两遍后,胰酶细胞消化液消化2 min,含血清的完全培养液3 mL终止消化,吹打使分散均匀,最多1∶10传代。
1.5ROP18重组腺病毒转染C17.2神经干细胞将对数生长期的C17.2神经干细胞制成1×105/mL单细胞悬液接种于6孔板,每孔2 mL,培养24 h待细胞贴壁后,PBS洗两遍。按照感染复数为1∶70转染含有ROP18重组腺病毒、腺病毒空载体(对照)至C17.2中,培养24、48、72、96 h后观察病毒的转染效率。
1.6CCK-8法检测细胞增殖将1×105/mL的C17.2神经干细胞加入96孔细胞培养板,每孔100 μL,分为4组,每组5个复孔,37 ℃、5%CO2培养箱中培养24 h,弃去培养液,PBS洗两遍。前两组分别加入ROP18重组腺病毒、腺病毒空载体对照(MOI为70),后两组为细胞对照组和空白对照组。腺病毒转染48 h,各孔弃一半液体,加CCK-8 溶液10 μL,在温箱中孵育2 h至肉眼颜色改变后,用酶标仪测定每孔450 nm波长光密度(optical density, OD)值,各组重复实验3次。
1.7Annexin V-APC/PI双染检测细胞凋亡将对数生长期的C17.2神经干细胞制成1×105/mL单细胞悬液接种于6孔板,每孔2 mL,培养24 h待细胞贴壁后,PBS洗两遍,加入MOI为70的ROP18重组腺病毒及腺病毒空载体,培养液换成5%胎牛血清,2.5%马血清的DMEM完全培养液。转染24 h用细胞刮收集贴壁细胞至10 mL离心管。用冷PBS洗涤细胞2次,离心800 r/min,4 ℃,10 min,弃培养液,收集细胞,加入500 μL的Binding Buffer 悬浮细胞,再加入5 μL Annexin V-APC混匀后,4 ℃避光,反应15 min。用PBS洗涤细胞一次,离心2 000 r/min,5 min后,用PBS重悬细胞,上流式仪前5 min加入5 μL PI染液混匀后室温避光孵育5 min。1 h内上流式细胞仪检测,每组实验重复3次。FCS express 4软件分析细胞凋亡率。
1.8 Western blot法检测蛋白表达收集重组腺病毒ROP18、腺病毒空载体及细胞对照组的贴壁细胞,用PBS洗2次,离心800 r/min,10 min,弃上清,每管加100 μL细胞总蛋白裂解液(99.5 μL强裂解液RIPA+0.5 μL蛋白酶抑制剂PMSF),冰上孵育20 min后离心12 000 r/min,4 ℃,10 min,取上清液,此即为细胞总蛋白。每次各组取30 μL蛋白上样缓冲液在SDS-PAGE凝胶中电泳,200 mA恒流转膜90 min,PVDF膜放入含5%脱脂奶粉的PBST封闭2 h,弃封闭液,PBST洗涤3次,加入按1∶1 000稀释的caspase-3一抗,4℃孵育过夜,PBST洗3次后加HRP标记的山羊抗兔IgG二抗,室温孵育2 h,PBST洗涤3次,ECL法显色,照相并分析结果。每组实验重复3次。
1.9统计学分析文中处理的数据结果均以均数±标准差形式表示。用t检验分析两组数据间的统计学差异,用方差分析分析两组以上数据间的统计学差异。t检验P<0.05表示差异具有统计学意义,方差分析P<0.05表示差异具有统计学意义。
2结果
2.1pHBAd-MCMV-GFP- ROP18重组腺病毒载体的鉴定重组子的鉴定结果见图1。7个克隆经PCR鉴定均检测到约1.6 kb的条带,与目的DNA的长度符合。阳性克隆经上海桑尼生物技术有限公司测序与PEGFP-G2-ROP18载体序列100%吻合。

泳道1: DNA Marker;泳道2-8:不同重组子PCR鉴定结果
Lane 1: DNA Marker;Lane2-8: PCR products of different recombinants monoclonal identification.
图1单克隆PCR鉴定结果
Fig.1Identification of recombinants using PCR
2.2ROP18重组腺病毒在293A细胞中的扩增及滴定将ROP18重组腺病毒转染至293A细胞中,每天观察细胞病变情况,约2~3 d,光镜下可见细胞变圆、变大,呈葡萄状,并在72 h左右漂起。改进的TCID50法测定重组腺病毒的滴度为1×106PFU/mL。ROP18重组腺病毒在293A细胞中的表达情况见图2。

A:荧光显微镜照片;B:明场对照
A: fluorescence expression; B: field control
图2ROP18重组腺病毒在293A细胞内的表达情况
Fig.2The 293A cell transfected by ROP18 recombinant adenovirus
2.3ROP18重组腺病毒在神经干细胞C17.2上的表达将ROP18重组腺病毒转染至C17.2神经干细胞,用荧光显微镜观察分别在转染24、48、72、96 h检测目的基因的表达情况。通过观察可见C17.2细胞在转染24、48 h时大约50%~70%表达绿色荧光蛋白,且细胞形态正常。
2.4ROP18重组腺病毒对C17.2细胞的增殖抑制作用CCK-8法检测结果显示(图4):ROP18重组腺病毒组细胞增殖活力为(58.13±7.373)%,较腺病毒对照组(85.34±6.092)%及细胞对照组(81.51±3.415)%均有明显的下降(P<0.05)。
2.5ROP18重组腺病毒诱导C17.2神经干细胞的凋亡流式细胞术检测结果显示:ROP18重组腺病毒组细胞凋亡率为(31.07±10.05)%,较腺病毒对照组(2.707±0.050 44)%及细胞对照组(0.777 5±0.052 50)%均有明显的下降(P<0.000 1)。

A:转染24 h、B:转染48 h、C:转染72 h、D:转染96 h荧光表达与明场细胞的合图情况
A: within 24 h; B: 48 h; C: 72 h; D: 96 h.
图3ROP18重组腺病毒在C17.2神经干细胞内的表达情况
Fig.3C17.2 neural stem cells cell transfected by ROP18 recombinant adenovirus

注:*P<0.05
Western blot检测结果显示:ROP18重组腺病毒转染组,C17.2神经干细胞内的caspase-3蛋白的表达量(0.519 7±0.064 81)较腺病毒空载体对照(0.177 7±0.093 08)和细胞对照组(0.034 0±0.013 53)均有明显升高。
3讨论
弓形虫作为人兽共患病的病原体,可以入侵所有的有核细胞,孕妇感染弓形虫后会造成胎儿的畸形、流产或死胎。国内外的文献资料[11-13]显示弓形虫感染有嗜中枢性,对于中枢神经系统修复来说神经干细胞是一个有力的工具,而在成年哺乳动物脑特定区域内多功能干细胞的数量是有限的[14]。鉴于此,我们选择了C17.2神经干细胞系作为研究对象,此细胞是小鼠小脑祖细胞内所形成的永生化细胞系,具有神经干细胞的所有特征,是目前研究移植治疗神经系统疾病的神经干细胞较好的细胞系[15-16]。有研究表明弓形虫的排泄分泌抗原ESAs[17]对神经干细胞C17.2有促凋亡的作用,而ROP18蛋白作为ESAs中重要的蛋白分子,是否对神经干细胞C17.2有直接的诱导凋亡的作用尚不明确。

注:***P<0.01
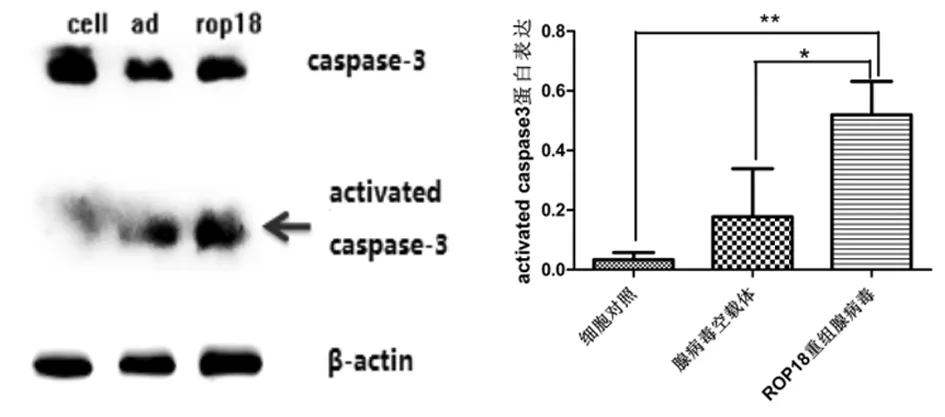
注:*P<0.05,**P<0.01
本实验选择MOI=70的ROP18重组腺病毒转染C17.2神经干细胞。CCK-8法检测转染48h的细胞增殖能力,结果显示,ROP18重组腺病毒组相对于细胞对照组、腺病毒空载体组能够明显的抑制神经干细胞C17.2的增殖活力。同时,用流式细胞术检测转染24 h细胞凋亡的情况,结果显示,ROP18重组腺病毒组C17.2神经干细胞的早期细胞凋亡率有明显升高。Caspase-3是凋亡信号通路中一个重要的蛋白酶,也是凋亡的关键执行分子,在凋亡的早期阶段,它被激活[18]。本研究采取定量的WB测定ROP18重组腺病毒刺激细胞24 h的细胞凋亡蛋白caspsae-3的表达量,结果显示ROP18重组腺病毒caspase-3被激活并且表达量明显高于其他两组。上述结果表明ROP18重组腺病毒可以诱导神经干细胞C17.2的凋亡。
Wang等人[8]研究发现ESAs可以通过内质网应激信号通路(endoplasmic reticulum stress, ERS)来介导细胞的凋亡,在此次实验中选用的是感染弓形虫速殖子小鼠的原代神经干细胞。Zhou等人[9]将前期实验进一步优化,研究对象转为神经干细胞系C17.2,发现同样通过ERS途径来介导细胞的凋亡。在本实验中我们发现ROP18重组腺病毒可以介导C17.2的凋亡,但是否同样通过ERS信号通路来发挥促凋亡的作用有待于进一步的研究和验证。
综上所述,本研究成功构建了ROP18重组腺病毒并转染神经干细胞C17.2,结果表明ROP18蛋白对神经干细胞C17.2有促凋亡的作用。该研究对于明确弓形虫致中枢神经系统的损伤机制有着重要的意义。
参考文献:
[1]Dubey JP. Toxoplasmosis of animals and humans[M]. Boca Raton: CRC Press, 2009: 313.
[2]Kravetz JD, Federman DG. Toxoplasmosis in pregnancy[J].Am J Med,2005,118(3):212-216.DOI:10.1080/10647440500068305
[3]Yu ES, Gan SB, Chen GJ. Toxoplasmosis in China[M]. Hong Kong: Asian Medical Press, 2000: 32-33. (in Chinese)
于恩庶,甘绍白,陈观今.中国弓形虫病[M].香港:亚洲医药出版社,2000: 32-33.
[4]el-Sagaff S, Salem HS, Nichols W, et al. Cell death pattern in cerebellum neurons infected withToxoplasmagondii[J]. J Egypt Soc Parasitol, 2005, 35(3): 809-818.
[5]Wang S, Xu ZH. Progress in the study of molecular mechanisms of developmental cortex malf or mations mechanisms of developmental cortex malformations[J]. Chin J Cell Biol, 2011, 33(8): 837-846. (in Chinese)
王硕,许执恒. 大脑皮质发育畸形及分子遗传机理研究进展[J]. 中国细胞生物学学报,2011, 33(8):837-846.
[6]El Hajjh H, Demey E, Poncet J, et al. The ROP2 family ofToxoplasmagondiirhoptry proteins: proteomic and genomic characterization and molecular modeling[J]. Proteomics, 2006, 6(21): 5773-5784.DOI:10.1002/pmic.200600187
[7]El Hajj H, Lebrun M, Arold ST, et al. ROP18 is a rhoptry kinase controlling the intracellular proliferation ofToxoplasmagondii[J]. PLoS Pathog, 2007, 3(2): e14.DOI:10.1371/journal.ppat.0030014
[8]Wang T, Zhou J, Yu L, et al.Toxoplasmagondiiinduce apoptosis of neural stem cells viaendoplasmic veticulum stress pathway[J]. Parasitology, 2014, 144 (7): 988-995.DOI:10.1017/S0031182014000183
[9]Zhou J, Gan X, Wang T, et al.Toxoplasmagondiiprevalent in China induce weaker apoptosis of neural stem cells C17.2 via endoplasmic veticulum stress (ERS) signaling pathways[J]. Parasit Vectors, 2015(8): 73.DOI:10.1186/s13071-015-0670-3
[10]Snyder EY, Deitcher DL, Walsh C, et al. Multipotent neural cell lines can engraft and participate in development of mouse cerebellum[J]. Cell, 1992, 68: 33-51.
[11]Doetsch F. The glial identity of neural stem cells[J]. Nat Neurosci, 2003, 6: 1127-1134.DOI:10.1038/nn1144
[12]Lopes FM, Goncalves DD, Mitsuka-Bregano R, et al.Toxoplasmagondiiinfection in pregnancy[J]. Braz J Infect Dis, 2007, 11(5): 496-506.
[13]Dearbhaile D, Pia V, Sven H, et al. Immunopharmacological intervention for successful neural stem cell therapy: New perspectives in CNS neurogenesis and repair[J]. Pharmacol Therapeutics, 2014, 141(1): 21-31.DOI:10.1016/j.pharmthera.2013.08.001
[14]Osunkalu VO, AKanmu SA, Ofomah NJ, et al. Seroprevalence ofToxoplasmagondiiIgG antibody in HIV-injected patients at the Lagos University Teaching Hospital[J]. HIV AIDS (Auck1), 2011, 3: 101-105.DOI:10.2147/HIV.S15532
[15]Riess P, Zhang C, Saatman KE, et al. Transplanted neural stem cells survive, differentiate, and improve neurology-icalmotor function after experimental traumatic brain injury[J]. Neurosurgery, 2002, 51(4): 1043-1052.
[16]Cheng A, Chan SL, Milhavet O, et al. p38 MAP kinase mediates nitric oxide-Induced apoptosis of neural progenitor cells[J]. J Biol Chem, 2001, 276(46): 43320-43327.DOI:10.1074/jbc.M107698200
[17]Daray F, Deslee D, Santoro F, et al. Induction of a protective antibody dependent response against Toxoplasmosis by in vitro excreted/secreted antigens from tachyzoites ofToxoplasmagondii[J]. Parasite Immunol, 1988, 10(5): 553-567.
[18]Sun Y, Guan Y, Li F, et al. Effects of rat cytomegalovirus on the nervous system of the early rat embryo[J]. Virol Sin, 2012, 27(4): 234-240.DOI: 10.1007/s12250-012-3250-0
DOI:10.3969/j.issn.1002-2694.2016.03.005
通讯作者:余莉,Email:lilyyu33@126.com
中图分类号:R382.5
文献标识码:A
文章编号:1002-2694(2016)03-0234-06
Corresponding author:Yu Li, Email:lilyyu33@126.com
收稿日期:2015-07-15;修回日期:2015-12-08
Construction of Toxoplasma ROP18 recombinant adenovirus vector and its effect on the apoptosis of C17.2 stem cells
ZHANG Xian1,2,GAN Xiao-feng1,2,CHENG Zheng-yang1,2,DU Jian3,LUO Qing-li1,2,SHEN Ji-long1,2,YU Li1,2
(1.DepartmentofMicrobiologyandParasitology,AuhuiMedicalUniversity,Hefei230032,China;2.AnhuiKeyLaboratoryofZoonoses,AuhuiMedicalUniversity,Hefei230032,China;3.DepartmentofBiochemistry,AuhuiMedicalUniversity,Hefei230032,China)
Abstract:To study the effect of Toxoplasma rhoptry kinase 18 (ROP18) on the apoptosis of C17.2 neural stem cells, Toxoplasma gondii ROP18 was subcloned from PEGFP-G2-ROP18 into pHBAd-MCMV-GFP. The recombinant adenovirus vector pHBAd-MCMV-GFP-ROP18 was comfirmed by PCR and sequencing, and the identified recombinant adenovirus vector was transfected into 293 cells for packaging with skeleton plasmid. After amplification, ROP18 recombinant adenovirus (MOI=70) was transfected into C17.2 neural stem cell. The proliferation of C17.2 cells at 48 horus Post-treatment was detected using CCK-8 kit and the apoptosis of C17.2 cells at 24 hours Post-treatment was detected by flow cytometer. Western blot was used to determine the expression levels of caspase-3. ROP18 recombinant adenovirus was expressed effectively in C17.2 neural stem. Compared with the control group, proliferation of C17.2 cells was significantly decreased (P<0.05) in the ROP18 recombinant adenovirus group at 48 hours while the apoptosis of C17.2 cells was significantly increased in the ROP18 recombinant adenovirus (P<0.001) at 24 hours Post treatment and the caspases-3 expression levels was significantly increased (P<0.05). ROP18 recombinant adenovirus was successfully constructed and was highly expressed in C17.2 neural stem cells. ROP18 recombinant adenovirus induced the apoptosis of C17.2 neural stem cells.
Keywords:Toxoplasma gondii; rhoptry protein 18; neural stem cells C17.2; Toxoplasma ROP18 recombinant adenovirus; cell apoptosis Supported by the National Natural Science Foundation of People’s Republic of China (No.81572022) and the program for Excellent Talents in Anhui Medical University (No.0113014104)
国家自然科学基金(No. 81572022)资助;安徽医科大学青年拔尖人才支持计划项目(No.0113014104)资助
