淡色库蚊氨肽酶N基因的克隆及生物信息学分析
2016-07-27郭秀霞杨培培王海防刘丽娟张崇星王怀位公茂庆
郭秀霞,程 鹏,杨培培,王海防,刘丽娟,张崇星,王怀位,公茂庆
淡色库蚊氨肽酶N基因的克隆及生物信息学分析
郭秀霞,程鹏,杨培培,王海防,刘丽娟,张崇星,王怀位,公茂庆
山东省医学科学院,山东省寄生虫病防治研究所,济宁272033
摘要:目的克隆淡色库蚊Bt毒素受体氨肽酶N(Aminopeptidase N,APN)基因,并对基因及编码蛋白进行生物信息学分析。方法提取淡色库蚊RNA,通过RT-PCR扩增氨肽酶N基因的全长cDNA序列,纯化PCR产物连接至pMD19-T载体,阳性重组质粒经PCR鉴定后进行基因测序。生物信息学分析APN基因的序列同源性及编码蛋白的结构特征。结果该基因cDNA序列全长为1 383 bp(含终止密码子),编码460个氨基酸,与致倦库蚊XM_001862270.1序列的同源性为100%。预测蛋白质分子量为52.9 kDa,等电点为4.98。前21个氨基酸为N-末端的信号肽,存在2个N-糖基化位点(93NLT95和169NVS171)。具有肽酶家族M1的序列特征、锌结合位点HEXXH和谷氨酸锌化氨肽酶的保守结构GAMEN。结论成功克隆了淡色库蚊氨肽酶N基因并对APN蛋白进行生物信息学分析,为进一步探讨淡色库蚊APN的功能及Bt毒素作用机制奠定了基础。
关键词:淡色库蚊;氨肽酶N;克隆;生物信息学
Supported by the National Natural Science Foundation of China (No. 81271877)
淡色库蚊(Culexpipienspallens)是我国北方入室吸血骚扰的主要蚊种,是班氏丝虫病和流行性乙型脑炎的重要媒介,严重危害人类健康[1-2]。生物防治是蚊虫防治的重要方法,由于其不污染环境,成本低,效果好等优势,为人们所关注。以苏云金杆菌(Bacillusthuringiensis, Bt)以色列变种和球形芽孢杆菌(Bacillussphaericus, Bs)为主的细菌制剂是在全球范围内普遍应用的有效的生物防治手段,然而包括五带淡色库蚊和埃及伊蚊在内的多种昆虫对Bt产生抗性的问题也不断引起人们的重视[3]。氨肽酶N(APN)是位于昆虫中肠刷状缘膜囊泡(BBMV)上Bt Cry 毒素的特异性受体,在Bt毒素作用于靶标害虫中的作用非常重要。昆虫产生Bt抗性的能力以及Bt Cry毒素的杀虫活性取决于APN与Bt Cry 毒素之间的结合能力[4]。本研究通过提取淡色库蚊幼虫的RNA,RT-PCR克隆淡色库蚊氨肽酶N基因的cDNA全长序列,并对其基因序列及编码的蛋白进行相应的生物信息学分析,获得该基因的序列特征,为进一步探讨该蛋白的生物学功能及Bt毒素作用机制奠定基础。
1材料与方法
1.1材料
1.1.1蚊虫样本淡色库蚊(敏感种群)来自山东省疾控中心,在实验室连续饲养,未接触任何杀虫剂。蚊饲养条件:温度26 ℃~28 ℃,相对湿度75%~85%,光照14 h/d的室内,用小白鼠饲喂来产卵传代。
1.1.2试剂RNA提取试剂盒购自QIAGEN公司;RT-PCR试剂盒、pMD19-T Vector试剂盒、大肠埃希菌感受态细胞EscherichiacoliJM109、DNA分子质量标准(DL-2000、1kbp Ladder )、T4 DNA连接酶均购自TaKaRa公司;质粒小提试剂盒和凝胶回收试剂盒购于Axygen公司;其余试剂为国产分析纯。
1.2方法
1.2.1总RNA提取及第一链cDNA的合成取单只淡色库蚊3龄幼虫中肠放入无RNase的匀浆器中加入液氮进行充分研磨,根据RNA提取试剂盒(购自QIAGEN公司)的操作步骤提取总RNA,进行1%琼脂糖凝胶电泳并测定其OD260/OD280值和浓度。以Oligo(dT)15为逆转录引物,在反转录酶的作用下催化第一链cDNA的合成。
1.2.2淡色库蚊APN基因的克隆根据GenBank中收录的致倦库蚊氨肽酶N核苷酸序列(XM_001862270.1)设计引物,上游引物:5′-ATGATGAGAAATGGTCTCGC-3′;下游引物:5′-TTATAAATCGTCCGGATCGTAC-3′。以第一链cDNA为模板进行PCR反应,扩增目的基因片段。采用50 μL反应体系:ddH2O 38.5 μL、 10×LA PCR Buffer 5 μL、10 mmol/L dNTP 1 μL 、模板1 μL、LA Taq聚合酶0.5 μL、上下游引物各2 μL。反应条件:94 ℃ 3 min; 94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 5 min;4 ℃保存。扩增产物进行1%琼脂糖凝胶电泳。
1.2.3PCR产物纯化及测序用DNA片段纯化/回收试剂盒对目的DNA片段进行纯化,将纯化后的基因片段连接到pMD-19T simple Vector上,然后转化至大肠埃希菌感受态细胞E.coliJM109,并将转化菌涂布到含有氨苄西林的LB固体培养平板上,37 ℃培养过夜,挑取单菌落进行菌体PCR鉴定,阳性克隆摇菌培养并送Invitrogen公司测序。
1.2.4淡色库蚊APN基因的序列分析及系统进化树构建将测序结果在NCBI上进行BLAST比对(http://www.ncbi.nlm.gov/blast/),搜集GenBank中收录的致倦库蚊、斯氏按蚊、冈比亚按蚊和埃及伊蚊等的氨肽酶N的氨基酸序列,运用DNAMAN6.0软件、ClustalX 1.81和Mega4.0软件进行序列比对,绘制生物进化树。
1.2.5淡色库蚊APN基因编码蛋白的生物信息学分析根据核苷酸序列推导出编码氨基酸序列,利用ExPASy在线分析APN的结构特征,应用ProtParam、SignalP3.0 Server、SWISSMODEL等不同的分析方法,对氨基酸序列的分子量和等电点、结构域、物理参数、序列特征、三级结构等进行分析和预测。
2结果
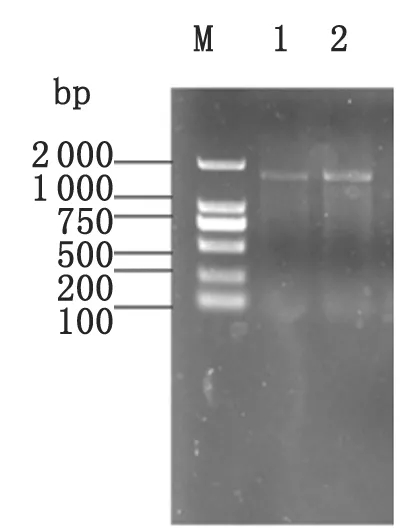
2.1总RNA提取利用RNA提取试剂盒提取总RNA,获得的RNA进行1%琼脂糖凝胶电泳(图1),并测定其OD260/OD280值和浓度。电泳条带显示,提取的淡色库蚊的总RNA样品质量较好,18S rRNA的亮度大约是28S rRNA的两倍,产物未被RNase降解;微量紫外分光光度仪测定纯度,并对其进行定量,结果显示1.9 M:DL 2 000 DNA Ladder Marker;1-2:淡色库蚊幼虫总RNA M:DL 2 000 DNA ladder marker; Lane 1-2: The RNA ofGulexpipienspallenslarva. 图1淡色库蚊幼虫总RNA电泳图 Fig.1RNA of Gulex pipiens pallens larva 2.2淡色库蚊APN全长cDNA的克隆采用两步法进行RT-PCR反应。第一步反应,在逆转录酶的作用下将淡色库蚊RNA反转录为cDNA。第二步反应,以上述获得的cDNA为模板,利用设计合成的引物进行PCR,扩增淡色库蚊的APN基因。进行1%琼脂糖凝胶电泳观察PCR的扩增情况。电泳可发现在2 000 bp下方有一条亮的DNA条带,与APN预期分子量大小相符,如图2所示。 M: DL 2 000 DNA Ladder Marker;1-2: 淡色库蚊APN PCR扩增产物; M: DL 2 000 DNA ladder marker; Lanes 1-2: AmplifiedCpapngene. 图2PCR产物电泳图 Fig.2Analysis of PCR amplified Cpapn gene from RNA 2.3菌落PCR鉴定及测序将纯化的PCR产物与pMD-19T simple Vector连接并转化E.coliJM109,37 ℃过夜培养后挑选单菌落进行PCR鉴定,阳性克隆送Invitrogen公司测序。 2.4淡色库蚊APN基因序列分析及系统进化树构建测序结果表明,淡色库蚊氨肽酶N基因cDNA片段全长1 383 bp(含终止密码子),其中GC含量为55.8%,AT含量为44.2%,A占23.7% ,C占27.5% ,G占28.3% ,T占20.5%。该基因可编码的氨基酸为460个,预测蛋白质的分子量为52.9 kDa,等电点为5.98。推测分子式为C2390H3674N632O685S23,半衰期为30 h,不稳定系数39.19,为稳定蛋白,脂肪系数84.63,总平均亲水性为-0.256。将测序结果与GenBank中收录的基因进行Blast同源序列比对,核苷酸序列同XM_001862270.1序列的同源性为100%。将获得的氨基酸序列与GenBank中收录的冈比亚按蚊、斯氏按蚊、埃及伊蚊和致倦库蚊等的氨肽酶N序列进行序列比对,绘制进化树并进行分析,发现这几类蚊种的氨肽酶N分属于不同的分支。如图3所示。 2.5淡色库蚊APN基因编码蛋白质生物信息学分析对该蛋白的二级结构预测发现,α螺旋占49.35%,β转角为6.30%,无规则卷曲占30.22%。经过Expasy在线分析,前21个氨基酸为N-末端的信号肽,C-末端没有潜在的糖基磷脂酰肌醇(GPI)锚信号肽。该氨基酸序列存在2个N-糖基化位点(93NLT95和169NVS171),没有O-糖基化位点,预测该蛋白有两个跨膜区(77-100和347-375)。该氨基酸存在肽酶家族M1的序列特征、锌结合位点HEXXH和谷氨酸锌化氨肽酶的保守结构GAMEN(图4)。应用Swissmodel在线分析对该蛋白进行结构建模,其三维结构如图5所示。 3讨论 苏云金杆菌是目前应用前景最为广泛的微生物杀虫剂,通常认为其作用机制是产生的毒素晶体蛋白与昆虫中肠受体相互作用,使细胞膜形成穿孔而导致昆虫死亡[5]。位于昆虫中肠的Bt毒素受体有氨肽酶N、钙黏蛋白、糖脂类、碱性磷酸酶等,其中,氨肽酶N是研究较多的Bt毒素受体[6]。氨肽酶N(APN)是一种锌离子依赖性的蛋白水解酶,属于金属蛋白酶Ml家族中的gluzincins亚族,以同源二聚体的形式存在于细胞膜上,能够从蛋白质多肽链的N末端降解中性或碱性氨基酸,从而激活体内一系列重要的生化反应过程。APN结构中含有多个糖基化位点,可以与不同细胞因子结合而发挥细胞信号传导或者受体的作用。近年来,APNs也被认为是疟疾传播阻断疫苗研发的最有潜力的蛋白[7]。 本实验以淡色库蚊为研究对象,成功提取了淡色库蚊总RNA,通过RT-PCR反应获得cDNA,然后以cDNA为模板扩增得到了淡色库蚊氨肽酶N的基因编码序列。序列测定结果分析表明淡色库蚊氨肽酶N基因编码序列全长约1 383 bp(含终止密码子),编码460个氨基酸,预测蛋白质分子量为52.9 kDa,等电点为4.98。通过同源序列比对分析,核苷酸序列同XM_001862270.1序列的同源性为100%。将获得的氨基酸序列与GenBank中收录不同蚊种及果蝇的部分的氨肽酶N序列进行多物种同源性序列比对,图中蓝黑色区域为完全保守区域,蓝色和粉色区域为相似区域,对这些保守区域和相似区域的分析预测,可以为进一步研究氨肽酶N的各功能位点提供一定的实验依据。绘制系统进化树并进行分析,发现这几类蚊种的氨肽酶N分属于不同的分支,其中按蚊属为独立分支,与库蚊属、伊蚊属分属于不同的分支,淡色库蚊与致倦库蚊的同源性最高,与东方果实蝇属于同一分支。 本实验对淡色库蚊APN基因编码蛋白二级结构进行预测,结果显示α螺旋和无规则卷曲占较高比例。蛋白结构及功能分析发现,该蛋白具有昆虫 注:以上为图A。蓝黑色:高度保守区域;蓝色和粉色:相似区域 A.Colour black: highly conserved region; Colour blue and pink: similar region. A: 不同蚊种氨肽酶N序列比对; B: 氨肽酶N生物进化分析斯氏按蚊(Anophelessinensis) KFB52687.1;冈比亚按蚊(Anophelesgambiae) ACJ10211.1;埃及伊蚊(Aedesaegypti)AGT95897.1;致倦库蚊(Culexquinquefasciatus)EDS31007.1 XP_001862305.1;东方果实蝇(Bactroceradorsalis)JAC39216.1; A: Alignment of the derived amino acid sequences of APN with a selected set of homologies from other mosquitoes; B: Phylogenetic analysis of APN from different organisms.AnophelessinensisKFB52687.1;AnophelesgambiaeACJ10211.1;AedesaegyptiAGT95897.1;CulexquinquefasciatusEDS31007.1, XP_001862305.1;BactroceradorsalisJAC39216.1. 图3不同蚊种的氨肽酶N氨基酸序列比对及进化分析 Fig.3Sequence alignment and evolution analysis of APN N端信号肽用双下划线标出;潜在的N-糖基化位点用单下划线标出;保守结构GAMAN用虚线标出;锌结合位点HEXXH结构用三角标出;GPI锚定位点用圆点标出。 Signal peptidase at N-terminal are double underlined. Potential N-glycosylaion sites are single underlined. The conserved GAMAN motif are marked by a broken line. The zinc-binding motif HEXXH are marked by triangle. The GPI anchor point is showed by solid circle. 图4淡色库蚊APN基因的cDNA全长及推导出的氨基酸序列 Fig.4Nucleotide and deduced amino acid sequences of Culex pipiens pallens APN gene 图5 CpAPN三级结构预测 氨肽酶N典型的结构特征,有锌结合位点HEXXH和谷氨酸锌化氨肽酶GAMEN的保守结构。APN高度保守的GAMEN基元被认为是形成催化活性位点的一部分[8]。前21个氨基酸为N-末端的信号肽序列,C-末端含有一个具有亲脂性和跨膜特性的糖基化磷脂酰肌醇(GPI)锚定位点,APN正是通过GPI-锚定在BBMV上。该氨基酸序列存在2个N-糖基化位点(93NLT95和169NVS171),但是不具备O-糖基化位点。三级结构预测分析,N-末端含有一个N-乙酰半乳糖胺结构,该结构能被Cry毒素识别。 目前对APN与Cry毒素作用机制的研究较多,Chen J等通过实验成功分离了埃及伊蚊APN1,并确定了其与Cry11Aa具有高度的亲和性,而与Cry11Ba具有较低的亲和力[9]。Zhang R等确定了冈比亚按蚊中一个大小为106 kDa的APN是Cry11Ba的特异性受体,之后在大肠杆菌中表达了冈比亚按蚊的APN2蛋白片段,证实该片段和Cry11Ba有高度的亲和力。为了进一步证实APN2的功能位点,APN2蛋白片段被剪切为30 kDa tb和ta片段以及28 kDa片段,发现AgAPN2ta可以使Cry11Ba的毒力降低85%,表明Cry11Ba主要和28 kDa AgAPN2ta发生作用[10-11]。虽然APN的研究取得了一定的进展,但是由于Cry毒素与APNs的结合非常复杂,尚有许多问题有待研究。淡色库蚊是我国流行性乙型脑炎和班氏丝虫病的重要传播媒介,对淡色库蚊氨肽酶N(APN)的研究国内外尚无相关报道。本研究成功克隆了淡色库蚊氨肽酶N基因并对其编码蛋白进行信号肽、保守区域、分子结构、跨膜区等进行分析,由于APN在生物体内的特殊而重要的生物学功能,淡色库蚊APN的研究为进一步探讨Bt毒素的作用机制及Bt抗性机制有重要意义。 参考文献: [1]Gemperli A, Sogoba N, Fondjo E, et al. Mapping malaria transmission in West and Central Africa[J]. Trop Med Int Health, 2006, 1(7): 1032-1046. [2]Onyango SA, Kitron U, Mungai P, et al. Monitoring malaria vector control interventions: effectiveness of five different adult mosquito sampling methods[J]. J Med Entomol, 2013, 50(5): 1140-1151. [3]Myriam S, Benoit G, Christine BL, et al. Resistance to bio-insecticides or how to enhance their sustainability: a review[J]. Front Plant Sci, 2015, 6: 381. [4]Alejandra B, Supaporn L, Sarjeet SG, et al,Bacillusthuringiensis: A story of a successful bioinsecticide[J]. Insect Biochem Mol Biol, 2011, 41(7): 423-431. [5]Vachon V, Laprade R, Schwartz JL. Current models of the mode of action ofBacillusthuringiensisinsecticidal crystal proteins: a critical review[J].J Invertebr Pathol, 2012,111(1):1-12. [6]Ren XL, Ma Y, Cui JJ, et al. RNA interference-mediated knockdown of three putative aminopeptidases N affects susceptibility ofSpodopteraexigualarvae toBacillusthuringiensisCry1Ca[J]. J Insect Physiol, 2014, 67: 28-36. [7]Bokharaei H, Raz A, Zakeri S, et al. 3′-RACE Amplification of aminopeptidase N gene fromAnophelesstephensiapplicable in transmission blocking vaccines[J]. Avicenna J Med Biotechnol, 2012, 4(3): 131-141. [8]Laustsen PG, Vang S, Kristensen T. Mutational analysis of the active site of human insulin- regulated aminopeptidase[J]. Eur J Biochem, 2001, 268(1): 98-104. [9]Chen J, Aimanova KG, Pan S, et al. Identification and characterization ofAedesaegyptiaminopeptidase N as a putative receptor ofBacillusthuringiensisCry11A toxin[J]. Insect Biochem Mol Biol, 2009, 39(10): 688-696. [10]Zhang R, Hua G, Andacht TM, et al. A 106-kDa aminopeptidase is a putative receptor forBacillusthuringiensisCry11Ba toxin in the mosquitoAnophelesgambiae[J]. Biochemistry, 2008, 47(43): 11263-11272. [11]Zhang R, Hua G, Urbauer J L, et al. Synergistic and inhibitory effects of aminopeptidase peptides onBacillusthuringiensisCry11Ba toxicity in the mosquitoAnophelesgambiae[J]. Biochemistry, 2010, 49(39): 8512-8519. DOI:10.3969/j.issn.1002-2694.2016.03.006 通讯作者:公茂庆,Email:maoqingg@yahoo.com 中图分类号:Q969.44 文献标识码:A 文章编号:1002-2694(2016)03-0240-06 Corresponding author:Gong Mao-qing, Email: maoqingg@yahoo.com 收稿日期:2015-10-14;修回日期:2016-01-19 Molecular cloning and bioinformatics analysis on aminopeptidase N of Culex pipiens pallens GUO Xiu-xia,CHENG Peng,WANG Hai-fang,LIU Li-juan,YANG Pei-pei,ZHANG Chong-xing,WANG Huai-wei,GONG Mao-qing (ShandongInstituteofParasiticDiseases,ShandongAcademyofMedicalSciences,Jining272033,China) Abstract:In order to clone the gene of aminopeptidase N (APN), the receptor of Bt insecticidal crystal protein of Culex pipiens pallens, and analyze the biological information of the coding protein, single mosquito larva RNA was extracted from Cx. pipiens pallens and the APN cDNA sequence was amplified by RT-PCR. The PCR products were cloned into the pMD-19T simple vectors and sequenced. The sequence homology and the structural feature of the coding protein were analyzed by biological information systems. Results showed that the full-length of CpAPN was 1 383 bp that encoded a protein of 460 amino acid residues. The homology with Culex quinquefasciatus (XM_001862270.1) was 100%. The predicted molecular weight and isoelectric point were 52.9 kDa and 6.33, respectively. It contained an N-terminal signal peptide with 21 amino acids, and two N- glycosylaion sites (93NLT95and169NVS171), showing the typical characteristics of peptidase family M1, and with the zinc-binding motif HEXXH and the conserved GAMAN motif. Aminopeptidase N gene of Culex pipiens pallens was cloned successfully and analyzed by bioinfomatics technique. The results provided experimental evidence for revealing the function of CpAPN and the insecticidal mechanism of Bt toxin. Keywords:Culex pipiens pallens; aminopeptidase N; gene cloning; bioinformatics analysis 国家自然科学基金项目(No.81271877)