接种枯草芽孢杆菌和丛枝菌根真菌促进红三叶修复石油污染土壤
2016-07-23王丽丽杨谦
王丽丽++杨谦

摘要:在温室内通过盆栽试验的方法,比较对照组(CK)、单纯接种枯草芽孢杆菌(Bacillus subtilis,简称Bs)、单纯接种丛枝菌根真菌——地球囊霉(Glomus geosporum,简称Gg)、混合接种Gg+Bs的红三叶种植于石油污染的土壤中后,植株与土壤理化性状差异。实验结果表明,经过60 d修复后,与对照组相比,单纯或混合接种处理均能显著增加红三叶地上和地下干生物量(P<0.05),可溶性糖含量和脯氨酸含量均显著升高(P<0.05),叶片CAT、POD活性显著升高(P<0.05),丙二醛含量明显减少(P<0.05)。在各种接种处理中,红三叶根际与非根际土壤脱氢酶活性和土壤中总石油烃降解率均显著升高(P<0.05)。Bs和Gg在红三叶修复石油污染土壤和植物抗石油胁迫的能力方面有协同作用,接种Bs+Gg处理修复效果要优于单独接种Bs或Gg。
关键词:枯草芽孢杆菌;丛枝菌根真菌;红三叶;石油污染;土壤修复
中图分类号: X53文献标志码: A文章编号:1002-1302(2016)05-0526-03
通信作者:杨谦,教授,博士生导师,主要从事环境微生物方面的研究。E-mail:yangq@hit.edu.cn。石油污染土壤的修复与治理已经成为当前亟待解决的问题。植物修复技术是降解修复石油污染土壤的一种有效手段,选择适宜油污区生长的绿色植物是实现植物修复的前提条件。植物-微生物修复系统作为农业生态环境保护领域具有价值和广阔前景的新型技术,不仅能促进土壤中石油污染物的降解和矿化,也能有效提高植物对石油类和其他有机污染物的修复效率。植物根际促生细菌(plant growth promoting rhizobacteria,PGPR)和丛枝菌根真菌(Arbuscular mycorrhiza fungi,AMF)是植物根际微生物的重要组成部分,二者都能加速土壤养分循环,增强污染物的降解能力,可以改善植物根际微生物和土壤酶活性,提高植物对逆境的抗御能力[1-7]。PGPR 和AMF既可通过促进植物的生长促进彼此在植物根际的繁衍,同时也存在对营养和生态位的竞争[8]。红三叶(Trifolium pratense)是一种抗逆性较强的天然牧草,具有发达的根系,对重金属、干旱、养分胁迫等逆境条件表现出不同的响应[9-11]。然而,红三叶对石油污染土壤的修复效果的报道还很少,有关枯草芽孢杆菌与地球囊霉对红三叶修复石油污染土壤效果的影响尚不明确。在前期的研究中,我们筛选出了一株根际枯草芽孢杆菌,该菌株对原油具有一定的降解能力。本研究结果可为利用PGPR和AMF强化植物原位修复降解大庆石油生产区域石油污染土壤提供理论依据。
1材料和方法
1.1材料
采用受石油污染土壤(黑龙江省大庆市卧里屯草甸土)作为供试基质,其主要理化性质为:pH值(土 ∶水=1 ∶2.5)8.09,有机质35.7 g/kg,全氮含量2.75 g/kg,全磷含量 3.28 g/kg,全钾含量18.8 g/kg,总石油烃含量75.24 g/kg。采集的土壤经风干,过2 mm网筛后,在105 ℃下湿热灭菌2 h。土壤过筛时并未发现有土著AM真菌。供试植物为红三叶(Trifolium pratense),将红三叶种子在10% NaClO中浸泡10 min,然后用无菌去离子水冲洗数次,而后置于湿润的滤纸上进行催芽处理。供试PGPR菌为枯草芽孢杆菌(Bacillus subtilis,以下简称Bs),由本实验室从问荆(Equisetum arvense)分离,保存在-80 ℃。在室温条件下将Bs接种在TSB液体培养基[12]、28 ℃下振荡培养24 h,用无菌水洗后,在4 ℃、4 000 r/min 条件下离心2次后重悬浮于无菌双蒸馏水中,用无菌水调整PGPR菌悬液浓度为 5×109 CFU/mL。供试AMF菌为地球囊霉(Glomus geosporum,以下简称Gg),由本实验室从双穗雀稗(Paspalum distichum)根际土壤中分离,保存在-80 ℃。使用时Gg预先经红三叶草盆栽繁殖,试验使用的菌剂是含有孢子、根外菌丝和被侵染植物根段的根际土壤混合物,每克菌剂中含有25~35个孢子。
1.2试验设计
试验在温室内进行,采用盆栽红三叶草接种不同菌种,共设置4个处理,分别为:(1)对照组(CK)(仅种植植物,未对植物进行任何接种处理),(2)单独接种PGPR(Bs),(3)单独接种AMF(Gg),(4)PGPR和AMF混合接种(Gg+Bs)。
盆栽塑料花盆高度30 cm,盆口内直径30 cm,盆底内直径20 cm,装土前在花盆内套上塑料袋,防止污染物随水流失,每盆装基质3 kg。将菌根真菌Gg接种剂与供试土壤按质量比1 ∶20的比例(约150 g)混匀散撒在种子下约2 cm处的土壤中;不接种处理的则加入等量灭活的菌根真菌Gg菌剂,以保持土壤理化性质与微生物区系的一致性。Bs接种处理是将经表面消毒处理过的红三叶用PGPR菌体悬浮液浸种0.5 h,未接种PGPR处理种子用无菌双蒸馏水浸种0.5 h。每处理设置4个重复,随机排列。
生长期间维持温度在(25±5) ℃,光照时间为14 h/d,每天7至21时用生物镝灯补充光照。待各盆出苗齐全后间苗,每盆留50株。植物生长期间用称质量法浇水,苗期每天按基质质量的10%浇水,植株生长出现差异后,隔2 d称质量一次并按土质量的20%补给,确保盆内水不外溢,土壤含水量保持在75%左右。
红三叶草生长60 d后收割,将根系清洗干净后,选取1 cm 长的新鲜根段用曲利本蓝染色法染色[13],制作切片,然后在光学显微镜下采用网格交叉计数法统计菌根侵染率。将鲜叶清洗干净后,称取5.0 g植株鲜叶片测定有关生理指标;并且对红三叶的地下和地上部分烘干后测定生物量。同时测定红三叶草根际和非根际土壤的脱氢酶活性和总石油烃含量,计算土壤中总石油烃降解率。
1.3测定项目
红三叶生物量采用烘干法测定,即将收获后的植株洗净沥干在105 ℃下杀青30 min,70 ℃下烘干至恒质量,用电子天平称量植株地上和地下生物量。游离脯氨酸(Pro)含量采用茚三酮显色法[14]测定;丙二醛(MDA)含量采用硫代巴比妥酸法[14](TBA)测定;过氧化物酶(POD)活性采用愈创木酚法测定[14];过氧化氢酶(CAT)活性采用H2O2还原法测定[14];可溶性糖测定采用蒽酮比色法[14];土壤脱氢酶活性采用TTC比色法[15];土壤中总石油烃含量测定采用质量法。
1.4统计分析
试验数据以x±s表示,运用SPSS 17.0软件对试验数据进行统计分析。
2结果与分析
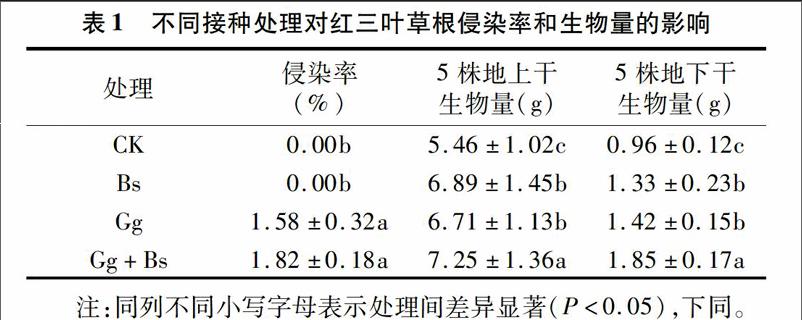
2.1不同接种处理对红三叶草根侵染率和生物量的影响
不同接种处理对在石油污染土壤中生长的红三叶草根侵染率和生物量存在很大差异(表1)。对照组(CK)和接种Bs处理红三叶草根部侵染率均为0,接种Gg的红三叶草根部的侵染率为1.58,接种Gg+Bs处理红三叶草根部侵染率达到3.32。Gg、Gg+Bs处理与对照组相比红三叶草菌根侵染率有显著增加(P<0.05)。接种处理后红三叶草的生物量(地上和地下)与对照组相比均显著增大(P<0.05),表明接种Bs、Gg可以提高红三叶草的生物量积累来缓解石油污染对红三叶草生长带来的不利影响。方差分析表明,Gg和Bs之间存在显著交互效应(P<0.05),主要表现在接种Gg+Bs处理协同促进红三叶生长,增加生物量,表明混合接种处理对于提高红三叶在石油污染土壤中的生长和修复能力有重要意义。
2.2不同接种处理对红三叶草植株生理指标的影响
2.2.1不同接种处理对红三叶草叶片可溶性糖含量的影响不同接种处理后红三叶草植株叶片可溶性糖含量都有一定幅度升高(表2)。在石油污染土壤条件下,接种Bs、Gg处理的红三叶草植株叶片中可溶性糖含量与对照组相比较显著升高(P<0.05),这说明单独接种Bs或Gg可以使红三叶草叶片可溶性糖含量增加。接种Gg+Bs处理的红三叶植株叶片可溶性糖明显高于对照组(P<0.05),方差分析表明,Gg和Bs之间存在显著交互作用效应(P<0.05),主要表现在接种Gg+Bs处理协同促进红三叶植株可溶性糖的积累。
2.2.2不同接种处理对红三叶草叶片脯氨酸含量的影响由表2可见,石油污染土壤条件下,接种Bs、Gg处理的红三叶植株脯氨酸含量显著高于对照组(P<0.05),Gg+Bs处理脯氨酸含量比Gg、Bs处理均显著升高(P<0.05)。说明Bs与Gg之间存在显著的交互作用效应,接种Bs+Gg对于提高石油污染胁迫下红三叶植株中脯氨酸含量有协同作用。
2.2.3不同接种处理对红三叶草叶片丙二醛含量的影响各接种处理的红三叶的MDA含量都表现出降低的趋势(表2)。与对照组相比较,接种Bs、Gg处理红三叶叶片MDA含量显著降低(P<0.05),Gg+Bs处理红三叶叶片MDA含量显著降低(P<0.05)。Gg和Bs混合接种处理对红三叶叶片MDA含量有显著协同效应。
2.2.4不同接种处理对红三叶草叶片POD活性的影响在石油污染土壤中,各接种处理后红三叶叶片POD活性都呈升高的趋势(表2),Bs、Gg、Gg+Bs处理后红三叶叶片POD活性与对照组相比显著升高(P<0.05),Gg+Bs处理最高。这说明Gg、Bs对红三叶植株叶片POD活性均有促进作用。
2.2.5不同接种处理对红三叶草叶片CAT活性的影响由表2可知,与对照组相比较,Bs、Gg、Gg+Bs处理能显著提高石油污染土壤生长的红三叶植株叶片CAT活性(P<0.05),Gg+Bs处理最大。Bs与Gg之间有显著的交互作用(P<005),表现为Gg+Bs处理协同提高石油污染土壤红三叶植株叶片的CAT活性。
2.3不同接种处理对石油污染土壤的脱氢酶活性和总石油烃含量的影响
不同接种处理的红三叶根际和非根际土中脱氢酶和总石油烃含量的变化如图1所示。相同处理的红三叶根际和非根际土之间的脱氢酶活性存在差异,呈现出红三叶非根际土脱氢酶活性普遍低于根际土脱氢酶的趋势。各接种处理红三叶根际和非根际土壤的脱氢酶活性均显著高于对照组(P<005),Bs+Gg处理的土壤脱氢酶活性最高,表现出显著的协同作用(P<0.05)。
不同接种处理对石油污染土壤总石油烃降解率如图2所示。对照组土壤中总石油烃的平均降解率为5.55%,接种处理的土壤中总石油烃含量显著降低(P<0.05),各接种处理中红三叶根际土的总石油烃降解率均高于其非根际土总石油烃降解率。Gg+Bs处理土壤总石油烃平均降解率达到2339%,接种Gg+Bs处理对土壤总石油烃的降解效果显著强于Gg、Bs处理(P<0.05), 表明混合接种Bs和Gg对红三叶降解石油污染土壤总石油烃具有协同增效作用。
3讨论
一般认为,植物体内通过一些渗透物质(如可溶性糖、脯氨酸等)的调节来防御逆境胁迫引起的不利影响[16]。在石油污染土壤中生长的植株,植物的呼吸和蒸腾作用受到影响,破坏了细胞膜结构,造成细胞内电解质的外渗,因而对植物产生一定的毒害作用,严重抑制植物的生长[17-19]。以往的研究表明通过接种PGPR和AMF可以增强逆境胁迫下植物的生长能力和抗逆性。本研究表明接种根际促生细菌Bacillus subtilis和菌根真菌地球囊霉Glomus geosporum能显著提高石油污染土壤中红三叶植株中可溶性糖、脯氨酸含量和生物量,对由于石油污染引起的红三叶的渗透胁迫起到保护作用,提高红三叶对石油污染胁迫的耐受性。丙二醛是活性氧启动膜脂过氧化的主要产物,其含量的高低和细胞质膜的透性变化是反映膜脂过氧化作用强弱和质膜破坏程度的重要指标[20]。在逆境胁迫下,植株的生长发育受到抑制,丙二醛含量会严重降低。在本试验中,我们发现接种促生细菌Bacillus subtilis和菌根真菌Glomus geosporum可以降低红三叶植株丙二醛含量的积累,表明促生细菌Bacillus subtilis和Glomus geosporum协同作用可以有效提高红三叶对石油污染胁迫的耐受性。接种PGPR和接种GM处理的红三叶叶片POD、CAT活性显著升高,增强了红三叶对活性氧的清除能力,降低膜脂过氧化程度,这为提高红三叶修复石油污染提供了一道生理屏障。
AM菌与根际促生菌假单胞菌属(Pseudomonas)和枯草芽孢杆菌属(Bacillus)等细菌[21]有相互促进作用,可以改善植物根际微生物和土壤酶活性,增强污染物的降解能力。Kohler等认为接种PGPR、AM真菌和溶磷菌处理的莴苣(Lactuca sativa)根际土壤酶活性显著高于非接种处理[22-23]。本试验认为,接种处理可以显著提高土壤脱氢酶的活性,表明不同接种处理的红三叶对石油污染土壤中总石油烃的降解能力存在差异。真菌、细菌可以协同作用对石油污染土壤进行修复,其生长及对石油烃的降解不受土著微生物的抑制。单独接种地球囊霉、摩西球囊霉以及混接AM真菌、细菌能显著提高柴油的降解率[24]。本试验研究表明单独和混合接种Bacillus subtilis和Glomus geosporum都能显著促进石油污染土壤中总石油烃降解能力,由此可见,接种Bacillus subtilis和菌根真菌Glomus geosporum是提高红三叶修复石油污染土壤的有效技术手段。
4结论
接种Bacillus subtilis和Glomus geosporum处理均能显著提高红三叶地上和地下干生物量、可溶性糖含量和脯氨酸含量(P<0.05),叶片CAT、POD活性显著升高(P<0.05),丙二醛含量明显减少(P<0.05)。在各接种处理中,红三叶根际与非根际土壤脱氢酶活性和土壤中总石油烃降解率均显著升高(P<0.05)。接种Bs+Gg处理修复效果要优于单独接种Bs或Gg,Bs和Gg在红三叶修复石油污染土壤和植物抗石油胁迫的能力方面有协同作用。
参考文献:
[1]耿春女,李培军,陈素华,等. 不同AM真菌对三叶草耐油性的影响[J]. 应用与环境生物学报,2002,8(6):648-652.
[2]Arshad M,Shaharoona B,Mahmood T. Inoculation with plant growth promoting rhizobacteria containing ACC-deaminase partially eliminates the effects of water stress on growth,yield and ripening of Pisum sativum L.[J]. Pedosphere,2008,18(5):611-620
[3]赵硕伟,沈嘉澍,沈标.复合菌群的构建及其对石油污染土壤修复的研究[J]. 农业环境科学学报,2011,30(8):1567-1572.
[4]Huang X D,El-Alawi Y,Gurska J,et al. A multi-process phytoremediation system for decontamination of persistent total petroleum hydrocarbons (TPHs) from soils[J]. Microchemical Journal,2005,81:139-147.
[5]Hong S H,Ryu H W,Kim J,et al. Rhizoremediation of diesel-contaminated soil using the plant growth-promoting rhizobacterium Gordonia sp. S2RP-17[J]. Biodegradation,2011,22:593-601.
[6]龙伟文,王平,冯新梅,等. PGPR与AMF相互关系的研究进展[J]. 应用生态学报,2000,11(2):311-314.
[7]秦芳玲,田中民. 同时接种解磷细菌与丛枝菌根真菌对低磷土壤红三叶草养分利用的影响[J]. 西北农林科技大学学报:自然科学版,2009,37(6):151-157.
[8]张瑞芹,卢致霖,陈洁雯,等. AM真菌影响三叶草根系抗氧化酶活性的系统效应[J]. 微生物学通报,2011,38(3):322-327.
[9]张颖,高景慧.镉胁迫对红三叶种子萌发及幼苗生理特性的影响[J]. 西北农业学报,2007,16(3):57-59.
[10]何玮,蒋安,王琳,等. PEG 干旱胁迫对红三叶抗性生理生化指标的影响研究[J]. 中国农学通报,2013,29(5):5-10.
[11]孔令慧,赵桂琴. 不同品种红三叶苗期对4 ℃低温胁迫的生理响应[J]. 中国草地学报,2013,35(3):31-37.
[12]吉云秀. 含ACC脱氨酶PGPR分离及提高植物抗逆性[D]. 大连:大连海事大学,2008.
[13]Phillips J M,Hayman D S.Improved procedures for clearingand staining parasitic and vesicular-arbuscular mycorrhizalfungi for rapid assessment of infection[J]. Trans Br Mycol Soc,1970,55:158-161.
[14]李玲. 植物生理学实验指导[M]. 北京:科学出版社,2009:10-11.
[15]刘光崧. 土壤理化分析与剖面描述[M]. 北京:中国标准出版社,1996.
[16]简令成,王红. 逆境植物细胞生物学[M]. 北京:科学出版社,2009.
[17]何洁,贺鑫.石油对翅碱蓬生长及生理特性的影响[J]. 农业环境科学学报 2011,30(4):650-655.
[18]岳冰冰,李鑫,任芳菲,等. 石油污染对紫花苜蓿部分生理指标的影响[J]. 草业科学,2011,28(2):236-240.
[19]李小利,刘国彬. 土壤石油污染对植物苗期生长和土壤呼吸的影响[J]. 水土保持学报,2007,21(3):95-98.
[20]张金林,李惠茹,郭姝媛,等. 高等植物适应盐逆境研究进展[J]. 草业学报,2015,24(12):220-236.
[21]Linderman R G. Role of VAM fungi in biocontrol[M]//Pfleger F L,Linderman R G. Mycorrhizae and plant health.St Paul,MN:APS Press,1994:1-26.
[22]Kohler J,Hernández J A,Caravaca F,et al. Induction of antioxidant enzymes is involved in the greater effectiveness of a PGPR versus AM fungi with respect to increasing the tolerance of lettuce to severe salt stress[J]. Environmental and Experimental Botany,2009,65:245-252.
[23]Kohler J,Caravaca F,Carrasco L,et al. Interactions between a plant growth-promoting rhizobacterium,an AM fungus and a phosphate-solubilising fungus in the rhizosphere of Lactuca sativa[J]. Applied Soil Ecology,2007,35:480-487.
[24]耿春女,李培军,陈素华,等. 不同丛枝菌根真菌对万寿菊生长及柴油降解率的影响[J]. 应用生态学报,2003,14(10):1775-1779.孙凯文,时佩佩,盛海君,等. 富营养化水体中磷浓度对不同种类浮萍生长的影响[J]. 江苏农业科学,2016,44(5):529-531.
