脾气虚和脾阳虚模型大鼠脑肠肽与下丘脑葡萄糖转运体1及葡萄糖转运体3表达水平变化的实验研究
2016-07-19丛培玮王艳杰赵丹玉王德山
丛培玮,尚 冰,王艳杰,赵丹玉,张 林,王德山
·论著·
脾气虚和脾阳虚模型大鼠脑肠肽与下丘脑葡萄糖转运体1及葡萄糖转运体3表达水平变化的实验研究
丛培玮,尚 冰,王艳杰,赵丹玉,张 林,王德山
110847 辽宁省沈阳市,辽宁中医药大学教学实验中心(丛培玮),中医文献研究院(尚冰),基础医学院(王艳杰,赵丹玉,张林,王德山)
【摘要】目的分析脾虚模型大鼠脑肠肽〔β-内啡肽(β-EP)、胆囊收缩素(CCK)、血管活性肽(VIP)〕、下丘脑葡萄糖转运体(GLUT)1、GLUT3表达水平变化。方法2015年3—9月,采用随机数字表法将24只SPF级雄性SD大鼠分为对照组、脾气虚组、脾阳虚组,每组8只。脾气虚模型的建立采用饮食失节结合劳倦过度的原则,脾阳虚模型则是在脾气虚的基础上施加苦寒泻下法完成。观察3组大鼠一般情况(体征状态、体质量、体温、进食量等)及前肢抓力。采用酶联免疫吸附试验(ELISA)法测定下丘脑、胃、空肠β-EP、CCK、VIP表达水平,实时荧光定量聚合酶链式反应(Real-time PCR)法测定下丘脑GLUT1、GLUT3 mRNA表达水平,Western blotting法测定下丘脑GLUT1、GLUT3表达水平。结果脾气虚组大鼠体质量、进食量、前肢抓力低于对照组(P<0.05);脾阳虚组大鼠体质量、体温、进食量、前肢抓力低于对照组(P<0.05);脾阳虚组大鼠体温低于脾气虚组(P<0.05)。脾气虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP表达水平及下丘脑、胃、空肠CCK、VIP表达水平高于对照组(P<0.05);脾阳虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP、CCK表达水平及下丘脑、胃、空肠VIP表达水平高于对照组(P<0.05);脾阳虚组大鼠下丘脑β-EP表达水平及下丘脑、空肠CCK表达水平低于脾气虚组,胃、空肠β-EP表达水平及下丘脑、胃、空肠VIP表达水平高于脾气虚组(P<0.05)。脾气虚组、脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于对照组(P<0.05);脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于脾气虚组(P<0.05)。结论脾虚状态下,大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平下降,导致下丘脑、胃、空肠β-EP、CCK、VIP表达水平异常,这可能是脾虚本质研究的又一新观点。
【关键词】脾气虚;脾阳虚;脑肠肽;葡萄糖转运蛋白质;下丘脑
丛培玮,尚冰,王艳杰,等.脾气虚和脾阳虚模型大鼠脑肠肽与下丘脑葡萄糖转运体1及葡萄糖转运体3表达水平变化的实验研究[J].中国全科医学,2016,19(18):2201-2205.[www.chinagp.net]
Cong PW,Shang B,Wang YJ,et al.Change of expression levels of glucose transporter-1 and glucose transporter-3 in hypothalamus and brain-gut peptide of spleen-qi deficiency rats and spleen-yang deficiency rats[J].Chinese General Practice,2016,19(18):2201-2205.
近代研究发现,由脑的各级中枢和脊髓接受内外环境变化时传入的各种信息,经过整合,再由自主神经系统和神经-内分泌系统将其调控信息传送到肠神经系统或直接作用于胃肠效应细胞,这种在不同层次将胃肠道与中枢神经系统联系起来的神经-内分泌网络称为脑肠神经-内分泌-免疫调节网络或脑肠轴,而其中发挥实质作用的相关物质被医学界称为脑肠肽[1-2]。现代临床试验及大量科研实验发现,脾虚患者及脾虚动物模型在脑肠神经方面均有不同程度的变化,这些结果进一步证实了脑肠神经系统可通过中枢水平调节胃肠功能[3]。
下丘脑是大脑与脑肠神经系统联系的最后通道,其神经活动必须不断依靠葡萄糖供能方能维持正常,血糖供应不足会使神经功能受损[4],因此血糖维持在相对稳定的正常水平极为重要。细胞对葡萄糖的摄取需要通过葡萄糖转运体(glucose transporter,GLUT)来完成,下丘脑表达的主要有GLUT1和GLUT3[5]。
脾因其“后天之本、气血生化之源”的地位,常被认为是人体生命活动、能量来源的基础保障[6]。由此本研究组推断,中医脾虚在临床出现的消化功能紊乱的病理特征可能是由于脾虚状态下丘脑功能不足,导致大量通过脑肠神经影响内分泌-免疫调节的脑肠肽的合成分泌及功能调控出现异常变化。本研究观察并分析脾气虚、脾阳虚模型大鼠脑肠肽〔β-内啡肽(β-endorphin,β-EP)、胆囊收缩素(cholecystokinin,CCK)、血管活性肽(vasoactive intestinal peptide,VIP)〕、下丘脑GLUT1、GLUT3表达水平变化,为临床脾虚治疗提供依据。
1材料与方法
1.1实验动物2015年3—9月选取SPF级雄性SD大鼠24只,体质量(200±10)g,鼠龄5周,由本溪实验动物中心提供﹝许可证号:SCXK(辽)2010-0001﹞。饲养于辽宁中医药大学实验动物中心﹝许可证号:SYXK(辽)2013-000-9﹞。
1.2主要试剂和仪器总RNA提取(Trizol法)试剂盒、实时荧光定量聚合酶链式反应(Real-time PCR)试剂盒﹝宝生物工程(大连)有限公司﹞;兔抗大鼠GLUT1、GLUT3抗体(一抗)、羊抗兔IgG(二抗)(Abcam公司);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、聚偏二氟乙烯(PVDF)膜、蛋白浓度测定(BCA法)试剂盒(武汉博士德生物工程有限公司);β-EP、CCK、VIP 酶联免疫吸附试验(ELISA)试剂盒(武汉优尔生科技股份有限公司);YLS-13A大小鼠抓力测定仪(济南益延科技发展有限公司);7500 Real-time PCR仪(ABI公司)。
1.3动物分组、模型建立和评价采用随机数字表法将24只大鼠分为对照组、脾气虚组、脾阳虚组,每组8只。脾虚动物模型建立及评价在课题组前期研究[7]的基础上加以改良,条件为:室温(20±2)℃,湿度(50±5)%,无拘束进食饮水1周后正式造模。(1)对照组:大鼠每日无拘束进食饮水,15 d。(2)脾气虚组(饮食失节+劳倦型):饱食1 d后禁食2 d,为1个循环,完成5个循环后造模结束,每日自由饮水;每日在35~37 ℃水箱中游泳至力竭,共15 d。(3)脾阳虚组(饮食失节+劳倦+苦寒泻下型):在脾气虚基础上,每日灌服20%番泻叶水浸剂(2 ml/100 g),早晚各1次,连续7 d。观察3组大鼠一般情况(体征状态、体质量、体温、进食量等)及前肢抓力对模型进行评价。
1.3.1体质量、体温、进食量检测测量3组大鼠体质量、体温后,放于代谢笼中,计算24 h进食量。
1.3.2前肢抓力检测按照YLS-13A大小鼠抓力测定仪说明书检测前肢抓力,每只大鼠测量3次,取平均值。
1.4ELISA法测定下丘脑、胃、空肠β-EP、CCK、VIP表达水平检测前肢抓力后处死大鼠,取大鼠下丘脑、胃、空肠组织,操作方法按β-EP、CCK、VIP ELISA试剂盒说明书进行。
1.5Real-time PCR法测定下丘脑GLUT1、GLUT3 mRNA表达水平取大鼠下丘脑组织,利用Trizol法试剂盒提取下丘脑总RNA,保证RNA纯度为1.8~2.2 nm。去基因组DNA,取RNA进行反转录合成cDNA,利用Real-time PCR试剂盒进行基因扩增,反应条件:95 ℃预变性10 s,95 ℃变性20 s,60 ℃退火35 s,共32个循环。采用7500 Real-time PCR仪检测GLUT1、GLUT3 mRNA表达水平。引物序列:GLUT1上游引物为5′-TCCTGCTCATCAATCGTAA-3′,下游引物为5′-GACCCTCTTCTTTCATCTCC-3′;GLUT3上游引物为5′-GTGTCTCCCACTGCCCTAC-3′,下游引物为5′-AGCCCAGAATAAAGTCCAAA-3′;GAPDH上游引物为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物为5′-ATGGTGGTGAAGACGCCAGTA-3′。
1.6Western blotting法测定下丘脑GLUT1、GLUT3表达水平取大鼠下丘脑组织,提总蛋白,采用BCA法试剂盒进行蛋白定量。取总蛋白80 μg采用SDS-PAGE试剂盒进行电泳,150 V 30 min半干转印至PVDF膜,常温下5%脱脂奶粉封闭2 h,加入一抗(稀释比例均为1∶100),4 ℃过夜。TBST洗膜3次,15 min/次;加入二抗,室温孵育1 h后TBST洗膜3次,15 min/次,化学发光法显影。
2结果
2.1一般情况及前肢抓力比较对照组大鼠动作灵敏,皮毛光泽紧实,大便正常;脾气虚组大鼠喜懒乏力,行动迟缓,皮毛蓬松无光泽,便软;脾阳虚组大鼠倦怠明显,反应更为迟钝,喜懒聚堆,皮毛枯槁,便稀溏。3组大鼠体质量、体温、进食量、前肢抓力比较,差异有统计学意义(P<0.05)。脾气虚组大鼠体质量、进食量、前肢抓力低于对照组,差异有统计学意义(P<0.05);脾阳虚组大鼠体质量、体温、进食量、前肢抓力低于对照组,差异有统计学意义(P<0.05);脾阳虚组大鼠体温低于脾气虚组,差异有统计学意义(P<0.05,见表1)。
2.2下丘脑、胃、空肠β-EP、CCK、VIP表达水平比较3组大鼠下丘脑、胃、空肠β-EP、CCK、VIP表达水平比较,差异均有统计学意义(P<0.05)。脾气虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP表达水平及下丘脑、胃、空肠CCK、VIP表达水平高于对照组,差异有统计学意义(P<0.05);脾阳虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP、CCK表达水平及下丘脑、胃、空肠VIP表达水平高于对照组,差异有统计学意义(P<0.05);脾阳虚组大鼠下丘脑β-EP表达水平及下丘脑、空肠CCK表达水平低于脾气虚组,胃、空肠β-EP表达水平及下丘脑、胃、空肠VIP表达水平高于脾气虚组,差异有统计学意义(P<0.05,见表2)。
2.3下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平比较3组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平比较,差异有统计学意义(P<0.05)。脾气虚组、脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于对照组,差异有统计学意义(P<0.05);脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于脾气虚组,差异有统计学意义(P<0.05,见表3、图1)。

Table 1Comparison of body mass,temperature,food-intake and forelimb grip among the three groups
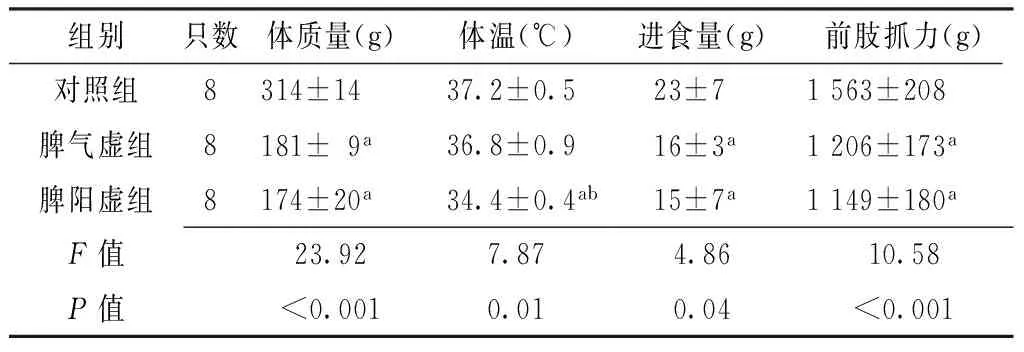
组别只数体质量(g)体温(℃)进食量(g)前肢抓力(g)对照组8314±1437.2±0.523±71563±208脾气虚组8181±9a36.8±0.916±3a1206±173a脾阳虚组8174±20a34.4±0.4ab15±7a1149±180aF值23.927.874.8610.58P值<0.0010.010.04<0.001
注:与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05

Table 3Comparison of mRNA and protein expression of GLUT1 and GLUT3 in hypothalamus among the three groups

组别只数GLUT1mRNAGLUT3mRNAGLUT1GLUT3对照组81.00±0.001.00±0.000.49±0.010.18±0.01脾气虚组80.51±0.18a0.63±0.12a0.41±0.01a0.12±0.01a脾阳虚组80.08±0.01ab0.23±0.05ab0.31±0.01ab0.08±0.01abF值20.0727.5371.3526.30P值<0.01<0.001<0.001<0.01
注:与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05;GLUT=葡萄糖转运体
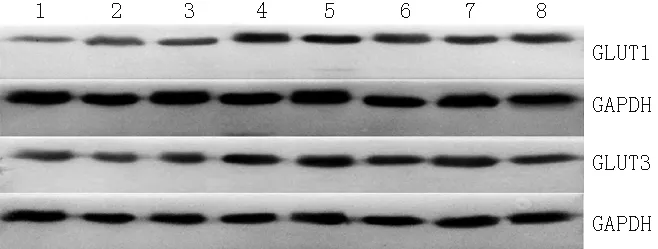
注:GLUT=葡萄糖转运体;1~3为脾阳虚组,4、5为对照组,6~8为脾气虚组
图1Western blotting法测定下丘脑GLUT1、GLUT3表达水平结果
Figure 1Expression levels of GLUT1 and GLUT3 in hypothalamus by Western blotting

表2 3组大鼠下丘脑、胃、空肠β-EP、CCK、VIP表达水平比较
注:与对照组比较,aP<0.05;与脾气虚组比较,bP<0.05;β-EP=β-内啡肽,CCK=胆囊收缩素,VIP=血管活性肽
3讨论
本研究脾气虚模型的建立采用了饮食失节结合劳倦过度的原则,脾阳虚模型则是在脾气虚的基础上施加苦寒泻下法完成[7]。本研究结果显示,对照组大鼠动作灵敏,皮毛光泽紧实,大便正常;脾气虚组大鼠喜懒乏力,行动迟缓,皮毛蓬松无光泽,便软;脾阳虚组大鼠倦怠明显,反应更为迟钝,喜懒聚堆,皮毛枯槁,便稀溏;脾气虚组大鼠体质量、进食量、前肢抓力低于对照组,脾阳虚组大鼠体质量、体温、进食量、前肢抓力低于对照组,脾阳虚组大鼠体温低于脾气虚组。以上结果表明,脾气虚、脾阳虚模型复制成功。
中医认为,“脾脏”是饮食水谷之消化、吸收和精微物质运输布散功能的“综合”单位[8]。现代医学研究发现,生物体自身调控机制在神经、内分泌及免疫系统间存在复杂相互作用的网络关系,网络间的信息传递大多依赖于细胞因子、激素、化学递质等物质[9]。脑肠肽是具有特殊生物作用的肽类激素,双重分布于胃肠道及中枢神经系统,对其双向调节起着重要作用。近年来研究证实,脑肠肽在脾虚状态下表达紊乱[2]。
本研究选取了广泛存在于胃肠道及脑组织中,较有代表性的对胃肠消化、吸收、分泌、运动等功能有着重要调节作用的脑肠肽——β-EP、CCK、VIP。β-EP具有刺激胃酸和十二指肠近段HCO3-分泌、保护胃肠黏膜细胞分泌、影响胃肠运动等作用[10]。CCK具有收缩胆囊和刺激胰酶分泌、增强胰酶活性、刺激胃肠肌肉、促进远端十二指肠和空肠的蠕动等功能[11]。VIP是神经系统抑制性神经递质,对胃肠运动有抑制作用[12]。吕琳等[13]发现,脾虚模型大鼠胃、肠组织中的β-EP水平明显高于同期对照组,而高秀兰等[14]对脾虚发热大鼠研究发现,大鼠外周血中CCK、β-EP水平有所升高,提示脾虚与β-EP、CCK等脑肠肽表达改变有密切的关系。张永东等[15]研究证实,四君子汤对脾虚模型鸭十二指肠、空肠CCK mRNA表达有较好的预防效果,提示CCK表达改变可能是脾虚的病理机制之一。李晓红等[16]认为,肝郁脾虚模型大鼠出现的胃黏膜血管收缩和胃过度蠕动等现象可能与脑组织VIP表达水平升高有关。本研究结果显示,脾气虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP表达水平及下丘脑、胃、空肠CCK、VIP表达水平高于对照组;脾阳虚组大鼠下丘脑β-EP表达水平低于对照组,胃、空肠β-EP、CCK表达水平及下丘脑、胃、空肠VIP表达水平高于对照组;脾阳虚组大鼠下丘脑β-EP表达水平及下丘脑、空肠CCK表达水平低于脾气虚组,胃、空肠β-EP表达水平及下丘脑、胃、空肠VIP表达水平高于脾气虚组。提示β-EP、CCK及VIP可能参与脾虚的病理过程,即脾虚导致了中枢神经系统的调控物质发生改变,进而影响了脑肠肽类物质的功能调控,最终导致脾虚的病理状态。但这些物质在血液及组织中的表达却体现或增高或降低的不同趋势,详尽原因有待进一步研究。
现代研究认为,脾主运化,“运”即依赖于细胞膜上的各种转运体协同作用,汲取营养物质以提供能量[17-18]。脑组织获取能量来源的唯一方式是糖代谢[19]。因此,葡萄糖是中枢神经系统的主要能源物质。下丘脑作为大脑与脑肠神经系统联系的终末唯一通道,其碳水化合物物质水平正常,才可保障脑肠神经系统功能稳定[4]。GLUTs家族(GLUT1~GLUT5)是细胞葡萄糖转运的主要载体,在下丘脑中分布的主要有GLUT1和GLUT3,GLUT1是大脑内第一个发现的GLUT,也是目前GLUTs家族唯一被纯化且研究深入的一个成员[20]。GLUT1分布在血-脑脊液屏障的内皮细胞上,负责将葡萄糖从血液跨血-脑脊液屏障转运到脑细胞间隙;GLUT3是神经元葡萄糖转运体,负责将葡萄糖从细胞外间隙转运至神经元内。故常将GLUT1、GLUT3称为脑型葡萄糖转运体[21-22]。本研究结果显示,脾气虚组、脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于对照组,脾阳虚组大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平低于脾气虚组,提示模型大鼠下丘脑GLUT表达水平的改变可能是脾虚对中枢神经系统产生影响的病理机制之一。
本研究目前仅以葡萄糖在体内不同部位的转运机制为出发点对脾虚本质展开研究,而这些GLUT是如何调控脑肠肽等一系列物质对机体产生影响的,则有待进一步研究加以探讨。
综上所述,脾虚状态下,大鼠下丘脑GLUT1、GLUT3 mRNA及其蛋白表达水平下降,导致下丘脑、胃、空肠β-EP、CCK、VIP表达水平异常,这可能是脾虚本质研究的又一新观点。
作者贡献:丛培玮进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;尚冰、王艳杰进行实验实施、评估、数据整理;赵丹玉、张林进行实验实施、审校;王德山负责总体审校。
本文无利益冲突。
参考文献
[1]Besedovsky H,Sorkin E.Network of immune-neuroendocrine interactions[J].Clin Exp Immunol,1977,27(1):1-12.
[2]刘未艾,刘密,何亚敏,等.功能性胃肠病脑肠肽的研究进展[J].中国中医急症,2012,21(6):951-953.
[3]Liu Q,Cai G.Content of somatostatin and cholecystokinin-8 in hypothalamus and colons in a rat model of spleen-deficiency syndrome[J].Journal of Chinese Integrative Medicine,2007,5(5):555-558.(in Chinese)
刘群,蔡淦.“脾虚证”大鼠下丘脑及结肠组织生长抑素和胆囊收缩素-8含量的变化[J].中西医结合学报,2007,5(5):555-558.
[4]史轶蘩.协和内分泌和代谢学[M].北京:科学出版社,1999:114.
[5]Stratton IM,Adler AI,Neil HA,et al.Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes(UKPDS 35):prospective observational study[J].BMJ,2000,321(7258):405-412.
[6]聂建华,孙世发.中医脾虚证的近10年相关研究[J].中医药学报,2011,39(1):128-130,封3.
[7]尚冰.脾气虚证、脾阴虚证、脾阳虚证模型大鼠MDA、SOD、GSH-Px、T-AOC、8-OHdG、端粒长度变化的实验研究[D].沈阳:辽宁中医药大学,2006.
[8]刘毅,冯晓桃.“脾主运化”理论再认识——“脾主运”与“脾主化”之辨析[J].中医杂志,2011,52(15):1264-1266.
[9]Fu Y,Chen B.Study the Neuro-Endocrine-Immunity Net Work(NEI) to promote the combination of TCM and mordern medicine[J].Chinese Archives of Traditional Chinese Medicine,2008,26(4):821-822.(in Chinese)
付义,陈冰.神经-内分泌-免疫(NEI)网络研究促进中西医交融[J].中华中医药学刊,2008,26(4):821-822.
[10]Jia YM.Relationship between β-endorphin and TCM"Spleen"[J].Journal of Zhejiang University of Traditional Chinese Medicine,2010,34(5):795-796.(in Chinese)
贾彦敏.β-内啡肽与中医“脾”的关系[J].浙江中医药大学学报,2010,34(5):795-796.
[11]王德山,王艳杰,张立德,等.眼针对IBS模型大鼠结肠组织VIP含量及基因表达的影响[J].中国中医基础医学杂志,2011,17(3):314-316.
[12]Zhang ZZ,Kuang WH,Zhang JL,et al.Effects of Tong Xie Yao Fang on intestinal function and the level of vasoactive intestinal peptide in hypothalamus and colon of rats with chronic stress[J].Journal of Anhui Traditional Chinese Medical College,2010,29(5):53-55.(in Chinese)
张铮铮,邝卫红,张进领,等.痛泻要方对慢性应激大鼠肠功能及下丘脑和结肠VIP的影响[J].安徽中医学院学报,2010,29(5):53-55.
[13]Lyu L,Chen YH,Pang SH,et al.Effects of medicated thread moxibustion of Zhuang medicine on somatostatin and β-endorphin in pituitary,hypothalamus,stomach and intestines in the rats of experimental spleen deficiency[J].Shanghai Journal of Traditional Chinese Medicine,2007,41(2):61-63.(in Chinese)
吕琳,陈永红,庞声航,等.壮医药线点灸对脾虚大鼠垂体、下丘脑、胃、肠生长抑素和β-内啡肽的影响[J].上海中医药杂志,2007,41(2):61-63.
[14]Gao XL,Zhao RH,Xie M,et al.Effect of compatibility of astragalus and different dose radix bupleuri on the model of spleen-qi deficiency with fever in rats[J].Chinese Journal of Experimental Traditional Medical Formulae,2013,19(22):246-250.(in Chinese)
高秀兰,赵荣华,谢鸣,等.黄芪配伍不同剂量柴胡对脾虚发热证模型的作用[J].中国实验方剂学杂志,2013,19(22):246-250.
[15]Zhang YD,Duan HQ,Dong H,et al.Effects of Sijunzi decoction on expression of CCK and VIP mRNA in Peking duck duodenum and jejunum[J].Acta Veterinaria Et Zootechnica Sinica,2006,37(8):809-813.(in Chinese)
张永东,段慧琴,董虹,等.四君子汤对北京鸭十二指肠、空肠CCK、VIP mRNA表达的影响[J].畜牧兽医学报,2006,37(8):809-813.
[16]Li XH,Liang Y,Xie YQ,et al.Effects of Xiaoyao Powder on SP,VIP gene expression in the liver stagnation and spleen deficiency syndrome of the chronic restraint stress in rats[J].Chinese Journal of Basic Medicine in Traditional Chinese Medicine,2014,20(7):901-904.(in Chinese)
李晓红,梁媛,谢宇晴,等.逍遥散对慢性束缚应激肝郁脾虚证模型大鼠SP、VIP基因表达的影响[J].中国中医基础医学杂志,2014,20(7):901-904.
[17]Yu M,Wang CX,Cui YX.Exploration of mechanism of spleen qi deficiency by studying expression of aquaporin 4[J].Chinese Archives of Traditional Chinese Medicine,2013,31(9):1881-1884.(in Chinese)
于漫,王彩霞,崔永霞.从水通道蛋白4的表达探讨脾气虚证的机理[J].中华中医药学刊,2013,31(9):1881-1884.
[18]Liu YZ,Wang CJ,Liu J,et al.Si-Jun-Zi decoction repairs mitochondrial damage of cells of liver,myocardium,gastric mucosa and skeletal muscle in rats with spleen asthenia[J].Chinese Journal of Clinical Rehabilitation,2006,10(39):170-173.(in Chinese)
刘友章,王昌俊,刘静,等.四君子汤对脾虚大鼠肝、心肌、胃黏膜和骨骼肌细胞线粒体损伤的修复作用[J].中国临床康复,2006,10(39):170-173.
[19]Jiang C,Xie J,Chen HF.The mechanism of conformation transformation of glucose transporter 1[J].Genomics and Applied Biology,2015,34(7):1372-1377.(in Chinese)
江诚,谢俊,陈海峰.葡萄糖转运蛋白的转运机制研究[J].基因组学与应用生物学,2015,34(7):1372-1377.
[20]Mueckler M,Makepeace C.Transmembrane segment 12 of the Glut1 glucose transporter is an outer helix and is not directly involved in the transportmechanism[J].J Biol Chem,2006,281(48):36993-36998.
[21]Aleen A,Messier C.Plastic changes in the astrocyte GLUT1 glucose transporter and bete-tubul in microtubule protein following voluntary exercise in mice[J].Behav Brain Res,2013,240:95-102.
[22]Wang YZ,Liu GL,Li XY,et al.Research progress for glucose transporter 1 at the blood brain barrier[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2014,19(9):1057-1063.(in Chinese)
王玉珠,刘皋林,李晓宇,等.血脑屏障上葡萄糖转运体1研究进展[J].中国临床药理学与治疗学,2014,19(9):1057-1063.
(本文编辑:崔丽红)
Change of Expression Levels of Glucose Transporter-1 and Glucose Transporter-3 in Hypothalamus and Brain-gut Peptide of Spleen-qi Deficiency Rats and Spleen-yang Deficiency Rats
CONGPei-wei,SHANGBing,WANGYan-jie,etal.
TeachingandExperimentCenter,LiaoningUniversityofTraditionalChineseMedicine,Shenyang110847,China
【Abstract】ObjectiveAnalysis the changes of the expression levels of brain-gut peptide〔β-endorplhin(β-EP),cholecystokinin(CCK) and vasoactive peptide(VIP)〕 and glucose transporter-1(GLUT1) and glucose transporter-3(GLUT3) in hypothalamus of spleen deficiency rats.MethodsFrom March to September 2015,a total of 24 SPF male SD rats were divided into control group,spleen-qi deficiency group and spleen-yang deficiency group with 8 rats in each group by random number table method.The model rats of spleen-qi deficiency were built by immoderate diet and overfatigue;the model rats of spleen-yang deficiency were built by bitter and cold aloes on the basis of the model rats of spleen-qi deficiency.The three groups were observed by general information(signs and state,body mass,temperature and food-intake) and grip of forelegs.The expression levels of β-EP,CCK and VIP in hypothalamus,stomach and jejunum were assessed by enzyme linked immunosorbent assay(ELISA);the mRNA levels of GLUT1 and GLUT3 were measured by real time quantitative fluorescent polymerase chain reaction(Real-time PCR);the levels of GLUT1 and GLUT3 in hypothalamus were measured by Western blotting.ResultsThe body mass,food-intake and grip of forelegs of spleen-qi deficiency group were lower than those of control group(P<0.05);the body mass, temperature, food-intake and grip of forelegs of spleen-yang deficiency group were lower than those of control group(P<0.05);the temperature of spleen-yang deficiency group was lower than that of spleen-qi deficiency group(P<0.05).The expression level of β-EP in hypothalamus of spleen-qi deficiency group was lower than that of control group(P<0.05);the expression level of β-EP in stomach and jejunum and the expression levels of CCK and VIP in hypothalamus,stomach and jejunum of spleen-qi deficiency group were higher than those of control group(P<0.05).The expression level of β-EP in hypothalamus of spleen-yang deficiency group was lower than that of control group and the expression levels of β-EP and CCK in stomach and jejunum and the expression level of VIP in hypothalamus,stomach and jejunum of spleen-yang deficiency group were higher than those of control group(P<0.05);the expression level of β-EP in hypothalamus and the expression level of CCK in hypothalamus and jejunum of spleen-yang deficiency group were lower than those of spleen-qi deficiency group and the expression level of β-EP in stomach and jejunum and the expression level of VIP in hypothalamus,stomach and jejunum of spleen-yang deficiency group were higher than those of spleen-qi deficiency group(P<0.05).The mRNA expression and protein expression of GLUT1 and GLUT3 in hypothalamus of spleen-qi deficiency group and spleen-yang deficiency group were lower than those of control group(P<0.05);the mRNA expression and protein expression of GLUT1 and GLUT3 in hypothalamus of spleen-yang deficiency group were lower than those of spleen-qi deficiency group(P<0.05).ConclusionUnder the condition of spleen deficiency,the mRNA expression levels of GLUT1 and GLUT3 in hypothalamus are lower and the expression levels of β-EP,CCK and VIP in hypothalamus,stomach and jejunum are abnormal,which may be a new viewpoint of studying the essence of spleen deficiency.
【Key words】Spleen-qi deficiency;Spleen-yang deficiency;Brain-gut peptide;Glucose transport protein;Hypothalamus
基金项目:国家重点基础研究发展计划(973计划)课题(2013CB531702)
通信作者:王艳杰,110847 辽宁省沈阳市,辽宁中医药大学基础医学院;E-mail:15940157054@163.com
【中图分类号】R 551.11
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.18.018
(收稿日期:2015-10-13;修回日期:2016-01-24)
·中医·中西医结合研究·
