红鳍东方鲀gsdf基因的克隆及表达模式分析
2016-07-15闫红伟田雨顺姜丽楠王连顺刘圣聪
闫红伟,田雨顺,姜丽楠,王连顺,刘 洋,刘 奇,刘圣聪
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.大连海洋大学辽宁省海洋牧场工程技术研究中心,辽宁大连116023;3.大连天正实业有限公司,辽宁大连116000)
红鳍东方鲀gsdf基因的克隆及表达模式分析
闫红伟1,田雨顺1,姜丽楠1,王连顺1,刘洋1,刘奇2,刘圣聪3
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.大连海洋大学辽宁省海洋牧场工程技术研究中心,辽宁大连116023;3.大连天正实业有限公司,辽宁大连116000)
摘要:为研究红鳍东方鲀Takifugu rubripes的性别决定因子 (gonadal soma derived factor,GSDF),利用cDNA末端快速扩增技术 (RACE)首次克隆了红鳍东方鲀gsdf基因 (Trgsdf)的cDNA全长序列 (GenBank登陆号:KR914667)。结果表明:Trgsdf cDNA序列全长为1734 bp,其中5′端非编码区144 bp,开放阅读框648 bp,3′端非编码区942 bp,共编码215个氨基酸;预测的氨基酸序列中存在1个长度为19个氨基酸的信号肽和相同长度的跨膜区,1个N-糖基化位点NST,1个TGF-β家族成员特有的保守结构域;BLAST同源性分析结果显示,红鳍东方鲀GSDF氨基酸序列与其他鱼类的相似性为26%~58%;系统发育分析结果显示,鱼类GSDF单独聚为一支,与TGF-β超家族内的其他成员分开,红鳍东方鲀与青鳉Oryzias latipes GSDF的亲缘关系最近,先聚为一支,后与三斑海猪鱼Halichoeres trimaculatus聚在一起,与矛尾鱼Latimeria menadoensis的GSDF亲缘关系最远;应用RT-PCR技术检测Trgsdf mRNA在雌性和雄性红鳍东方鲀成鱼不同组织中的表达,结果显示,Trgsdf mRNA在卵巢和精巢中高表达,在皮肤和肌肉组织中微量表达,在其他组织中无表达;采用相对实时荧光定量PCR方法比较了成鱼卵巢和精巢中Trgsdf mRNA的表达量,结果显示,Trgsdf mRNA在精巢中的表达量显著高于卵巢 (P<0.05),约为卵巢表达量的6倍。研究表明,gsdf基因可能在红鳍东方鲀的性腺尤其是精巢的分化和发育过程中起着重要的作用。
关键词:红鳍东方鲀;性别决定因子;cDNA末端快速扩增技术;实时荧光定量PCR;基因表达
转化生长因子-β(transformation growth factorβ,TGF-β)是一类在结构和功能上相关的多肽生长因子,已发现在哺乳动物中有超过30个细胞因子可能属于TGF-β超家族,如活化素 (activin)、骨形态发生蛋白 (bone morphogenetic protein,BMP)、生长分化因子 (growth differentiation factor,GDF)等,它们广泛参与各种细胞作用,在胚胎发育与维持组织平衡中发挥了重要作用。2007年,Sawatari等[1]在研究虹鳟Oncorhynchnsmykiss性别分化机制时,发现了一个新的TGF-β超家族成员——gonadal soma derived factor(GSDF),在虹鳟性腺发育早期,gsdf基因表达于原始生殖细胞(PGC)周围的体细胞中,在性腺发育后期,表达于卵巢的颗粒细胞以及精巢的Sertoli细胞中。此外,在受精卵阶段,采用反义RNA技术敲降虹鳟中gsdf基因的表达水平,受精后30 d发现,试验组PGC的增殖受到明显抑制。以上结果显示,gsdf基因在原始生殖细胞增殖的过程中起到重要作用。随后,研究人员在多种硬骨鱼类中都成功克隆得到了该基因,其中包括青鳉Oryzias latipes[2]、银大马哈鱼 Oncorhynchus kisutch[3]、三斑海猪鱼Halichoeres trimaculatus[4]、斑马鱼 Danio rerio[5]、尼罗罗非鱼 Oreochromis niloticus[6]等。以往的研究认为,gsdf基因主要在精巢中高表达,并在鱼类性别决定、分化和生殖细胞的增殖过程中发挥必不可少的作用[2-7]。因此,gsdf基因被认为是继 DMRT1、SRY、DMY、AMHY等之后发现的又一与鱼类性别决定及分化密切相关的重要基因。
红鳍东方鲀Takifugu rubripes是中国重要的海水养殖经济鱼类,其精巢被视为美味,出口商品鱼雄鱼价格较高,故单性养殖备受期待[8]。现已确定红鳍东方鲀的性别决定类型为XX/XY型[9-10],一些性别分化过程中的保守基因,如 DMRT1、CYP19A1等也被成功克隆[11-13]。此外,有学者发现,红鳍东方鲀的性别由一个SNP位点 (Amhr2)决定[14]。尽管如此,尚不清楚还有哪些其他基因也参与到性别分化这个复杂的生理过程中,关于其性别分化的调控网络还有很多是未知的。目前,有关红鳍东方鲀gsdf基因的克隆与表达国内外尚未见报道,为此,本研究中以红鳍东方鲀为研究对象,首先采用RACE法克隆得到Trgsdf基因的cDNA全长序列,并对序列进行生物信息学分析,然后采用RT-PCR技术对其在不同性别红鳍东方鲀不同组织中的表达模式进行了分析,并采用实时荧光定量PCR比较了该基因在卵巢和精巢中的表达量,旨在为深入探讨gsdf基因在红鳍东方鲀性别分化过程中的功能奠定基础。
1 材料与方法
1.1 材料
试验用红鳍东方鲀取自大连天正实业有限公司,为2龄成鱼。
TIANNamp Marine Animals DNA试剂盒购自上海天根化工有限公司;RNeasy Mini RNA(QIAGEN)试剂盒购自凯杰 (上海)有限公司;Taq DNA聚合酶、SMARTer©RACE 5′/3′(Clontech)试剂盒、DNA凝胶回收试剂盒、MMLV反转录试剂盒、One Step©SYBR PrimeScript RT-PCR(Perfect Real Time)试剂盒均购自宝生物工程 (大连)有限公司 (TaKaRa);DEPC水、组织切片用品、引物均来自生工生物工程 (上海)股份有限公司。
1.2 方法
1.2.1 样品的制备 将雌、雄红鳍东方鲀麻醉后,于冰上解剖,并迅速采集性腺、脑、肌肉、心脏、脾脏、前肾、中肾、鳃、鳔、肝脏、皮肤、肠、气囊组织,然后放入 RNAlater中,于超低温冰箱(-80℃)中保存,用于总RNA提取。取对应鱼的肌肉组织用于提取DNA进行性别鉴定,并分别取部分性腺组织,用于制作石蜡切片。
1.2.2 红鳍东方鲀性别的鉴定 红鳍东方鲀的性别难以根据其外部形态及性腺颜色进行辨别。研究发现,红鳍东方鲀的性别由一个 SNP位点(Amhr2)决定[14],可通过高分辨率熔解曲线分析(HRM)法或直接测序法检测该SNP位点,从而有效判别其性别[15]。本试验中,首先使用TIANNamp Marine Animals DNA试剂盒提取各个试验鱼肌肉组织的DNA,用15 g/L琼脂糖凝胶电泳检测其质量后,用 Anti-Mullerian hormone receptor,type II (Amhr2)基因特异性引物SDexon-F和SDexon-R(表1)进行 PCR扩增。扩增体系 (共50μL):ddH2O 30.5μL,10×PCR Buffer 5μL,dNTPMix(各2.5mmol/L)8μL,上、下游引物(10 mol/L)各2μL,Taq DNA聚合酶 (5 U/μL)0.5 μL,模板DNA(10倍稀释后使用)2μL。PCR反应程序:94℃下预变性5 min;94℃下变性30 s,56℃下退火30 s,72℃下延伸1 min,共进行35个循环;最后在72℃下再延伸10 min,于4℃下保存。经琼脂糖凝胶电泳检测后,将PCR扩增产物送生工生物工程 (上海)股份有限公司进行测序。根据测序结果进行性别鉴定,如图1所示。如果Amhr2的SNP位点是杂合型,则对应个体为雄性;如果SNP位点是纯合型,则对应个体是雌性。
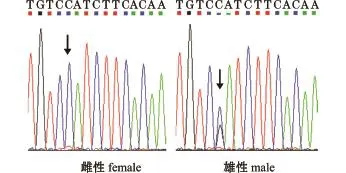
图1 红鳍东方鲀的遗传性别Fig.1 Genetic sex of red fin pu ffer Takifugu rubripes
1.2.3 总 RNA的提取 性别鉴定后,采用RNeasy Mini RNA试剂盒提取各个组织中的总RNA,并检验其完整性,并用NV3000(美国威斯特)检测总RNA的浓度和质量。提取的RNA置于超低温冰箱 (-80℃)中保存备用。
1.2.4 红鳍东方鲀gsdf cDNA全长序列的克隆根据数据库提供的 gsdf cDNA部分序列,采用Premier 5.0软件设计RACE的特异性引物 (表1)。采用SMARTer©RACE 5′/3′试剂盒,以红鳍东方鲀精巢为模板,利用5′-RACE和3′-RACE PCR反应得到5′和3′cDNA片段。Touch down PCR反应条件:94℃下预变性5 min;94℃下变性30 s,72℃下退火3 min,共进行5个循环;94℃下变性30 s,70℃下退火30 s,72℃下延伸3min,共进行5个循环;94℃下变性30 s,68℃下退火30 s,72℃下延伸3 min,共进行25个循环;最后在72℃下再延伸10 min。反应体系共50μL,扩增产物经琼脂糖电泳检测后回收、纯化、连接、克隆,菌液送生工生物工程 (上海)股份有限公司进行测序。

表1 试验用引物Tab.1 Prim er sequences used in the experimen ts
1.2.5 红鳍东方鲀gsdf基因序列分析 将测序得到的序列运用BioEdit软件进行拼接分析,得到Trgsdf cDNA全长序列。在NCBI中应用ORF Finder找到开放阅读框,同时翻译出相应的氨基酸序列,分别用SignalP 4.1、TMPRED预测蛋白的信号肽、跨膜结构,分别用NetNGlyc 1.0、ProtParam、PredictProtein预测蛋白的糖基化位点、理化性质和二级结构。使用ClustalX软件比对GSDF和TGF-β超家族其他成员的氨基酸序列,用MEGA 5.0,采用NJ(Neighbor-Joining)法构建系统进化树,设定Bootstrap为1000。
1.2.6 红鳍东方鲀gsdf基因在不同组织中的表达分析 根据已有的Trgsdf全长序列设计PCR用特异性引物 (表1),为避免扩增受提取RNA中DNA的影响,引物均为跨内含子区域引物,以防止非特异性扩增。以提取的雌、雄各组织的RNA(500 ng)为模板,按照MMLV反转录试剂盒使用说明书合成cDNA,然后以其为模板,以β-actin为内参进行 RT-PCR扩增。扩增体系 (共10μL):ddH2O 6.15μL,10×Ex Taq PCR Buffer 1μL,dNTPMix(各2.5 mmol/L)0.8μL,上、下游引物(10 mol/L)各0.5μL,Ex Taq DNA聚合酶(5 U/μL)0.05μL,模板cDNA 1μL。PCR反应条件:94℃下预变性5 min;94℃下变性30 s,52℃下退火30 s,70℃下延伸30 s,共进行30个循环;最后在70℃下再延伸5 min,于4℃下保存备用。
1.2.7 实时荧光定量RCR 采用相对实时荧光定量PCR,对红鳍东方鲀卵巢和精巢中的Trgsdf表达进行定量分析,试验按照One Step©SYBR Prime-Script RT-PCR(Perfect Real Time)试剂盒说明书进行。反应体系 (共20μL):One Step SYBR©RT-PCR Buffer(2×)10μL,上、下游引物 (10 mol/L)各0.8μL,ROX Reference Dye II(50×)0.4μL,EX-Tag HSMix(TaKaRa)1.2μL,PrimeScript Plus RTase Mix 0.4μL,RNase-free H2O 4.4μL,模板RNA 2μL。每个样品设3个重复。采用ABI 7500 Real-Time PCR仪 (Applied Biosystems,美国)进行分析。
1.3 数据处理
实时荧光定量数据以2-ΔΔCT法处理,相对表达量以平均值±标准差 (mean±S.D.)表示,采用SPSS 19.0软件的t-检验分析法比较卵巢和精巢中Trgsdf表达量的差异,显著性水平设为0.05。
2 结果与分析
2.1 红鳍东方鲀gsdf基因序列特征及其编码蛋白的结构分析
将克隆得到的Trgsdf基因全长cDNA序列并提交到GenBank 数据库(GenBank 登录号:KR914667)。结果显示,该序列全长为1734 bp,其中5′端非编码区和3′端非编码区分别为144 bp 和942 bp,开放阅读框 (ORF)由648 bp组成,编码215个氨基酸,起始密码子为ATG,终止密码子为TAA(图2)。经ProtParam分析得知,编码的GSDF蛋白的相对分子质量为23 305.7,理论等电点p I为4.98,为酸性蛋白。其中信号肽由19个氨基酸残基组成,信号肽的切割位点在 Ala19和Phe20之间。跨膜预测结果显示,GSDF具有一个明显的跨膜区,长度为19个氨基酸残基,属于跨膜类蛋白。经NetNGlyc 1.0软件分析推测出1个N-糖基化位点 (NST),由此可知,GSDF是一个糖蛋白。结构域预测结果显示,红鳍东方鲀GSDF仅有TGF-β一个结构域,该保守域内部有由9个半胱氨酸残基组成的半胱氨酸结结构基序,用PredictProtein预测该蛋白的二级结构,结果显示,α-螺旋、β折叠和无规则卷曲分别占8.37%(18个)、24.19% (52个)和67.44% (145个)。
2.2 红鳍东方鲀GSDF氨基酸序列的同源性及系统进化分析
使用NCBI的BLASTP分析红鳍东方鲀GSDF氨基酸序列与其他物种的同源性 (表2)。结果显示,红鳍东方鲀GSDF氨基酸序列与舌齿鲈Dicentrachus labrax的相似性最高,为58%,与三斑海猪鱼的相似性为57%,与青鳉的相似性为50%,与矛尾鱼 Latimeria menadoensis的相似性最低,为26%,而与TGF-β超家族的其他成员的相似性均低于30%。使用MEGA 5.0对鱼类GSDF氨基酸序列与TGF-β超家族内的其他成员构建系统发育树。结果显示,鱼类GSDF单独聚为一支,与超家族内的其他成员分开,红鳍东方鲀与青鳉的亲缘关系最近,先聚为一支,然后与三斑海猪鱼聚在一起,与矛尾鱼的GSDF亲缘关系最远 (图3)。

注:ATG、TAA分别为起始密码子和终止密码子;下划线表示信号肽序列和ploy(A)序列;NST为N-糖基化位点;AATAAA为加尾信号;跨膜区域用方框标出;上括号中表示TGF-β保守结构域Note:ATG and TAA show the start codon and the stop codon,respectively;the signal peptide sequence and the ploy(A)singal sequence are underlined;NST shows N-glycosylation site;AATAAA shows polyadenylation signal;the transmembrane region is indicated in the frame;the TGF-β domain is indicated in bracket图2 红鳍东方鲀gsdf cDNA全长序列及其推导的氨基酸序列Fig.2 The cDNA full-length of gsdf and the deduced am ino acid sequence in red fin puffer Takifugu rubripes
2.3 红鳍东方鲀gsdf基因的组织表达分析采
用RT-PCR对雌性和雄性红鳍东方鲀各组织中Trgsdf基因的表达模式进行分析。结果显示,Trgsdf基因在卵巢和精巢中均有表达,在皮肤和肌肉中微量表达,而在其他组织中均无表达 (图4)。
采用相对实时荧光定量PCR,对卵巢和精巢中Trgsdf mRNA的表达量进行比较。结果显示,Trgsdf mRNA在性腺中的表达量存在差异,其在精巢中的表达量显著高于在卵巢中的表达量 (P<0.05),约为卵巢表达量的6倍 (图5)。
3 讨论
本研究中,首次在红鳍东方鲀中克隆到gsdf cDNA全长序列,并解析了该基因的表达模式,为进一步解读gsdf基因与性分化的关系及其背后的分子机制奠定了重要基础,也为深入了解其他脊椎动物的性别分化过程提供了比较和参考。目前,已在多种鱼类中得到gsdf cDNA序列,其与红鳍东方鲀GSDF氨基酸序列的相似性为26%~58% (表2),这表明,GSDF蛋白在功能上也较为保守。NCBIBLAST比对结果表明,在除鱼类之外的哺乳类、两栖类和鸟类等脊椎动物中,未发现与gsdf高度相似的基因,且在构建的系统发育树中,鱼类GSDF单独聚为一支,并与TGF-β超家族其他成员anti-Mullerian hormone(AMH)、growth-differentiation factor(GDF)、TGF等分开,表明 GSDF可能是仅存于鱼类的一个特殊的TGF-β超家族成员。有研究发现,鱼类在进化过程中经历了特有的全基因组复制事件[16-18],基因组复制后会产生大量的冗余基因,这些重复基因可能会被沉默、丢失、亚功能化或产生新功能。因此,鱼类特有的gsdf基因可能是基因组复制事件的产物,并在随后的进化过程中获得了新的表达模式和功能。学界普遍认为,鱼类在进化过程中共经历了3次基因组复制事件,分别发生在有颌类和无颌类分离之前、仅发生在有颌类和仅发生在辐鳍鱼类的基因组复制事件。杨惠惠[6]在最新公布的软骨鱼类象鲨 Callorhinchusmilii基因组中成功分离到gsdf基因,而Gautier等[5]发现,在圆口纲的七鳃鳗Petromyzon marinus等原始种类均未发现gsdf同源基因。此外,在更为原始的物种,如文昌鱼等中均未发现其同源基因。因此,以上研究表明,gsdf基因可能是鱼类第二次基因组复制事件的产物。研究表明,对于四足动物,在其祖先物种肉鳍鱼类如矛尾鱼[19]中存在gsdf基因,但在现存四足动物中却未见有关gsdf同源基因的报道,这可能是因为gsdf基因在四足动物进化过程中次生性的丢失。生物信息学分析显示,红鳍东方鲀GSDF是一种分泌型糖蛋白,这与对其他鱼类的研究结果一致。此外,红鳍东方鲀GSDF蛋白的TGF-β保守域有9个半胱氨酸残基,在不同鱼类中其保守半胱氨酸的数量稍有不同。与红鳍东方鲀相比,三刺鱼Gasterosteus aculeatus GSDF蛋白的TGF-β保守域内,缺少第6位的半胱氨酸残基,虹鳟GSDF则缺少第9位的半胱氨酸残基,仅有8个半胱氨酸残基[4]。总体而言,TGF-β超家族成员有6个保守半胱氨酸[1],通常这些半胱氨酸残基中的一个用于形成链间二硫键桥,其他参与形成分子内环,即所谓的半胱氨酸结基序 (cysteine knotmotif)。该结构可迫使疏水残基暴露给周围的水分子,阻止分子成为假定的球状蛋白结构并能驱动分子发生二聚化,与一个蝶状结构形成一个高稳定性的二聚体蛋白,因此,它在形成链内二硫键、二聚体形成、维持GSDF结构和分子生物活性方面具有重要的作用[20]。半胱氨酸结结构基序不仅在TGF-β蛋白中存在,也存在于其他半胱氨酸家族蛋白中,如 NGF、PDGF、糖蛋白激素(GPH)和IL-17等。此外,TGF-β家族成员、糖蛋白、血小板来源生长因子等的半胱氨酸结结构基序的一个显著特征是基序内部无甘氨酸[21]。

表2 红鳍东方鲀GSDF氨基酸序列的同源性分析Tab.2 Comparative identity of GSDF am ino acid sequence in red fin pu ffer Takifugu rubripes

图3 基于GSDF氨基酸序列的红鳍东方鲀与其他物种系统发育分析Fig.3 Phylogenetic analysis based on GSDF am ino acid sequences in redfin puffer Takifugu rubripes and other species

注:β-actin为内参基因;M为Marker;1为皮肤;2为脾;3为肝脏;4为气囊;5为中肾;6为肠;7为鳔;8为肌肉;9为心脏;10为鳃;11为脑;12为头肾;13为卵巢 (精巢)Note:β-actin is used as internal control;M,Marker;1,skin;2,spleen;3,liver;4,air sac;5,trunk kidney;6,intestine;7,air bladder;8,muscle;9,heart;10,gill;11,brain;12,head kidney;13,ovary(testis)图4 雌性 (A)和雄性 (B)红鳍东方鲀各组织中gsdf基因的表达Fig.4 Exp ression profile of gsdf gene in various tissues of female(A)and male(B)red fin puffer Takifugu rubripes
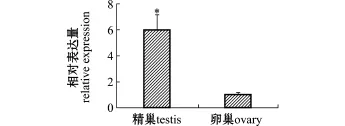
注:*表示组间有显著性差异 (P<0.05)Note:*means significant difference(P<0.05)图5 Trgsdf mRNA在红鳍东方鲀性腺中的相对表达Fig.5 Relative expression of Trgsdf m RNA in gonad of red fin pu ffer Takifugu rubripes
RT-PCR结果显示,红鳍东方鲀gsdf基因在性腺中高表达,在皮肤和肌肉中微量表达,而在其他组织中无表达。这表明,gsdf基因主要在红鳍东方鲀的性腺中发挥功能。采用实时荧光定量PCR比较了红旗东方鲀精巢和卵巢中gsdf基因的表达量,结果发现,gsdf基因在精巢中的表达量要显著高于卵巢,约为卵巢表达量的6倍。以上结果表明,gsdf基因与性别决定无关,但可能参与性腺的分化,特别是精巢的分化和发育过程。这与对虹鳟、青鳉、三斑海猪鱼等的研究结果一致。关于gsdf基因在红鳍东方鲀精巢分化过程中的功能还有待进一步研究。在虹鳟的相关研究中,采用重组gsdf对精巢细胞进行培养,发现gsdf基因能促进原始生殖细胞和A型精原细胞的增殖[4]。本试验中,已克隆得到Trgsdf cDNA的全长序列,今后可通过制作重组蛋白或使用基因敲低技术等手段来阐明其功能。gsdf基因在红鳍东方鲀卵巢中也有少量表达,但其功能尚不清楚。对银大麻哈鱼的研究显示[22],卵母细胞生长过程中gsdf mRNA的表达量上升。由此可以推断,gsdf基因可能对颗粒细胞(granulosa cell)的增殖起着重要的作用。今后,笔者将在本研究基础上就gsdf基因在红鳍东方鲀幼鱼性别分化过程中的表达模式及其作用机制进行进一步研究。
参考文献:
[1] Sawatari E,Shikina S,Takeuchi T,et al.A novel transforming growth factor-βsuperfamilymember expressed in gonadal somatic cells enhances primordial germ cell and spermatogonial proliferation in rainbow trout(Oncorhynchusmykiss)[J].Developmental Biology,2007,301(1):266-275.
[2] Shibata Y,Paul-Prasanth B,Suzuki A,et al.Expression of gonadal soma derived factor(GSDF)is spatially and temporally correlated with early testicular differentiation in medaka[J].Gene Expression Patterns,2010,10(6):283-289.
[3] Crespo B,Gómez A,Mazón M J,etal.Isolation and characterization of Ff1 and Gsd f family genes in European sea bass and identification of early gonadalmarkers of precocious puberty in males[J]. General and Comparative Endocrinology,2013,191:155-167.
[4] Horiguchi R,Nozu R,Hirai T,et al.Characterization ofgonadal soma-derived factor expression during sex change in the protogynous wrasse,Halichoeres trimaculatus[J].Developmental Dynamics,2013,242(4):388-399.
[5] Gautier A,Sohm F,Joly JS,et al.The proximal promoter region of the zebrafish gsdf gene is sufficient to mimic the spatio-temporal expression pattern of the endogenousgene in Sertoliand granulosa cells[J].Biology of Reproduction,2011,85(6):1240-1251.
[6] 杨惠惠.罗非鱼gsdf在性腺的表达及其在性别决定中的功能[D].重庆:西南大学,2014.
[7] Myosho T,Otake H,Masuyama H,et al.Tracing the emergence ofa novel sex-determining gene inmedaka,Oryzias luzonensis[J].Genetics,2012,191(1):163-170.
[8] 陈松林.鱼类性别控制与细胞工程育种[M].北京:科学出版社,2013:411.
[9] 柿本芳久,相田聡,荒井克俊,等.トラフグTakifugu rubripesにおける低温、高温処理による雌性発生二倍体の誘起[J].広島大生物生産学部紀要,1994,33(1):103-111.
[10] Kikuchi K,KaiW,Hosokawa A,et al.The sex-determining locus in the tiger pufferfish,Takifugu rubripes[J].Genetics,2007,175 (4):2039-2042.
[11] Lee K H,Yamaguchi A,Rashid H,et al.Germ cell degeneration in high-temperature treated pufferfish,Takifugu rubripes[J].Sexual Development,2009,3(4):225-232.
[12] Rashid H,Kitano H,Lee K H,et al.Fugu(Takifugu rubripes)sexual differentiation:CYP19 regulation and aromatase inhibitor induced testicular development[J].Sexual Development,2007,1 (5):311-322.
[13] Yamaguchi A,Lee K H,Fujimoto H,et al.Expression of the DMRT gene and its roles in early gonadal development of the Japanese pufferfish Takifugu rubripes[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2006,1(1):59-68.
[14] Kamiya T,KaiW,Tasumi S,et al.A trans-speciesmissense SNP in Amhr2 is associated with sex determination in the tiger pufferfish,Takifugu rubripes(Fugu)[J].PLoSGenetics,2012,8(7):e1002798,doi:10.1371/journal.pgen.1002798.
[15] Matsunaga T,Ieda R,Hosoya S,etal.An efficientmolecular technique for sexing tiger pufferfish(fugu)and the occurrence of sex reversal in a hatchery population[J].Fisheries Science,2014,80 (5):933-942.
[16] Taylor JS,Braasch I,Frickey T,et al.Genome duplication,a trait shared by 22,000 species of ray-finned fish[J].Genome Research,2003,13(3):382-390.
[17] Christoffels A,Koh E G L,Chia JM,et al.Fugu genome analysis provides evidence for a whole-genome duplication early during the evolution of ray-finned fishes[J].Molecular Biology and Evolution,2004,21(6):1146-1151.
[18] 孙新,魏振邦,孙效文.鱼类特异的基因组复制及鱼类多样性[J].生命科学研究,2007,11(4):62-69.
[19] Forconi M,Canapa A,Barucca M,et al.Characterization of sex determination and sex differentiation genes in Latimeria[J].PLoS One,2013,8(4):e56006,doi:10.1371/journal.pone.0056006.
[20] Daopin S,Piez K A,Ogawa Y,et al.Crystal structure of transforming growth factor-beta 2:an unusual fold for the superfamily [J].Science,1992,257:369-373.
[21] Vitt U A,Hsu SY,Hsueh A JW.Evolution and classification of cystine knot-containing hormones and related extracellular signalingmolecules[J].Molecular Endocrinology,2001,15(5):681-694.
[22] Luckenbach JA,Iliev D B,Goetz FW,et al.Identification of differentially expressed ovarian genes during primary and early secondary oocyte growth in coho salmon,Oncorhynchus kisutch[J]. Reproductive Biology and Endocrinology,2008,6:2,doi:10. 1186/1477-7827-6-2.
Cloning and expression profiling of the gsdf gene in red fin puffer Takifugu rubripes
YAN Hong-wei1,TIAN Yu-shun1,JIANG Li-nan1,WANG Lian-shun1,LIU Yang1,LIU Qi2,LIU Sheng-cong3
(1.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2.Center for Marine Ranching Engineering Science Research of Liaoning,Dalian Ocean University,Dalian 116023,China;3.Dalian Tianzheng Co.Ltd.Dalian 116000,China)
Abstract:The full length cDNA of gsdf gene(Trgsdf,GenBank accession No.KR914667)was first cloned in redfin puffer Takifugu rubripeshis using rapid amplification of cDNA ends(RACE).The results showed that the Trgsdf gene had 1734 bp in length,with 144 bp of5′-untranslated region(UTR),942 bp of3′-UTR and 648 bp of the coding region encoding a 215 amino acids predicted protein.The predicted protein contained a signal peptide(19 amino acid long),a transmembrane region(19 amino acid long),an N-glycosylation site(NST)and a conserverd domain of the TGF-βsuperfamily.A BLAST search against the NCBIprotein database showed that the Trgsdf-encoding protein shared 26%-58%identity with the GSDF proteins found in other fish species.Phylogenetic analysis revealed that the fish GSDF proteins had a clade separated from the othermembers of the TGF-βsuperfamily.Moreover,the Trgsdf-encoding protein showed a higher similarity with themedaka Oryzias latipes GSDF and the protogynous wrasse Halichoeres trimaculatusgsdf as compared with the GSDF in other species.The expression pattern of Trgsdf in various tissues by RT-PCR(reverse transcription polymerase chain reaction)showed that therewas Trgsdf transcripts in both female and male redfin puffer,with a high expression level in ovary and testis,low expression level in skin andmuscle and withoutexpression in other tissues.Relative real-time PCR showed that there was significantly higher expression level of Trgsdf in testis than that in ovary(P<0.05).The findings suggest that GSDF might be involved in the development of gonad(especially in testis differention and development)in redfin puffer.
Key words:Takifugu rubripes;gonadal soma derived factor(GSDF);RACE;Real-Time PCR;gene expression
中图分类号:S917.4
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.004
文章编号:2095-1388(2016)02-0140-07
收稿日期:2015-07-01
基金项目:辽宁省博士启动基金资助项目 (20141105);教育部留学回国人员科研启动基金资助项目 (2015-311);农业部北方海水增养殖重点实验室开放课题 (2014-MSENC-KF-14)
作者简介:闫红伟 (1985—),女,博士,讲师。E-mail:yanhongwei@dlou.edu.cn
通信作者:刘奇 (1983—),男,博士,讲师。E-mail:liuqisunson@dlou.edu.cn
