独角雪冰鱼和伯氏肩孔南极鱼TRPV1基因的克隆及低温适应功能检测
2016-07-15王桂志许强华
王桂志,张 永, 张 弛,许强华、2、3、4、5
(1.上海海洋大学海洋科学学院,上海201306;2.大洋渔业资源可持续开发省部共建教育部重点实验室,上海201306;3.农业部大洋渔业资源环境科学观测试验站,上海201306;4.国家远洋渔业工程技术研究中心,上海201306;5.远洋渔业协同创新中心,上海201306)
独角雪冰鱼和伯氏肩孔南极鱼TRPV1基因的克隆及低温适应功能检测
王桂志1,张永1, 张弛1,许强华1、2、3、4、5
(1.上海海洋大学海洋科学学院,上海201306;2.大洋渔业资源可持续开发省部共建教育部重点实验室,上海201306;3.农业部大洋渔业资源环境科学观测试验站,上海201306;4.国家远洋渔业工程技术研究中心,上海201306;5.远洋渔业协同创新中心,上海201306)
摘要:为从细胞水平上研究独角雪冰鱼Chionodraco hamatus和伯氏肩孔南极鱼Trematomus bernacchii的低温适应能力,采用RT-PCR方法,获得独角雪冰鱼和伯氏肩孔南极鱼的瞬时受体电位阳离子通道蛋白(transient receptor potential channels V1,TRPV1)基因序列,其开放阅读框全长均为2310 bp;生物信息学分析表明,两种南极鱼TRPV1基因均编码769氨基酸残基,预测其蛋白相对分子质量分别为88 210和88 160,理论等电点分别为7.63和8.26;两种南极鱼TRPV1蛋白均无信号肽;亚细胞定位显示,TRPV1蛋白主要在细胞膜和内质网中发挥生物学功能;理化性质分析表明,两种南极鱼的TRPV1为不溶性跨膜蛋白,分别有34、35个磷酸化位点和6、5个糖基化位点,二者均含有6个跨膜结构域、5个锚蛋白结构域,二级结构以随机卷曲为主;同源性分析显示,独角雪冰鱼TRPV1氨基酸序列与伯氏肩孔南极鱼的一致性最高,为93.4%,与其他物种的一致性为44.3%~69.8%;低温适应试验结果显示,两种南极鱼的TRPV1基因不能被温度所激活。研究表明,独角雪冰鱼和伯氏肩孔南极鱼TRPV1基因可能与低温适应无关。
关键词:独角雪冰鱼;伯氏肩孔南极鱼;TPRV1基因;低温适应
瞬时受体电位阳离子通道蛋白 (transient receptor potential ion channel protein,TRP)是研究比较广泛的一类非选择性阳离子通道蛋白,主要存在于生物膜上,其超家族由TRPC、TRPV、TRPM、TRPML、TRPP、TRPA、TRPN等7个亚家族组成[1-2]。TRPV亚家族蛋白主要由6个跨膜结构域和3~4个锚蛋白结构域组成,在第5和第6跨膜结构域之间有一个孔道环[1],作为阳离子进出的门户。TRP超家族中有不少蛋白与温度感应有关,其中包括TRPV亚家族的 TRPV1、TRPV2、TRPV3、TRPV4,TRPM亚家族的TRPM8,TRPA亚家族的TRPA1[3-4]。TRPV1是TRP超家族中的一种可以感受高温的非选择性阳离子通道蛋白,该蛋白可被多种因子激活,包括温度、辣椒碱、渗透压刺激、机械力刺激、化学刺激、膜电位刺激等因子[1,3]。研究表明,当温度高于43℃时,小鼠的TRPV1基因可被激活[1,3],但当温度高于25℃时,斑马鱼的TRPV1基因即可被激活,同时随着pH值的减小,TRPV1基因的热激活温度阈值也相应降低[5-6]。此外,敲除小鼠的TRPV1基因后,小鼠对热的反应能力明显降低甚至缺失,且TRPV1基因的阻断剂能够使动物的体温升高[3];Gau等[6]的研究显示,敲除TRPV1基因后,斑马鱼的温度适应能力明显降低。以上研究表明,TRPV1基因在动物的热觉感受及体温调节中发挥重要的作用[3-4]。目前的研究已经确认,TRPV1基因被激活时细胞外的钙离子流到细胞内,使细胞内的钙离子浓度增高,从而调节相应的生理功能或病理机制[7-8]。在心血管系统中,TRPV1基因还参与血管张力变化[9]以及高血压[10]、心肌缺血[11]、动脉粥样硬化[12]等多种心血管疾病的生理和病理过程。
南极海域的海水温度最低可以降到-1.8℃,南极鱼类生活在如此低的温度环境中,经过长期低温适应,其负责运输氧气的器官选择压力有所下降。独角雪冰鱼Chionodraco hamatusis隶属于鲈形目、南极鱼亚目、鳄冰鱼科,与其他脊椎动物不同的是其终生没有血红蛋白的表达[13-14],该鱼生活的水域水深为800 m,是南极整个大陆架生物多样性的重要组成部分。研究发现,南极独角雪冰鱼心脏的大小及收缩强度、组织血管化程度、血管内径和线粒体密度均比非南极鱼大,这些特殊的适应特性与TRPV1蛋白参与调节心血管疾病的性状有相似之处,作者猜测TRPV1蛋白是南极冰鱼低温适应过程中的一个重要的通道,故本研究中选其作为目的物种;伯氏肩孔南极鱼Trematomus bernacchii为鲈形目、南极鱼亚目、南极鱼科的一种,经过初步试验研究,发现其与冰鱼有较近的亲缘关系,不同的是其心血管系统并没有发生像独角雪冰鱼一样的适应进化,故选其作为独角雪冰鱼的第一种对照物种;尼罗罗非鱼Oreochromis niloticus是世界上重要的淡水养殖鱼类,最适生长温度为28~32℃,因其生长在热带,故选其作为研究独角雪冰鱼低温适应功能的另一种对照物种。本研究中,通过克隆首次获得了两种南极鱼的TRPV1基因序列,对其进行生物信息学分析,并在细胞水平上对其低温适应性进行了探讨,旨在为进一步研究TRPV1基因在鱼类的低温功能适应方面提供参考。
1 材料与方法
1.1 材料
独角雪冰鱼和伯氏肩孔南极鱼均采自南极埃默里冰架和熊猫码头,体质量分别为450 g和125 g;尼罗罗非鱼采自上海南汇水产养殖场,体质量为355 g。
真核细胞CHO-K1是中国仓鼠卵巢细胞的一种,为大洋渔业资源可持续开发省部共建教育部重点实验室冻存,直接复苏后使用。
1.2 方法
1.2.1 样品的制备 将独角雪冰鱼和伯氏肩孔南极鱼解剖后,取其脑组织于超低温冰箱 (-80℃)中保存备用;将尼罗罗非鱼活体解剖后,直接取脑组织使用。
1.2.2 脑组织总RNA的提取 通过Trizol法提取3种鱼的脑组织总RNA。
1.2.3 TRPV1 ORF序列的克隆 运用RT-PCR技术对目的基因ORF片段进行扩增。使用M-MLV Reverse Transcriptase(Promega,USA)试剂盒将RNA反转录生成cDNA,用于PCR扩增。根据南极美露鳕Dissostichusmawsoni基因组测序相关序列和GenBank数据库中相应的同源序列设计引物(表1)。PCR反应体系 (共25μL):10×PCR buffer 2.5μL,dNTPMix(2.5 mmol/L each)2.0μL,上、下游引物各0.5μL,Taq DNA Polymerase(5 U/μL)0.5μL,用ddH2O补足至25μL。PCR反应程序:95℃下预变性3 min;95℃下变性30 s,52~68℃下退火30 s,72℃下延伸1~2 min,共进行30个循环;最后在72℃下再延伸10 min。PCR产物纯化后与pGEM©-T Easy载体连接,转化至大肠杆菌中,挑选阳性菌液提取质粒,将阳性质粒送生工生物工程 (上海)股份有限公司进行测序,根据测序结果,选取限制性内切酶NheⅠ和SacⅡ,设计相应的酶切引物 (表1),以TRPV1各自两段序列的胶回收产物为模板,应用高保真酶进行ORF全长PCR,并进行克隆、提取质粒、测序,方法同上。

表1 扩增TRPV1 ORF所用引物Tab.1 Nucleotide sequences of p rimers used in cloning of TRPV1 open reading frame(ORF)
1.2.4 生物信息学分析 采用DNAStar进行TRPV1序列片段的拼接和氨基酸序列的推导;分别用ProtParam、IBCP、PHYRE2和TMHM程序推测蛋白的理化性质[15]、二级结构[16]、三级结构[17]和跨膜结构[18];分别用Protscale、NetPhos和NetNGlyc软件推测蛋白的亲疏水性、磷酸化位点和糖基化位点;分别用 TargetP、SignalP 4.0软件推测蛋白的潜在信号肽和分泌途径,用PSORT IIPrediction程序分析蛋白的亚细胞定位,用Smart程序推测氨基酸序列的保守结构域;分别使用BLAST和MEGA 5.1软件分析其同源性以及构建系统发育树[19]。
1.2.5 真核表达载体的构建 根据所得ORF序列与pIRES2-EGFP-ToL2-CMV真核表达载体 (本实验室拥有)序列,选取限制性内切酶NheⅠ和SacⅡ构建3种试验鱼TRPV1的真核重组表达载体。
1.2.6 真核细胞低温适应试验 将CHO细胞提前24 h转移至96孔黑板 (可以加PS+FBS),且保证次日转染时细胞汇合度为60%~80%。24 h后采用1∶3比例进行转染 (转染试剂为英格恩生物公司的EntransterTM-D),置于37℃培养箱中培养6 h后换液,继续培养24 h;换液后,将细胞分常温和低温两组,分别置于常温37℃培养箱和低温10℃培养箱中培养24 h。两组分别加入培养基 (90 μL培养基+10μL PrestoBlue试剂),于37℃下放置15 min,用FlexStation 3多功能酶标仪检测其荧光强度,调节到560 nm激发光和590 nm散射光,获得每孔的荧光强度值。试验重复3次,每次设3个平行,取其平均值,根据Zulkifli Mustafa相关文献报道[6]进行计算:
细胞类型X的活性=细胞类型X荧光值-培养基荧光值。
1.3 数据处理
试验数据通过SPSS 13.0软件进行处理,利用One-Way ANOVA分析法进行显著性检验。
2 结果与分析
2.1 TRPV1基因的序列分析
以试验鱼脑组织总RNA为模板,反转录得到cDNA,采用RT-PCR技术克隆获得独角雪冰鱼和伯氏肩孔南极鱼TRPV1基因ORF全长均为2310 bp,推定其均编码769个氨基酸残基 (图1、图2),预测其相应蛋白的相对分子质量分别为88 210 和88 160,pH为7.0时的理论等电点分别为7.63 和8.03。

图1 由独角雪冰鱼TRPV1基因推导的氨基酸序列Fig.1 Am ino acid sequence deduced by TRPV1 gene in icefish Chionodraco hamatusis

图2 由伯氏肩孔南极鱼TRPV1基因推导的氨基酸序列Fig.2 Am ino acid sequence deduced by TRPV1 gene in Trematomus bernacchii
2.2 TRPV1氨基酸序列的同源性分析
将独角雪冰鱼TRPV1氨基酸序列与其他脊椎动物的相应序列进行同源性分析 (表2)。结果显示:独角雪冰鱼TRPV1氨基酸序列与伯氏肩孔南极鱼的一致性最高,为93.4%;与爬行类 (响尾蛇)的一致性最低,为44.3%;与两栖类 (非洲爪蟾)的一致性为47.5%;与鸟类 (原鸡)的一致性为47.1%;与其他哺乳类动物的一致性为45.1%~45.6%。
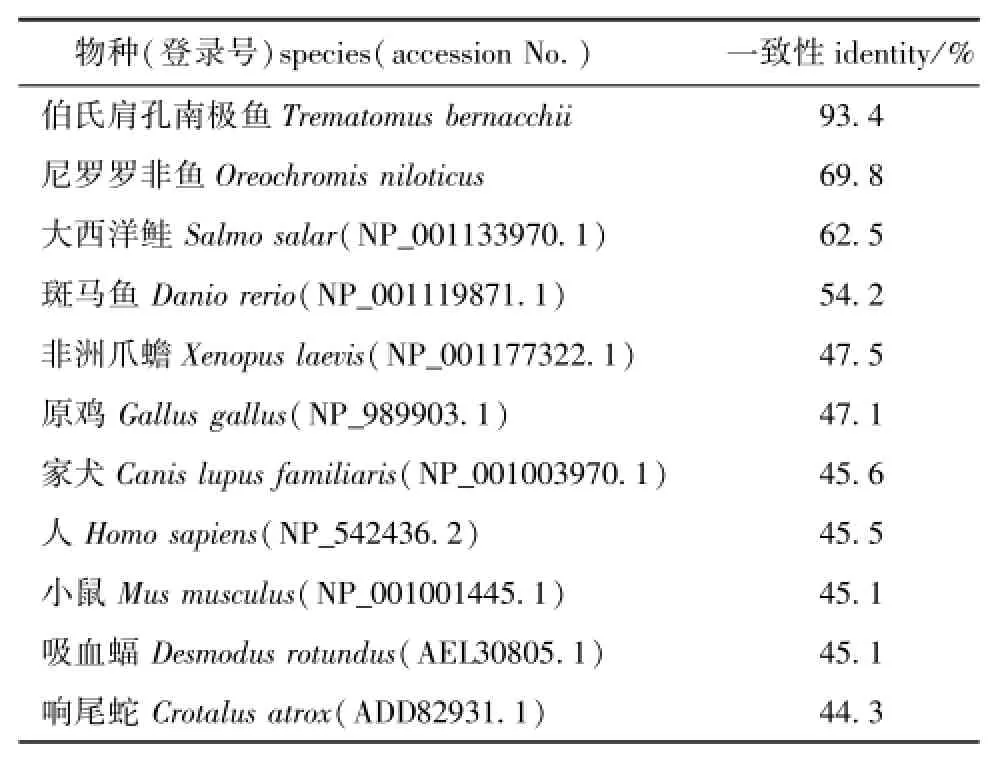
表2 独角雪冰鱼与其他物种TRPV1氨基酸序列的同源性分析Tab.2 Identity of TRPV1 am ino acid sequence in icefish Chionodraco hamatusis com paried w ith other species
2.3 TRPV1基因的遗传分析
独角雪冰鱼和伯氏肩孔南极鱼TRPV1系统发育树 (N-J树)如图3所示,独角雪冰鱼和伯氏肩孔南极鱼TRPV1氨基酸序列与其他鱼类的氨基酸序列聚为一支,而哺乳类、两栖类、爬行类和禽类也分别与氨基酸序列聚类。

图3 独角雪冰鱼和伯氏肩孔南极鱼的TRPV1系统发育树Fig.3 Phy logenetic tree based on putative TRPV1 am ino acid sequences in Chionodraco hamatus,and Trematomus bernacchii
2.4 TRPV1蛋白的结构分析
2.4.1 TRPV1蛋白的理化性质 经DNAStar软件分析显示,独角雪冰鱼TRPV1蛋白含84个碱性氨基酸 (K、R),占所有氨基酸总数的10.9%;含83个酸性氨基酸 (D、E),占所有氨基酸总数的10.8%;含278个疏水氨基酸 (A、I、F、W、V),占所有氨基酸总数的36.2%;含201个极性氨基酸 (N、C、Q、S、T、Y),占所有氨基酸总数的26.1%。伯氏肩孔南极鱼TRPV1蛋白含90个碱性氨基酸 (K、R),占所有氨基酸总数的11.7%;含86个酸性氨基酸 (D、E),占所有氨基酸总数的11.2%;含276个疏水氨基酸 (A、I、F、W、V),占所有氨基酸总数的35.9%;含199个极性氨基酸 (N、C、Q、S、T、Y),占所有氨基酸总数的25.9%。
2.4.2 TRPV1蛋白的二级结构与三级结构预测利用ProtParam程序推测独角雪冰鱼TRPV1蛋白中,α-螺旋 (alpha helix,h)占整个蛋白的40.83%;随机卷曲 (random coil,c)占整个蛋白的43.82%;延伸链 (extendedstrand,e)占整个蛋白的15.34%。推测伯氏肩孔南极鱼TRPV1蛋白中,α-螺旋 (h)占整个蛋白的44.08%;随机卷曲 (c)占整个蛋白的41.09%;延伸链 (e)占整个蛋白的14.82%。通过PHYRE2程序推测两种鱼的三级结构,结果显示,独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白均含有6个跨膜结构域和锚蛋白结构域 (图4)。
2.4.3 TRPV1蛋白的保守结构域和亲疏水性 根据Smart和TMHM软件分析显示,独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白并不确定是否含有离子转运结构域,非洲爪蟾同样也不确定是否含有离子转运结构域,而其他高等脊椎动物和斑马鱼的TRPV1蛋白确定含有离子转运结构域 (图5)。从图5还可以看出,所有物种的TRPV1蛋白均具有6个跨膜结构域 (后面的物种未在图上标出)和5~6个锚定蛋白结构域,这两种结构域为TRPV1蛋白相对保守的结构域。
利用Protscale推测蛋白的疏水性,结果表明,独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白疏水性最大值均为4.500,最小值均为-4.500,其氨基酸序列内亲水和疏水性残基都大量存在,推测两种鱼的TRPV1均为不溶性跨膜蛋白。
2.4.4 亚细胞定位 利用TargetP和SignalP预测独角雪冰鱼和伯氏肩孔南极鱼的TRPV1蛋白在细胞内的定位情况。结果发现,两种鱼的TRPV1蛋白均没有信号肽,不属于分泌蛋白 (表3)。独角雪冰鱼TRPV1蛋白主要在细胞膜 (65.2%)和内质网 (30.4%)中发挥作用,少量在细胞支架(4.3%)中发挥作用;伯氏肩孔南极鱼TRPV1蛋白主要在细胞膜 (69.6%)和内质网 (21.7%)中发挥作用,少量在细胞支架 (4.3%)和过氧化物酶体(4.3%)中发挥作用,从而推断两种鱼TRPV1蛋白在细胞质附着核糖体上合成,其中伯氏肩孔南极鱼TRPV1蛋白功能与过氧化物酶体有关。

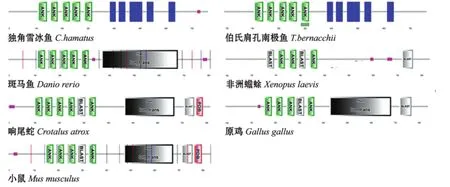
注:蓝色区域表示跨膜结构域;绿色区域表示锚定蛋白结构域;pink粉红色区域表示低复杂性区段;FDB表示FDB数据库已有蛋白;BLAST代表已知结构的同系物;Ion_trans代表离子转运结构域Note:Blue area shows transmembrane structure domain;green area represents the ANK structure domain;pink area shows low complexity region;FDB shows protein in the PDB database;BLAST shows homologues of known structure;Ion_trans represents translocation domain图5 TRPV1蛋白保守结构域分析Fig.5 Conservative structure domain analyses of TRPV1 protein

表3 独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白亚细胞定位Tab.3 The sub-cellular localization of TRPV1 protein predicted by TargetP in icefish Chionodraco hamatus and Trematomus bernacchii
2.4.5 TRPV1蛋白的磷酸化与糖基化位点 经NetPhos 2.0软件分析表明:独角雪冰鱼TRPV1蛋白的磷酸化位点有21个丝氨酸、7个酪氨酸、6个苏氨酸,可以成为蛋白激酶磷酸化的位点;伯氏肩孔南极鱼TRPV1蛋白的磷酸化位点有21个丝氨酸、8个酪氨酸、6个苏氨酸,可以成为蛋白激酶磷酸化位点。根据NetNGlyc 1.0软件推测,独角雪冰鱼、伯氏肩孔南极鱼TRPV1蛋白N端分别有6、5个糖基化位点。
2.5 真核细胞的低温适应结果
EGFP蛋白和目的蛋白在本载体中同时表达,再加上目前还暂时无检测南极鱼TRPV1蛋白表达的抗体,本试验中通过观察EGFP荧光来验证目的蛋白的表达。带有3种鱼TRPV1基因的质粒在荧光显微镜下都观察到大量的荧光,证明3种鱼的TRPV1蛋白均已得到表达 (图6)。
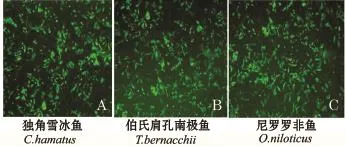
图6 转染20 h后3种鱼细胞的瞬时荧光表达情况Fig.6 Instantaneous fluorescence expression of cells in three fish species exposed to cell transfection for 24 h
显著性检验分析显示:各种样品的CHO细胞存活率在不同温度之间均无显著性差异 (P>0.05);转染独角雪冰鱼、伯氏肩孔南极鱼和尼罗罗非鱼TRPV1基因的CHO细胞,其存活率同野生型细胞 (对照WT)相比无显著性差异 (P> 0.05),同时 3种鱼之间也无显著性差异 (P>0.05)。可以推测,TRPV1基因可能并无低温适应的功能 (图7)。

注:TB、CH、ON、TOL2、WT分别为伯氏肩孔南极鱼、独角雪冰鱼、尼罗罗非鱼、TOL2空白载体、CHO细胞野生型Note:Themeans of TB,CH,ON,TOL2,and WT are icefish Trematomus bernacchii,Chionodraco hamatus,and Nile tilapia Oreochromis niloticus,pure supporter of TOL2,and wild-type cell of CHO图7 温度对CHO细胞存活率的影响Fig.7 Effects of tem perature on the viability of CHO
3 讨论
本研究中通过RT-PCR技术首次克隆了独角雪冰鱼和伯氏肩孔南极鱼TRPV1基因,其开放阅读框全长均为2310 bp,推定均编码769个氨基酸残基。同源性分析表明,独角雪冰鱼TRPV1氨基酸序列与伯氏肩孔南极鱼的一致性最高(93.4%),与其他鱼类的一致性次之(54.2% ~69.8%),同其他高等脊椎动物的一致性较低 (44.3% ~47.1%)。基于TRPV1氨基酸序列构建的系统进化分析也显示,鱼类TRPV1聚为一支,而两栖类、爬行类、禽类和哺乳类也分别与相应TRPV1氨基酸序列聚类。由此可见,TRPV1基因在动物由低等到高等的进化过程中发生了较大的适应性进化。
对蛋白结构分析显示,独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白均无信号肽,有6个跨膜结构域,为不溶性跨膜蛋白。蛋白亚细胞定位预测表明:独角雪冰鱼 TRPV1蛋白主要在细胞膜(65.2%)和内质网 (30.4%)中发挥作用,少量在细胞支架 (4.3%)中发挥作用;伯氏肩孔南极鱼TRPV1主要在细胞膜 (69.6%)和内质网(21.7%)中发挥作用,少量在细胞支架 (4.3%)和过氧化物酶体 (4.3%)中发挥作用。由此推断,两种鱼TRPV1蛋白均在细胞质附着核糖体上合成,且伯氏肩孔南极鱼TRPV1功能还与过氧化物酶体有关。这表明,南极鱼类的TRPV1同其他高等脊椎动物的TRPV1相同,也是一种通道蛋白。
研究显示,TRPV1通道蛋白可被cAMP依赖的蛋白激酶磷酸化,从而导致该蛋白失活,同时,TRPV1蛋白也可以和蛋白激酶C相结合,以此来完成细胞内外一系列信号传递过程,进而调节细胞的各项功能[20]。对蛋白磷酸化位点分析发现,独角雪冰鱼和伯氏肩孔南极鱼TRPV1氨基酸序列分别含有34和35个磷酸化位点,推测这些磷酸化位点可能是TRPV1和蛋白激酶结合的位点。同时独角雪冰鱼、伯氏肩孔南极鱼TRPV1蛋白N端分别有6、5个糖基化位点,这些糖基化位点可使TRPV1形成糖蛋白,在细胞膜上发挥其感知外界信号调控离子通透性的功能。蛋白的保守结构域分析表明,独角雪冰鱼和伯氏肩孔南极鱼TRPV1蛋白并不确定含有离子转运结构域,除非洲爪蟾外,其他高等脊椎动物和斑马鱼确定含有离子转运结构域,推测离子转运结构域可能在鱼类环境适应进化过程中发生了比较大的变化,离子转运结构域的变化可能会导致TRPV1通道蛋白功能发生相应的变化。但结构分析同时还显示,所有物种的TRPV1蛋白都有6个跨膜螺旋,具备6个跨膜结构域,还有5~6个锚定蛋白结构域,这两种结构域为TRPV1蛋白相对保守的结构域。
研究表明,小鼠的TRPV1基因具有高温的感应功能,当温度大于43℃时可被激活[3]。本研究中进行的低温耐受性试验表明,独角雪冰鱼、伯氏肩孔南极鱼和尼罗罗非鱼TRPV1基因都不具有低温适应的功能,且南极鱼类TRPV1蛋白又缺少离子转运结构域,而对一个离子通道蛋白而言,离子转运结构域无疑是最重要的一个结构域。由此推测,离子转运结构域的缺失是南极鱼类TRPV1蛋白不具有温度感应功能的重要因素。
本试验中仅仅从细胞水平上做了初步的探索,最终结论还需要从蛋白水平等领域进一步验证;同时TRPV1基因作为一种重要的多觉感受器,还可被多种激活因子激活,因此,南极鱼类的TRPV1基因到底在南极鱼类低温适应中发挥何种作用,还需要做大量的工作来进一步探究。
参考文献:
[1] Venkatachalam K,Montell C.TRP channels[J].Annual Review of Biochemistry,2007,76:387-417.
[2] 马悦颖,李沧海,霍海如,等.瞬时感受器电位V亚家族离子通道——温度感受器[J].医学分子生物学杂志,2007,4(1):174-177.
[3] Gavva N R,Treanor J JS,Garami A,et al.Pharmacological blockade of the vanilloid receptor TRPV1 elicitsmarked hyperthermia in humans[J].Pain,2008,136(1-2):202-210.
[4] 邓可宣,和七一,邹家丽,等.瞬时受体电位通道蛋白TRPA1的研究进展[J].重庆师范大学学报:自然科学版,2013,30 (1):33-37.
[5] Huang Choulong.The transient receptor potential superfamily of ion channels[J].Journal of the American Society of Nephrology,2004,15(7):1690-1699.
[6] Gau P,Poon J,Ufret-Vincenty C,et al.The zebrafish ortholog of TRPV1 is required for heat-induced locomotion[J].The Journalof Neuroscience,2013,33(12):5249-5260.
[7] Golech S A,McCarrion R M,Chen Ye,et al.Human brain endothelium:coexpression and function of vanilloid and endocannabinoid receptors[J].Molecular Brain Research,2004,132(1):87-92.
[8] Wang L,Wang D H.TRPV1 gene knockout impairs postischemic recovery in isolated perfused heart in mice[J].Circulation,2005,112(23):3617-3623.
[9] 隋峰,霍海如,姜廷良,等.TRPV1通道蛋白介导的生理病理机制[J].医学分子生物学杂志,2008,5(1):55-58,64.
[10] 李魁君,李春刚,刘兴君.辣椒素受体(TRPV1)的生物学作用及其作为药物靶点的研究进展[J].沈阳药科大学学报,2011,28(11):917-927.
[11] 于新宇,柳青.瞬时受体电位香草酸亚型1在心血管系统中的调节作用[J].心血管病学进展,2012,33(2):282-284.
[12] Joke B,Bert V.Methanandamide hyperpolarizes gastric arteries by stimulation of TRPV1 receptors on perivascular CGRP containing nerves[J].Journal of Cardiovascular Pharmacology,2006,47 (2):303-309.
[13] Clapham D E.SnapShot:mammalian TRP channels[J].Cell,2007,129(1):220.
[14] Montell C.Physiology,phylogeny,and functions of the TRP superfamily of cation channels[J].Science's STKE,2001,1:90-93.
[15] Tyagi N,Srinivasan N.Recognition of nontrivial remote homology relationships involving proteins of Helicobacter pylori:implications for function recognition[M]//Kortagere S.In Silico Models for Drug Discovery.Humana:Humana Press,2013,933:155-175.
[16] Möller S,Croning M D R,Apweiler R.Evaluation ofmethods for the prediction ofmembrane spanning regions[J].Bioinformatics,2001,17(7):646-653.
[17] 张宝,黄克勇,郭劲松,等.H7N9病毒的来源和重组模式[J].南方医科大学学报,2013,33(7):1017-1021.
[18] Bhave G,Zhu Weiguo,Wang Haibin,etal.cAMP-dependentprotein kinase regulates desensitization of the capsaicin receptor (VR1)by direct phosphorylation[J].Neuron,2002,35(4):721-731.
[19] Tominaga M,Caterina M J,Malmberg A B,et al.The cloned capsaicin receptor integrates multiple pain-producing stimuli[J]. Neuron,1998,21(3):531-543.
[20] Wilkins M R,Gasteiger E,Bairoch A,et al.Protein identification and analysis tools in the ExPASy Server[M]//Link A J.2-D Proteome Analysis Protocols.Humana:Humana Press,1999,112:531-552.
Cloning and cold adaptation verification of TRPV1 genes from icefish Chionodraco hamatus and Trematomus bernacchii
WANG Gui-zhi1,ZHANG Yong1,ZHANG Chi1,XU Qiang-hua1,2,3,4,5
(1.College of Marine Sciences,ShanghaiOcean University,Shanghai201306,China;2.Key Laboratory of Sustainable Exploitation ofOceanic Fisheries Resources,Ministry of Education,Shanghai201306,China;3.Scientific Observing and Experimental Station ofOceanic Fishery Resources,Ministry of Agriculture,Shanghai 201306,China;4.National Engineering Research Center for Oceanic Fisheries,Shanghai 201306,China;5.Collaborative Innovation Center for Distant-water Fisheries,Shanghai201306,China)
Abstract:Transient receptor potential channels V1(TRPV1)gene sequence was cloned in icefish Chionodraco hamatus and Trematomus bernacchii using RT-PCR technology to investigatemolecularmechanism of the two Antarctic fish species to cold adaptation.The bioinformatics analysis indicated that the TRPV1s contained the 2310 bp open reading frame encoding 769 amino acids in length,with relativemolecularweightof88 210 and the theoretical isoelectric point of 7.63 in C.hamatus and relative molecular weight of 88 160 and theoretical isoelectric point of 8.26 in T.bernacchii.Sub-cellular localization revealed that TRPV1 proteins as insoluble transmembrane protein without signal peptide played primrily a role in plasmamembrane and endoplasmic reticulum.Physical and chemical properties showed that there were 34 phosphorylation sites and 6 glycosylation sites in in TRPV1 in C.hamatus and 35 phosphorylation sites,and 5 glycosylation sites in TRPV1 in T.bernacchii,with 6 transmembrane domains and 5 ANK domains.The TRPV1 had secondary structure of random coil.Nucleotide sequence analysis revealed that C.hamatusis TRPV1 had sequence similarity of44.3%-69.8%with TRPV1 in other vertebrates,themaximal similarity(93.4%)with the T.bernacchii TRPV1.Cold adaptation experiments showed that the TRPV1 of both ice fishes was not activated by temperature changes,indicating that the Antarctic fish TRPV1 isnot involved in cold adaptation.
Key words:Chionodraco hamatus;Trematomus bernacchii;TRPV1 gene;cold adaptation
中图分类号:R363
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.002
文章编号:2095-1388(2016)02-0124-07
收稿日期:2015-06-09
基金项目:国家自然科学基金面上项目 (31572598);上海市教育发展基金会与上海市教育委员会 “曙光计划”(13SG51);教育部科学技术研究项目 (213013A);上海市教委水产学一流学科项目
作者简介:王桂志 (1989—),男,硕士研究生。E-mail:wangguizhihi@163.com
通信作者:许强华 (1974—),女,博士,教授。E-mail:qhxu@shou.edu.cn
