小鼠脓毒症模型的建立和评价
2016-07-15荆喜中贾欢欢罗挺凌雪荧李韵峰刘书华马俊峰黄韧张钰王晖
荆喜中,贾欢欢,罗挺,凌雪荧,李韵峰,刘书华,马俊峰,黄韧,张钰*,王晖
(1.广东省实验动物监测所,广省实验动物重点实验室,广州 510663;2.广东药学院中药学院,广州 510006)
小鼠脓毒症模型的建立和评价
荆喜中2,1,贾欢欢1,罗挺1,凌雪荧1,李韵峰1,刘书华1,马俊峰1,黄韧1,张钰1*,王晖2*
(1.广东省实验动物监测所,广省实验动物重点实验室,广州 510663;2.广东药学院中药学院,广州 510006)
【摘要】目的 建立小鼠脓毒症模型并进行评价,为研究脓毒症致病机制和开发抗炎药物提供模型动物。方法 采用盲肠结扎穿孔法(cecal ligation and puncture,CLP)诱导小鼠脓毒症,通过动物生存、术后小鼠载菌量、血常规和血生化指标、细胞因子水平、组织病理变化等方面对模型进行评价。结果 小鼠的死亡率与盲肠结扎部位密切相关,盲肠结扎50%小鼠12 d存活率在40%左右,结扎75%小鼠4 d全部死亡(P<0.01)。与假手术组相比,50%结扎CLP小鼠血液和腹腔中载菌量增加,白细胞下降,差异有显著性(P<0.001)。CLP小鼠肝转氨酶ALT、AST和血清尿素氮BUN水平升高,差异具有显著性(P<0.01),炎症因子IL1a、IL6、IL10、MIP1a、MIP1β、TNFa水平升高。手术后48 h小鼠的肝和肺出现明显组织病理损伤。结论 小鼠CLP模型具有典型的脓毒症病理特征,为后期研究抗炎药物的筛选提供了较好的动物模型。
【关键词】脓毒症;盲肠结扎穿孔;小鼠模型;炎症反应;感染
脓毒症(sepsis)是由微生物入侵机体感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)。临床常见于手术、创伤及免疫力低下等状况,细菌进入血液循环并在其中生长繁殖、产生毒素而引起的全身性严重感染。如果感染得不到有效控制,可进一步发展为脓毒症休克(septic shock)和多器官功能衰竭(multiple organ dysfunction syndrome,MODS)[1],脓毒症的死亡率高达30%~50%[2],但其致病的病理生理机制还不完全清楚,至今没有有效的药物用于脓毒症的治疗,因此,建立脓毒症动物模型,对脓毒症致病机制研究和开展抗炎药物筛选工作具有重要意义。
过去对脓毒症做了大量研究,其病理机理研究进展得益于多种动物模型,目前已有不同种属和诱导方法的脓毒症动物模型[3-6],其中小鼠CLP模型因动物价廉易得,操作简单等优点被广泛应用,但目前该模型尚缺乏标准化的操作规范及评价指标,本研究将利用CLP建立小鼠脓毒症模型,通过评价小鼠生存率、载菌量、血常规和血生化变化、肝肾损伤指标、炎症因子水平、组织病理损伤等指标,对CLP诱导脓毒症的致病机制进行研究,为后期开展抗炎药物筛选提供技术支撑。
1 材料与方法
1.1 实验动物
SPF级雄性C57BL/6小鼠75只,8~10周龄,体重25~29 g,由广东省医学实验动物中心提供【SCXK(粤)2013-0002】,小鼠手术及组织取材在广东省实验动物监测所屏障动物实验设施内进行【SYXK(粤)2012-0122】。
1.2 材料和仪器
异氟烷(深圳市瑞沃德生物科技有限公司),盐酸曲马多注射液(德国格兰泰有限公司),胰蛋白酶血平板(广州市迪景微生物科技有限公司),EDTAK2抗凝管(广州健福医药科技有限公司),Luminex多因子检测试剂盒(Merck),呼吸麻醉机(Matrx型,美国),生化培养箱(Blue Pard,中国),血细胞仪(XT2000iV型,日本),血生化仪(日立7020型,日本),Luminex仪(MAGPIX型,德国)
1.3 实验动物分组及模型的建立
小鼠随机分3组,假手术组10只,50%和75%盲肠结扎组各20只,用于建模并统计生存率;假手术组10只,50%盲肠结扎组15只用于模型评价。
手术采用异氟烷呼吸麻醉,待小鼠麻醉后,剃去小鼠腹部被毛,75%酒精消毒小鼠腹部皮肤,沿腹中线位置剪开1~2 cm开口,分离表皮和肌层,找到盲肠,小心分离盲肠,避免伤害肠系膜血管。在盲肠长度1/2或3/4的位置用3号线结扎,结扎后使用8号针头在盲肠盲端以上约0.5 cm处横穿扎孔,用针头来回贯穿两次,从针孔挤出少量肠内容物,将盲肠放回腹腔,尽量避免肠内容物粘附在手术切口。逐层缝合肌肉层和皮肤。术后给予每只小鼠皮下注射1 mL 37℃预热的生理盐水补充液体,按体重10 mg/ kg皮下注射盐酸曲马多作为止痛剂,在手术后48 h内每12 h注射一次。假手术组除不进行盲肠结扎和穿孔外,其余操作同手术组。为避免小鼠时间节律对手术的影响,每次手术均选择在下午2点进行,每只小鼠手术时间尽量维持在10 min之内。
1.4 载菌量检测
在术后16 h和48 h,眼球放血,EDTA抗凝管收集血液。用3.5 mL无菌生理盐水灌洗小鼠腹腔,采集腹腔灌洗液,将采集的血液和腹腔液倍比稀释,均匀涂布在胰蛋白酶血平板上,37℃恒温培养箱进行培养,24 h后计数平板上菌落数。
1.5 血常规和生化指标测定
采集术后16 h和48 h小鼠血液,血细胞仪进行血常规检测,考察白细胞及中性粒细胞、单核细胞、淋巴细胞数目变化。血液离心,取血浆,血生化仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清尿素氮(BUN)水平。剩余血浆放于-80℃保存备用。
1.6 细胞因子检测
收集CLP造模后16 h和48 h血浆,利用Luminex液相芯片技术检测细胞因子表达,所用试剂和方法按照说明书操作。检测GM-CSF、INF-γ、IL-1a、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12、IL-15、IL-17、MIP-1a、MIP-1β、MIP-2表达水平。
1.7 组织病理检测
CLP造模48 h后,颈椎脱臼处死小鼠,采集小鼠肝和肺,4%中性甲醛溶液固定,经组织脱水、石蜡包埋处理制作石蜡标本切片,HE染色,在光学显微镜下观察组织病变情况。
1.8 统计学分析
采用spss19.0软件进行数据分析,生存统计使用Log-rank(Mantel-Cox)检验,组间数值差异比较使用t检验,作图使用GraphPad Prism 6.0软件。P <0.05认为有统计学意义。
2 结果
2.1 CLP术后小鼠一般观察
CLP术后小鼠精神萎靡,活动减少,行动迟缓,背部毛发竖立,眼睑部出现粘稠分泌物,小鼠肛门处有粪便粘连,尿液浑浊。对死亡小鼠解剖可见腹腔充满浑浊的渗出液,肠道黏连。5 d后存活小鼠状态开始好转。假手术组小鼠术后苏醒即恢复正常状态。
2.2 CLP小鼠生存率
观察不同盲肠结扎部位小鼠生存状况并记录死亡时间。如图1所示,大部分小鼠死亡发生在手术后5 d内。小鼠生存率与盲肠结扎长度密切相关,75%盲肠结扎小鼠4 d全部死亡,50%盲肠结扎小鼠12 d存活率约40%,假手术小鼠全部存活。因75%盲肠结扎小鼠病情发展过快,不利于进行模型评价,在后续实验中选择50%盲肠结扎作为手术模型。
2.3 CLP术后小鼠腹腔和血液载菌量
如图2所示,CLP术后16 h和48 h CLP模型组小鼠腹腔和血液中均检测到细菌,随时间变化,腹腔中菌量逐渐增加,血液中菌量逐渐减少,表明肠菌从穿孔部位持续释放到腹腔中,菌丛由腹膜进入血液循环,免疫系统被激活并随时间延长免疫清除速率增加。假手术组小鼠腹腔和血液中未检测到细菌。
2.4 CLP术后小鼠血常规和血生化指标检测
对CLP术后16 h和48 h小鼠进行血常规检测,CLP组小鼠与假手术组相比,白细胞明显减少(P<0.001),中性粒细胞、淋巴细胞和单核细胞也有不同程度下降(图3),表示小鼠机体免疫系统受到抑制。术后48 h,白细胞及淋巴细胞、中性粒细胞和单核细胞仍维持较低水平。
对CLP术后16 h和48 h小鼠进行血生化检测,相比假手术组,ALT、AST和BUN均有显著性升高(P<0.01),手术组48 h各项指标仍维持较高水平(图4)。
2.5 CLP术后小鼠细胞因子水平
对CLP术后16 h和48 h小鼠进行细胞因子GM-CSF、INF-γ、IL-1a、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-12、IL-15、IL-17、MIP-1a、MIP-1β、MIP-2检测。在术后16 h、48 h与假手术组相比,促炎因子IL-1a、IL-6、TNFa出现明显升高,其他促炎因子GMCSF、INF-γ、IL-1β、IL-2、IL-12、IL-17未见明显升高(未列出);抑炎因子IL-10出现明显升高,其他抑炎因子IL-4、IL-15未见明显变化(未列出);趋化因子MIP1a、MIP1β和MIP-2出现明显升高(图5)。术后48 h,细胞因子仍然维持较高水平。
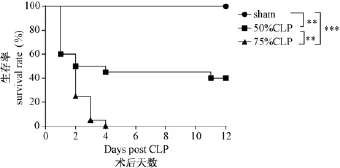
图1 小鼠不同盲肠结扎位置生存曲线Note.Sham:sham operated group(n=10);50%CLP:Ligation of 50%of the cecum group(n=20);75%CLP:Ligation of 75%of the cecum group(n=20).**:P<0.01;***:P<0.001.Fig.1 Survival curves of the mice with cecal ligation at different sites.
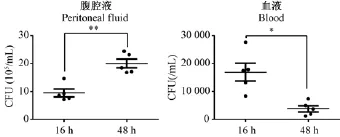
图2 小鼠CLP术后16 h和48 h血液和腹腔载菌量变化Note.Post CLP 16 h group compared with the 48 h group,*P<0.05;**P<0.01.Fig.2 Bacterial load in the mouse peritoneal fluid and blood at 16 and 48 h post CLP
2.6 CLP小鼠病理变化
如图6所示,对照假手术组小鼠,组织病理可见小鼠CLP术后48 h肝有大量空泡脂肪样变性,肝细胞肿胀并有炎性细胞浸润。肺组织毛细血管充血,肺间隔增厚,部分肺泡组织结构被破坏,炎细胞浸润。
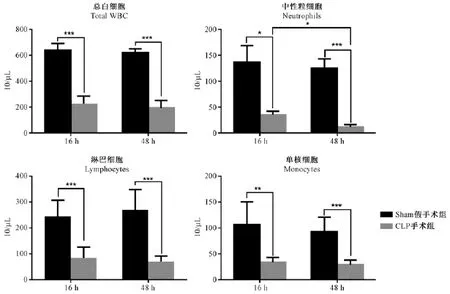
图3 小鼠CLP术后16 h和48 h各类白细胞水平Note.Post CLP 16 h and 48 h groups compare with the sham group,*P<0.05;**P<0.01;***P<0.001.Fig.3 Leukocyte counts in the mice at 16 and 48 h post CLP
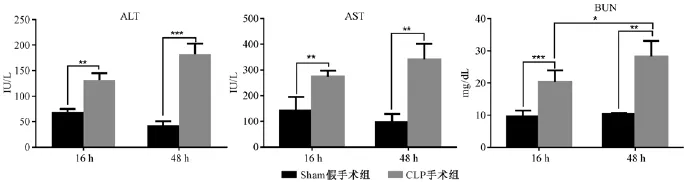
图4 小鼠CLP术后16 h和48 h血生化水平Note.Post CLP 16 h and 48 h group compared with the sham group,*P<0.05;**P<0.01;***P<0.001.Fig.4 Blood biochemical parameters of the mice at 16 and 48 h post CLP
3 讨论
脓毒症及其引起的脓毒症休克和多器官衰竭病情凶险,死亡率高,是因感染住院病人死亡的主要原因之一[7],也是科学家和临床医生共同的挑战。机体任何部位的感染均可引起脓毒症,脓毒症涉及到全身多系统复杂的网络效应,包括炎症反应、免疫功能紊乱、凝血功能障碍、内皮损伤、多器官损伤和休克等[8],其发病机理目前尚不明了,建立稳定性高、重复好的动物模型是研究脓毒症发病机制和筛选评价治疗药物的重要环节。
目前建立脓毒症动物模型的方法主要有:腹腔或静脉注射外源性内毒素或脂多糖;静脉注射单一活菌或混合菌丛;破坏宿主内源性屏障造成内源菌丛移位引发感染[9]。内毒素血症或菌血症模型可以人为精确控制感染剂量,稳定性和重复性好,然而从脓毒症临床发病的角度看,患者一般体内存在感染病灶,感染灶持续性地释放病菌和内毒素,从而引起全身炎症反应和循环、代谢状态的改变。短暂一过性的输入内毒素或菌丛可引起动物快速耐受或死亡,不能很好地模拟临床特征。小鼠CLP脓毒症模型通过破坏肠道屏障,引起肠内菌丛持续性弥漫释放,模拟临床阑尾炎或憩室炎穿孔导致腹膜感染而引起的脓毒症,病情非一过性,较注射LPS或活菌的诱导方法具有更好的临床相关性。

图5 小鼠CLP术后16 h和48 h细胞因子水平Note.Post CLP 16 h and 48 h groups compared with the sham group,*P<0.05.Fig.5 Cytokine levels of the mice at 16 and 48 h post CLP
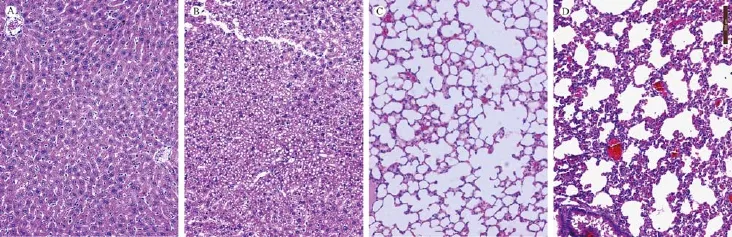
图6 小鼠CLP术后48 h肝、肺组织病理学变化Note.A.The normal liver of a sham-operated mouse.B.The hepatic damages of a CLP mouse. C.The normal lung of a sham-operated mouse.D.The lung damages of a CLP mouse.Fig.6 Pathologial changes in the mouse liver and lung at 48 h post CLP
若仅以感染加上SIRS反应作为脓毒症诊断指标过于敏感,临床上患者需要有明确感染或可疑感染加上以下两者或两者以上的症状作为脓毒症指标[10]:①体温高于38.5℃或低于35℃;②心率大于90次/分钟;③呼吸频率大于20次/分钟或CO2分压小于32 mmHg;④白细胞增多(大于12×109/L)或白细胞减少(少于4×109/L)或白细胞正常但不成熟白细胞大于10%。除此之外,韦志炜[11]报道动脉乳酸水平是重症脓毒症严重程度的一个良好指标。许娜娜等[12]报道C反应蛋白(CRP)、降钙素原(PCT)、细胞因子和凝血系统标志物等指标可作为脓毒症的生物标志物。小鼠CLP模型能较好地模拟脓毒症的病理过程,模型动物术后出现寒颤、软弱无力,肝肾损伤因子升高,多种炎症因子水平升高。血中内毒素检出率及细菌培养阳性率高,动物体温下降,白细胞降低以及血流动力学早期高排低阻,晚期低排高阻的特征也与临床相仿[13]。小鼠从手术到死亡经历数天时间,可以进行实验研究。
脓毒症发病早期过强的炎症反应被认为是导致患者病情恶化和不良预后的关键因素[14]。TNF-a、IL-1和IL-6是三种主要的促炎因子,过强的炎症反应如果得不到控制会造成“细胞因子风暴”并引起促炎和抗炎失衡[15],免疫细胞出现大量凋亡,抑炎因子IL-10表达增加,诱发代偿性抗炎反应综合征(CARS)[16],CARS限制了急性炎症损伤,但造成“免疫麻痹”状态,使病原不能被彻底清除,并容易引起二次感染[17]。单纯针对炎症因子的抗炎治疗未能有效提高CLP模型动物和临床患者的生存率[18],提示脓毒症免疫紊乱机制十分复杂。从本研究可以看出,CLP诱导的小鼠脓毒症模型从结扎的盲肠持续地释放病原,引起多菌丛的混合感染,促炎因子IL1a、IL6、TNFa和抑炎因子IL-10明显升高,模型很好地模拟了人脓毒血症SIRS与CARS反应症状。
综上所述,CLP小鼠脓毒症模型操作简单,稳定性和重复性好,较好地模拟了临床脓毒症的病理过程,方便推广应用。模型制作中,盲肠结扎长度和穿孔大小被认为是影响CLP模型小鼠生存率的关键因素[19],盲肠结扎长度代表感染菌量的多少,盲肠穿孔大小代表菌丛流出的快慢。本研究提供了盲肠结扎50%小鼠的模型指标特征,与对照相比,模型指标具有明显的差异变化,是进行脓毒症致病机制研究和抗炎药物筛选较好的动物模型。
参考文献
[1] Sun SY,Liu YH,Chen YG.Progress in diagnosis and treatment of sepsis[J].Med Recap.2013,19(3):499-501.
[2] Angus DC,Linde Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:analysis of incidence,outcome,and associated costs of care[J].Crit Care Med.2001,29(7):1303-1310.
[3] Schabbauer G.Polymicrobial sepsis models:CLP versus CASP [J].Drug Discov Today Dis Models.2012,9(1):17-21.
[4] Buras JA,Holzmann B,Sitkovsky M.Animal models of sepsis:setting the stage[J].Nat Rev Drug Discov.2005,4(10):854 -865.
[5] Kieslichova E,Rocen M,Merta D,et al.The effect of immunosuppression on manifestations of sepsis in an animal model of cecal ligation and puncture[J].Transplant Proc.2013,45(2):770-777.
[6] 李守明,刘志勇,李岚,等.NF-κB活化阻断剂对盲肠结扎穿刺所致豚鼠急性肺损伤的预防与治疗[J].中国比较医学杂志.2006,16(2):89-92.
[7] Uhle F,Lichtenstern C,Brenner T,et al.Pathophysiology of sepsis [J].Anas Intens Notfa Schmer.2015,50(2):114-122.
[8] Bosmann M,Ward PA.The inflammatory response in sepsis [J].Trends Immunol.2013,34(3):129-136.
[9] Doi K,Leelahavanichkul A,Yuen PS,et al.Animal models of sepsis and sepsis-induced kidney injury[J].J Clin Invest. 2009,119(10):2868-2878.
[10] Iskander KN,Osuchowski MF,Stearns-Kurosawa DJ,et al. Sepsis:multiple abnormalities,heterogeneous responses,and evolving understanding[J].Physiol Rev.2013,93(3):1247-1288.
[11] 韦志炜.重症脓毒症患者动态监测血乳酸的预后价值 [J].中国医药导报.2011,8(30):96-97.
[12] 许娜娜,李守霞.脓毒症诊断和预后的生物标志物研究进展[J].中国医药导报.2014,11(30):162-164.
[13] Tao W,Deyo DJ,Traber DL,et al.Hemodynamic and cardiac contractile function during sepsis caused by cecal ligation and puncture in mice[J].Shock.2004,21(1):31-37.
[14] Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc.2009,4(1):31-36.
[15] Harrison C.Sepsis:calming the cytokine storm[J].Nat Rev Drug Discov.2010,9(5):360-361.
[16] van der Poll T,Meijers JC.Systemic inflammatory response syndrome and compensatory anti-inflammatory response syndrome in sepsis[J].J Innate Immun.2010,2(5):379-380.
[17] Delano MJ,Thayer T,Gabrilovich S,et al.Sepsis induces early alterations in innate immunity that impact mortality to secondary infection[J].J Immunol.2011,186(1):195-202.
[18] Shubin NJ,Monaghan SF,Ayala A.Anti-inflammatory mechanisms of sepsis[J].Contrib Microbiol.2011,17:108-124.
[19] Cuenca AG,Delano MJ,Kelly-Scumpia KM,et al.Current protocols in immunology:cecal ligation and puncture[J].Curr Protoc Immunol.2010,19(13):1-15.
Establishment and evaluation of a mouse model of sepsis
JING Xi-zhong2,1,JIA Huan-huan1,LUO Ting1,LING Xue-ying1,LI Yun-feng1,LIU Shu-hua1,MA Jun-feng1,HUANG Ren1,ZHANG Yu1*,WANG Hui2*
(1.Guangdong Laboratory Animals Monitoring Institute,Guangdong Key Laboratory of Experimental Animals Guangzhou,510663,China;2.School of Traditional Chinese Medicine,Guangdong Pharmaceutical University,Guangzhou 510006)
【Abstract】Objective The purpose of this study was to establish and evaluate a mouse model of sepsis for studying the mechanism of sepsis and development of anti-inflammatory drugs.Methods The sepsis in mice was induced by cecal ligation and puncture(CLP).The survival rates,microbial load,liver and kidney damages,cytokines and pathological changes were detected to evaluate the mouse models.Results The death of mice was closely related with the ligated sites. The mice with 50%cecal ligation displayed about 40%of 12-day survival rate,however,all the mice with 75%cecum ligation died within 4 days(P<0.01).Compared with the sham surgery group,the mice with 50%cecal ligation had a high microbial load in the blood and abdominal cavity.Leukopenia was also emerged(P<0.001).CLP mice demonstrated elevated levels of serum ALT,AST and BUN(P<0.01).The levels of IL1a,IL6,IL10,MIP1a,MIP1β,and TNFa were increased a lot.The liver and lung showed obvious pathological injury at 48 h post CLP.Conclusions The established mouse model of CLP shows typical characteristics of sepsis and is an ideal tool for further study of anti-inflammatory drugs.
【Key words】Sepsis;CLP;Mouse model;Inflammatory response;Infection
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0158-06
Doi:10.3969/j.issn.1005-4847.2016.02.009
[基金项目]广东省科技计划项目(2015A030302034)。
[作者简介]荆喜中(1989年-),男,硕士,研究方向:中药药理学。E-mail:jingxzh@foxmail.com
[通讯作者]张钰(1970年-),女,研究员,E-mail:Zhangyugzh@hotmail.com;王晖(1964年-),男,教授,E-mail:gdwanghui2006@126.com
Corresponding author:ZHANG Yu,Email:Zhangyugzh@hotmail.com;WANG Hui:gdwanghui2006@126.com
[收稿日期]2015-11-02
