Alb-cre/DTR小鼠可诱导性肝损伤模型的建立
2016-07-15任晓楠任蓉蓉刘雪杨华秦波音周晓辉
任晓楠,任蓉蓉,刘雪,杨华,秦波音,周晓辉
(上海市公共卫生临床中心,上海 201508)
Alb-cre/DTR小鼠可诱导性肝损伤模型的建立
任晓楠,任蓉蓉,刘雪,杨华,秦波音,周晓辉*
(上海市公共卫生临床中心,上海 201508)
【摘要】目的 建立Alb-cre/DTR双转基因小鼠模型并进行相关表型分析,在此基础上建立可诱导性肝损模型,用于肝脏疾病的相关研究。方法 将引进的Alb-cre和DTR小鼠扩繁后,通过杂交的方式获得双转基因小鼠。提取小鼠尾部组织DNA,利用PCR方法进行基因型鉴定。在双转基因小鼠上腹腔注射白喉毒素,之后在不同时间点进行称重、采血,检测血清ALT、AST水平。结果 将Alb-cre和DTR小鼠杂交、筛选后获得了Alb-cre/DTR双转基因小鼠,对该小鼠使用0.625 ng/g剂量的白喉毒素,可使小鼠血清中ALT与AST水平显著升高,解剖小鼠后观察到肝整体变白,HE染色结果显示肝细胞明显坏死。结论 成功建立可诱导特异性肝损伤小鼠模型。
【关键词】Alb-cre;DTR;转基因;特异性肝损伤;小鼠
肝疾病是对人类威胁最大的疾病之一[1-2],除病毒性肝炎外[3-4],肝脏疾病中肝硬化、肝癌等危害也相当严重;肝脏移植手术对于解决肝系统疾病和肝代谢紊乱等来说是一种非常重要的手段[5],但是肝移植手术仍然面临很多尚未解决的问题,需要更多的相关研究来提高移植后肝细胞的再生和增殖问题。与肝脏的移植相比,肝细胞的移植更具可行性[6],所需费用也较小。
建立肝损伤动物模型是研究肝细胞移植和再生的关键性技术[7]。基于上述研究背景,研究者利用Cre-loxp条件性敲除系统控制转基因表达的技术,将白喉毒素受体基因特定表达于小鼠肝细胞,构建了Alb-cre/DTR小鼠。目前基于Cre-loxp条件性敲除系统的应用非常多,但是通过该技术使用白喉毒素诱导肝损伤的动物模型还未见相关报道。研究者构建的模型即可通过注射白喉毒素实现可控性、诱导性肝损的发生,是一种新型的肝损模型。
1 材料与方法
1.1 实验动物
B6.Cg-Tg(Alb-cre)21Mgn/J小鼠(以下简称Alb-cre小鼠)引自美国 Jackson实验室,pCAGSTOP-DTR-2A-EGFP小鼠(以下简称DTR小鼠)引自北京百奥赛图基因生物技术有限公司。遗传背景均系C57BL/6小鼠。
1.2 小鼠的饲养和繁殖
按照SPF级动物饲养标准在上海市公共卫生临床中心实验动物中心[SYXK(沪)2015-0008]进行饲养。室内温度20~25℃,相对湿度50% ~60%,每日光照12 h,小鼠饲料、饮水、垫料均经高温高压灭菌处理。将引进的Alb-cre和DTR小鼠分别繁殖扩群后,采用公∶母=1∶1的同居方式进行繁殖,母鼠妊娠后单笼饲养。产生F1代杂交小鼠后在幼仔21日龄左右离乳,剪脚趾标记,剪鼠尾待检测基因型。
1.3 主要试剂
动物组织基因组小量提取试剂盒(DK611-02)和2×Taq PCR Master mix(PT102-02)购自上海莱枫生物科技有限公司,琼脂糖和DNA marker购自北京全式金生物生物技术有限公司,白喉毒素购自Sigma公司。
1.4 小鼠的基因型鉴定
1.4.1 小鼠尾部基因组DNA提取
剪小鼠尾0.5~1 cm置入EP管中,按照上海莱枫生物公司的动物组织DNA提取试剂盒的说明书进行DNA抽提。
1.4.2 小鼠基因组DNA的PCR扩增反应(Alb-cre 和DTR定型用引物如表1)
(1)Alb-cre/DTR小鼠Alb-cre基因的PCR反应体系
下列反应物构成25 μL的反应体系:2×PCR Master Mix 12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,模板DNA 2 μL,加ddH2O 8.5 μL,共25 μL。PCR反应条件:预变性95℃ 5 min;变性95℃30 s;退火62℃30 s;延伸72℃30 s;共30个循环,最后再延伸72℃10 min,之后10℃保存。
(2)Alb-cre/DTR小鼠DTR基因的PCR反应体系
下列反应物构成25 μL的反应体系:2×PCR master Mix 12.5 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,模板DNA 2 μL,加ddH2O 8.5 μL,共25 μL。WT rosa-GT PCR反应条件:预变性95℃ 5 min;变性95℃30 s;退火62℃ 35 s;延伸72℃ 35 s;共35个循环,最后再延伸72℃ 10 min,之后10℃保存。Mutant EGFP PCR反应条件:预变性95℃ 5 min;变性95℃30 s;退火62℃ 20 s;延伸72℃ 20 s;共35个循环,最后再延伸72℃ 10 min,之后10℃保存。
1.4.3 琼脂糖凝胶电泳及结果分析
PCR之后通过琼脂糖凝胶电泳进行鉴定。制备1%琼脂糖凝胶,取PCR反应终产物10 μL进行电泳,120 V,20 min。电泳后使用凝胶成像系统进行电泳图片分析。鼠尾琼脂糖凝胶电泳基因型片段为:鉴定Alb-cre基因,含有该基因的片段大小为275 bp,野生型则没有相应片段;鉴定DTR,野生型为Rosa-GT引物对扩增片段,大小为469 bp,纯合子为DTR/EGFP引物对扩增片段,大小为234 bp,杂合子为469 bp和234 bp,根据条带大小鉴别含有双基因的小鼠。
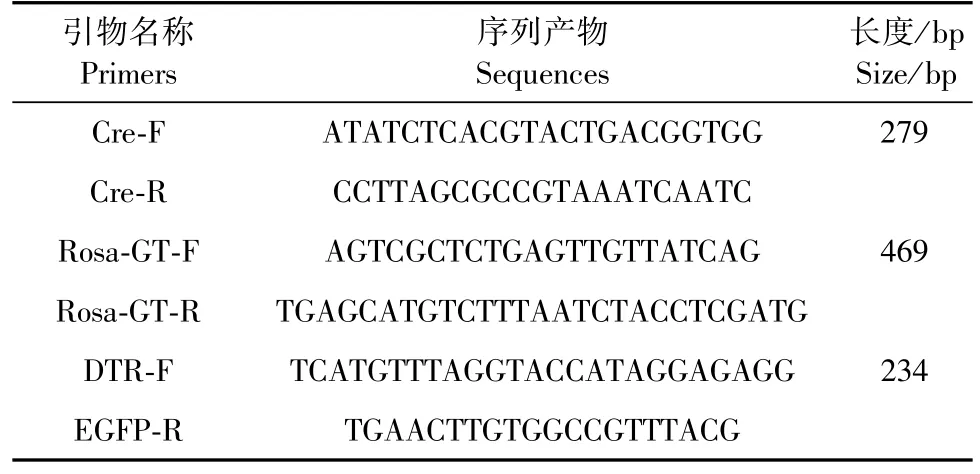
表1 Alb-cre/DTR小鼠基因型鉴定PCR引物序列Tab.1 The PCR primers and their sequences
1.5 特异性肝损伤小鼠模型的建立
取SPF级Alb-cre/DTR小鼠(含有cre、DTR杂合)和C57BL/6小鼠(购自上海斯莱克实验动物中心)各3只,9~10周龄,雄性,于实验前采血,分离血清,检测造模前小鼠本底ALT、AST值,之后称取体重,将0.625 ng/g小鼠体重剂量的白喉毒素溶于200 μL的PBS溶液中,通过腹腔注射的方式造模;分别于造模后第1、2、3、4、7、8、9天监测小鼠体重并采血,全血标本于室温静置1 h后600 r/min离心15 min分离血清,用于ALT与AST指标的检测,实验第四天时自然死亡小鼠解剖取肝进行大体观察,留取肝4%多聚甲醛固定,石蜡包埋,HE染色,观察肝病理组织学改变。
1.6 统计学方法
数据均以均值±标准差表示,两组间均值的统计比较实用非配对t检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 Alb-cre/DTR小鼠Alb-cre基因型鉴定结果
通过PCR检测Alb-cre/DTR小鼠的Alb-cre基因型,含有Alb-cre基因的小鼠在279 bp有条带,野生型在相应位置则没有条带(图1)。

图1 Alb-cre基因型鉴定结果Note.Lanes 1,2 and 4 were Alb-cre mice;Lanes 3 and 5 were wild type mice.Fig.1 PCR identification of Alb-cre gene
2.2 Alb-cre/DTR小鼠DTR基因型鉴定结果
通过PCR检测Alb-cre/DTR小鼠的DTR基因型,野生型为469 bp,纯合子只有234 bp一条带,杂合子有469 bp和234 bp两条带(图2A和2B)。
2.3 肝损伤表型的建立
2.3.1 小鼠体重变化的比较
造模后,Alb-cre/DTR小鼠的体重开始下降,第4天降至最低,只有原有体重的(87.89%± 0.8822),C57BL/6小鼠为(100.3% ±0.4490),两者差异有显著性(P<0.001)。之后Alb-cre/DTR小鼠体重逐渐恢复,但一直没有超过C57BL/6小鼠,C57BL/6小鼠体重一直平稳上升(图3)。第0 ~4天小鼠只数为3只,第7~9天小鼠只数为2只(第4天Alb-cre/DTR小鼠自然死亡,同时处死1只C57BL/6小鼠作为对照)。
2.3.2 小鼠谷丙转氨酶(ALT)值变化
腹腔注射白喉毒素后,Alb-cre/DTR小鼠的血清ALT值与C57BL/6小鼠相比显著升高,在造模后的第2天达到峰值,高达(1419±455.7)IU/mL,C57BL/6小鼠为(36.67±7.667)IU/mL,两者差异有显著性(P<0.05)。之后Alb-cre/DTR小鼠ALT值降低,第4天又再次升高,为(1117±3.0)IU/ mL,且有一只小鼠肝损严重出现死亡,对照组小鼠仅为(37.0±13.2)IU/mL,两者差异有显著性(P<0.001)。之后Alb-cre/DTR小鼠ALT值又再次降低(图4)。
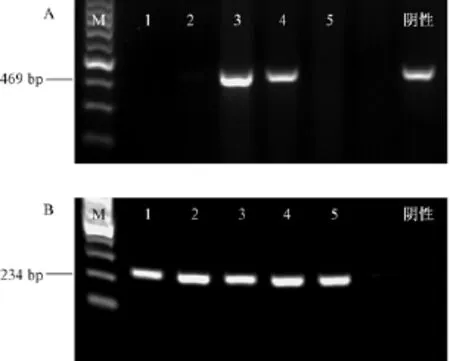
图2 DTR基因型鉴定结果Note.Note:Lanes 1,2 and 5 were DTR homozygous mice;Lanes 3 and 4 were DTR heterozygous mice.Fig.2 PCR identification of DTR gene

图3 小鼠体重变化曲线Note.Compared with the C57BL/6 mouse,***P<0.001.Fig.3 Changes of body weight in the mice
2.3.3 小鼠谷草转氨酶(AST)值变化
Alb-cre/DTR小鼠的血清AST值与C57BL/6小鼠相比显著升高,趋势与ALT值一致。在造模后的第2天达到峰值,高达(1260±329.1)IU/mL,C57BL/6小鼠为(84.67±16.13)IU/mL,两者差异有显著性(P<0.05)。之后Alb-cre/DTR小鼠AST值降低,第4天又再次升高,为(1293±98.00)IU/mL,且有一只小鼠肝损严重出现死亡,C57BL/6小鼠仅为(73.33±15.90)IU/mL,两者差异有显著性(P<0.001)。之后Alb-cre/DTR小鼠AST值又再次降低(图5)。
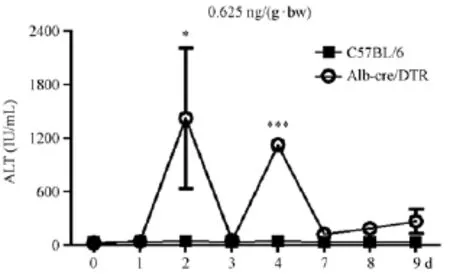
图4 小鼠ALT水平变化曲线Note.Compared with the C57BL/6 mice,*P<0.05,***P<0.001.Fig.4 The curves of ALT changes in the mice
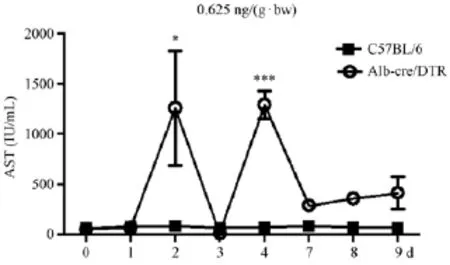
图5 小鼠AST水平变化曲线Note.Compared with C57BL/6 mice,*P<0.05,***P<0.001.Fig.5 The curves of AST changes in the mice
2.3.4 小鼠肝大体观察与病理学监测结果
取Alb-cre/DTR死亡小鼠肝大体观察,其肝脏较C57BL/6正常小鼠明显变白,损伤显著(图6)。
C57BL/6小鼠肝组织结构正常,肝小叶结构完整,肝细胞索与肝血窦排列规则,肝细胞以中央静脉为中心呈放射状排列,未见肝细胞变性及坏死等变化;而Alb-cre/DTR死亡小鼠肝内部出现了肝细胞核碎裂,核溶解消失等病理现象,表现出严重的肝细胞坏死现象(图7)。

图6 小鼠肝大体观察Note.A.C57BL/6 mouse;B.Alb-cre/DTR mouse.Fig.6 Gross appearance of the mouse livers
3 讨论
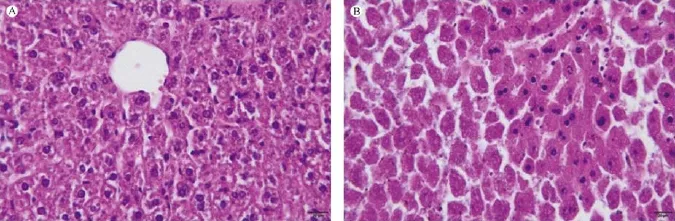
图7 小鼠肝病理图(HE染色,标尺=20 μm)Note.A.C57BL/6 mouse;B.Alb-cre/DTR mouse.Fig.7 Histological changes in the liver tissue of the mice.HE staining,bar=20 μm)
肝移植手术对于解决肝脏系统疾病和肝代谢紊乱等是一种重要的手段,所以肝脏损伤的动物模型是研究肝细胞移植和再生的重要技术平台。然而,缺乏合适的小动物模型很大程度上限制了肝移植技术优化相关的临床前研究[8-9]。就小鼠而言,移植的外源肝细胞要在小鼠体内嵌合、再生成功,其先决条件之一是要求肝本身有损伤,外源植入的肝细胞才有机会克服生存竞争而“殖民”成功。现有的动物模型,例如Alb-uPA小鼠模型曾被应用于肝细胞移植研究中,但是由于uPA小鼠繁殖困难,死亡率高,移植手术需要在小鼠出生2周内完成且手术风险较大等一系列问题而限制了其广泛应用[10]。
研究者将Alb-cre小鼠和DTR小鼠杂交后获得Alb-cre/DTR小鼠,该小鼠是同时表达 Alb-cre和DTR基因的,DTR[11-12]是指条件性转入人白喉毒素受体(diphtheria toxin receptor,DTR)基因,该基因的前端含有转录终止信号(STOP)位点,在STOP位点两侧还有Cre酶识别的LoxP位点。因此,DTR基因表达受Cre/LoxP系统[13]控制,当在特定组织表达有Cre酶时,可通过识别LoxP而将STOP位点切除,从而启动DTR基因的表达。Alb-cre小鼠含有在肝中特异性表达的白蛋白(Alb)基因启动子,可以在肝组织中特异性表达Cre酶,故而Alb-cre/DTR小鼠就可在肝特异性表达人白喉毒素受体(DTR),通过腹腔注射白喉毒素(DT)就可以特异性地诱导Alb-cre/DTR小鼠的肝发生损伤。
研究者通过腹腔注射白喉毒素到该小鼠体内,建立了一种新型的可控性、诱导性肝损小鼠模型。该模型小鼠出现了以下特征,在腹腔注射白喉毒素后第2天ALT与AST值达到高峰,在第3天出现回落,在第4天又重新回到峰值,第3天的回落可能是由于某些代偿性调节机制的作用,但由于白喉毒素可能还未完全清除,所以第4天又重新出现峰值,这与之前肝损模型的大多数研究规律相累似[14-15];同时研究者也希望参照前人研究成果在ALT峰值期间进行相关实验,后续考虑可通过更低剂量多次注射的方式使小鼠处于持续的肝损伤状态,从而更利于相关研究的进行。
该模型由于可以通过调控白喉毒素的注射时间而解决Alb-uPA小鼠手术窗口期短的问题,使手术时间更灵活,可根据实验的具体要求来确定肝损模型的建立时间。此外,其他研究2011年报导建立的FKB-caspase-8调控的可诱导性肝损小鼠模型虽然比较成功,但人肝细胞嵌合效率较低[15],研究者希望该模型的构建可以在一定程度上提高外源人肝细胞的高重建率。综上所述,该模型的建立是肝细胞移植研究、人源化肝脏小鼠模型构建等的重要基础,在肝疾病基础性研究中具有广泛应用前景,并可应用于相关新型药物的筛选研发。
参考文献
[1] Alter MJ.Epidemiology and prevention of hepatitis B[J].Semin Liver Dis,2003,23(1):39-46.
[2]Shepard CW,Finelli L,Alter MJ.Global epidemiology of hepatitis C virus infection[J].Lancet Infect Dis,2005,5(9):558-567.
[3] Guidotti LG,Chisari FV.Immunobiology and pathogenesis of viral hepatitis[J].Annu Rev Pathol,2006,1:23-61.
[4] 丁善龙,王杰,鲁凤民.乙型肝炎研究及我国防治现状[J].传染病信息,2013,26(6):369-372.
[5] Starzl TE.The long reach of liver transplantation[J].Nat Med,2012,18(10):1489-1492.
[6] Forbes SJ,Gupta S,Dhawan A.Cell therapy for liver disease:From liver transplantation to cell factory[J].J Hepatol,2015,62(1S):S157-S169.
[7] de Jong YP,Rice CM,Ploss A.New horizons for studying human hepatotropic infections[J].J Clin Invest,2010,120(3):650-653.
[8] Gilgenkrantz H.Humanized mice for the study of hepatitis C [J].Med Sci(Paris).2011,27(6-7):587-589.
[9] Brezillon N,Brunelle MN,Massinet H,et al.Antiviral activity of bay 41-4109 on hepatitis B virus in humanized Alb-uPA/ SCID mice[J].PLoS One.2011,6(12):e25096.
[10] Sandgren EP,Palmiter RD,Heckel JL,et al.Complete hepatic regeneration after somatic deletion of an albumin plasminogen activator transgene[J].Cell 1991,66:245-256
[11] Buch T,Heppner FL,Tertilt C,et al.A Cre-inducible diphtheria toxin receptor mediates cell lineage ablation after toxin administration[J].Nat Methods,2005,2(6):419-426.
[12] Roberts LM,Ledvina HE,Tuladhar S,et al.Depletion of alveolar macrophages in CD11c diphtheria toxin receptor mice produces an inflammatory response[J].Immun Inflamm Dis,2015,3(2):71-81.
[13] Austin S,Ziese M,Sternberg N.A novel role for site-specific recombination in maintenance of bacterial replicons[J].Cell,1981,25(3):729-736.
[14] Song X,Guo Y,Duo S,et al.A mouse model of inducible liver injury caused by tet-on regulated urokinase for studies of hepatocyte transplantation[J].Am J Pathol.2009,175(5):1975-1983.
[15] Washburn ML,Bility MT,Zhang L,et al.A humanized mouse model to study hepatitis C virus infection,immune response,and liver disease[J].Gastroenterology,2011,140(4):1334-1344.
Establishment of an Alb-cre/DTR mouse model of inducible liver injury
REN Xiao-nan,REN Rong-rong,LIU Xue,YANG Hua,QIN Bo-yin,ZHOU Xiao-hui*
(Shanghai Public Health Clinical Center,Shanghai 201508,China)
【Abstract】Objective To analyze the Alb-cre/DTR mouse phenotype,and establish a model of induced liver damage to serve basic researches of liver diseases.Methods The introduced Alb-cre and DTR mice were crossed to obtain Alb-cre/DTR mice and the genomic DNAs were extracted from the tail tissue of the mice for genotying by PCR.Diphtheria toxin was intraperitoneally(i.p.)injected into the Alb-cre/DTR mice,then the body weights were monitored and the sera were collected for the detection of serum ALT and AST levels.Results By crossing Alb-cre and DTR mice we obtained the Alb-cre and DTR double transgenic mouse.The intraperitoneal injection of diphtheria toxin in a dose of 0.625 ng/g body weight significantly induced liver injury in these mice,as showed by the elevated levels of ALT and AST,the gross appearance of liver damage and the pathological changes such as necrosis in the liver tissue.Conclusions We have obtained a novel mouse strain of Alb-cre/DTR by crossing Alb-cre and DTR mice.Liver damages in those Alb-cre/DTR mice can be induced by injection of diphtheria toxin.This established mouse model of inducible liver damage is a useful platform for the studies of liver damage and recovery,as well as liver transplantation.
【Key words】Alb-cre;DTR;Transgene;Induced liver injury;Mice
【中图分类号】Q95-33
【文献标识码】A
【文章编号】1005-4847(2016)02-0134-05
Doi:10.3969/j.issn.1005-4847.2016.02.005
[基金项目]上海市科技发展基金实验动物研究项目(项目编号12140900300);上海市卫生和计划生育委员会科研课题(项目编号20144Y0073);上海市公共卫生临床中心中心科研课题面上项目(项目编号2014M08)。
[作者简介]任晓楠(1986-),女,硕士,从事肝炎肝病相关动物模型研究,E-mail:renxiaonan66@126.com
[通讯作者]周晓辉(1971-),男,副教授,E-mail:zhouxiaohui@shaphc.org
Corresponding author:ZHOU Xiao-hui,E-mail:zhouxiaohui@shaphc.org
[收稿日期]2015-09-02
