MIF及HIF-1α在上皮性卵巢癌中的表达及其临床意义*
2016-06-20陕西省渭南市中心医院妇产科渭南714000牛力春尚铁燕
陕西省渭南市中心医院妇产科(渭南 714000) 张 博 张 颖 牛力春 尚铁燕 雷 红
MIF及HIF-1α在上皮性卵巢癌中的表达及其临床意义*
陕西省渭南市中心医院妇产科(渭南 714000)张博张颖△▲牛力春△尚铁燕雷红
摘要目的:探讨MIF和HIF-1α在上皮性卵巢癌组织中的表达情况及其与临床病理因素的相关性。方法:采用免疫组织化学SP法检测80例上皮性卵巢癌组织中MIF和HIF-1α的表达情况,分析MIF和HIF-1α表达在上皮性卵巢癌组织中的临床意义。结果:MIF在卵巢癌组织中表达阳性率为68.8%,HIF-1α在卵巢癌组织中表达阳性率为77.5%。MIF和HIF-1α表达均与卵巢癌手术分期、细胞分化程度、淋巴结转移呈正相关(P<0.05),与卵巢癌患者年龄和病理类型无关(P>0.05)。卵巢癌组织中MIF和HIF-1α两者表达之间为正相关(R=0.605,P<0.05)。结论:MIF和HIF-1α表达之间具有协同作用,与卵巢癌病程发生发展相关。
主题词 卵巢肿瘤 巨噬细胞游走抑制因子缺氧诱导因子1,α亚单位 免疫组织化学
巨噬细胞移动抑制因子(MIF)是一个功能强大的多功能蛋白,可由活化的T淋巴细胞分泌,并抑制巨噬细胞迁移,还可促进多种炎性因子分泌从而参与炎症反应和免疫应答调控[1-2]。近年来研究表明,MIF作为细胞因子可促进肿瘤细胞生长增殖、血管形成、增加侵袭能力、抑制抑癌基因p53活性等多种机制参与肿瘤的发生发展;还有研究表明,MIF高表达与乳腺癌、结肠癌、膀胱癌等多种肿瘤的不良预后和淋巴结转移相关[3-4]。有文献报道缺氧诱导因子(HIF-1α)可上调MIF基因表达水平,而MIF过表达可促进HIF-1α基因的稳定性和转录活性,从而正向反馈促进肿瘤细胞在低氧环境下的新生血管生成、侵袭转移等[1-3]。因此,MIF和HIF-1α在肿瘤的发生发展中可能发挥极其重要的作用。本研究通过RT-PCR及免疫组化技术探讨MIF和HIF-1α在上皮性卵巢癌中的表达情况及其相关性,为进一步深入理解卵巢癌发病机制提供实验依据。
对象与方法
1对象收集三二三医院及渭南市中心医院妇产科于2010年1月至2014年12月期间收治的卵巢肿瘤患者80例,年龄31~79岁,平均48.75岁。病理类型包括浆液性囊腺癌38例,粘液性囊腺癌26例,子宫内膜样癌11例,其他类型5例;细胞学分级高分化癌18例,中分化癌32例,低分化癌40例。按国际妇产科联盟(FIGO)2012年新的手术病理分期标准分为I期8例、Ⅱ期12例、Ⅲ期46例、Ⅳ期14例。纳入标准:①初诊卵巢肿瘤患者,未经任何治疗;②手术病理组织HE染色确诊为上皮性卵巢癌;③临床病理资料完整。
2实验试剂小鼠抗人HIF-1α单克隆抗体购自美国Santa公司,兔抗人MIF单克隆抗体购自美国CST公司,SP法免疫组织化学试剂盒购自北京中杉金桥公司。
3实验方法卵巢癌病理组织蜡块常规4 μm切片,分别做HE染色、MIF和HIF-1α免疫组织化学染色,以PBS代替一抗作为阴性对照,以乳腺癌组织作为MIF和HIF-1α的阳性对照。免疫组化操作严格按照SP法免疫组织化学试剂盒说明书进行。
4结果判读首先由病理医生根据HE染色结果进行病理诊断复核,然后MIF和HIF-1α的免疫组化结果由两名病理医生分别独立阅片进行结果判读。细胞核或细胞质见棕色或棕褐色颗粒为免疫组化结果阳性。显微镜高倍视野下随机观察5个视野,按照每个视野中阳性细胞数比例进行评分,阳性细胞<5%记为0,5%~25%为1,26%~50%为2,51%~75%为3,>50%为4,评分为1~4分为阳性。
结果
1卵巢癌病理组织中MIF和HIF-1α的表达情况见附图。MIF在卵巢癌组织中为细胞质表达,阳性率为68.8%(55/80),HIF-1α在卵巢癌组织中主
要为细胞质表达,也可见细胞核表达,阳性率为77.5%(62/80)。
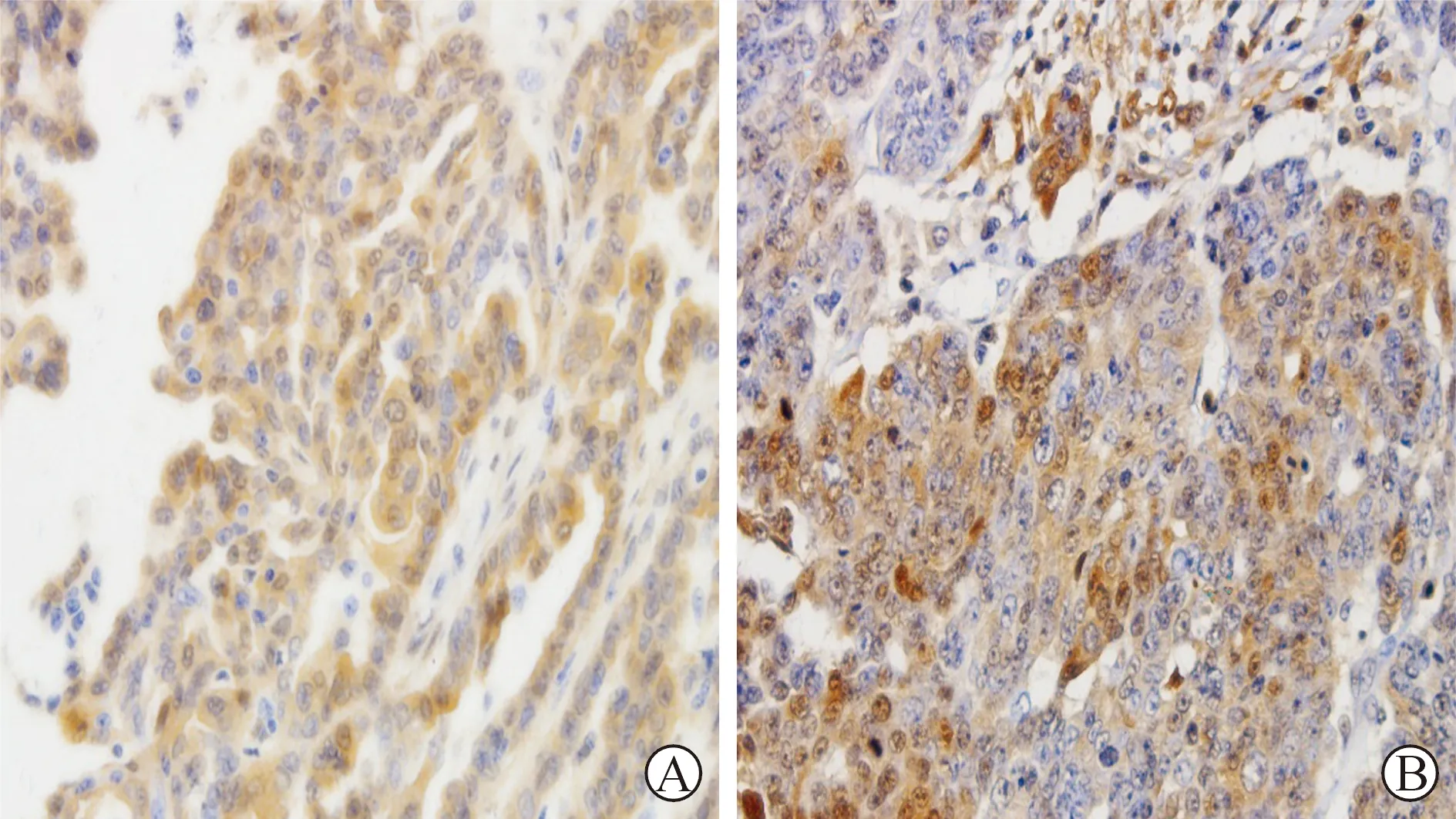
附图 MIF和HIF-1α在卵巢癌组织中表达情况(SP×400)
2MIF和HIF-1α阳性表达与卵巢癌临床病理因素的相关性见表1。中晚期(Ⅲ+Ⅳ)卵巢癌患者中MIF和HIF-1α阳性表达率均显著高于早期(Ⅰ+Ⅱ)卵巢癌患者(P<0.05)。卵巢癌组织中MIF和HIF-1α在高分化、中分化和低分化分组中阳性表达率分别为50.0%,84.4%,72.5%和55.6%,78.1%和92.5%,随着细胞分化程度的降低,MIF和HIF-1α蛋白阳性表达率均逐渐升高,差异有统计学差异(P<0.01)。卵巢癌患者中淋巴结转移阳性的MIF和HIF-1α阳性表达率高于淋巴结阴性的患者,差异有统计学差异(P<0.05)。但卵巢癌组织中MIF和HIF-1α阳性表达均与年龄、病理类型无关(P>0.05)。

表1 MIF和HIF-1α阳性表达与卵巢癌临床病理因素的关系[n(%)]
注:*P<0.05,**P<0.01,#P<0.001
3MIF和HIF-1α蛋白在卵巢癌组织中表达的相关性见表2。80例卵巢癌组织中,MIF和HIF-1α蛋白表达均阳性为52例,MIF和HIF-1α蛋白表达均阴性为15例,采用Spearman等级相关性分析MIF和HIF-1α蛋白在卵巢癌组织中表达的相关性结果表明,两者表达之间为正相关,相关系数R=0.605,具有统计学意义(X2=29.326,P=0.000)。

表2 卵巢癌组织中MIF和HIF-1α表达之间的相关性
讨论
MIF是一种多效能的蛋白,同时具有炎性因子和细胞因子的功能。MIF作为炎性因子,由活化的T淋巴细胞分泌,通过抑制巨噬细胞迁移和促进多种炎性因子分泌,广泛参与机体的病理生理过程,在炎症和免疫反应中发挥重要调控作用。作为细胞因子,MIF在肿瘤细胞生长增殖、血管形成、侵袭转移、细胞分化等方面扮演重要角色[3-4]。因此有学者提出MIF通过诱导炎性因子改变组织微环境从而促进细胞恶变发生和肿瘤细胞转移。这一学说已经得到初步证实。现有的研究表明MIF可能通过以下几种途径在肿瘤细胞发病机制中扮演重要角色:①MIF通过激活MAPK/ERK和PI3K/AKT信号通路促进肿瘤细胞生长增殖;②MIF可上调血管内皮生长因子(VEGF)表达,促进肿瘤新生血管形成;③MIF能增加多种基质金属蛋白酶(MMPs)表达,通过促进细胞外基质降解增加肿瘤细胞浸润转移能力;④MIF通过抑制抑癌基因p53功能发挥抵抗凋亡作用;⑤MIF通过诱导NFκB等炎症因子参与肿瘤细胞的免疫逃逸[5-8]。本研究用免疫组化检测了卵巢癌中MIF蛋白的表达情况。结果表明MIF在卵巢癌组织中表达阳性率为68.8%。卵巢癌组织中FIGO分期较晚、细胞分化程度差、淋巴结转移阳性的患者中MIF表达阳性率较高(P<0.05),但MIF表达与年龄、病理类型无关(P>0.05)。这一结果提示,随着卵巢癌病程的进展,MIF表达水平也逐渐增加,MIF可能在卵巢癌发生发展中发挥重要作用。
由于实体瘤组织处于乏氧状态,因此HIF-1α在肿瘤细胞的适应性生存过程中发挥非常重要的调控作用。HIF-1α主要通过以下途径促进肿瘤发生发展:①通过促进VEGF转录水平和增加VEGF mRNA稳定性上调VEGF的表达水平,从而促进肿瘤组织新生血管形成,有利于肿瘤细胞生长和浸润;②HIF-1α通过上调糖酵解中关键酶表达,促进肿瘤细胞糖酵解,为肿瘤细胞提供能量支持;③HIF-1α通过降低E-cadherin和β-catenin表达,降低细胞间、细胞与基质间粘附性,从而有利于肿瘤细胞迁移和浸润[9-10]。本研究免疫组化结果显示,FIGO分期较晚、细胞分化程度差、淋巴结转移阳性的卵巢癌患者中HIF-1α蛋白表达水平较高,提示HIF-1α表达上调参与卵巢癌发生发展,并与肿瘤浸润和转移相关。
本研究用Spearman相关分析进一步探索了卵巢癌组织中MIF和HIF-1α表达的相关性,结果表明MIF和HIF-1α两者表达之间为正相关(R=0.605,P<0.05),提示MIF和HIF-1α表达在卵巢癌发生发展中起协同作用。文献报道,HIF-1α可上调MIF基因表达水平,而MIF过表达可促进HIF-1α基因的稳定性和转录活性[1-3]。因此我们推测,肿瘤组织中乏氧环境诱导HIF-1α表达,HIF-1α高表达进一步促进MIF表达水平增加。MIF上调一方面发挥炎性因子作用,通过诱导炎性因子改变组织微环境,为肿瘤细胞创造生存条件;另一方面,发挥细胞因子作用,促进肿瘤细胞生长增殖、血管形成、侵袭转移等。同时,MIF又可正反馈调控HIF-1α表达,从而在肿瘤的发生发展中可能发挥极其重要的作用。
综上所述,MIF和HIF-1α表达之间具有协同作用,与卵巢癌病程发生发展相关,但其具体机制还需进一步深入研究。
参考文献
[1]Stojanovic I,Saksida T,Stosic-Grujicic S.Beta cell function:the role of macrophage migration inhibitory factor[J].Immunol Res,2012,52(1-2):81-88.
[2]Al-Abed Y,VanPatten S.MIF as a disease target:ISO-1 as a proof-of-concept therapeutic[J].Future Med Chem,2011,3(1):45-63.
[3]Grieb G,Kim BS,Simons D,etal.MIF and CD74-suitability as clinical biomarkers[J].Mini Rev Med Chem, 2014,14(14):1125-1131.
[4]Babu SN,Chetal G,Kumar S.Macrophage migration inhibitory factor:a potential marker for cancer diagnosis and therapy[J].Asian Pac J cancer P,2012,13(5):1737-1744.
[5]Tawadros T,Alonso F,Jichlinski P,etal.Release of macrophage migration inhibitory factor by neuroendocrine-differentiated LNCaP cells sustains the proliferation and survival of prostate cancer cells[J].Endocr-Relat Cancer,2013,20(1):137-149.
[6] Hussain F,Freissmuth M,Volkel D,etal. Human anti-macrophage migration inhibitory factor antibodies inhibit growth of human prostate cancer cells in vitro and in vivo[J]. Mol Cancer Ther,2013,12(7):1223-1234.
[7]Giannice R,Erreni M,Allavena P,etal.Chemokines mRNA expression in relation to the Macrophage Migration Inhibitory Factor (MIF) mRNA and Vascular Endothelial Growth Factor (VEGF) mRNA expression in the microenvironment of endometrial cancer tissue and normal endometrium:a pilot study[J]. Cytokine,2013,64(2):509-515.
[8] Huang Q,Zhao SL,Tian XY,etal.Increased co-expression of macrophage migration inhibitory factor and matrix metalloproteinase 9 is associated with tumor recurrence of meningioma[J].Int J Med Sci, 2013,10(3):276-285.
[9] Lee SH,Kim DY,Kang YY,etal. Developmental endothelial locus-1 inhibits MIF production through suppression of NF-kappaB in macrophages[J].Int J Mol Med,2014,33(4):919-924.
[10]Chen H,Shen A,Zhang Y,etal.Pien Tze Huang inhibits hypoxia-induced epithelial-mesenchymal transition in human colon carcinoma cells through suppression of the HIF-1 pathway[J].Exp Ther Med,2014,7(5):1237-1242.
(收稿:2015-12-04)
Expression and significance of MIF and HIF-1α in the epithelial ovarian carcinoma
Department of Gynecology and Obstetrics,Weinan Central Hospital(Weinan 714000)
Zhang BoZhang YingNiu Lichunet al
ABSTRACTObjective:To determine the expression of MIF和HIF-1α in the epithelial ovarian carcinoma and explore the correlation between the MIF and HIF-1α and clinicopathologic features. Methods:Using immunohistochemistry SP method to detected the expression of MIF and HIF-1α in 80 cases diagnosed with epithelial ovarian carcinoma in obstetrics and gynecology department.Results:The positive expression rate of MIF and HIF-1α were 68.8% and 77.5% separately. The expression of MIF and HIF-1α were closely related with FIGO stage, differentiation degree and lymph node metastasis(P<0.05). There was a positive correlation between the positive rates of MIF and the positive rates of HIF-1α(R=0.605,P<0.05). Conclusion:MIF and HIF-1α maybe play an important role during tumor progress, invasion and metastasis of epithelial ovarian carcinoma.
KEY WORDSOvarian neoplasmsMacrophage migration-inhibitory factors Hypoxia-inducible factor 1, alpha subunit Immunohistochemistry
【中图分类号】R737.33
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.06.040
*国家自然科学基金资助项目(81302243)
陕西省自然科学基金资助项目(2014JM4157)
解放军第三二三医院培育课题(2012323B14)
△解放军第三二三医院妇产科
▲通讯作者
·临床病理·
