口服法舒地尔治疗EAE对巨噬细胞、T细胞及TLR/NF-B通路的作用研究
2016-06-17于婧文张辉宋国斌李自青尉杰忠刘春云张海飞刘建春王青肖保国李艳花马存根
于婧文 张辉 宋国斌 李自青 尉杰忠 刘春云 张海飞 刘建春王青 肖保国 李艳花 马存根
037009 山西大同大学脑科学研究所(于婧文、张辉、宋国斌、李自青、尉杰忠、刘春云、肖保国、李艳花、马存根);037009 山西大同市第五人民医院神经科(张海飞);030024 山西中医学院“2011”协同创新中心/神经生物学研究中心 山西中医学院(刘建春、王青、马存根);200025 复旦大学华山医院神经病学研究所(肖保国)
于婧文张辉宋国斌李自青尉杰忠刘春云张海飞刘建春王青肖保国李艳花马存根
037009 山西大同大学脑科学研究所(于婧文、张辉、宋国斌、李自青、尉杰忠、刘春云、肖保国、李艳花、马存根);037009 山西大同市第五人民医院神经科(张海飞);030024 山西中医学院“2011”协同创新中心/神经生物学研究中心 山西中医学院(刘建春、王青、马存根);200025 复旦大学华山医院神经病学研究所(肖保国)
摘要:目的探讨口服盐酸法舒地尔(Fasudil)对实验性自身免疫性脑脊髓炎(experimental allergic encephalomyelitis,EAE)小鼠巨噬细胞及TLR/NF-B通路的作用。方法采用小鼠髓鞘少突胶质细胞糖蛋白35-55 肽(myelin oligodendrocyte glycoprotein 35-55 peptide,MOG35-55)诱导C57BL/6小鼠建立EAE模型,将EAE小鼠随机分为EAE模型组和Fasudil治疗组,免疫后第3天给予Fasudil治疗组小鼠Fasudil灌胃干预,直到免疫后第27天,EAE模型组同样处理给予等量生理盐水。光镜观察脊髓组织CD4+T细胞/CD68巨噬细胞表达的变化,Western blot法测定脊髓诱导型一氧化氮合酶(iNOS)、精氨酸酶1(Arg-1)、Toll样受体2(TLR-2)、TLR-4和磷酸化核因子B(p-NF-B)蛋白的表达,ELISA法测定培养72 h脾细胞分泌细胞因子的含量。结果与EAE模型组比较,Fasudil组CD4+T细胞数和CD68巨噬细胞数明显减少(P<0.01),巨噬细胞M1表型iNOS表达减少(P<0.05),M2表型Arg-1表达增加(P<0.01),炎性通路蛋白p-NF-B、TLR-2和TLR-4表达减少(P<0.05),外周细胞炎性因子白细胞介素-6(IL-6)、IL-1β、肿瘤坏死因子α(TNF-α)、干扰素γ(IFN-γ)和IL-17分泌减少(P<0.05),而IL-10分泌增加(P<0.05)。结论口服Fasudil可抑制CD4+T细胞/CD68巨噬细胞的激活,促进巨噬细胞表型M1向M2转化,抑制脊髓组织中p-NF-B、TLR-2和TLR-4的表达,抑制外周免疫细胞炎性因子分泌,而增加IL-10的分泌。
关键词:脑脊髓炎,自身免疫性,实验性;巨噬细胞;TLR/NF-B通路;神经通路
实验性自身免疫性脑脊髓炎(experimental allergic encephalomyelitis,EAE)是中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病的理想动物模型,它与多发性硬化(multiple sclerosis,MS)的临床表现、免疫及病理特征相似[1]。

1材料和方法
1.1实验动物选取C57BL/6雌性小鼠16只,鼠龄8~10周,体重18~20 g,购自北京维通利华公司。
1.2主要试剂及仪器包括小鼠髓鞘少突胶质细胞糖蛋白35-55 肽(MOG35-55,西安联美生物科技有限公司合成)、完全福氏佐剂(Sigma公司)、结核分枝杆菌(TB,BD公司)、百日咳毒素(PTX,ENZO公司)、Bio-RAD凝胶成像分析(Bio-RAD 公司)、BCA蛋白定量试剂盒(欣科中晶生物技术有限公司)、ECL化学发光试剂盒(Millipore公司)、ELISA试剂盒(Peprotech公司)。
1.3方法
1.3.1模型制备及分组:将4 mg MOG35-55肽段溶于0.8 mL生理盐水,4 mg TB溶于0.8 mL 完全福氏佐剂(含0.8 mg TB);将两种溶液用针管混合器等体积充分混合为油包水样乳白色混悬液,取一滴乳剂滴于水上,若乳剂不扩散为合格。将实验小鼠按体重18、19、20 g分层后再随机分入EAE模型组和Fasudil治疗组,每组8只。给予小鼠皮下注射MOG35-55福氏完全佐剂0.1 mL/只,于免疫后当天和48 h后注射PTX 300 ng。免疫后第3天Fasudil治疗组小鼠给予5 mg/mL Fasudil灌胃200 μL(溶剂生理盐水)直到免疫后第27天;EAE模型组以相同方式给予等量生理盐水。模型制备成功的标准为:有EAE临床症状且脊髓病理切片中有大量炎性细胞浸润及髓鞘脱失。免疫后第10天EAE组小鼠开始陆续发病,在第14天进入发病高峰期,发病率达100%。
1.3.2免疫组化:免疫第28天处死动物,两组小鼠各随机选取4只,以4%(质量浓度)多聚甲醛灌流进行体内组织固定,分离脊髓,包埋后行冷冻切片,切片厚10 μm,切片以4%(质量浓度)多聚甲醛固定10 min,PBS洗5 min×3次;分别加抗大鼠一抗CD68(1∶1000)和抗大鼠CD4(1∶1000),4℃ 孵育过夜。次日PBS再次洗3次,分别加 DyLight 488荧光标记的抗大鼠的二抗(1∶1000),室温孵育2 h后,甘油封片,光镜下观察脊髓组织白质区CD68和CD4阳性细胞荧光强度,并用Image pro plus 软件计数小鼠脊髓白质区阳性细胞数,结果取均值。

1.3.4ELISA检测:取两组各4只小鼠脾细胞,研磨制备单细胞悬液,在CO2培养箱中培养72 h后,收集细胞上清液,按照ELISA试剂盒说明书,于492 nm波长测定细胞因子白细胞介素(IL-6)、IL-1β、肿瘤坏死因子α(TNF-α)、IL-10、干扰素γ(IFN-γ)和IL-17吸光度。同时制作标准曲线,测定并计算各细胞因子分泌分泌水平。
1.4统计学处理采用GraphPad Prism5.0进行分析处理,计量资料采用均数±标准差表示,两组间均数比较采用t检验。以P<0.05为差异有统计学意义。
2结果
2.1两组CD4+T细胞和CD68巨噬细胞表达Fasudil治疗组小鼠脊髓CD4+T细胞与CD68巨噬细胞较EAE模型组明显降低(P<0.01)。结果见图1和表1。

表1 两组小鼠脊髓CD4+T细胞与CD68

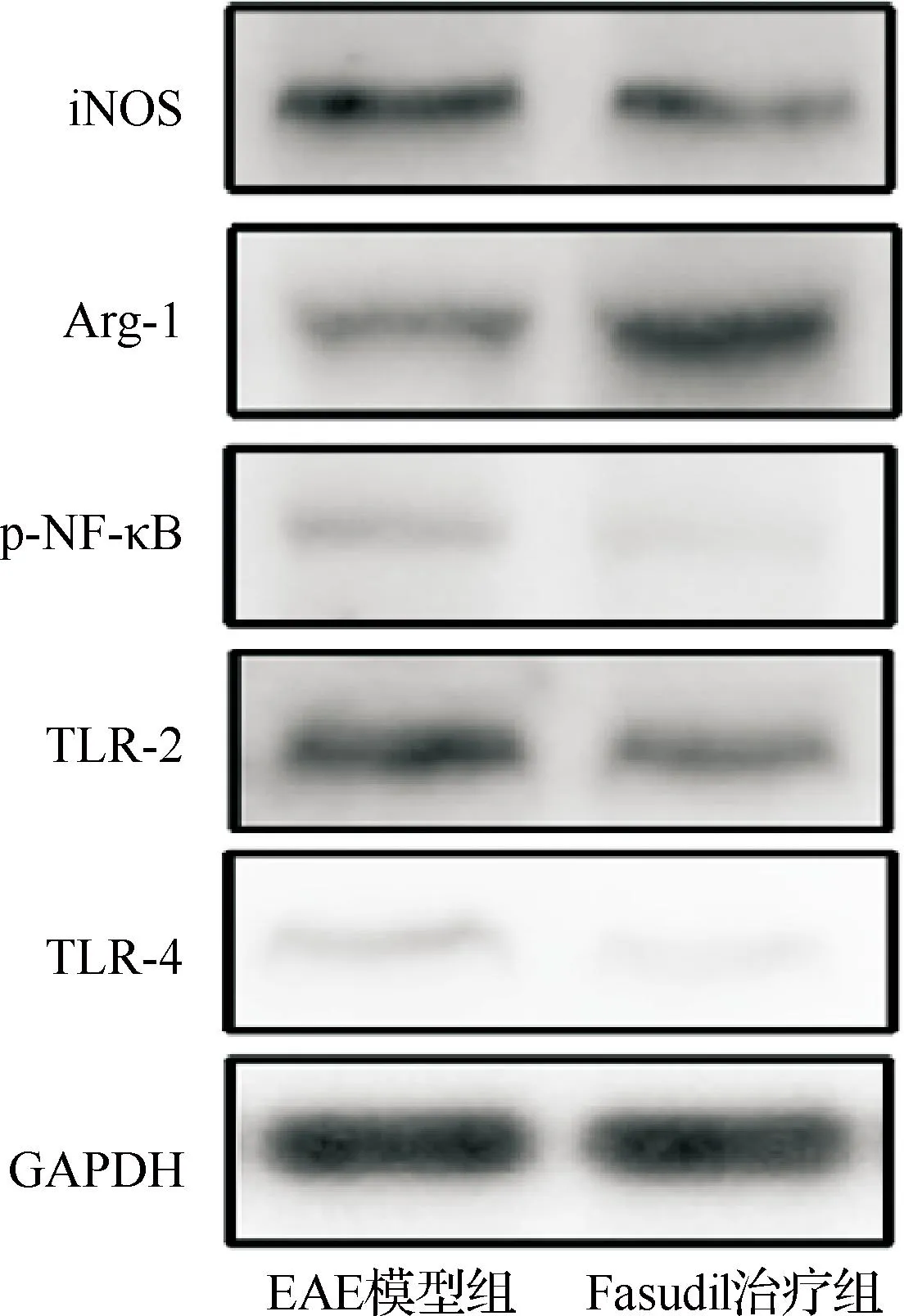
iNOS:诱导型一氧化氮合酶,Arg-1:精氨酸酶1,p-NF-B:磷酸化核因子B,TLR:Toll样受体,表2同;GAPDH:磷酸甘油醛脱氢酶图2 Western blot检测两组小鼠脊髓各种蛋白表达

EAE:实验性自身免疫性脑脊髓炎,表1~3、图2同;右侧图分别为左侧图中方框部分的放大图像图1 两组小鼠脊髓CD4+T细胞和CD68巨噬细胞表达(免疫荧光染色)

组 别iNOS蛋白Arg-1蛋白p-NF-B蛋白TLR-2蛋白TLR-4蛋白EAE模型组0.33±0.090.14±0.040.10±0.020.34±0.040.23±0.03Fasudil治疗组0.19±0.030.39±0.060.07±0.010.25±0.040.14±0.03t值2.506.082.733.133.680P值0.030.000.030.040.012

表3 ELISA检测两组小鼠脾细胞培养上清液中各细胞因子表达水平
注:IL:白细胞介素;TNF-α:肿瘤坏死因子α;TNF-γ:γ干扰素
2.3ELISA检测两组小鼠脾细胞培养上清液细胞因子表达Fasudil治疗组脾细胞培养上清液中细胞因子IL-1β、IL-6、TNF-α、IL-17和IFN-γ水平均低于EAE模型组(P<0.05),而IL-10水平高于EAE模型组(P<0.05)。结果见表3。
3讨论
目前针对MS的治疗仍缺乏经济有效的手段,糖皮质激素多用于MS 急性发作期的治疗,但短期应用对MS长期功能恢复并无明显疗效;环孢素等免疫抑制剂对进展型MS 有一定治疗作用,但长期应用不良反应较大;免疫球蛋白治疗可缩短病程、加速神经功能恢复,但价格昂贵且对多次复发者和进展型MS效果不理想[11-13]。MS属慢性病,上述药物的给药方式多为皮下注射和静脉点滴,长期用药不便。口服给药是临床上常用的给药方式,具有方便安全的优点。
在EAE发病情况下,CD4+T细胞通过血-脑脊液屏障进入CNS,经抗原提呈激活CNS内小胶质细胞,在小鼠发病28 d左右,进入慢性损伤期,小胶质细胞分泌TNF-α、IL-6 、IL-1等致炎性细胞因子,形成炎性微环境,更多的CD4+T细胞和巨噬细胞进入CNS,放大炎性反应,最终导致神经元的变性死亡。而Fasudil可影响炎性细胞向CNS的移行[14]和改善血管内皮细胞的完整性[15]。本研究结果显示,Fasudil组CD4+T细胞浸润较少,外周巨噬细胞CD68进入CNS极少。
Fasudil不仅可抑制炎性细胞浸润,而且可以调节M1和M2型巨噬细胞免疫应答的平衡。巨噬细胞根据其特有的表型和功能不同,分为经典活化M1炎性巨噬细胞,以分泌IL-6、IL-1β、TNF-α、iNOS/CD11b+、CD16/32、iNOS、IL-12或IL-23增加为特征;替代性活化的M2抗炎巨噬细胞以分泌IL-10、Arg-1/CD11b+、CD206、IL-10、CD23或IL-4/13增加为特征。本研究选取iNOS和CD68为CNS M1型巨噬细胞的表型标志,Arg-1为M2型表型标志,结果显示,Fasudil可抑制CNS中iNOS和CD68表达,增加Arg-1表达,促使致炎性的M1型巨噬细胞向抗炎保护性M2型转化,同时抑制外周免疫细胞分泌炎性因子IL-6、IL-1β、TNF-α、IL-17和IFN-γ表达,增加 IL-10表达。


在MS急性期和复发期,TLR2能够促进CNS大量的促炎性因子表达以及巨噬细胞和小胶质细胞表达[17]。TLR4与配体结合后,可导致CNS小胶质细胞过度激活产生炎性因子,损伤神经元。体外实验证明,用丙泊酚或Fasudil干预经过LPS刺激的BV2细胞,其TLR4蛋白表达和炎性因子表达受到抑制,推测Fasudil通过下调TLR4受体表达,从而抑制抗炎性反应因子(如IL-10)的过度释放,发挥对小胶质细胞的神经保护作用[18-19]。这与本研究的结果一致。

参考文献:
[1]Constantinescu CS,Farooqi N,O′Brien K,et al.Experimental autoimmune encephalomyelitis(EAE) as a model for multiple sclerosis(MS)[J].Br J Pharmacol,2011,164(4):1079-1106.
[2]Street CA,Bryan BA.Rho kinase proteins-pleiotropic modulators of cell survival and apoptosis [J].Anticancer Res,2011,31(11):3645-3657.
[3]Guilluy C,Garcia-Mata R,Burridge K.Rho protein crosstalk:another social network? [J].Trends Cell Biol,2011,21(12):718-726.
[4]Yu JZ,Ding J,Ma CG,et al.Therapeutic potential of experimental autoimmune encephalomyelitis by Fasudil,a Rho kinase inhibitor [J].J Neurosci Res,2010,88(8):1664-1672.
[5]Mueller BK,Mack H,Teusch N. Rho kinase,a promising drug target for neurological disorders [J].Nat Rev Drug Discov,2005,4(5):387-398.
[6]Huang XN,Fu J,Wang WZ.The effects of fasudil on the permeability of the rat blood-brain barrier and blood-spinal cord barrier following experimental autoimmune encephalomyelitis [J].J Neuroimmunol,2011,239(1-2):61-67.
[7]Hou SW,Liu CY,Li YH,et al.Fasudil ameliorates disease progression in experimental autoimmune encephalomyelitis,acting possibly through immunomodulation effect [J].CNS Neurosci Ther,2012,18(11):909-917.
[8]Li Q,Huang XJ,He W,et al.Neuroprotective potential of fasudil mesylate in brain ischemia-reperfusion injury of rats [J].Cell Mol Neurobiol,2009,29(2):169-180.
[9]Liu CY,Li YH,Yu JZ,et al.Targeting the shift from M1 to M2 macrophages in experimental autoimmune encephalomyelitis mice treated with Fasudil [J].PLoS One,2013,8(2):e54841.
[10]张辉,张海飞,李艳花,等.口服盐酸法舒地尔治疗小鼠EAE有效性初探[J].中国病理生理杂志,2013,29(11):2060-2065.
[11]Langer-Gould A,Moses HH,Murray TJ.Strategies for managing the side effects of treatments for multiple sclerosis [J].Neurology,2004,63(11 suppl 5):S35-41.
[12]李新,王纪佐.那他珠单抗治疗多发性硬化的循证医学回顾[J].中华神经科杂志,2009,42(6):364.
[13]李蕊,胡学强.多发性硬化的治疗进展[J].实用医院临床杂志,2013,10(3):1-4.
[14]Bennett J,Basivireddy J,Kollar A,et al.Bloodbrain barrier disruption and enhanced vascular permeability in the multiple sclerosis model EAE [J].J Neuroimmunol,2010,229(1-2):180-191.
[15]刘岳婷,侯绍蔚,刘春云,等.法舒地尔通过诱导EAE小鼠Occluding表达抑制其炎性细胞浸润[J].中国神经免疫学和神经病学杂志,2012,19(3):206-210.
[16]Kretschmer K,Apostolou I,Hawiger D,et al.Inducing and expanding regulatory T cell populations by foreign antigen[J].Nat Immunol,2005,6(12):1219-1227.
[17]Andersson A,Covacu R,Sunnemark D,et al.Pivotal advance:HMGB1 expression in active lesions of human and experimental multiple sclerosis [J].J Leukoc Biol,2008,84(5):1248-1255.
[18]Gui B,Su M,Chen J,et al.Neuroprotective effects of pretreatment with propofol in LPS-induced BV-2 microglia cells:role of TLR4 and GSK-3β [J].Inflammation,2012,35(5):1632-1640.
[19]李艳花,杨兴旺,张辉,等.Fasudil 通过TLR4通路抑制脂多糖诱导的小鼠BV-2小胶质细胞TNF-α和IL-1β的表达[J].细胞与分子免疫学杂志,2014,30(1):11-14.
(本文编辑:时秋宽)

YUJingwen,ZHANGHui,SONGGuobin,LIZiqing,YUJiezhong,LIUChunyun,ZHANGHaifei,LIUJianchun,WANGQing,XIAOBaoguo,LIYanhua,MACungen*.
*InstituteofBrainScience,ShanxiDatongUniversity,Datong037009,China;“2011”CollaborativeInnovationCenter/ReaserchCenterofNeurobiology,ShanxiUniversityofTraditionalChineseMedicine,Taiyuan030024,ChinaCorresponding author:MA Cungen,Email:macungen2001@163.com
ABSTRACT:ObjectiveTo explore the effect and mechanism of oral fasudil on macrophages and TLR/NF-B pathway in mice with experimental autoimmune encephalomyelitis(EAE) .MethodsEAE models were induced by myelin oligodendrocyte glycoprotein 35-55 peptide(MOG35-55) in C57BL/6 mice.The models were randomly divided into the EAE group and the fasudil group.Mice in the fasudil group were intragastrically infused with fasudil one time every day from the 3rd day after immunization to the 27th day.Mice in the EAE group were treated with the same dosage of saline.CD4+T cells and CD68 macrophages expressions in the spinal cord tissue were observed by light microscope.The expression of iNOS,Arg-1,TLR -2,TLR-4 and p-NF-B in spinal cord were detected by western blot.The cytokine of splenocyte cells cultured for 72 h were analyzed by ELISA. ResultsThe number of CD4+T cells and CD68 macrophages decreased in the fasudil group(P<0.01).iNOS phenotype of macrophages M1 was inhibited(P<0.05),and the expression of M2 phenotypic Arg-1 increased(P<0.01).The expression of inflammatory signaling pathway proteins including p-NF-B,TLR-2 and TLR-4 reduced(P<0.05).Macrophage inflammatory cytokines including IL-6,IL-1β and TNF-α decreased(P<0.05),and secretion of IL-10 increased(P<0.05),T cells inflammatory cytokine IL-17 and IFN-γ decreased(P<0.05).ConclusionsOral treatment with fasudil inhibits CD4+T cells/CD68 macrophages activation,improves the conversion from macrophage phenotype M1 to M2,and inhibits the expression of p-NF-B,TLR-2 and TLR-4 in spinal cord.Inflammatory cytokines secreted by macrophages and T cells in spleen are inhibited,and the secretion of IL-10 increases.
Key words:encephalomyelitis,autoimmune,experimental;macrophages;TLR/NF-B pathway;neural pathways
doi:10.3969/j.issn.1006-2963.2016.03.003
基金项目:国家自然科学基金2012年面上项目(81272163);山西中医学院“2011”培育计划项目(2011PY-1);山西省国际科技合作项目(2013081058);山西省回国留学人员重点科研资助项目(2014-重点7);大同大学校科研项目(2015Q15)
通讯作者:马存根,Email:macungen2001@163.com
中图分类号:R744.5+1
文献标志码:A
文章编号:1006-2963(2016)03-0172-05
(收稿日期:2015-12-23)
