术前新辅助化疗对局限期小细胞肺癌预后的影响研究
2016-06-16范宜楚汪笑冬迟明友孙大强
范宜楚,汪笑冬,迟明友,孙大强
300070天津市,天津医科大学研究生院(范宜楚,汪笑冬,迟明友);天津市胸科医院胸外科(孙大强)
·论著·
术前新辅助化疗对局限期小细胞肺癌预后的影响研究
范宜楚,汪笑冬,迟明友,孙大强
300070天津市,天津医科大学研究生院(范宜楚,汪笑冬,迟明友);天津市胸科医院胸外科(孙大强)
【摘要】目的评价术前新辅助化疗对局限期小细胞肺癌(LD-SCLC)预后的影响。方法选取1990年1月—2012年12月天津市胸科医院收治的行开胸手术或胸腔镜手术的LD-SCLC患者119例,其中39例患者术前经细胞学或组织学病理诊断为SCLC,作为术前新辅助化疗组(A组);80例患者术前未获得明确病理,作为直接手术组(B组)。A组行2个周期的足叶乙甙加顺铂化疗,每21 d为1个周期,1个月后全面复查进行疗效评估,身体状况可以耐受手术者予以手术切除,术后1个月继续予以足叶乙甙加顺铂方案化疗4个周期。B组直接行手术切除,术后1个月予以足叶乙甙加顺铂方案化疗6个周期。应用Kaplan-Meier方法进行生存分析,Log-rank检验比较生存率,Cox比例风险回归模型分析影响预后的因素。结果119例患者中,不同性别、年龄、吸烟指数、手术方式、肿瘤位置者预后比较,差异均无统计学意义(P>0.05);不同TNM分期、治疗方式者预后比较,差异有统计学意义(P<0.05)。Cox比例风险回归模型结果显示,TNM分期和治疗方式是影响LD-SCLC患者预后的影响因素(P<0.05)。A组中TNM分期Ⅰ期7例,Ⅱ期19例,Ⅲ期13例;B组分别为9、39、32例。Ⅰ期患者中,两组生存率比较,差异无统计学意义(χ2=0.042,P=0.838);Ⅱ期患者中,两组生存率比较,差异无统计学意义(χ2=1.084,P=0.298);Ⅲ期患者中,两组生存率比较,差异有统计学意义(χ2=5.966,P=0.015)。45例Ⅲ期患者中,不同年龄、手术方式、肿瘤位置者预后比较,差异无统计学意义(P>0.05);不同性别、吸烟指数、治疗方式者预后比较,差异有统计学意义(P<0.05)。Cox比例风险回归模型结果显示,治疗方式是影响Ⅲ期患者预后的影响因素(P<0.05)。A组化疗后达到完全缓解(CR)+部分缓解(PR)者26例,稳定(SD)者13例,缓解率为66.7%(26/39)。CR+PR者与SD者生存率比较,差异有统计学意义(χ2=4.309,P=0.038)。A组Ⅲ期者中达到CR+PR 7例,SD 6例,CR+PR者与SD者生存率比较,差异有统计学意义(χ2=4.772,P=0.029)。结论术前新辅助化疗对于Ⅰ期和Ⅱ期LD-SCLC患者预后没有明显影响,而对于Ⅲ期LD-SCLC患者可以提高其术后生存率,并且经过术前新辅助化疗后达到CR+PR的患者生存获益。
【关键词】小细胞肺癌;术前新辅助化疗;预后
范宜楚,汪笑冬,迟明友,等.术前新辅助化疗对局限期小细胞肺癌预后的影响研究[J].中国全科医学,2016,19(14):1653-1658.[www.chinagp.net]
Fan YC, Wang XD,Chi MY,et al.Prognosis of limited-stage small cell lung cancer after preoperative neoadjuvant chemotherapy[J].Chinese General Practice,2016,19(14):1653-1658.
小细胞肺癌(SCLC)占肺癌总数的15%~20%[1],其预后较差主要是因为恶性程度高,生长快,较早出现淋巴结转移和血行播散,但是其对化疗敏感,所以化疗为主的综合治疗是治疗SCLC的总方针。20世纪70—80年代联合化疗加放疗成为SCLC的标准疗法,但远期疗效未提高,5年生存率不超过5%[2]。现在认为,外科切除能根除原发病灶的残存耐药细胞及可能存在的非小细胞肺癌成分或化疗后SCLC转型的非小细胞肺癌组织,并清除纵隔转移淋巴结,降低了局部复发和向远处转移的可能性,所以有外科手术参与的综合治理模式已成为局限期SCLC(LD-SCLC)的标准治疗方法[3]。LD-SCLC究竟行不行术前新辅助化疗?术前新辅助化疗是否使患者的生存获益?这些问题一直没有定论。本研究旨在探索术前新辅助化疗对LD-SCLC的预后效果。
1对象与方法
1.1研究对象选取1990年1月—2012年12月天津市胸科医院收治的经开胸手术或胸腔镜手术的LD-SCLC患者119例,其均行纵隔淋巴结清扫术,术后病理(细胞学和组织学)均证实为SCLC,术前尽量通过痰脱落细胞学检查、纤维支气管镜检查、CT引导下经皮肺穿刺活检术等明确病理,纳入TNM分期Ⅰ、Ⅱ、Ⅲ期患者;并常规行胸部增强CT、腹部CT或彩色超声、颅脑磁共振、全身核素骨扫描等检测,21例患者行PET-CT检查。
1.2分组方法39例患者术前经细胞学或组织学病理诊断为SCLC,作为术前新辅助化疗组(A组),其中痰查瘤细胞病理诊断3例,纤维支气管镜检查(咬检或刷片)病理诊断17例,CT引导下经皮肺穿刺活检诊断19例,所有患者术后病理检查进一步证实为SCLC。80例患者术前未获得明确病理诊断,作为直接手术组(B组),术后病理诊断为SCLC。
1.3治疗方法A组行2个周期的足叶乙甙(江苏恒瑞医药股份有限公司)80 mg·(m2)-1·d-1(d1~3)加顺铂(齐鲁制药有限公司)20 mg·(m2)-1·d-1(d1),每21 d为1个周期,1个月后全面复查,进行疗效评估:(1)经化疗后完全缓解(CR);(2)经化疗后部分缓解(PR);(3)经化疗后原发病灶未明显变化。身体状况可以耐受手术者予以手术切除,术后1个月继续予以足叶乙甙加顺铂方案化疗4个周期。B组直接行手术切除,术后1个月予以足叶乙甙加顺铂方案化疗6个周期。
1.4判定标准根据美国退伍军人医院肺癌研究小组制定的分期标准[4],分为LD和广泛期(ED),肿瘤局限于一侧胸腔或纵隔且能被纳入一个放射治疗野的定义为LD,肿瘤超出LD范围即为ED。对侧纵隔和同侧锁骨上淋巴结转移通常归为LD,对侧肺门和对侧锁骨上淋巴结转移归为ED。患者TNM分期根据2009年UICC第七版肺癌TNM分期标准[5]。治疗效果采用RECIST标准[6]进行评估,即全部病灶消失为CR;基线病灶最大径之和减少30%及以上为PR;基线病灶最大径之和增加20%及以上或出现新发病灶为进展(PD);介于PR和PD之间为稳定(SD)。
1.5随访采用门诊随访、病案查询及电话随访的方式进行病例资料的收集与整理,截止时间为2014-12-01,以患者死亡或截至随访时间为终点。患者生存期定义为从病理确诊或手术日开始至患者死亡或截至随访时间,以月为计量单位。
1.6统计学方法采用SPSS 17.0软件进行统计学分析,采用Kaplan-Meier方法计算生存率并描绘生存曲线,采用Log-rank检验进行生存率比较,采用Cox比例风险回归模型进行多因素生存分析。以P<0.05为差异有统计学意义。
2结果
2.1119例患者预后的临床病理因素单因素分析不同性别、年龄、吸烟指数、手术方式、肿瘤位置者预后比较,差异均无统计学意义(P>0.05);不同TNM分期、治疗方式者预后比较,差异有统计学意义(P<0.05,见表1)。
表1119例患者预后的临床病理因素单因素分析
Table 1Univariate analysis of clinical and pathological prognostic factors for 119 LD-SCLC patients

临床病理因素例数中位生存期(95%CI)(月)5年生存率(%)χ2值P值性别0.0530.817 男8124(17,31)12.4 女3824(14,33)5.3年龄(岁)2.1300.080 <608123(18,28)12.4 ≥603830(18,42)21.0吸烟指数(支年)0.6500.420 ≤4005227(20,34)4.9 >4006723(17,29)4.0TNM分期(期)24.188<0.010 Ⅰ1647(45,49)31.2 Ⅱ5827(21,33)10.2 Ⅲ4512(8,16)2.2治疗方式4.9670.026 术前新辅助化疗3934(24,44)15.4 直接手术8023(18,28)7.5手术方式0.5150.473 肺叶切除6724(18,30)13.4 全肺切除5223(15,31)5.8肿瘤位置0.0560.812 左侧5923(18,38)11.9 右侧6026(21,31)8.3
2.2119例患者预后影响因素的Cox比例风险回归模型分析以患者预后为因变量(赋值:生存=1,死亡=2),以单因素分析结果中有统计学意义的变量即TNM分期(赋值:Ⅰ期=1,Ⅱ期=2,Ⅲ期=3)和治疗方式(赋值:术前新辅助化疗=1,直接手术=2)为自变量,代入Cox比例风险回归模型进行多因素分析,结果显示,TNM分期和治疗方式是LD-SCLC患者预后的影响因素(P<0.05,见表2)。
表2119例患者预后影响因素的Cox比例风险回归模型分析
Table 2Cox proportional hazards regression model analysis on influencing factors for the prognosis of 119 LD-SCLC patients

影响因素βSEWaldχ2值HR(95%CI)P值TNM分期(期)--23.099-<0.001Ⅰ0.6710.3044.8771.957(1.078,3.552)0.027Ⅱ1.3910.31619.3944.020(2.164,7.466)<0.001治疗方式-0.5190.2076.2810.595(0.396,0.893)0.012
注:-表示无此数值
2.3不同TNM分期者治疗方式对预后的影响A组中TNM分期Ⅰ期7例,Ⅱ期19例,Ⅲ期13例;B组分别为9、39、32例。Ⅰ期患者中,两组生存率比较,差异无统计学意义(χ2=0.042,P=0.838,见图1);Ⅱ期患者中,两组生存率比较,差异无统计学意义(χ2=1.084,P=0.298,见图2);Ⅲ期患者中,两组生存率比较,差异有统计学意义(χ2=5.966,P=0.015,见图3)。
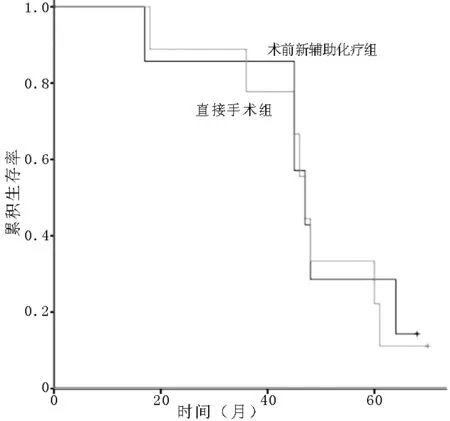
图1 A组与B组Ⅰ期患者生存率比较的生存曲线
Figure 1Survival curves of patients at stage Ⅰ between group A and group B
2.4Ⅲ期患者预后的临床病理因素单因素分析不同年龄、手术方式、肿瘤位置者预后比较,差异无统计学意义(P>0.05);不同性别、吸烟指数、治疗方式者预后比较,差异有统计学意义(P<0.05,见表3)。
2.5Ⅲ期患者预后影响因素的Cox比例风险回归模型分析以患者预后为因变量(赋值:生存=1,死亡=2),以单因素分析中差异有统计学意义的变量即性别(赋值:男=1,女=2)、吸烟指数(赋值:≤400支年=1,>400支年=2)、治疗方式(赋值:术前新辅助化疗=1,直接手术=2)为自变量,纳入Cox比例风险回归模型,结果显示,治疗方式是Ⅲ期患者预后的影响因素(P<0.05,见表4)。
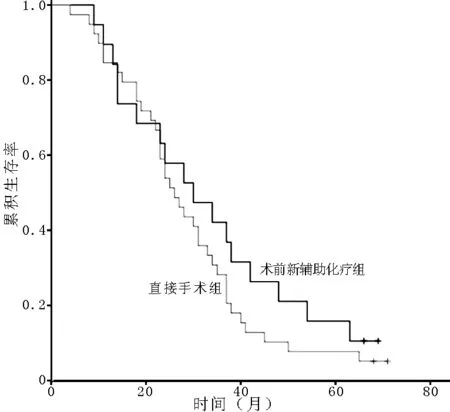
图2 A组与B组Ⅱ期患者生存率比较的生存曲线
Figure 2Survival curves of patients at stage Ⅱ between group A and group B

图3 A组与B组Ⅲ期患者生存率比较的生存曲线
Figure 3Survival curves of patients at stage Ⅲ between group A and group B
表3Ⅲ期患者预后的临床病理因素单因素分析
Table 3Univariate analysis of clinical and pathological prognostic factors for patients at stage Ⅲ

临床病理因素例数中位生存期(95%CI)(月)3年生存率(%)χ2值P值性别4.7060.030 男2811(10,12)10.7 女1723(14,32)35.3年龄(岁)1.0950.295 <603516(10,22)13.3 ≥601011(9,13)1.7吸烟指数(支年)4.2500.039 ≤4001819(6,31)27.8 >4002711(10,12)14.8治疗方式5.9660.015 术前新辅助化疗1319(5,33)38.5 直接手术3211(10,12)12.5手术方式1.9990.157 肺叶切除2211(9,13)9.1 全肺切除2319(2,36)30.4肿瘤位置2.1700.141 左侧2318(13,23)26.1 右侧2211(10,12)13.6
表4Ⅲ期患者预后影响因素的Cox比例风险回归模型分析
Table 4Cox proportional hazards regression model analysis on influencing factors for the prognosis of LD-SCLC patients at stage Ⅲ

影响因素βSEWaldχ2值HR(95%CI)P值性别0.6300.3253.7551.877(0.993,3.550)0.053吸烟指数0.4740.3272.0950.623(0.846,3.049)0.148治疗方式-0.7190.3643.9032.053(1.006,4.189)0.048
2.6术前新辅助化疗不同疗效者预后比较A组达到CR+PR者26例,SD者13例,缓解率为66.7%(26/39)。CR+PR者1、3、5年生存率分别为92.3%、61.5%、23.1%,SD者1、3、5年生存率分别为76.9%、23.1%、7.7%,两组生存率比较,差异有统计学意义(χ2=4.309,P=0.038,见图4)。A组Ⅲ期患者中达到CR+PR 7例,SD 6例。CR+PR者1、3、5年生存率分别为100.0%、57.1%、14.3%,SD者1、3、5年生存率分别为50.0%、16.7%、0,两组生存率比较,差异有统计学意义(χ2=4.772,P=0.029,见图5)。
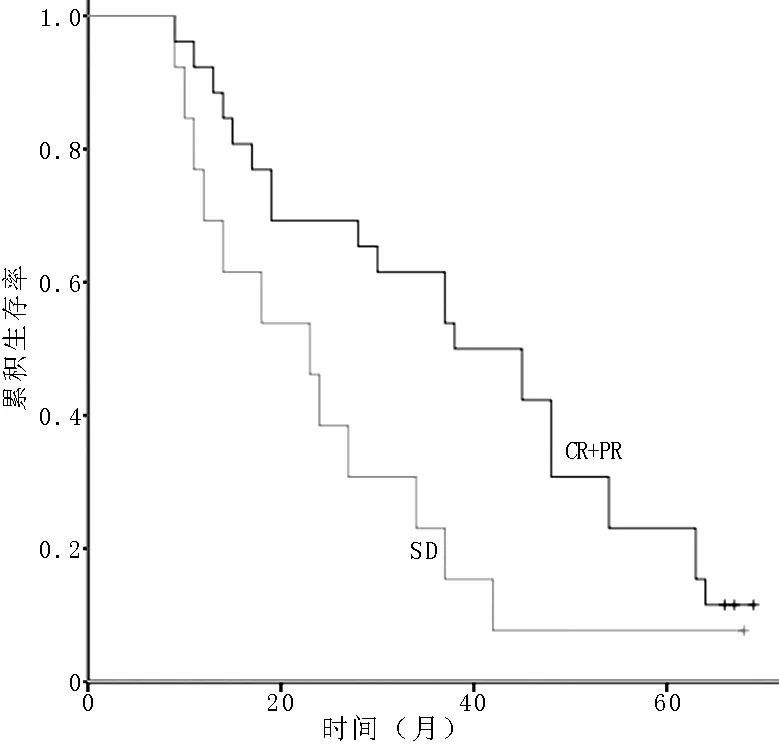
注:CR=完全缓解,PR=部分缓解,SD=稳定
图4A组CR+PR者与SD者生存率比较的生存曲线
Figure 4Survival curves of CR+PR and SD patients in group A
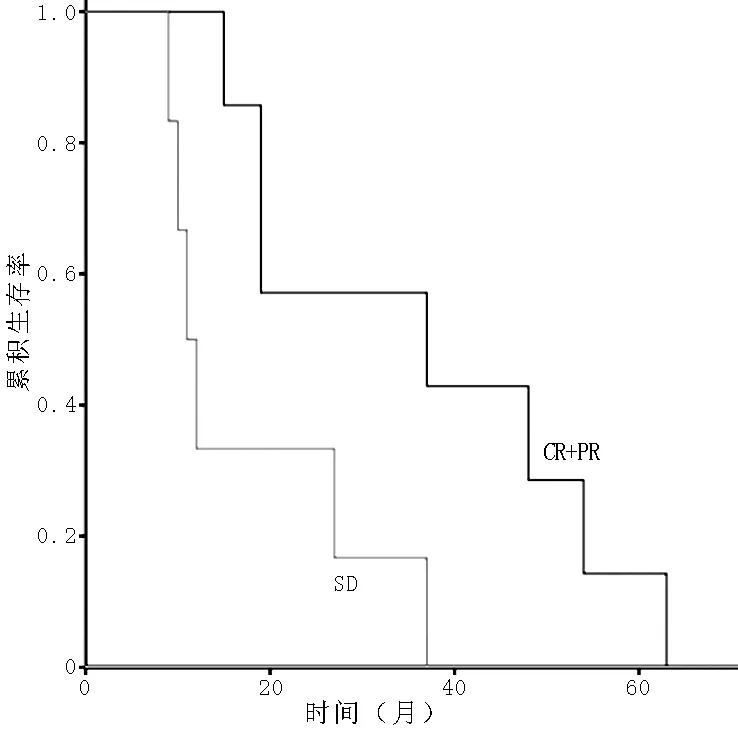
图5 A组Ⅲ期患者CR+PR者与SD者生存率比较的生存曲线
Figure 5Survival curves of CR+PR and SD patients at stage Ⅲ in group A
3讨论
术前新辅助化疗是各种恶性肿瘤治疗的新方法,对本来无法手术或手术困难的患者首先予以化疗,然后评价化疗效果,在条件允许的情况下予以手术切除病灶。1989年Skarin等[7]首先提出了新辅助化疗的概念并报道初步的临床治疗效果,其认为某些恶性肿瘤患者在术前先进行化疗能够提高治疗效果和预后。在现在的临床工作中,新辅助化疗具有良好的治疗效果,已经成为了恶性肿瘤多学科综合治疗的重要组成部分。新辅助化疗是肿瘤细胞的减量治疗,即通过术前化疗减轻肿瘤负荷,从而提高肿瘤病灶的切除率和提高患者的生存率。目前,化疗在SCLC治疗中的重要作用已经被临床试验证实,在一般情况下,用依托泊苷/顺铂全身化疗是LD-SCLC患者的合理选择[8]。但化疗后局部复发率较高,达到了26%~63%[9]。目前为止,SCLC仍然具有很高的病死率,即使是LD-SCLC,多数患者在化疗后短期内复发死亡。手术在LD-SCLC中的作用越来越大,尤其是局限Ⅰ期SCLC,肺癌NCCN临床实践指南指出对于TNM分期为Ⅰ期(T1~T2,N0)的SCLC,并经过标准分期评估(包括胸部和上腹部CT、全身骨扫描、脑影像检查甚至PET)后可考虑手术切除[10]。Shah等[11]报道手术直接切除的28例SCLC患者5年生存率为43%。Schreiber等[12]研究表明SCLC的肺叶切除术能够取得良好的生存率。韩国Ju等[13]报道TNM分期在Ⅰ期和Ⅱ期的患者经手术及辅助化疗后的3年生存率为83%,Ⅲ期患者3年生存率为13%。多年来手术被认为是SCLC的禁忌,但近年来SCLC手术切除越来越多,主要是因为虽然SCLC对化疗特别敏感,但是远期疗效并不佳。因此,术前新辅助化疗得到发展,然而SCLC术前新辅助化疗效果如何目前未有定论,Wada等[14]认为,Ⅲ期SCLC患者术前化疗比术后化疗5年生存率明显提高。Ginsberg[15]认为,手术指征应控制在Ⅰ~Ⅱ期;Ohkubo等[16]认为如Ⅲa期的患者在经过化疗后不敏感者也应手术治疗,因为此种肿瘤内常混有非小细胞肺癌成分。Xu等[17]报道术前新辅助化疗对淋巴结分期为N2LD-SCLC患者生存有明显获益,术前新辅助组Ⅲ期患者5年生存率为34%,而直接手术组5年生存率为12%。周源等[18]报道术前新辅助化疗有效率为81.1%,1、3、5年生存率分别为86.6%、49.1%、28.3%,显著高于直接手术组的79.3%、31.0%、10.3%。
本研究结果表明,Ⅰ期和Ⅱ期LD-SCLC患者预后无差异,A组Ⅲ期患者生存率高于B组。本研究结果亦显示,A组达到CR+PR者生存率高于SD患者;且A组Ⅲ期患者达到CR+PR者生存率高于SD患者。由于SCLC的生理特性,早期即可发生转移,因此大部分患者在明确诊断时已处于局限晚期,多数患者仅选择化疗,而没有重新评估化疗效果后予以手术切除病灶,本研究为LD-SCLC患者的治疗提供新的方式,使其生存获益。但是由于病例数较少,还需要更多的数据支持。
总体来说,对于Ⅰ期和Ⅱ期LD-SCLC患者,术前新辅助化疗对预后没有明显意义,应首选手术直接切除病灶,术后给予4~6个周期的化疗;对于Ⅲ期LD-SCLC患者术前推荐先给予2个周期的新辅助化疗,术后继续予以4个周期化疗。其中术前新辅助化疗后经RECIST标准进行评估为CR+PR者的预后优于SD患者。
本文要点:
由于小细胞肺癌的生理特性,诊断时大部分已处于局限晚期,多数患者均选择化疗,而没有再重新评估化疗效果后进行手术切除病灶。本文结果提示,对于局限早期(Ⅰ期和Ⅱ期)的小细胞肺癌患者确诊后直接予以手术切除,而对于局限Ⅲ期患者,可以先予以术前新辅助化疗,评估化疗效果后予以手术切除,可以明显提高生存率,因此本文为小细胞肺癌的手术治疗提供了方向和支持。
作者贡献:范宜楚进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;汪笑冬、迟明友进行试验实施、评估、资料收集;孙大强进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Govindan R,Page N,Morgensztern D,et al.Changing epidemiology of small-cell lung cancer in the United States over the last 30 years:analysis of the surveillance,epidemiologic,and end results database[J].J Clin Oncol,2006,24(28):4539-4544.
[2]徐振华,杨宇飞.肺癌[M].北京:人民卫生出版社,2002:349.
[3]张国良.实用胸部外科学[M].北京:中国医药科技出版社,2007:480-482.
[4]Laskin JJ,Erridge SC,Coldman AJ,et al.Population-based outcomes for small cell lung cancer:impact of standard management policies in British Columbia[J].Lung Cancer,2004,43(1):7-16.
[5]Shepherd FA,Crowley J,Van Houtte P,et al.The International Association for the Study of Lung Cancer lung cancer staging project:proposals regarding the clinical staging of small cell lung cancer in the forthcoming (seventh) edition of the tumor,node,metastasis classification for lung cancer[J].J Thorac Oncol,2007,2(12):1067-1077.
[6]Yang XN,Wu YL.RECIST-new guidelines to evaluate the response to treatment in solid tumors[J].The Journal of Evidence-based Medicine,2004,4(2):85-90.(in Chinese)
杨学宁,吴一龙.实体瘤治疗疗效评价标准——RECIST[J].循证医学,2004,4(2):85-90.
[7]Skarin A,Jochelson M,Sheldon T,et al.Neoadjuvant chemotherapy in marginally resectable stage Ⅲ M0 non-small cell lung cancer:long-term follow-up in 41 patients[J].J Surg Oncol,1989,40(4):266-274.
[8]Zimmermann FB,Bamberg M,Molls M,et al.Limited-disease small-cell lung cancer[J].Semin Surg Oncol,2003,21(3):156-163.
[9]Takada M,Fukuoka M,Kawahara M,et al.Phase Ⅲ study of concurrent versus sequential thoracic radiotherapy in combination with cisplatin and etoposide for limited-stage small-cell lung cancer:results of the Japan Clinical Oncology Group Study 9104[J].J Clin Oncol,2002,20(14):3054-3060.
[10]Johnson BE,Crawford J,Downey RJ,et al.Small cell lung cancer clinical practice guidelines in oncology[J].J Natl Compr Canc Netw,2006,4(6):602-622.
[11]Shah SS,Thompson J,Goldstraw P.Results of operation without adjuvant therapy in the treatment of small cell lung cancer[J].Ann Thorac Surg,1992,54(3):498-501.
[12]Schreiber D,Rineer J,Weedon J,et al.Survival outcomes with the use of surgery in limited-stage small cell lung cancer:should its role be re-evaluated?[J].Cancer,2010,116(5):1350-1357.
[13]Ju MH,Kim HR,Kim JB,et al.Surgical outcomes in small cell lung cancer[J].Korean J Thorac Cardiovasc Surg,2012,45(1):40-44.
[14]Wada H,Yokomise H,Tanaka F,et al.Surgical treatment of small cell carcinoma of the lung:advantage of preoperative chemotherapy[J].Lung Cancer,1995,13(1):45-56.
[15]Ginsberg RJ.Small cell lung cancer:how should we treat it?What is it?[J].Ann Thorac Surg,2000,70(5):1453-1454.
[16]Ohkubo T,Ito K,Sugiura H,et al.Surgical analysis for small cell lung cancer of the lung[J].Kyobu Geka,1999,52(13):1061-1068.
[17]Xu YJ,Zheng H,Gao W,et al.Is neoadjuvant chemotherapy mandatory for limited-disease small-cell lung cancer?[J].Interact Cardiovasc Thorac Surg,2014,19(6):887-893.
[18]Zhou Y,Wang D,Han KB,et al.The value of preoperative neoadjuvant chemotherapy and surgery in treating resectable small cell lung cancer[J].Chinese Journal of Clinicians(Electronic Edition),2012,6(14):3933-3936.(in Chinese)
周源,汪栋,韩开宝,等.新辅助化疗加手术在可切除小细胞肺癌中的疗效分析[J].中华临床医师杂志:电子版,2012,6(14):3933-3936.
(本文编辑:贾萌萌)
Prognosis of Limited-stage Small Cell Lung Cancer After Preoperative Neoadjuvant Chemotherapy
FANYi-chu,WANGXiao-dong,CHIMing-you,etal.
GraduateSchoolofTianjinMedicalUniversity,Tianjin300070,China
【Abstract】ObjectiveTo evaluate the effect of preoperative neoadjuvant chemotherapy on the prognosis of limited-stage small cell lung cancer(LD-SCLC).MethodsFrom January 1990 to December 2012,we enrolled 119 LD-SCLC patients who underwent thoracotomy or thoracoscopic surgery in Tianjin Chest Hospital.Among them,39 patients who were diagnosed as SCLC by cytological/histological pathological diagnosis were enrolled as preoperative neoadjuvant chemotherapy group(group A),and 80 patients who were not definitely diagnosed were enrolled as direct surgery group(group B).Group A was administrated with cisplatin plus etoposide chemotherapy for two periods with 21 days in each period,and received comprehensive reexamination to evaluate the efficacy;the patients who could tolerate surgery underwent excision and continued to take cisplatin plus etoposide chemotherapy for 4 periods after the surgery.Group B underwent excision directly and took cisplatin plus etoposide chemotherapy for 6 periods one months after surgery.Kaplan-Meier method was used to conduct survival analysis,Log-rank method was used to compare the survival rate,and Cox proportional hazards regression model was used to analysis the influencing factors for prognosis.ResultsAmong 119 patients,patients of different genders,ages,smoking index,surgical methods and tumor sites were not significantly different in prognosis(P>0.05);patients with different TNM stages and treatment methods were significantly different in prognosis(P<0.05).The results of Cox proportional hazards regression model showed that TNM staging and treatment methods were influencing factors for the prognosis of LD-SCLC patients(P<0.05).In group A,the number of patients at TNM stage Ⅰ,Ⅱ and Ⅲ was 7,19 and 13 respectively,and in group B,the number of patients was 9,39 and 32 respectively.The two groups were not significantly different in the survival rates of patients at stage Ⅰ(χ2=0.042,P=0.838);the two groups were not significantly different in the survival rates of patients at stage Ⅱ(χ2=1.084,P=0.298);the two groups were significantly different in the survival rates of patients at stage Ⅲ(χ2=5.966,P=0.015).Among 45 patients at stage Ⅲ,patients with different ages,surgical methods and tumor sites were not significantly different in prognosis(P>0.05),and patients with different genders,smoking index and treatment methods were significantly different in prognosis(P<0.05).Cox proportional hazards regression model showed that treatment methods was an influencing factor for the prognosis of patients at stage Ⅲ(P<0.05).In group A,there were 26 patients who had CR+PR and 13 patients who had SD;the remission rate was 66.7%(26/39).CR+PR patients and SD patients were significantly different in the survival rates(χ2=4.309,P=0.038).Among patients at stage Ⅲ in group A,there were 7 patients who reached CR+PR and 6 patients who reached SD;CR+PR patients and SD patients were significantly different in the survival rates(χ2=4.772,P=0.029).ConclusionPreoperative neoadjuvant chemotherapy has no significant influence on the prognosis of LD-SCLC patients at stage Ⅰ and Ⅱ,whereas it can improve the postoperative survival rate of patients at stage Ⅲ and bring marked benefit for the survival of patients who reach CR+PR through preoperative neoadjuvant chemotherapy.
【Key words】Small cell lung carcinoma;Preoperative neoadjuvant chemotherapy;Prognosis
通信作者:孙大强,300222天津市,天津市胸科医院胸外科;E-mail:sdqmd@163.com
【中图分类号】R 734.1
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.14.010
(收稿日期:2015-11-26;修回日期:2016-03-15)
