春季不同叶色鹅耳枥叶片生理生化特性的研究
2016-06-06吴驭帆祝遵凌
吴驭帆,于 萍,祝遵凌,b,c
(南京林业大学 a 风景园林学院,b 艺术设计学院,c 南方现代林业协同创新中心,江苏 南京 210037)
春季不同叶色鹅耳枥叶片生理生化特性的研究
吴驭帆a,于萍a,祝遵凌a,b,c
(南京林业大学 a 风景园林学院,b 艺术设计学院,c 南方现代林业协同创新中心,江苏 南京 210037)
[摘要]【目的】 研究春季不同叶色鹅耳枥叶片生理生化特性及各生理指标与叶色变化的关系。【方法】 以春季展叶期红叶和对照绿叶的鹅耳枥(Carpinus turczaninowii)植株为试材,通过测定叶片叶绿素、类胡萝卜素、花色素苷、可溶性糖含量及苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)活性,研究叶片生理指标的变化动态并比较2种叶色植株叶片转色的差异性;通过相关分析探究各生理指标间的相关关系,明确其与叶色变化的关系。【结果】 与红叶植株相比,绿叶鹅耳枥植株积累的花色素苷相对含量较少,但叶绿素含量积累相对较多,叶片呈现绿色;可溶性糖含量呈平稳的先上升后下降的变化趋势,变化幅度较小。2种叶色鹅耳枥PAL、POD酶活性变化趋势较为一致,均呈下降趋势,但红叶植株下降幅度较快,与花色素苷的变化动态相似。2种植株花色素苷与叶绿素含量均呈显著负相关,花色素苷含量占色素比例较大时,叶片呈红色;反之叶绿素占优势,叶片呈绿色。花色素苷含量与PAL、POD活性均呈显著相关,与可溶性糖呈不显著相关。【结论】 鹅耳枥叶色变化最直接的原因在于叶片色素成分和比例的差异,PAL、POD、可溶性糖含量均是影响花色素苷生物合成及叶片显现红色的重要因素,园林栽培中可通过提高相关酶活性和内含物含量延长鹅耳枥春季的叶色观赏期。
[关键词]鹅耳枥;叶色;花色素苷;酶;可溶性糖
春色叶植物是指春季新发生的嫩叶叶色有显著不同的植物[1],如:臭椿(Ailanthusaltissima)、石楠(Photiniaserrulata),早春新叶红艳,观赏价值很高。我国近几年才重视对春色叶树种的应用,随着园林绿化水平的提高,春色叶树种的应用日趋多样,无论是数量、种类、品种还是应用方式,都呈现出较好的发展态势[2]。春色叶植物的叶色表现是遗传因素和外部环境共同作用的结果,春季叶片刚刚萌发,叶绿素合成较少,花色素苷在各种色素中占主导地位,所以叶片通常呈现红色。
鹅耳枥(Carpinusturczaninowii)广泛分布于我国甘肃、河北、山东等省区,其耐寒耐旱,适应性强,喜生长于贫瘠的土地上[3],春季嫩叶红艳可爱,树型秀丽、果穗奇特,用于园林、道路绿化,观赏价值很高。我国作为鹅耳枥属植物的分布中心,大部分植物还处于野生待开发的状态,国内对鹅耳枥的研究主要集中在形态解剖、生物学特性和群落生态等方面[4-5],对鹅耳枥春季叶色变化的生理研究及其在园林绿地中的应用尚未见报道。本试验通过研究鹅耳枥春季叶片呈色机理,对红叶与绿叶植株的呈色差异及红叶“返绿”现象进行初步探讨,并提出保持鹅耳枥早春红叶观赏性的合理建议,以期为将鹅耳枥作为春色叶树种应用于园林绿化提供理论基础和科学依据,更好地发挥其在城市景观中的作用。
1材料与方法
1.1材料
供试鹅耳枥来自江西省,为2年生扦插苗,试验选用生长健壮、长势一致的鹅耳枥扦插苗,进行统一的肥水管理。
1.2方法
1.2.1叶片的采集试验在南京林业大学实验教学中心和园林实验室进行。从2014年4月1日至5月10日(植株完全展叶)每隔10 d取样一次,展叶初期为4月1号至10号,展叶中期为4月10号至4月30号,展叶后期为4月30号至5月10号。取鹅耳枥春季红叶植株为供试材料,叶片未变色的绿叶植株为对照,每次取样均在早晨09:30进行,选择扦插苗植株中部相同部位的叶片。具体采样日期与叶片状况如表1所示。
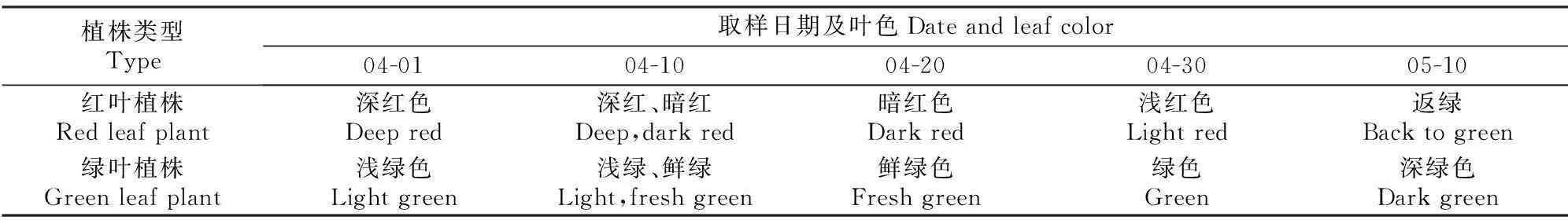
表 1 供试鹅耳枥叶片信息
1.2.2测定项目及方法光合色素的提取与测定参照张宪政[6]的方法;花色素苷的提取与测定参照唐前瑞[7]及何奕昆等[8]的方法;可溶性糖的提取与测定参照李合生[9]的蒽酮比色法;苯丙氨酸解氨酶(PAL)的提取与测定参照王敬文等[10]的方法;过氧化物酶(POD)的提取与测定参照郑炳松[11]的愈创木酚法。
1.2.3数据分析试验数据测定均重复3次,使用SPSS软件进行数据分析,采用Excel 2003作图。
2结果与分析
2.12种叶色鹅耳枥光合色素含量的变化
2.1.1红叶植株叶片的变化由图1可知,春季叶片转色期,鹅耳枥红叶植株的光合色素含量均呈现平稳的上升趋势,其中叶绿素a含量变化幅度较大,转色期内上升了40.58%;叶绿素b与类胡萝卜素相对含量分别上升了50.43%,31.96%;叶绿素总量变化趋势与叶绿素a较一致,转色期内上升了43.30%。这说明随着叶片发育成熟、光照增强和温度的升高,叶片中的光合色素含量呈上升趋势;叶绿素a上升较快,原因可能是叶绿素a占植物叶片中叶绿素总量的3/4,呈蓝绿色,其是叶片呈现绿色的主要因子;叶绿素b含量较少且相对不稳定;红叶植株展叶后期,红叶逐渐变淡呈浅绿色,可能是因为叶绿素a含量比重增大导致的叶片呈色变化。
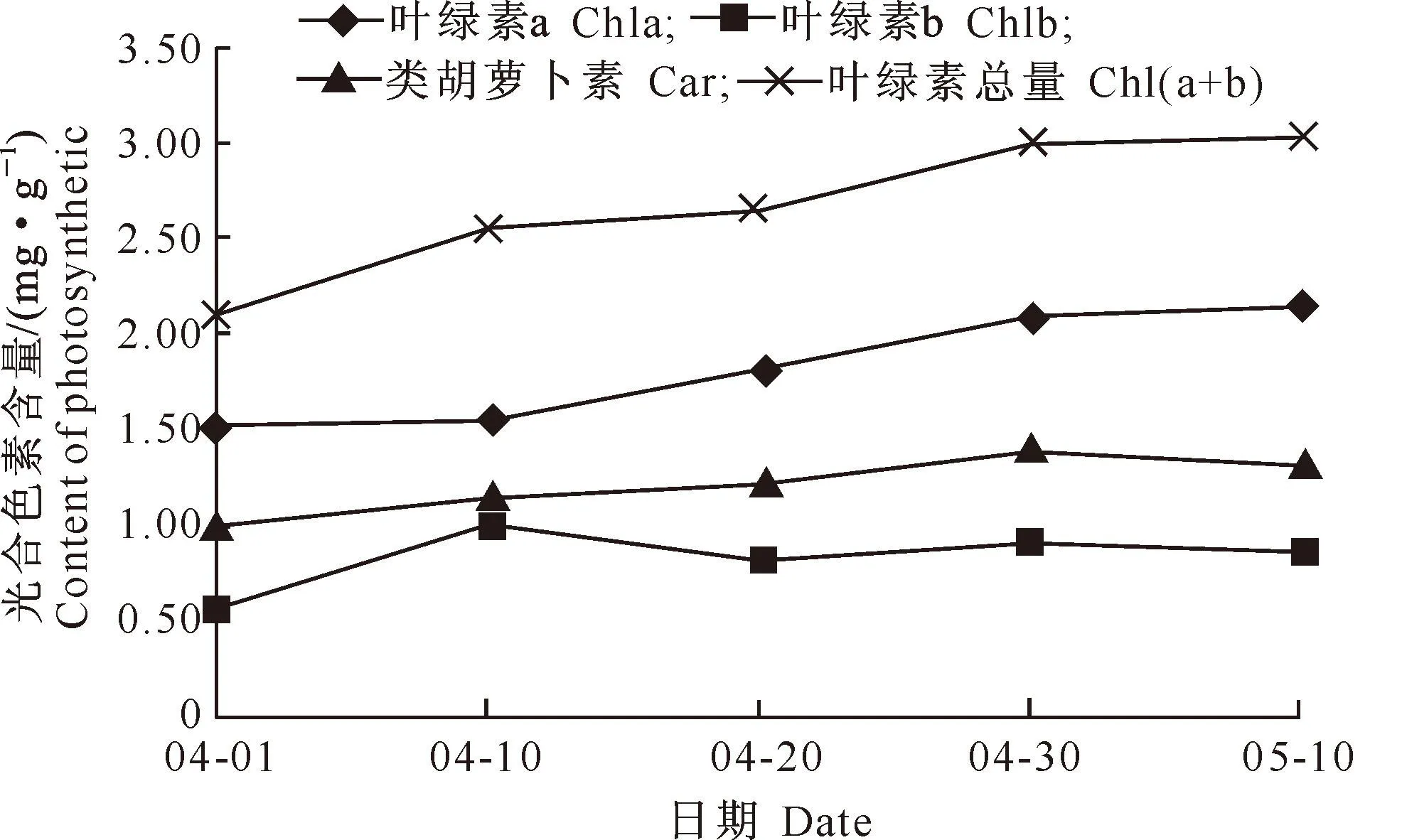
图 1红叶鹅耳枥植株叶片光合色素含量的变化动态
Fig.1Variation trends of photosynthetic
pigments of red leaves

图 2绿叶鹅耳枥植株叶片光合色素含量的变化动态
Fig.2Variation trends of photosynthetic
pigments of green leaves
2.1.2绿叶植株叶片的变化由图2可知,与红叶植株相比,绿叶植株的光合色素含量呈显著上升趋势。其中,叶绿素a与叶绿素总量的变化趋势较为一致,在04-20之前平稳上升,之后呈显著的上升趋势,整个变化期叶绿素a和叶绿素总量增幅分别为140.56%,137.78%,这可能是因为绿叶植株叶片内叶绿素含量较高,随着叶片逐渐发育成熟,叶绿素积累速度加快,导致叶片呈色由浅绿向深绿转变。类胡萝卜素与叶绿素b上升趋势较为一致,呈现缓慢上升,整个变化期内类胡萝卜素与叶绿素b的相对增幅分别为110.74%,138.68%。
综上可知,转色期绿叶植株叶片光合色素的增幅高于红叶植株,尤其是叶绿素a和叶绿素总量的平均相对含量分别高出红叶植株59.59%,62.26%,转色期内2种植株叶绿素含量差异可能是叶片呈色不同的原因。
2.22种叶色鹅耳枥花色素苷相对含量的变化
花色素是一类酚类化合物,是植物体内的次生代谢物质,它在植物体内通常与糖结合为花色素苷,使植物叶片呈现彩色[12]。由图3可见,春季展叶初期(04-01-04-10),鹅耳枥红叶植株的花色素苷相对含量非常高,为25.96~24.89 U,原因可能是初春温度较低,昼夜温差大,这一时期花色素苷大量合成,导致叶片呈现深红色;展叶中期(04-10-04-30),花色素苷合成缓慢,相对含量下降到9.99 U,与展叶初期相比降幅为59.86%;至展叶后期(04-30-05-10),积累的花色素苷开始降解,相对含量下降到4.54 U,与展叶中期相比降幅为54.55%,红叶植株花色素苷的含量变化是导致叶片转色的原因之一。相比而言,绿叶植株的花色素苷相对含量远小于红叶植株,呈先缓慢上升后下降的趋势;展叶初期,叶片花色素苷含量为11.77 U,至展叶中期增加到12.43 U,增幅为5.6%;展叶中后期,花色素苷含量下降至6.73 U,与展叶中期初相比降幅为45.86%;由此看出:随着时序变化,如环境温度的升高,2种叶色鹅耳枥植株花色素苷含量均呈下降趋势,且绿叶植株降幅较小,红叶植株降幅明显。由于叶色表现是遗传因素和外部环境共同作用的结果,与叶片细胞内色素的种类、相对含量以及在叶片中的分布有关[13]。因此推测,在外部环境相同的条件下,2种植株叶片呈色差异可能是由于内部遗传因素不同,进而导致色素相对含量及分布不同。
2.32种叶色鹅耳枥可溶性糖含量的变化
糖是花色素苷合成的前体物质,也是花色素苷分子结构的组分之一。在信号转导中,糖作为信号分子通过调节花色素苷合成酶基因的表达调控其合成[14]。由图4可知,春季展叶初期,鹅耳枥红叶植株可溶性糖含量呈较显著的下降趋势,可能是因为这一时期花色素苷的大量合成消耗了较多的可溶性糖,导致其含量降低;展叶中期,随着花色素苷合成渐缓并不断分解,可溶性糖含量又有所回升。展叶前期,鹅耳枥绿叶植株可溶性糖含量平稳下降,随后呈先上升后下降的变化趋势,但变化幅度均较小。
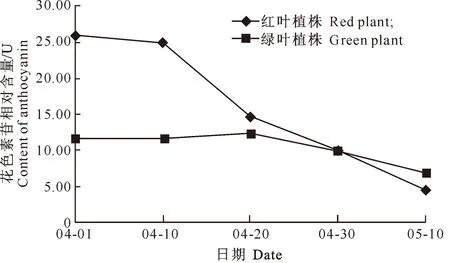
图 32种叶色鹅耳枥转色期花色素苷
相对含量的变化趋势比较
Fig.3Variation trends of anthocyanin contents of
twoC.turczaninowiiduring color-changing period
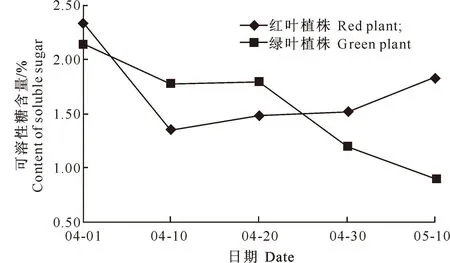
图 42种叶色鹅耳枥转色期可溶性糖含量的
变化趋势比较
Fig.4Variation trends of soluble sugar contents of
twoC.turczaninowiiduring color-changing period
2.42种叶色鹅耳枥PAL、POD活性的变化
2.4.1PAL活性的变化苯丙氨酸解氨酶(PAL)是植物苯丙酸类代谢途径和花色素苷合成的第一个关键酶[15]。由图5可见,鹅耳枥红叶植株PAL活性呈下降趋势,展叶初期下降幅度较大,为43.73%;随后呈平稳的下降趋势,与展叶初期相比降幅为10.59%,叶片PAL活性的最大值与花色素苷相对含量最大值的出现时间一致,随着红叶转绿,两者含量均下降;这说明PAL与花色素苷可能有着相关关系,并共同影响叶片呈色。鹅耳枥绿叶植株的PAL活性变化幅度较小,04-01-05-10仅下降了 12.98%,这表明PAL对绿叶植株叶片呈色影响较小,推测PAL与叶绿素没有显著的相关关系。
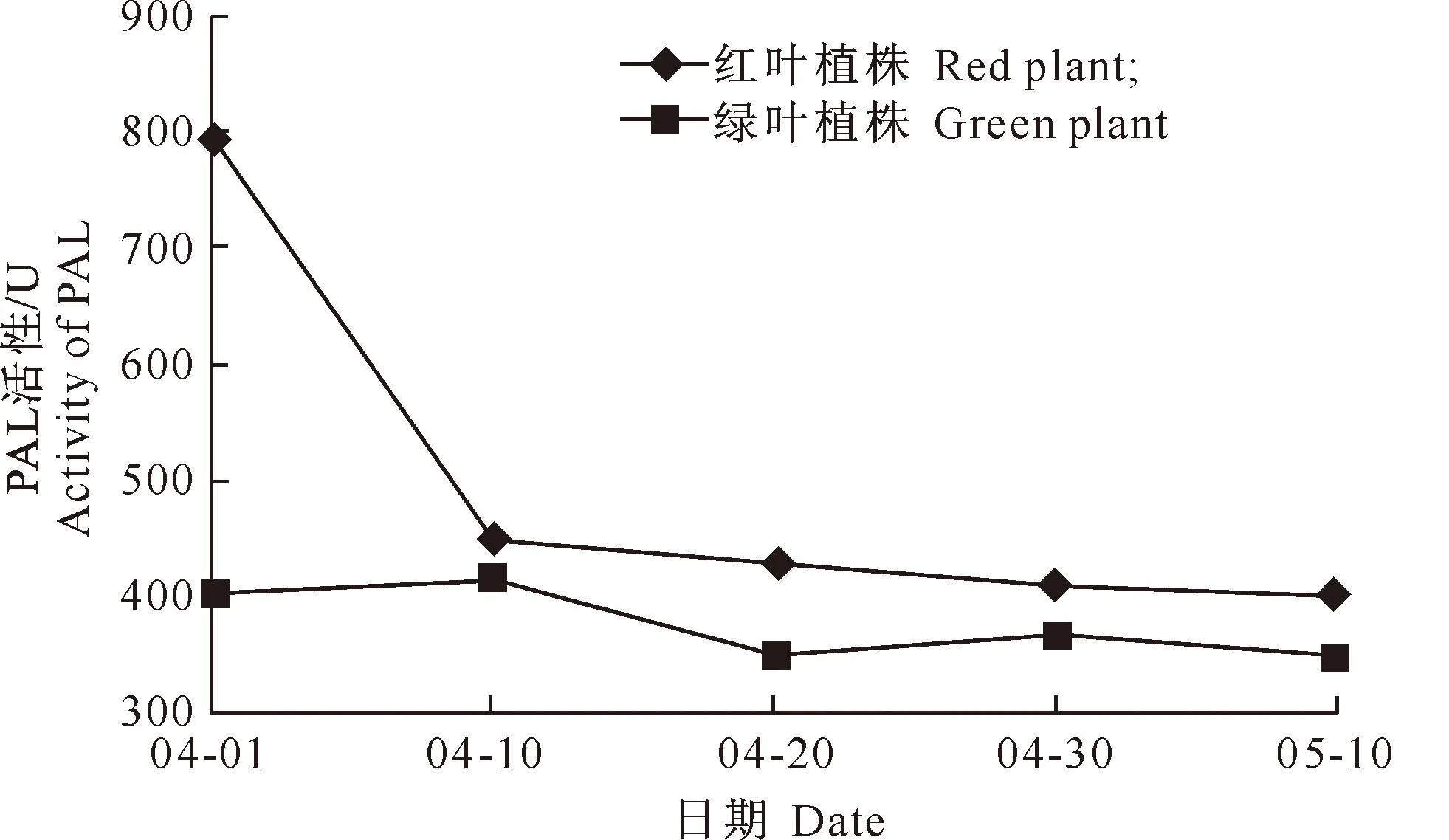
图 52种叶色鹅耳枥转色期PAL活性的变化趋势比较
Fig.5Variation trends of PAL activities of two
C.turczaninowiiduring color-changing period
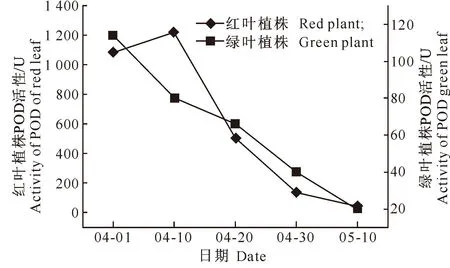
图 62种叶色鹅耳枥转色期POD活性的变化趋势比较
Fig.6Variation trends of POD activities of two
C.turczaninowiiduring color-changing period
2.4.2POD活性的变化过氧化物酶(POD)是植物体内一种重要的保护酶, POD参与酚类物质的形成,其活性大小影响花色素苷的合成[16]。由图6可知,展叶初期至中期(04-01-04-30),鹅耳枥红叶植株的POD活性总体上显著高于绿叶植株;展叶后期,随着红叶植株叶色逐渐返绿,两者POD活性大小趋于一致。整体而言,POD活性在红叶鹅耳枥中较高,这与花色素苷含量在红叶中显著高于绿叶的结果一致。表明POD活性可能影响叶片花色素苷的含量, POD活性越大,叶片花色素苷积累越多。
2.52种叶色鹅耳枥各生理指标间的相关性分析
由表2可知,鹅耳枥红叶植株叶绿素a与花色素苷含量、POD活性呈极显著负相关,与可溶性糖含量、PAL活性呈不显著负相关;叶绿素b与花色素苷含量、可溶性糖含量、PAL和POD活性的相关性均不显著;叶绿素总量与花色素苷含量、PAL活性呈显著负相关,与可溶性糖含量、POD活性呈不显著负相关;花色素苷含量与可溶性糖含量、PAL活性间相关性均不显著,但与POD活性呈极显著正相关。以上结果表明,红叶植株的花色素苷含量随叶绿素含量的升高而降低,负相关性极显著;可溶性糖、PAL、POD在一定程度上均可促进花色素苷的合成,进而影响叶片呈色。
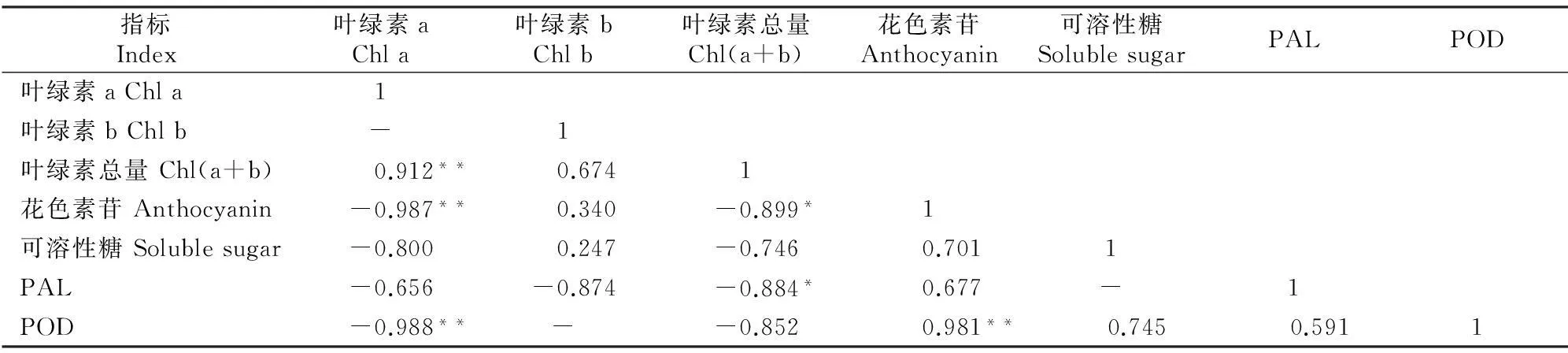
表 2 鹅耳枥红叶植株各生理指标间的相关性
注:**表示达到极显著水平P<0.01,*表示达到显著水平P<0.05。下表同。
Note:**Significant difference at 0.01 level;*Significant difference at 0.05 level.The same below.
由表3可知,鹅耳枥绿叶植株叶绿素a与花色素苷含量、可溶性糖含量、POD活性均呈极显著负相关,与PAL活性呈不显著负相关;叶绿素b与花色素苷含量、可溶性糖含量、POD活性均呈显著负相关,与PAL活性相关性不显著;叶绿素总量与花色素苷含量、PAL和POD活性呈显著负相关,与可溶性糖含量呈极显著负相关;花色素苷含量与可溶性糖含量呈显著正相关,与PAL、POD活性相关性不显著;可溶性糖含量与POD活性呈极显著正相关。以上结果表明:绿叶植株的花色素苷、可溶性糖含量、POD活性均随着叶绿素a含量的升高而降低,相关性极显著;可溶性糖对花色素苷的合成有显著促成作用,PAL、POD活性均可影响花色素苷的合成,但影响不显著。
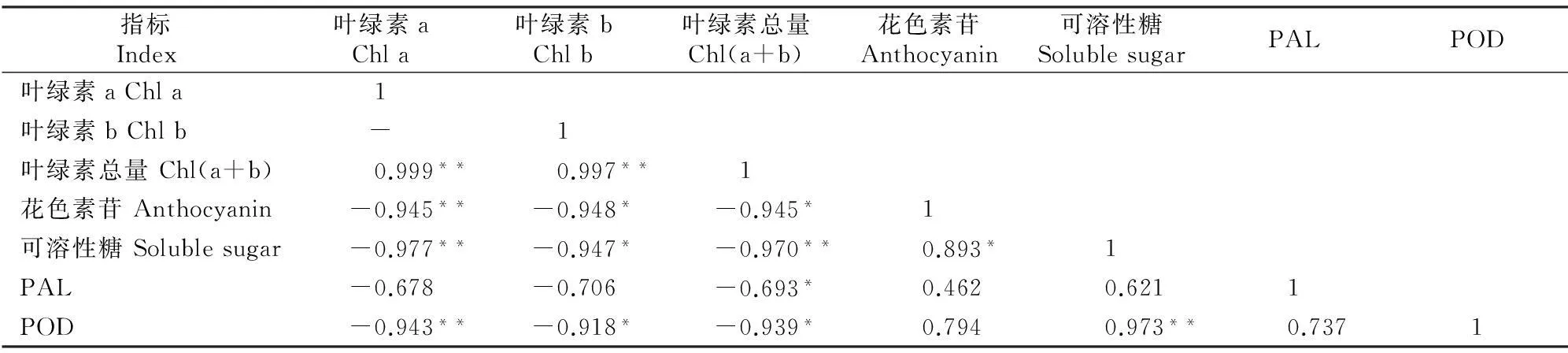
表 3 鹅耳枥绿叶植株各生理指标间的相关性
3结论与讨论
叶绿素、花青素、类胡萝卜素是植物叶片细胞内的3种主要色素,它们在叶片中的分布、比例、含量共同决定叶片呈色。研究表明,当叶绿素所占比重较大时,叶片呈现绿色,叶绿素a在叶绿素中占主导;花青素所占比重较大时,叶片呈红色;类胡萝卜素所占比重较大时,叶片呈黄色[17]。本研究发现:鹅耳枥花色素苷与叶绿素总量呈显著负相关,随着花色素苷含量的降低,叶绿素含量上升。春季鹅耳枥嫩叶开始发育,叶绿体发育尚未健全,花色素苷的色泽得以良好表现;展叶前期,红叶植株花色素苷含量远高于叶绿素,花色素苷占优势,使叶片呈红色,随后花色素苷含量下降,叶绿素含量上升导致花色素苷所占比例下降,叶绿素开始占优势,导致红色变浅、逐渐返绿。绿叶植株叶绿素含量高,花色素苷占比较低,因此春季转色期叶片一直呈现绿色,且逐渐加深。这说明春季鹅耳枥叶片出现呈色差异的直接原因是花色素苷与叶绿素比值有别,比值增大使叶片呈红色,反之呈绿色。这与史宝胜等[18]对不同叶色五叶地锦及杨淑红等[19]对全红杨叶色的研究结论一致。
叶绿素是植物体内含镁的卟啉化合物, 它的合成完全是在前质体或叶绿体中进行的, 原叶绿酸a 转变为叶绿酸a 的反应是一个依赖光的过程[20]。Oren等[21]研究表明,较低的温度可以诱导美国黄栌叶片中花色素苷的合成。Deal[22]认为,在较高的夜温下,鸡爪槭呼吸作用加强,致使糖分不能积累,花色素苷被消耗,叶片红色变淡。本试验中,随着气候回暖,样地昼夜温差减小,光照时间延长,暗呼吸速率增强,碳水化合物积累下降,花色素苷积累明显下降甚至开始分解,影响了红叶植株叶色的表达。这说明温度、光照等环境因子是影响红叶植株呈色的重要因素。这与唐前瑞[7]在红檵木叶色变化上的研究结论一致。在栽培管理中,若想保持鹅耳枥早春红叶的观赏性,可以通过遮阴、喷水降温等栽培措施来延缓花色素苷的降解,达到延缓红叶“返绿”的效果。但影响叶片色素含量的环境因子还包括湿度、土壤、光照强度等,且不同生长阶段对叶色表达的影响机制也不同,这需要进一步深入研究。
碳水化合物是植物生长和花色素苷形成的物质基础,可溶性糖作为渗透调节因子调节细胞的渗透势,从而促进花色素苷的合成,又可作为能源物质为花色素苷的合成提供碳骨架[23]。研究表明,花色素苷与可溶性糖含量间呈极显著线性相关,可溶性糖对花色素苷的积累有明显的促进作用[24]。但原永兵[25]研究发现,苹果果实的花色素苷含量与可溶性固体物含量不存在相关关系,但在一定范围内可溶性固体物含量增加,花色素苷含量也随之增加。本研究发现,展叶前期,2种叶色鹅耳枥植株的可溶性糖含量开始达到最大值,后与花色素苷一样表现出下降趋势,这是因为花色素苷的合成消耗了可溶性糖;展叶中后期,花色素苷含量仍处下降趋势,但2种植株中可溶性糖含量表现出不同的趋势,相关分析显示两者相关性不显著。这说明一定量的可溶性糖对花色素苷有促进作用,是影响叶片呈现红色的重要因素,因此在栽培过程中可以通过喷施一定量的蔗糖营养液以提高鹅耳枥叶片中的含糖量,人为调控叶色以延长红叶期,增强红叶植株早春的观赏效果。这与陈继卫等[26]对红枫、唐前瑞[7]对红檵木的叶色研究结果类似。但不同糖源对花色素苷的积累作用不一致,研究表明,蔗糖对玉米胚乳中花色素苷的积累效果较果糖、葡萄糖好;在杨属(Populus)细胞悬浮培养试验中发现,蔗糖对花色素苷的积累效果比果糖更有效[27]。何种糖源对花色素苷的合成效果最佳还需深入研究。
PAL是催化花色素苷的生物合成的第一个关键酶。周爱琴等[28]研究认为,随着果实中花青素含量增加,PAL活性增大,但两者并非呈简单的正相关关系;Constabel[29]研究认为,花色素苷含量与PAL活性间无正相关性,因为PAL虽然是催化花色素苷合成的第一个酶,但是该途径的最终产物包括类黄酮、花青苷、木质素等多种物质,因此PAL活性与花色素苷之间的关系会受到其他产物合成速率的影响[30]。本试验相关分析结果表明,花色素苷与PAL呈不显著正相关,与叶绿素呈显著负相关。展叶前期,红叶植株的PAL活性远高于绿叶植株,而后随着叶色变淡,花色素苷含量下降,两者趋于一致,说明PAL有利于叶片中花色素苷的合成,促进叶片呈现红色。抗氧化物酶如POD含量的变化影响花色素苷的合成[30]。史宝胜[17]认为,POD活性影响叶片中多酚含量,促进了紫叶李叶片中花色素苷的合成,使叶片显现红色。本试验中,2种叶色鹅耳枥花色素苷含量与POD活性呈极显著负相关,红叶植株的POD活性高于绿叶植株,且此时红叶植株的花色素苷含量也较高,表明POD可能参与并促进了叶片花色素的积累,进而影响鹅耳枥叶片的呈色。这一结论与史宝胜等[18]对不同叶色五叶地锦及聂庆娟等[31]对不同叶色红栌的研究结果相似。目前有关彩叶植物保护酶系统的研究较少,本试验研究了叶色与POD活性之间的相关关系,为今后深入研究花色素苷含量与其他抗氧化酶活性之间的关系提供了理论基础。
综上所述,春季鹅耳枥出现叶色差异是外界环境因素和内部因素综合作用的结果,最直接的原因在于叶片色素成分和比例的差异, PAL、POD活性和可溶性糖含量均是影响叶片花色素苷生物合成及叶片显色的重要内部因素。今后通过人工措施,如适当的遮阴增湿、增加光照、喷施蔗糖等技术,以提高鹅耳枥叶片中花色素苷合成相关酶的活性、内含物的含量,增大叶片中花色素苷与叶绿素的比值,延长红叶观赏期,保证鹅耳枥红叶观赏期的景观效果。
[参考文献]
[1]张启翔,吴静.彩叶植物资源及其在园林中的应用 [J].北京林业大学学报,1998,20(4):126-127.
Zhang Q X,Wu J.Resource of color-leaf plants and its application in gardens [J].Journal of Beijing Forestry University,1998,20(4):126-127.(in Chinese)
[2]刘秀文.湖南彩叶树呈色机理及园林应用研究 [D].长沙:中南林业科技大学,2007.
Liu X W.Mechanism of coloring and usage in garden of colored-leaf trees in Hunan [D].Changsha:Central South University of Forestry and Technology,2007.(in Chinese)
[3]周正.世界主要用材树种概论 [M].北京:中国林业出版社,1997:192-193.
Zhou Z. Introduction to the main timber tree species in the world [M].Beijing:Chinese Forestry Press,1997:192-193.(in Chinese)
[4]陈之端,邢树平,梁汉兴.鹅耳枥和虎榛子(桦木科)雌性生殖器官的形态发生 [J].植物学报,2001,43(11):1110-1114.
Chen Z D,Xing S P,Liang H X.Morphogenesis of female reproductive organs inCarpinusturczaninowiiandOstryopsisdavidiana(Betulaceae) [J].Chinese Bulletin of Botany,2001,43(11):1110-1114.(in Chinese)
[5]祝遵凌,金建邦.鹅耳枥属植物研究进展 [J].林业科技开发,2013,27(3):10-14.
Zhu Z L,Jin J B.Advances in studies on plants ofCapinusL. [J].China Forestry Science and Technology,2013,27(3):10-14.(in Chinese)
[6]张宪政.植物叶绿素含量测定:丙酮乙醇混合液法 [J].辽宁农业科学,1986(3):26-28.
Zhang X Z.Determination of chlorophyll content in plants-acetone and alcohol mixture [J].Liaoning Agricultural Sciences,1986(3):26-28.(in Chinese)
[7]唐前瑞.红檵木遗传多样性及其叶色变化的生理生化研究 [D].长沙:湖南农业大学,2001.
Tang Q R.Study on the genetic diversity amongLoropetalumchinensevar.rubrumintroductions and changes of physiology and biochemistry during its leaf color transformation [D].Changsha:Hunan Agriculture University,2001.(in Chinese)
[8]何奕昆,代庆阳,苏学辉.雁来红叶色转变与超微结构及色素含量的关系 [J].四川师范学院学报:自然科学版,1995,16(3):195-197.
He Y K,Dai Q Y,Su X H.The relationship between leaf discoloration and the leaf ultrastructure and pigments inAmaranthustricolorL. [J].Journal of Sichuan Teachers College:Natural Science,1995,16(3):195-197.(in Chinese)
[9]李合生.植物生理生化实验原理和技术 [M].北京:高等教育出版社,1999.
Li H S.The principle and technology of plant physiology and biochemistry experiment [M].Beijing:Higher Education Press,1999.(in Chinese)
[10]王敬文,薛应龙.植物苯丙氨酸解氨酶的研究.Ⅱ:植物激素对甘薯块根植物苯丙氨酸解氨酶和肉桂酸经化酶活性变化及其伴随性的影响 [J].植物生理学报,1981,7(4):373-379.
Wang J W,Xue Y L.Studies on plant phenylalanine ammonia-lyase(PAL).Ⅱ:The role of PAL in the resistance of potato late blight [J].Plant Physiology Journal,1981,7(4):373-379.(in Chinese)
[11]郑炳松.现代植物生理生化技术研究 [M].北京:气象出版社,2006.
Zheng B S.Study on the physiological biochemical technology of modern plant [M].Beijing:China Meteorological Press,2006.(in Chinese)
[12]Vaknin H,BAR-AKIVA,Ovadia R,et al.Active anthocyanin degradation inBrunfelsiacalycina(yesterday-today-tomorrow)flowers [J].Planta,2005,222:19-26.
[13]Richard T T F,Bjorn R,Anna M H.Road traffic and nearby grassland bird patterns in a suburbanizing landscape [J].Environmental Management,2002,29(6):782-800.
[14]钱见平.元宝枫转色机理的初步研究 [D].泰安:山东农业大学,2013.
Qian J P.Preliminary study about color change mechanism ofAcertruncatum[D].Tai’an:Shandong Agriculture University,2013.(in Chinese)
[15]洪丽.槭幼树叶色变化的生理学研究 [D].哈尔滨:东北林业大学,2008.
Hong L.The physiology characteristic research of the leaf color changes on the sapling of theAcerginnalamaxim [D].Harbin:Northeast Forestry University,2008.(in Chinese)
[16]吴明江,于萍.植物过氧化物酶的生理作用 [J].生物杂志,1994(4):14-16.
Wu M J,Yu P.Physiology of plant peroxidase [J].Journal of Biology,1994(4):14-16.(in Chinese)
[17]史宝胜.紫叶李叶色生理变化及影响因素研究 [D].哈尔滨:东北林业大学,2008.
Shi B S.The research on the physiological characters and the influence factors on leave color of purple leaf Cherry Plum [D].Harbin:Northeast Forestry University,2008.(in Chinese)
[18]史宝胜,孟建朝,刘冬云,等.秋季不同色泽五叶地锦叶片生理生化特性的研究 [J].华北农学报,2009(24):172-175.
Shi B S,Meng J C,Liu D Y,et al.The study on physiological and biochemical characteristics in different color Leaves ofParthenocissusquinquefoliain autumn [J].Acta Agric Boreali Sin,2009(24):172-175.(in Chinese)
[19]杨淑红,朱延林,马永涛,等.生长季全红杨叶色与色素组成的相关性 [J].东北林业大学学报,2013,41(7):63-68.
Yang S H,Zhu Y L,Ma Y T,et al.Correlation between leaf color and pigment composition of thePopulus×euramericana‘Quanhong’ leaves in growing season [J].Journal of Northeast Forestry University,2013,41(7):63-68.(in Chinese)
[20]唐前瑞,陈德富,陈友云,等.红檵木叶色变化的生理生化研究 [J].林业科学,2006,42(2):111-115.
Tang Q R,Chen D F,Chen Y Y,et al.Changes of physiology and biochemistry during leaf color transformation inLoropetalumchinensevar.rubrum[J].Scientia Silvae Sinicae,2006,42(2):111-115.(in Chinese)
[21]Oren S M,Levi N A.Temperature effect on the leaf pigmentation ofCotinuscoggygria‘Royal Purple’ [J].Journal of Horticultural Science,1997,72:425-432.
[22]Deal D L.Leaf color retention,dark respiration,and growth of red-leafed Japanese maples under high night temperature [J].Journal of the America Society for Horticultural Science,1990,115(1):135-140.
[23]郭衍银,徐坤.矿质营养与植物病害机理研究进展 [J].甘肃农业大学学报,2003,38(4):385-393.
Guo Y Y,Xu K.Research progress on the mechanism of plant disease related to mineral nutrition [J].Journal of Gansu Agricultural University,2003,38(4):385-393.(in Chinese)
[24]赵宗芳,谢嘉宝,吴桂法,等.富士苹果果皮花青素发育的相关因素分析 [J].果树科学,1992,9(3):134-137.
Zhao Z F,Xie J B,Wu G F,et al.Correlation analysis on development of anthocyanidin in pericarp of Fuji Apple [J].Journal of Fruit Science,1992,9(3):134-137.(in Chinese)
[25]原永兵.苹果果皮红色形成的机制 [M].北京:科学出版社,1995:121-129.
Yuan Y B.Mechanism of red formation of apple peel [M].Beijing:Science Press,1995:121-129.(in Chinese)
[26]陈继卫,沈朝栋,贾玉芳,等.红枫秋冬转色期叶色变化的生理特性 [J].浙江大学学报:农业与生命科学版,2010,36(2):181-186.
Chen J W,Shen C D,Jia Y F,et al.Physiological changes of maple leaves during the color-changing period in autumn and winter [J].Journal of Zhejiang University:Agriculture and Biotechnology,2010,36(2):181-186.(in Chinese)
[27]安田齐.花色的生理生物化学 [M].傅玉兰,译.北京:中国林业出版社,1989:68-100.
An T Q.Physiological biochemistry of flower color [M].Fu Y L,translate.Beijing:Chinese Forestry Press,1989:68-100.(in Chinese)
[28]周爱琴,祝军,生吉萍,等.苹果花青素形成与PAL活性及蛋白质含量的关系 [J].中国农业大学学报,1997,2(3):97-99.
Zhou A Q,Zhu J,Sheng J P,et al.The relationship of anthocyanidin fomation,PAL activity and protein content during apple coloring [J].Journal of China Agriculture University,1997,2(3):97-99.(in Chinese)
[29]Constabel F.The correlation of phenylalamine ammoniaband cinnamic acid 4-hydoxylase activity changes inJerusalemartichoketuber tissues [J].Planta,1971,96:306.
[30]崔晓静.红叶石楠叶色变化的生理生化研究 [D].保定:河北农业大学,2008.
Cui X J.Study on changes of physiology and biochemistry during leaf color transformation ofPhotiniafrasery‘Red Robin’ [D].Baoding:Hebei Agriculture University,2008.(in Chinese)
[31]聂庆娟,史宝胜,孟朝,等.不同叶色红栌叶片中色素含量、酶活性及内含物差异的研究 [J].植物研究,2008,28(5):599-602.
Nie Q J,Shi B S,Meng C,et al.The enzyme activities,pigment and inclusion contents in different leaves color ofCotinuscoggygria‘Royal Purple’ in autumn [J].Bulletin of Botanical Research,2008,28(5):599-602.(in Chinese)
Physiological and biochemical characteristics ofCarpinusturczaninowiileaves with different colors in spring
WU Yu-fana, YU Pingb,ZHU Zun-linga,b,c
(aCollegeofLandscapeArchitecture,bCollegeofArts&Design,cCo-InnovationCenterforSustainableForestryinSouthernChina,NanjingForestryUniversity,Nanjing,Jiangsu210037,China)
Abstract:【Objective】 The study investigated physiological and biochemical characteristics of Carpinus turczaninowii leaves with different colors in spring and the relationships between physiological indexes and leaf colors.【Method】 Carpinus turczaninowii plants with two different colors were selected in spring to investigate the changes in physiological indexes and the differences in color changing by determining contents of chlorophyll,carotenoid,anthocyanin,and soluble sugar as well as activities of PAL and POD.Correlations between physiological indexes were also analyzed to understand their relationships with change of leaf color.【Result】 Compared to red-leaf plants,green ones accumulated less anthocyanin but much more chlorophyll,which resulted in green leaves.Soluble sugar showed a trend of steady rise and fall with smaller magnitude than chlorophyll.Both plants had consistent decreasing trend in PAL and POD activities,but red ones had a faster decline similar to anthocyanin.The contents of anthocyanin had extremely significant and negative correlation with chlorophyll.The leaf color turned red when anthocyanin was dominant whereas leaf turned green when chlorophyll was dominant.Anthocyanin had extremely significant correlation with PAL and POD,but had insignificant correlation with soluble sugar.【Conclusion】 The change of leaf color was determined by the composition and proportion of pigments.PAL and POD activities and sugar contents were important factors affecting the accumulation of anthocyanin and red color of leaves.Enhancing activities of related enzymes and increasing contents of different compositions could extend the viewing period.
Key words:Carpinus turczaninowii;leaf color;pigment;enzyme;soluble sugar
DOI:网络出版时间:2016-04-0709:0010.13207/j.cnki.jnwafu.2016.05.016
[收稿日期]2014-09-19
[基金项目]江苏省科技支撑计划项目(BE2012345);江苏省工程技术研究中心建设项目(BM2013478);江苏省六大人才高峰项目(NY-029);江苏省“青蓝工程”资助项目(2012);江苏高校优势学科建设工程资助项目(PAPD)
[作者简介]吴驭帆(1992-),女,安徽黄山人,硕士,主要从事园林植物应用与栽培研究。[通信作者]祝遵凌(1968-),男,河南固始人,教授,博士生导师,主要从事园林植物应用与栽培研究。E-mail:zhuzunling@aliyun.com
[中图分类号]Q945.78
[文献标志码]A
[文章编号]1671-9387(2016)05-0120-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160407.0900.032.html
