生长激素受体激活剂的制备及鉴定
2016-06-06李雨萌兰海楠吴天成
李雨萌,洪 盼,兰海楠,吴天成,郑 鑫
(吉林农业大学 动物科技学院,吉林 长春 130118)
生长激素受体激活剂的制备及鉴定
李雨萌,洪盼,兰海楠,吴天成,郑鑫
(吉林农业大学 动物科技学院,吉林 长春 130118)
[摘要]【目的】 制备生长激素受体的单克隆抗体,探讨其对生长激素受体的激活作用,为研究生长激素模拟物提供新思路。【方法】 以生长激素受体胞外域(GHBP)免疫BALB/c鼠,通过杂交瘤技术制备抗生长激素受体的单克隆抗体,用流式技术筛选抗体,通过流式、激光共聚焦显微镜观察研究该单克隆抗体对生长激素受体的激活作用,然后通过Western-blot等技术手段研究其胞内的信号通路。【结果】 通过杂交瘤技术共获得了30个分泌抗生长激素受体的单克隆抗体,经流式分析筛选到具有受体激动剂活性的单克隆抗体(命名为L8)。竞争性结合分析结果表明,L8在受体上的结合表位与生长激素重叠;激光共聚焦观察结果表明,L8不但能结合到细胞表面的生长激素受体,而且还能内化进入胞体。经Western-blot和流式分析表明,L8能与转染GHR基因的CHO-GHR638细胞表面的生长激素受体结合,并启动JAK2-STAT5、ERK1/2信号转导通路,且呈现出剂量依赖性。【结论】 生长激素受体抗体可以作为受体的激动剂,其可能是通过诱导受体构象变化的方式激活受体,并启动JAK2-STAT5等信号转导通路。
[关键词]生长激素;抗生长激素受体抗体;信号转导通路
生长激素(Growth hormone,GH)是由垂体分泌的多肽,经循环系统运送至靶器官上发挥相应的生物效应,由191个氨基酸组成,分子质量为22 ku[1-2]。研究表明,GH对动物的生长发育有着极其重要的作用,同时在免疫、生殖、代谢等方面亦有许多重要生理功能,是动物机体最重要的内分泌激素之一[3-4]。
GH生理作用的发挥主要通过生长激素受体(Growth hormone receptor,GHR)介导。GHR属于典型的Ⅰ类生长因子受体,由620个氨基酸组成,包括胞外域、跨膜域和胞内域[5]。GH与相应靶细胞的GHR相结合发挥其生理作用,产生相应的生长因子和免疫调节因子,如胰岛素样生长因子(insulin-like growth factors-1,IGF1)、白介素-6(interleukin-6,IL6)、白介素-2(interleukin-2,IL2)等,胞内信号转导路径主要包括janus激酶(janus kianse,JAK)-信号传导及转录激活因子(Signal transducers and activators of transcription,STAT)、JAK-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和JAK-细胞外调节蛋白激酶(extracellular signal-regulated kinases 1 and 2,ERK1/2)途径,GHR介导信号转导开启靶基因通过旁分泌和自分泌的方式发挥相应的生理作用[5-6]。Cunningham等[7]首次利用晶体试验证实,一分子GH与两分子的GHR相结合产生二聚体而激活GHR,其结合位点一个为高亲和性的位点(site1),一个为低亲和性的位点(site2)。 Herrington等[8]研究表明,GH高亲和性位点先与GHR结合,导致GH发生翻转,再与低亲和性位点相结合形成二聚体,进而启动信号转导。然而近年来研究表明,仅形成二聚体不足以启动信号转导,GH与GHR结合后须经过GHR的旋转才能启动信号转导[9]。
随着人们对动物产品安全性要求的逐步提高,动物生产中过量使用激素造成的残留问题引起社会广泛关注。外源性的生长激素是被禁止在动物生产中使用的,但GH在动物生长发育过程中具有重要作用,所以研究开发可替代GH的生物制剂尤为重要。本课题组多年来一直致力于GH可替代物的研究,从多个角度研究和开发了GHR激活剂,如使用肽类物质[10]和抗独特型抗体等[11],都取得了一定的效果。在笔者尝试使用新的方法制备GHR激活剂的过程中,通过查阅文献发现,1991年科学杂志(Science)首先报道了生长激素与其受体的晶体结构(GH-GHR),晶体结构表面一分子GH与两分子GHR结合,当时科学家认为GHR的激活机制是二聚化(即1个GH分子将2个GHR分子招募到一起,形成二聚化的受体GH-(GHR)2)。Fuh等[12]研究发现,部分抗GHR抗体能够使表达有GHR的细胞增殖,但若将抗GHR抗体降解为单价的Fab后,其则失去了促进细胞增殖的功能,这再次验证了GHR的激活是通过二聚化完成的。此外,Rowlinson等[13]通过制备一系列的抗GHR抗体,发现部分抗体能够促进有GHR表达的细胞增殖。Wan等[14]对一个激活性抗GHR单克隆抗体进行表位作图发现,抗GHR的抗体诱导受体产生相应的构象变化。这一系列研究似乎表明抗GHR抗体能够激活GHR,为此推测抗GHR抗体也能够作为GH的模拟物,但目前国内尚未见相关的研究报道。为此,本试验采用杂交瘤技术制备抗GHR单克隆抗体,并就其对GHR的激活作用进行了研究,旨在为GH替代物的开发提供新的思路。
1材料与方法
1.1材料
1.1.1试验动物6周龄BALB/c雌性小鼠,共6只,平均体质量22 g/只,购自吉林大学动物实验中心。
1.1.2细胞转染大鼠全长GHR基因的中国仓鼠卵巢细胞(CHO),由吉林农业大学细胞生物学实验室制备,命名为CHO-GHR638细胞。小鼠骨髓瘤细胞(SP2/0)由华程生物公司提供。
1.1.3主要试剂与仪器HAT选择性培养基、HT选择性培养基、弗氏完全佐剂、弗氏不完全佐剂、异硫氰酸荧光素(FITC)标记羊抗兔及抗鼠IgG、四甲基异硫氰酸(FITC)、罗丹明(TRITC)、ImmunPureIgG1Fab&F(ab′)2、4′,6-二脒基-2-苯基吲哚(DAPI)、钥孔血蓝蛋白(KLH)、ImmunPureIgG1Fab&F(ab′)2抽提试剂盒,购自Sigma公司;RPMI-1640培养基、胎牛血清,购自GIBCO公司;小鼠单抗Ig亚类检测试剂盒、非免疫鼠IgG (对照用)购自华程生物公司;磷酸化与非磷酸化酪氨酸激酶(JAK2、STAT5、ERK1/2)抗体,购自CST公司。激光共聚焦显微镜LV1000型,日本奥林巴斯公司产品;流式细胞仪,美国BD公司产品;大鼠生长激素受体胞外域(GHBP),由华程生物公司提供。
1.2方法
1.2.1荧光标记生长激素标记抗GHR单克隆抗体 (L8)、非免疫对照抗体标记FITC的制备方法参照文献[15],为保证标记的荧光分子不影响被标记物的生理活性,本研究选择荧光分子与所标记蛋白之间的分子比例为2∶1。
1.2.2细胞培养用含体积分数10%灭活胎牛血清、青霉素100 IU/mL、链霉素100 IU/mL的RPMI-1640 培养基培养CHO-GHR638细胞,培养条件37 ℃、体积分数5% CO2。
1.2.3抗GHR单克隆抗体的制备选取6周龄雌性BALB/c鼠6只,首免以100 μg GHBP与等体积弗氏完全佐剂乳化后免疫BALB/c鼠(免疫剂量为50 μg/只),并以14 d为间隔进行加强免疫,剂量与首免相同(不同的是与弗氏不完全佐剂乳化),每次加强免疫后3 d采尾静脉血测效价,直至效价达到1∶20 000以上时,取鼠脾脏细胞与SP2/0融合,融合过程参照文献[16]的方法。将融合后的细胞分散于96孔细胞培养板中,经含有HAT的培养基筛选培养10 d后,利用间接ELISA筛选阳性克隆,将阳性克隆转移到20孔培养板,扩大培养。
为筛选到能与GHR特异性结合的单克隆抗体,以表达GHR638的CHO细胞为模型对上述ELISA检测阳性孔进行进一步筛选。取ELISA检测阳性孔上清液500 μL与CHO-GHR638(细胞密度为1×104mL-1)4 ℃孵育30 min,以ELISA检测阴性孔同样处理作对照,PBS洗涤细胞3次,洗涤后1 000 r/min离心10 min沉淀细胞并加入FITC标记羊抗鼠IgG抗体(二抗)(1∶200稀释),37 ℃避光孵育30 min。然后用PBS洗涤细胞,进行流式细胞仪检测,通过CellQuest软件分析流式数据,扩大培养经3次流式检测均为阳性的杂交瘤细胞,通过小鼠体内诱生腹水的方法制备腹水,采用辛酸-饱和硫酸铵法纯化腹水,纯化后的抗体(IgG)保存备用。
单克隆抗体的F(ab′)2部分制备参照ImmunPureIgG1Fab&F(ab′)2抽提试剂盒说明书进行。亚类分析采用鼠单抗Ig亚类检测试剂盒说明书鉴定。
1.2.4竞争性结合受体分析以PBS洗涤新消化的CHO-GHR638细胞,用无血清RPMI-1640培养基调整细胞密度为1×104mL-1,37 ℃平衡30 min。将定量的FITC-GH(60 ng/mL)分别与2,4,6,8,10,12,14,16,18,20 ng/mL的未标记GH或纯化的抗GHR抗体混合,并与CHO-GHR638细胞4 ℃共孵育60 min,PBS洗涤2次后,将各组细胞分别用500 μL PBS重悬,并移入流式管,进行流式分析。
1.2.5抗GHR单克隆抗体的激光共聚焦显微镜观察用PBS洗涤新分离的CHO-GHR638细胞后,用无血清RPMI-1640培养基重悬细胞,37 ℃平衡30 min,将500 μL(50 ng/mL)的FITC-L8加入1 mL细胞悬液中,37 ℃孵育30 min。PBS洗涤2次后,1 000 r/min离心5 min沉淀细胞,以质量分数4%多聚甲醛室温固定10 min(避光),PBS洗涤2次后,以体积分数50%甘油重悬细胞并进行激光共聚焦显微镜观察。以FITC标记非免疫鼠IgG作对照。
1.2.6信号转导的Western-blot分析将新消化的CHO-GHR638细胞洗涤2次后,37 ℃平衡30 min,然后加入1 000 ng/mL的L8或GH刺激细胞,37 ℃孵育15 min,用细胞裂解液溶解细胞20 min,煮沸10 min,14 000 r/min离心30 min,取上清测定蛋白浓度。取40 μg蛋白点样在SDS-PAGE(分离胶为12%,浓缩胶为4%),蛋白经电泳分离后,转至硝酸纤维素膜上(130 mA,4 ℃ 转膜3 h)。TBST洗涤3次后,质量分数5%脱脂奶粉封闭1 h,然后将膜放入1∶1 000稀释的一抗(Anti-JAK2、Anti-pJAK2、Anti-STAT5、Anti-pstat5、ERK1/2、Anti-pERK1/2)中孵育,TBST洗涤3次后,加入HRP标记的羊抗兔IgG抗体(1∶3 000稀释)孵育1 h,TBST洗涤3次,DAB法显色。以同样处理的L8的Fab段(Fab的制备方法见材料部分)和非免疫鼠IgG抗体作为对照。
1.2.7JAK2、STAT5及ERK1/2的激活动力学流式分析将新消化的CHO-GHR638细胞用PBS洗涤2次后,调整细胞密度为1×104mL-1,1 mL/管,37 ℃平衡30 min,分别与L8(0,10,50,100,500 ng)孵育15 min后,以质量分数1%多聚甲醛室温固定10 min,Trion X-100透化细胞10 min,PBS洗涤细胞2次,1 000 r/min离心5 min、沉淀并分别加入100 μL抗磷酸化JAK2、STAT5及ERK1/2抗体(1∶100稀释)孵育60 min, PBS洗涤3次后,加入FITC标记的羊抗兔IgG抗体(1∶200稀释)室温避光孵育60 min,孵育后洗涤离心细胞并重悬于PBS中进行流式分析。
2结果与分析
2.1抗GHR单克隆抗体的筛选和鉴定
通过间接ELISA检测融合孔的上清液,共检测出分泌生长激素受体的单克隆抗体阳性孔30个。但这30个阳性孔中可能只有部分单克隆抗体能与活细胞表面的生长激素受体结合,因为本试验免疫使用的是GHR胞外域而非全长GHR,因此本试验进一步对这30个阳性克隆进行流式筛选,结果其中有13个表现出阳性信号,因为它们能结合到活细胞表面,这表明它们有可能与细胞表面的生长激素受体结合,与对照抗体相比,L8与细胞表面的GHR结合能力较强,因此本研究选择流式检测阳性信号最强的L8进行进一步分析,经鉴定L8为IgG2a亚类(图1)。
2.2L8与GHR的竞争性结合作用
竞争性结合分析结果表明:未标记的生长激素与L8均以剂量依赖性竞争的方式结合CHO细胞表面GHR,而对照抗体未能表现出这种作用(图2),这表明L8与GHR上的结合表位重叠。

图 1 抗GHR单克隆抗体L8的流式筛选结果
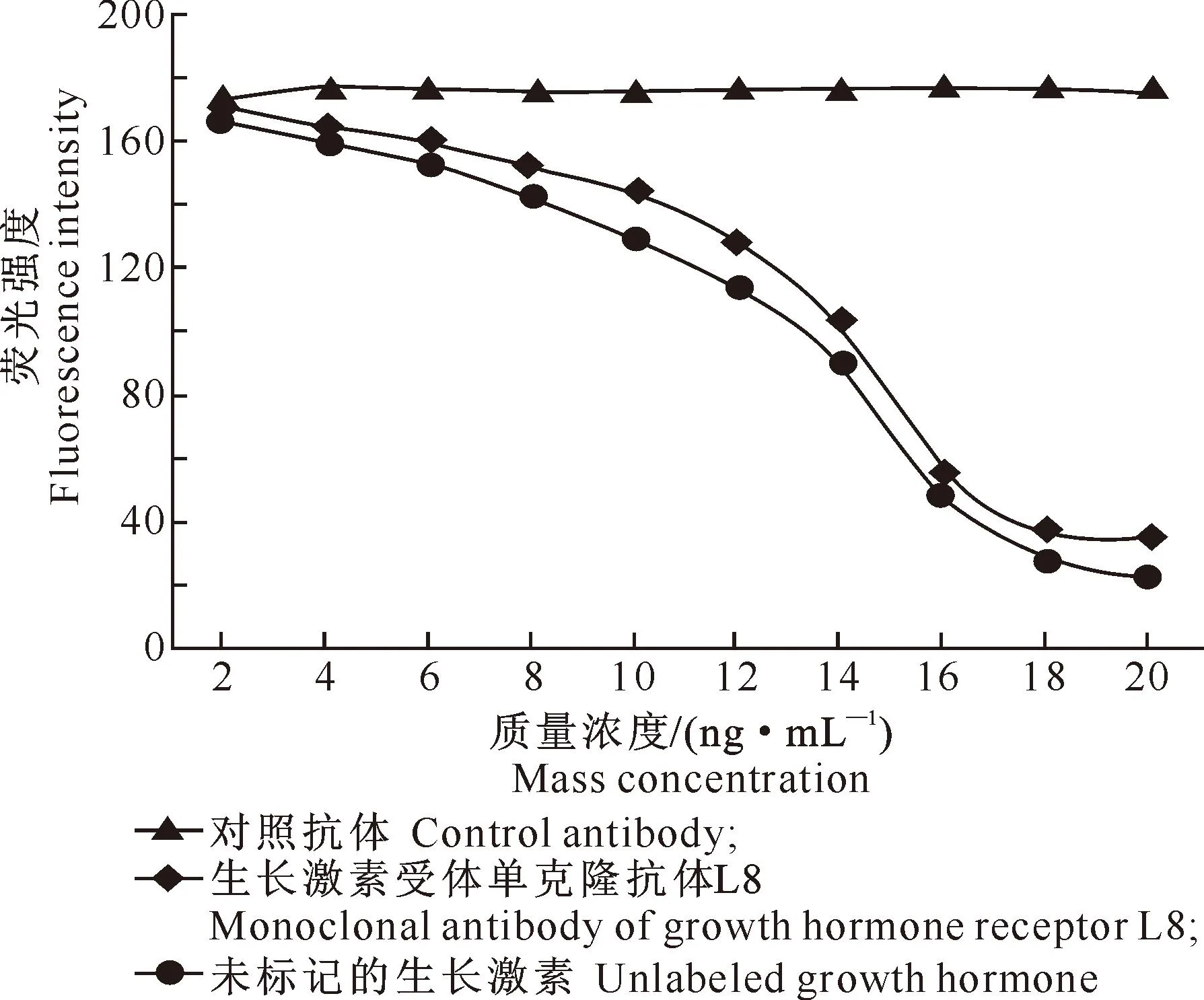
图 2 L8与GHR的竞争性结合
2.3L8结合GHR的激光共聚焦显微镜观察
激光共聚焦观察结果表明,L8不但能结合到细胞表面GHR,而且还可内化进入胞体,而对照抗体没有表现出任何效果(图3)。

图 3 L8特异性地结合到CHO-GHR638细胞GHR的激光共聚焦显微镜观察(×800)
L8属于IgG类分子,这类免疫球蛋白具有2个抗原结合位点,因此能同时结合2个GHR,进而启动信号转导。本试验使用经典的Western-blot方法来分析L8对磷酸化信号转导蛋白JAK2、STAT5和ERK1/2 (这3个信号分子为生长激素启动胞内信号转导的最重要的信号转导蛋白[17-18])的影响,结果表明,GH与L8均能激活磷酸化JAK2、STAT5和ERK1/2,而非免疫鼠IgG抗体未能表现出任何作用(图4)。

图 4 L8作用机制的Western-blot分析
本试验采用流式分析JAK2、STAT5、ERK1/2的动力学,结果表明,L8均以剂量依赖性的方式磷酸化JAK2(图5)、STAT5(图6)和ERK1/2(图7)信号蛋白。而且流式分析信号转导蛋白磷酸化的技术比Western-blot更敏感,尤其是在低浓度和高浓度L8的刺激下表现更明显,这与文献[19-20]报道结果一致。
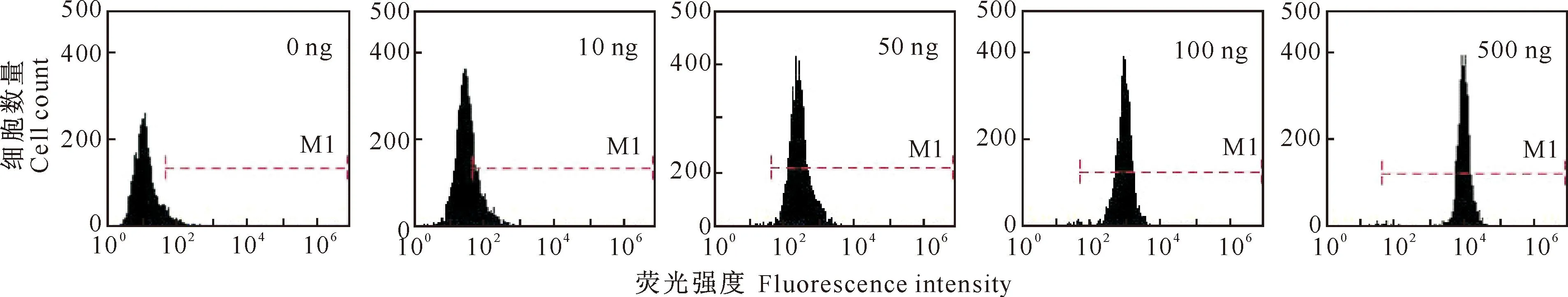
图 5 不同剂量L8对CHO-GHR638细胞信号转导蛋白JAK2磷酸化的影响

图 6 不同剂量L8对CHO-GHR638细胞信号转导蛋白STAT5磷酸化的影响
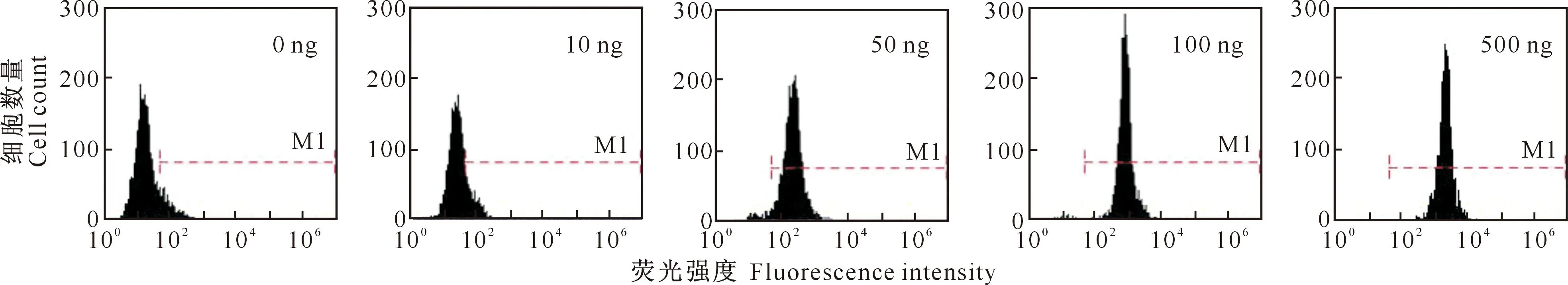
图 7 不同剂量L8对CHO-GHR638细胞信号转导蛋白ERK1/2磷酸化的影响
3讨论
GH属于非对称性分子,没有对称中心。然而,本研究制备的抗GHR单克隆抗体L8属于对称性IgG类免疫球蛋白,这类免疫球蛋白具有两个亲和性相同的抗原结合部位(Fab),L8不但能特异性地结合CHO-GHR638细胞上受体,而且还能够激活胞内信号通路,这表明对称的L8也可以作为生长激素受体激活剂,因为它激活了胞内信号通路蛋白JAK2、STAT5、ERK1/2。
已有文献报道,生长激素以二聚化的方式激活生长激素受体,进而开启胞内信号通路[12]。在本研究中,双价的L8能够激活JAK2、STAT5、ERK1/2等,而单价L8 Fab部分虽然能够结合生长激素受体,但却不能激活胞内信号转导蛋白,这说明L8是通过二聚化方式使受体激活的。但是,最近Brooks等[21]研究表明,在没有配体的情况下,生长激素受体本身以二聚体形式存在,而生长激素受体的激活是通过有GH诱导的受体的构象变化而发生的。因此,笔者推测,L8很可能也是通过诱导受体发生构象变化进而激活生长激素受体的,并且已有文献报道,生长激素受体的单克隆抗体能够诱导生长激素受体产生构象变化,并且这个构象变化与生长激素作用于生长激素受体引起的构象变化相似[11]。
以往的研究表明,如果以Ⅰ类生长因子受体抗体作为激动剂,则该抗体与受体的结合位点非常重要,本研究发现,L8能够与生长激素竞争性地结合生长激素受体,这表明L8的结合表位与生长激素的结合表位相近或者部分甚至全部重合。
很多研究者一直在追寻能够模拟天然配体的物质,最初研究人员专注于使用肽类物质。Cwirla等[22]利用噬菌体筛选了血细胞生成素受体(EPOR),分离到能够与EPOR结合的肽,但发现肽与其他同类受体会发生交叉反应,未能达到理想的效果。之后科学工作者开始尝试使用抗体类物质,其中抗独特型抗体有着广泛的报道[11,23-24],但是使用生长激素受体抗体类的物质尚未见报道。本研究制备了抗生长激素受体抗体L8,并且这个单克隆抗体表现出生长激素样的活性,这为进一步探索生长激素类似物提供了新的方向。
[参考文献]
[1]高雪,许尚忠,张英汉.生长激素作用机理的研究进展 [J].黄牛杂志,2003,29(1):50-53.
Gao X,Xu S Z,Zhang Y H.Advance in action mechanism of growth hormone [J].Journal of Yellow Cattle Science,2003,29(1):50-53.(in Chinese)
[2]马晓,胡毅,熊钢,等.生长激素受体及其基因研究进展 [J].湖南农业大学学报:自然科学版,2010,36(1):58-62.
Ma X,Hu Y,Xiong G,et al.Overview of growth hormone receptor gene and growth hormone receptor [J].Journal of Hunan Agricultural University:Natural Sciences,2010,36(1):58-62.(in Chinese)
[3]孙逊,朱尚权.生长激素的结构与功能 [J].国外医学:生理病理科学与临床分册,1999,19(1):6-9.
Sun X,Zhu S Q.The structure and function of the growth hormone [J].Foreign Medical Sciences:Section of Pathophysiology and Clinical Medicine,1999,19(1):6-9.(in Chinese)
[4]郑茂恩,王可洲,金东庆,等.生长激素在肿瘤治疗方面的研究进展 [J].现代肿瘤医学,2013,21(4):883-886.
Zheng M E,Wang K Z,Jin D Q,et al.Research progresses of growth hormone and tumor [J].Journal of Modern Oncology,2013,21(4):883-886.(in Chinese)
[5]杨艳红,付志玲,兰海楠,等. 生长激素激活受体机理的研究进展 [J].中国畜牧兽医,2013,40(10):148-151.
Yang Y H,Fu Z L,Lan H N,et al.Research progress on the mechanism of growth hormone-activated receptor [J].China Animal Husbandry &Veterinary Medicine,2013,40(10):148-151.(in Chinese)
[6]张明哲,叶丹,张志和,等.生长激素受体及其介导的信号转导 [J].细胞生物学杂志,2005,27(1):49-52.
Zhang M Z,Ye D,Zhang Z H,et al.Growth hormone receptor and signal transduction [J].Chinese Journal of Cell Biology,2005,27(1):49-52.(in Chinese)
[7]Cunningham B C,Ultsch M,De Vos A M,et al.Dimerization of the extracellular domain of the human growth hormone receptor by a single hormone molecule [J].Science,1991,254(5033):821-825.
[8]Herrington J,Carter-Su C.Signaling pathways activated by the growth hormone receptor [J].Trends in Endocrinology & Metabolism,2001,12(6):252-257.
[9]Brooks A J,Waters M J.The growth hormone receptor:Mechanism of activation and clinical implications [J].Nature Reviews Endocrinology,2010,6(9):515-525.
[10]郑鑫,兰海楠,刘景圣,等.一种模拟猪生长激素样的活性肽及制备方法与应用,中国:ZL201110442548.8 [P].2013-11-06.
Zheng X,Lan H N,Liu J S,et al.Preparation method and application of porcine growth hormone-like peptides analog,China:ZL201110442548.8 [P].2013-11-06.(in Chinese)
[11]兰海楠,李维,郑鑫.猪生长激素抗独特型抗体的制备及生物活性检测 [J].西北农林科技大学学报:自然科学版,2012,40(11):7-12.
Lan H N,Li W,Zheng X.Preparation of porcine growth hormone anti-idiotypic antibody and detection of its biological activity [J].Journal of Northwest A&F University:Natural Science Edition,2012,40(11):7-12.(in Chinese)
[12]Fuh G,Cunningham B C,Fukunaga R,et al.Rational design of potent antagonists to the human growth hormone receptor [J].Science,1992,256(5064):1677-1680.
[13]Rowlinson S W,Yoshizato H,Barclay J L,et al.An agonist-induced conformational change in the growth hormone receptor determines the choice of signalling pathway [J].Nature Cell Biology,2008,10(6):740-747.
[14]Wan Y,Zheng Y Z,Harris J M,et al.Epitope map for a grow-th hormone receptor agonist monoclonal antibody,MAb 263 [J].Molecular Endocrinology,2003,17(11):2240-2250.
[15]Rapaport R,Sills I N,Green L,et al.Detection of human gro-wth hormone receptors on IM-9 cells and peripheral blood mononuclear cell subsets by flow cytometry:Correlation with growth hormone-binding protein levels [J].The Journal of Clinical Endocrinology & Metabolism,1995,80(9):2612-2619.
[16]郑鑫,朱世成,李家奎,等.猪生长激素单克隆抗体的制备及其特性 [J].中国兽医学报,2005,25(3):293-294.
Zheng X,Zhu S C,Li J K,et al.Preparation and characterization of monoclonal antibody for porcine growth hormone [J].Chinese Journal of Veterinary,2005,25(3):293-294.(in Chinese)
[17]Waters M J,Brooks A J.Growth hormone and cell growth [J].Endocr Dev,2012(23):86-95.
[18]王鹰,李苏宜.生长激素受体及其生物学效应的研究进展 [J].肠外与肠内营养,2007,14(3):183-187.
Wang Y,Li S Y.Research progresses in growth hormone receptor tumor biology effects [J].Parenteral & Enteral Nutrition,2007,14(3):183-187.(in Chinese)
[19]Candotti F,Notarangelo L,Visconti R,et al.Molecular aspects of primary immunodeficiencies:Lessons from cytokine and other signaling pathways [J].The Journal of Clinical Investigation,2002,109(10):1261-1269.
[20]Fleisher T A,Dorman S E,Anderson J A,et al.Detection of intracellular phosphorylated STAT-1 by flow cytometry [J].Clinical Immunology,1999,90(3):425-430.
[21]Brooks A J,Dai W,O’Mara M L,et al.Mechanism of activation of protein kinase JAK2 by the growth hormone receptor [J].Science,2014,344(6185):1249783.
[22]Cwirla S E,Balasubramanian P,Duffin D J,et al.Peptide agonist of the thrombopoietin receptor as potent as the natural cytokine [J].Science,1997,276(5319):1696-1699.
[23]Wang B S,Zhang R J,Bona C A,et al.Promotion of animal growth with a monoclonal anti-idiotype specific to anti-porcine growth hormone antibody [J].Molecular Immunology,1994,31(9):651-656.
[24]Gardner M J,Morrison C A,Stevenson L Q,et al.Production of anti-idiotypic antisera to rat GH antibodies capable of binding to GH receptors and increasing body weight gain in hypophysectomized rats [J].Journal of Endocrinology,1990,125(1):53-59.
Preparation and identification of growth hormone receptor agonist
LI Yu-meng,HONG Pan,LAN Hai-nan,WU Tian-cheng,ZHENG Xin
(CollegeofAnimalScience,JilinAgriculturalUniversity,Changchun,Jilin130118,China)
Abstract:【Objective】 This study prepared monoclonal antibody of growth hormone receptor and investigated its effect on activation of growth hormone receptor to provide new ideas for studying growth hormone analog.【Method】 The monoclonal growth hormone receptor antibody to GH was prepared through hybridoma technology using immunized BALB/c mice with extracellular domain (GHBP).Then,monoclonal antibody was screened by flow cytometry.Its effect on activation of growth hormone receptor was also explored by flow cytometry and laser confocal microscope technology and the intracellular signaling pathways were explored by Western-blot.【Result】 A total of 30 monoclonal antibodies secreting anti-growth hormone receptor were obtained by hybridoma technique,and monoclonal antibody with receptor agonist activity (named as L8) was screened by flow cytometry.Competitive binding analysis showed that L8 and growth hormone overlapped on epitope of receptor.Laser confocal microscope observation showed that L8 can not only combine to growth hormone receptor on cell surface,but also internalize into cell body.L8 can bind to growth hormone receptor on the surface of CHO-GHR638 which transfected GHR gene and trigger JAK2-STAT5 and ERK1/2 signal transduction pathway with dose-dependence.【Conclusion】 Antibodies of growth hormone receptor can be used as receptor agonist.It may activate receptor by inducing conformational changes of the receptor and triggering JAK2-STAT5 signal transduction pathway.
Key words:growth hormone;anti-growth hormone receptor antibody;signal transduction pathway
DOI:网络出版时间:2016-04-0709:0010.13207/j.cnki.jnwafu.2016.05.003
[收稿日期]2014-09-19
[基金项目]吉林省教育厅应用基础项目“猪生长激素模拟肽与生长激素受体结合特异性的研究”(吉教科合字[2012]第39号);“十二五”农村领域国家科技计划项目(2013BAD10B00)
[作者简介]李雨萌(1990-),女,吉林大安人,在读硕士,主要从事细胞生物学研究。E-mail:13843139909@163.comE-mail:zhengxin_3@yahoo.com
[通信作者]郑鑫(1965-),女,吉林长春人,教授,博士,博士生导师,主要从事动物营养免疫与调控研究。
[中图分类号]Q575+.11
[文献标志码]A
[文章编号]1671-9387(2016)05-0013-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160407.0900.006.html
