5-HT1B受体亚型对小脑顶核介导的运动行为的影响*
2016-06-05高伟王楠乔虎
高伟,王楠,乔虎
赵明1△,崔晓雪2,于淼2,王伊林2,龙杰2,赵强1
5-HT1B受体亚型对小脑顶核介导的运动行为的影响*
高伟1△,王楠2,乔虎2
(1.西安理工大学体育部,陕西西安710048;2.西安交通大学医学部,陕西西安710061)
目的:探讨5-羟色胺(5-HT)能神经系统在经小脑顶核介导的运动行为中的作用。方法:采用大鼠离体脑片膜片钳及大鼠走步机的行为学测试方法。结果:阻断5-HT1B受体能够增强小脑顶核兴奋性突触传递,行为学试验中给予5-HT及5-HT1B受体阻断剂SB224289,发现注射5-HT到小脑顶核后,大鼠在Rota-rod走步机上的持续时间显著延长,而给予其阻断剂SB224289后,能够反转此作用。结论:5-HT很可能通过5-HT1B受体抑制顶核神经元的兴奋性突触传递从而调节小脑核团神经元环路的活动,继而影响小脑的最终输出,实现对小脑顶核介导的运动平衡和协调能力的调控。
5-HT;5-HT1B受体;小脑顶核;兴奋性突触后电流;大鼠;膜片钳
5-羟色胺(5-hydroxytryptamine,5-HT)属于单胺类神经递质,是中枢系统中重要的神经递质和调质。5-HT能神经元起源于大脑中缝核、延髓及脑桥网状结构,直接投射于小脑核团从而支配小脑皮层。而小脑皮层是参与运动调节的最主要的结构之一,在动物的平衡控制、肌张力调节、协调个体动作的精准性和随意运动控制中发挥重要作用[1-5]。小脑传入信息经过一系列整合和处理后,主要由小脑内部深层核团接受。顶核(fastigial nucleus,FN)作为小脑深部的三大核团之一,能接受来自小脑皮层,苔状纤维和爬行纤维的相关运动信息,以及包括5-HT能纤维传入在内的第三类传入系统传来的信息,从而控制躯干和肢体近端肌肉的运动[4-6]。但目前为止,中枢5-HT能传入纤维对经小脑顶核介导的运动行为的作用尚不明确,对其潜在的神经机制仍不清楚。5-羟色胺受体家族庞大,依据其不同分子结构及药理学特性,迄今已发现14种不同亚型。这些受体都广泛但不均一的分布于中枢和外周神经系统中,介导着脑内兴奋性或抑制性的神经传递。其中5-HT1B受体广泛分布于浦肯野(Purkinje)细胞上、或在投射到核团中的浦肯野细胞轴突终末或来自于苔状纤维的谷氨酸能末梢上[7]。该受体属于G蛋白偶联受体家族。在突触前与突触后均有分布,可与Gi蛋白结合,抑制腺苷酸环化酶,下调cAMP生成,介导着脑内兴奋性或抑制性的神经传递。5-HT1B受体可以调节5-HT的释放,已被证明参与多种生理功能,主要包括运动积极性,运动协调性和情感行为[8,9]。但是5-HT1B受体对小脑神经元的活动发挥何种效应?这种效应对运动行为产生什么样的影响?均需要进行探讨。为此,本研究采用大鼠离体脑片膜片钳技术研究5-HT1B受体在小脑顶核兴奋性突触传递中的作用并观察其对大鼠运动行为学的影响。
1 材料与方法
1.1材料
实验动物均为健康雄性SD大鼠,来自西安交通大学动物中心。单笼饲养,自由进食进水,同时保证恒定温度、湿度,光暗周期为12 h。根据“Principles of Laboratory Animal Care”(NIH publication no.85-23)和西安交通大学动物保护委员会制定的条例,整个实验流程最大程度的减轻动物所受的痛苦和减少所用动物数量。实验中需要的药品用0.15%的DMSO将5-TH及拮抗剂SB224289溶解,并置于-20℃存储。实验时将其稀释至所需浓度进行操作。
1.2小脑薄片的制备
将大鼠腹腔注射4%的水合氯醛(0.4 g/kg体重)麻醉,快速断头,用持针器剥离开颅骨,将脑组织取出,整个操作应该在冰上完成,控制时间在5 min左右。期间使用95%医用氧气将人工脑脊液充至饱和,最后将脑组织放入0℃的人工脑脊液静置1 min,后沿矢状面修剪掉一侧小脑半球,用502胶水将另一半和琼脂块一起粘于振动切片机(DTK-1 000 DosakaEM,Japan)载物台上,沿矢状面切取厚度为300μm的脑片,之后将其放入通有95%医用氧气的孵育槽中,室温下孵育1 h。为获得活性状态好的神经元,制备脑片的整个过程越快越好,并且在冰上进行,用来剥离脑片的整套器械要提前预冷,以减少对脑组织的物理损伤。
1.3全细胞膜片钳记录
将孵育后的小脑薄片移入半浸式脑片灌流槽,将蠕动泵的流速调至2.2~2.6 ml/min,首先在低倍镜(×10)下寻找记录的位置。缓慢移动载物台并结合大鼠脑图谱,将视野移至大鼠小脑顶核区,之后切换到高倍镜(水镜×40)寻找表面光滑,轮廓清晰的神经元,并将其移至视野正中央。找到细胞后,再次转换回低倍镜,安放电极。实验中所用记录电极是美国Sutter公司提供的电极(外径是1.2 mm,内径是0.69 mm)。用水平拉制仪(P-87,Sutter,USA)采用两次拉制,拉制的电极阻抗一般为2~4 MΩ。我们用含Cs电极内液(其成分:单位mmol/L: Cs2SO4,110;CaCl2,0.5;MgCl2,2;EGTA,5; HEPES,5;etraethylammonium-Cl,5;)用CsOH调节pH值至7.2~7.4,渗透压为290~320 mOsm。打开测试方波,给予约4 ml空气的正压,使用微操使电极入水。当电极碰触到细胞表面时,移去正压,并给予负压,封接成功,可以看到软件界面的测试方波慢慢变为一条直线,此时将钳制电压设为-70 mV,并且进行快电容补偿(c-fast),当封接电阻达到GΩ以上后,进行慢电容补偿(c-slow)。准备破膜,破膜时可以看到快变电容所引起的两个尖波在电压钳模式下,膜电位被钳制到-70 mV以维持细胞正常的生理状况。ACSF中加入20μmol/L的Bicuculline用来阻断GABA受体介导的抑制性突触后电流。双钨丝电极放在小脑蚓部皮质,用频率为0.025 Hz,持续时间为0.3 ms,刺激强度范围为0.25~0.5 mA,通过每次0.05 mA阶梯式增加刺激强度,根据最终反应结果确定最佳实验刺激强度(最大反应幅值的50%)。待诱发的兴奋性突触后电流(eEPSCs)稳定至少10 min后,用之前确定的最佳刺激强度诱发eEPSCs(对照组CP),并将给药后10 min记录数据视为药物组(PD),然后洗脱10 min并将记录数据标记为洗脱组(WO)。所有的记录与刺激程序都通过美国Axon Digidata 1440A放大器控制。此外,实验过程如果电阻Rs变化超过30%,或静息膜电位小于-50 mV,则舍弃不用。
1.4动物手术
大鼠经腹腔注射2.5%戊巴比妥钠溶液(50 mg/kg),待麻醉后,将其头部固定于脑立体定位仪上,头部剪毛备皮,用碘伏消毒,在大鼠脑部做一正中切口,暴露颅骨,用双氧水进行伤口止血。根据大鼠脑立体定位仪图谱,确定小脑顶核坐标,为前囟前11.4~11.6 mm,中线旁开1.2 mm,进针深度为5.4~5.6 mm。根据此坐标在大鼠双侧小脑顶核正上方打孔,将用于微量注射的两根不锈钢套管植入小脑内,并用不锈钢螺丝和牙科水泥将套管固定于颅骨上。手术后每只大鼠给予肌注两万单位青霉素抗感染,动物均单笼饲养,自由饮水取食。饲养间温度维持在22℃~26℃,光照时间为12 h/d。整个实验过程尽可能地减少对动物的伤害及所用动物的数量。
1.5行为学测试
本实验中使用Rota-rod(XR1514-RZPR)走步机测试,大鼠随机分为3组:Saline组(n=12),5-HT组(n=10),SB224289组(n=12)。所有大鼠均选择上午9:00开始进行测试,在正式实验前每只大鼠先进行连续5 d至少10次以上的训练,用于稳定大鼠的行为学实验。测试分为4个阶段:给药前、给药后5 min、给药后4 h、给药后24 h。
行为学实验给药时,先将实验鼠放入小动物麻醉机(RWD isoflurane R580)的玻璃罩中,30 s后大鼠麻醉,将其取出用吸入式麻醉机的透明的面罩置于大鼠口鼻端后开始给药。将Hamilton微量注射器的不锈钢针插入套管,使其顶端超出套管末端2 mm,以保证注射位点正好落在顶核的表面。药物每侧注射1μl,持续注射2 min,结束后停针2 min。以利药物充分吸收,退针后将套芯重新插入套管中。所用药物包括:5-HT(50μmol/L),选择性5-HT1B受体阻断剂SB224289(10μmol/L),以及生理盐水。分别注射到不同组别大鼠的双侧顶核,以评估小脑5-HT能神经传入对大鼠运动行为学的影响。根据Song YN相关研究[10],1μl的注射量在核团内的作用范围不超过2.0 mm,因此,本实验中注射药物的有效范围将局限在小脑顶核内。给药后恢复5 min (一般情况小动物麻醉机面罩去掉后,大鼠会迅速恢复清醒),马上进行单只大鼠5 min时间点的行为学实验。大鼠首先在低速(4 r/min)状态下适应30 s,然后将横梁的转速在3 min内从4 r/min匀加速到60 r/min。在大鼠麻醉恢复期间可以进行下一只大鼠的给药操作。将一个处理组所有给药大鼠的实验完成后。开始测量4 h时间点的行为数据,最后测量24 h的行为学数据。其中,24 h的测试时,每只大鼠测量3次,每次间隙5 min,以减少动物紧张和疲劳。
根据HeYC等研究确定5-HT和拮抗剂的使用初始浓度梯度[11],预实验中使用5-HT和拮抗剂的浓度分别为1μmol/L,10μmol/L、50μmol/L、100 μmol/L发现。给予50μmol/L的5-HT时,大鼠的在走步机的停留时间最长。拮抗剂使用10μmol/L浓度时,大鼠在走步机的停留时间最短。由此确定了行为学实验的药物浓度。
1.6统计学处理
数据用SPSS 13.0统计软件进行统计分析,用Origin 7.0作图。膜片钳数据利用Clampfit 9.0采集响应电流的幅度以CP最大幅值作为100%,PD和WO的计算公式为分别为:PD-CP/CP×100%及WO-CP/CP×100%。行为学数据用走步机计数器进行采集。所有数据用均数±标准差(珋x±s)表示,用独立样本t检验、单因素方差分析进行数据处理。
2 结果
离体脑片全细胞膜片钳记录发现,给予5-HT1B受体拮抗剂SB224289(10μmol/L)时,相比于给药前,诱发的兴奋性突触后电流(eEPSCs)波幅呈现显著的增加。小脑顶核eEPSCs的幅度较给药前分别增加(49.52±7.91)%(P<0.05,图1 a),洗脱10 min后,eEPSCs的幅度恢复到给药前的(104.99± 12.67)%(图1b)。
2.2微量注射5-HT1B受体阻断剂显著对大鼠运动能力的影响
加速Rota-rod走步机测试显示,给药前34只大鼠的平均成绩为(95.7±2.1)s。当注射5-HT到顶核5 min后,大鼠在Rota-rod走步机上的持续时间显著延长(P<0.01,图2),给药后4 h和24 h后逐渐恢复到给药前状态;而微量注射SB224289(n= 12)到小脑顶核5 min后,大鼠在走步机上停留的时间显著缩短(P<0.01,图2),同样在给药4 h和24 h后逐渐恢复到初始状态。上述结果提示5-HT可以增强大鼠的运动能力,在这个过程中5-HT1B受体发挥了重要作用。
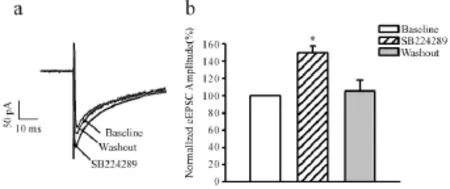
Fig.1 The analysis of the changes in excitatory synaptic transmission in the cerebella fastigial nucleus a.The scope of 5-HT1 receptor antagonist SB224289(10 μmol/L,n=10);b.The cartogram of SB224289(10 min,bias)and the eEPSCs of WO(10 min,grey)*P<0.05 vs baseline group
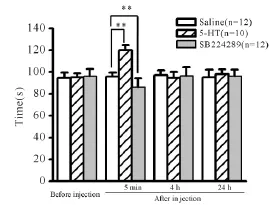
Fig.2 Motor performances of rats in saline group,5-HT-injected group,SB224289-injected group in accelerating rotarod test(珋x±s)**P<0.01 vs saline group
2.1选择性地阻断5-HT1B受体对小脑顶核兴奋性突触传递的影响
3 讨论
小脑5-HT能神经传入是继苔状纤维和爬行纤维外最大的传入系统。但5-HT能神经系统在经小脑介导的运动行为中所起的作用及其潜在的神经机制有待研究。小脑中存在多种类型的5-HT受体,Yew等人发现小鼠小脑细胞层和分子层含有少量5-HT1A阳性细胞,5-HT2A阳性细胞数比较多,但是小鼠Purkinje细胞层中没有5-HT1A及5-HT2 A受体[12];大鼠小脑中有少量5-HT2A及5-HT2B mRNA表达[13];同样5-HT5A、5-HT4和5-HT6在小脑中的含量也非常低[14,15]。而Boschertd等研究发现在purkinje细胞主要分布着5-HT1B受体的mRNA,但是这些细胞受体结合位点很少,相反,在包含顶核在内的小脑深部核团,也就是purkinje细胞投射的主要区域,才存在稳定的受体结合位点[16]。Sari研究发现,在大鼠中枢神经系统使用缩氨酸抗体识别5-HT1B受体进行定位发现,最密集的5-HT1B受体免疫反应性发生在腹侧苍白球,苍白球、黑质。此外,中等密度的免疫反应性发生在小脑核团、上丘灰质层和尾状核[17]。Murano等[18]研究发现5-HT1B受体广泛分布于浦肯野细胞上,小脑核团中也存在5-HT1B受体,主要分布在投射到核团中的浦肯野细胞轴突终末或来自于苔状纤维的谷氨酸能末梢上。Singer等人[19]发现5-HT作用于突触前5-HT1B受体,通过减少囊泡释放的几率抑制了舌下神经核中谷氨酸介导的兴奋性突触传递。同样突触前5-HT1受体的激活可以抑制丘脑顶核兴奋性及抑制性突触后电流[20]。与前期文献报道相一致,我们采用离体电生理技术,给予5-HT也使小脑顶核内兴奋性突触传递效能被抑制,而选择性地阻断5-HT1B受体,兴奋性突出传递效能增加。有研究发现,5-HT能够通过激活苔藓纤维突触前终末的5-HT1B受体减少诱发的兴奋性突触后电流的幅度(eEPSCs),在灌流液中加入5-HT后所诱发的LTD的幅度也是明显减少的,提示5-HT不仅能够短暂的抑制苔藓纤维诱发的eEPSCs,并且在调节长时程突触效能方面起着重要的作用[18]。因此可以看出,5-HT可以调节谷氨酸和GABA的释放,而且很可能通过5-HT1B受体抑制核团神经元的兴奋性突触传递,从而调节小脑核团神经元环路的活动,继而影响到初级小脑环路的信息整合,以及脊髓小脑的最终输出来实现对运动行为的调控。
中枢5-HT能神经系统在运动调控中起着重要的作用,目前在运动控制中心(苍白球,黑质和小脑的深核)发现了大量的5-HT1B受体,表明其参与了运动行为的调控[21,22]。基因敲除5-HT受体后的小鼠在旷场实验中减少了整个旷场的垂直探索和旷场中央的水平探索,在高架十字迷宫实验中表现出在开放臂停留时间减少等不同程度的运动功能异常[23],说明中枢5-HT的确参与了运动行为的调控。在本研究中,通过向小脑顶核微量注射的方法评估5-HT及其他5-HT能药物对顶核介导的运动行为的影响,注射5-HT后,大鼠在Rota-rod走步机运动成绩显著提高。而注射5-HT1B的阻断剂,以阻断顶核内内源性5-HT传入则显著降低大鼠的运动能力。这些结果说明,5-HT或5-HT能传入可以通过调节小脑核团神经元环路的活动来增强大鼠的运动能力,在这一过程中5-HT1B受体发挥了重要的作用。因此,可以推测小脑5-HT能神经传入可以通过对小脑顶核神经元环路的调节,影响小脑的最终输出,从而实现对小脑介导的运动平衡和协调能力的调控。
[1]Ito M.The modifiable neuronal network of the cerebellum[J].Jpn J Physiol,1984,34(5):781-792.
[2]杨东升,刘晓莉,乔德才.力竭运动及恢复期大鼠纹状体5-HT、DA及其代谢物浓度的动态变化研究[J].中国应用生理学杂志,2011,27(4):432-436.
[3]张健,胡旺平,周克纯,等.5-HT2和5-HT3受体在外周初级感觉神经末梢痛反应和痛调制中的相互作用[J].中国应用生理学杂志,2006,22(1):40-44.
[4]刘洪珍,曾莉,孔喜良,等.复方中药对大鼠力竭运动与恢复过程中端脑神经递质含量的影响[J].中国应用生理学杂志,2011,27(4):439-443.
[5]Schweighofer N,Doya K,Kuroda S.Cerebellar aminergicneuromodulation:towards a functional understanding[J].Brain Res Brain Res Rev,2004,44(2-3):103-116.
[6]Mori S,Matsui T,Kuze B,et al.Stimulation of a restricted region in the midline cerebellar white matter evokes coordinated quadrupedal locomotion in the decerebrate cat[J].J Neurophysiol,1999,82(1):290-300.
[7]Sari Y.Serotonin1B receptors:from protein to physiological function and behavior[J].Neurosci Biobehav Rev,2004,28(6):565-82.
[8]Griebel G,Saffroy-Spittler M,Misslin R,etal.Serenicsfluprazine(DU 27716)and eltoprazine(DU 28853)enhance neophobic and emotional behaviour in mice[J].Psychopharmacology(Berl),1990,102(4):498-502.
[9]Boulenguez P,Foreman N,Chauveau,et al.Distractibility and locomotor activity in rat following intra-collicular injection of a serotonin 1B-1D agonist[J].Behav Brain Res,1995,67(2):229-239.
[10]Song YN,Li HZ,Zhu JN,et al.Histamine improves rat rots-rod and balance beam performances through H(2) receptors in the cerebellar interpositus nucleus[J].Neurosci,2006,140(1):33-43.
[11]He YC,Wu GY,Li D,et al.Histamine promotes rat motor performances by activation of H(2)receptors in the cerebellar fastigial nucleus[J].Behav Brain Res,2012,228(1):44-52.
[12]Yew DT,Yeung LY,Wai MS,et al.5-HT 1A and 2A receptor positive cells in the cerebella of mice and human and their decline during aging[J].Microsc Res Tech,2009,72(9):684-689.
[13]Choi DS,Maroteaux L.Immunohistochemicallocalisation of the serotonin 5-HT2B receptor in mouse gut,cardiovascular system,and brain[J].FEBS Lett,1996,391 (1-2):45-51.
[14]Gérard C,el Mestikawy S,LebrandC,et al.Quantitative RT-PCR distribution of serotonin 5-HT6 receptor mRNA in the central nervous system of control or 5,7-dihydroxytryptamine-treated rats[J].Synapse,1996,23 (3):164-173.
[15]Geurts FJ,De Schutter E,Timmermans JP.Localization of 5-HT2A,5-HT3,5-HT5A and 5-HT7 receptor-like immunoreactivity in the rat cerebellum[J].Neuroanat,2002,24(1):65-74.
[16]Boschert U,Amara DA,SeguL,et al.The mouse 5-hydroxytryptamine1B receptor is localized predominantly on axon terminals[J].Neurosci,1994,58(1):167-182.
[17]Sari Y,Miquel MC,Brisorgueil MJ,et al.Cellular and subcellular localization of 5-hydroxytryptamine1B receptors in the rat central nervous system:immunocytochemical,autoradiographic and lesion studies[J].Neurosci,1999,88(3):899-915.
[18]Murano M,Saitow F,Suzuki H.Modulatory effects of serotonin on glutamatergic synaptic transmission and longterm depression in the deep cerebellar nuclei[J].Neurosci,2011,172:118-128.
[19]Singer JH,Bellingham MC,Berger AJ.Presynaptic inhibition of glutamatergic synaptic transmission to rat motoneurons by serotonin[J].J Neurophysiol,1996,76(2): 799-807.
[20]Shen KZ,Johnson SW.5-HT inhibits synaptic transmission in rat subthalamic nucleus neurons in vitro[J].Neurosci,2008,151(4):1029-1033.
[21]De Souza RJ,Goodwin GM,Green AR,et al.Effect of chronic treatment with 5-HT1 agonist(8-OH-DPAT and RU 24969)and antagonist(isapirone)drugs on the behavioural responses of mice to 5-HT1 and 5-HT2 agonists[J].Br J Pharmacol,1986,89(2):377-384.
[22]Green AR,Guy AP,Gardner CR.The behavioural effects of RU 24969,a suggested 5-HT1 receptor agonist in rodents and the effect on the behaviour of treatment with antidepressants[J].Neuropharmacol,1984,23 (6):655-661.
[23]Kalueff AV,Jensen CL,Murphy DL.Locomotory patterns,spatiotemporal organization of exploration and spatial memory in serotonin transporter knockout mice[J].Brain Res,2007,1169:87-97.
赵明1△,崔晓雪2,于淼2,王伊林2,龙杰2,赵强1
(1.内蒙古民族大学第一临床医院,2.内蒙古民族大学,通辽028000)
【摘要】目的:研究阿霉素损伤心肌细胞miRNA378与网腔钙结合蛋白(calumenin)、内质网应激相关性。方法:原代培养乳鼠心肌细胞分为6组:对照组、阿霉素组、miRNA378过表达对照组、miRNA378过表达组、miRNA378沉默对照组、miRNA378沉默组,采用免疫组化法检测细胞α-SMA蛋白;慢病毒质粒转染心室肌细胞,实时荧光定量PCR技术检测各组心肌细胞miRNA378、calumenin及葡萄糖调节蛋白78(GRP78)mRNA表达。结果:与阿霉素组相比较,miRNA378过表达组心肌细胞calumenin mRNA表达增加(P<0.01),而GRP78 mRNA表达减少(P<0.01);与阿霉素组相比较,miRNA378沉默组calumenin及GRP78 mRNA表达无统计学差异。结论:阿霉素损伤乳鼠心肌细胞是通过减少calumenin蛋白表达进而引起内质网应激,该作用通过上调miRNA378得到缓解。
【关键词】阿霉素;内质网应激;miRNA378;网腔钙结合蛋白;乳鼠
The effects of 5-HT1Breceptor subtypes on motor behaviors mediated by cerebellar fastigial nucleus
GAO Wei1△,WANG Nan2,QIAO Hu2
(1.Department of Physical Education,Xi'an University of Technology,Xi'an 710048; 2.Department of Physiology and Pathophysiology,Xi'an Jiaotong University School of Medicine,Xi'an 710061,China)
Objective:To investigate the effects of the serotonergic nervous system on motor behaviors mediated by cerebellar fastigial nucleus(FN).Methods:In this experiment,the main methods are whole-cell patch clamp recording and Rota-rod test.Results:We found that the excitatory synaptic transmission was enhanced in the cerebella FN after blocking 5-hydroxytryptamine,(5-HT) receptor.Microinjection of5-HT into FNs remarkably promoted motor performances on Rota-rod,which could be reversed by microinjection of 5-HT receptor antagonist SB224289.Conclusion:These results suggest that the 5-HT can suppress cerebellar FN excitatory synaptic transmission via 5-HT1Breceptors,thereby modulate the activity of cerebellar nuclear neurons circuitry,and subsequently influence the cerebellum-mediated ongoing motor balance and coordination.
5-HT;5-HT1Breceptor;fastigial nucleus(FN);excitatory post-synaptic currents;rat;patch clamp
Q429【
】A【文章编号】1000-6834(2016)06-550-05
10.13459/j.cnki.cjap.2016.06.014
R331.3;R332【文献标识码】A
1000-6834(2016)06-555-04
国家自然科学基金项目(30900544)
2016-01-04
2016-05-26
△【通讯作者】Tel:029-82312959;E-mail:59073939@qq.com
【DOI】10.13459/j.cnki.cjap.2016.06.015
猜你喜欢
杂志排行
中国应用生理学杂志的其它文章
- Changes of microcirculation in healthy volunteers and patients with septic shock in Xining
- Iptakalim ameliorates relaxation to acetylcholine in thoracic aortic rings impaired by microvesicles derived from hypoxia/ reoxygenation-treated HUVECs
- Association study between the angiotensin converting enzyme gene insertion/deletion polymorphism and Qinghai Han Chinese with congenital heart disease
- The infl uence of heterogeneity on the analysis of sleep-wake architecture in the single-prolonged stress rats
- Effect of creatine phosphate sodium on miRNA378, miRNA378* and calumenin mRNA in adriamycin-injured cardiomyocytes
- 当归黄芪提取物对慢性腹膜功能衰竭大鼠腹膜功能、结构及TGF-β1表达的影响*
