人参皂苷Rg1对阿霉素引起的血管内皮细胞损伤的作用及机制研究
2020-09-21马铂涵韩兵刘婷王一黄建华陶贵周
马铂涵,韩兵,刘婷,王一,黄建华,陶贵周
(1.锦州医科大学附属第一医院,辽宁 锦州 121000;2.青岛市即墨区中医医院,山东 青岛 266200)
阿霉素是一种抗肿瘤抗生素,抗瘤谱较广,对乳腺癌等肿瘤有一定疗效。可是,阿霉素具有许多副作用,最明显的为心脏毒性[1-2]。阿霉素诱导的心肌细胞损伤的主要特征是心肌细胞内活性氧(reactive oxygen species,ROS)引起的细胞凋亡[3-4]。目前关于阿霉素可引起心脏毒性的研究侧重于心肌细胞在阿霉素损伤心脏中的作用,而对血管内皮细胞在阿霉素损伤心脏中的作用研究较少。近来研究发现血管内皮细胞在阿霉素损伤心脏中起重要作用[5]。有文献报道人参皂苷Rg1 对血管内皮细胞具有保护作用[6-7]。近期研究发现Rg1 可以防止阿霉素引起的心脏毒性[8]。提示Rg1 除了保护心肌细胞外,还可能通过保护心脏血管内皮细胞从而防止阿霉素对心脏产生的损伤。本实验通过体外阿霉素损伤血管内皮细胞,观察人参皂苷Rg1 对阿霉素损伤后的血管内皮细胞增殖、迁移、小管形成、凋亡及ROS 的影响,并初步探讨其机制。
1 材料与方法
1.1 材料与试剂
人脐静脉血管内皮细胞(human umbilical vein vascular endothelial cells,HUVECs)购自中国科学院上海细胞库。人参皂苷Rg1 购自南京景竹生物科技有限公司,阿霉素购自美国APExBIO 公司,DMEM-F12培养基购自美国Hyclone 公司,胎牛血清购自美国CLARK Bioscience 公司,胰酶购自加拿大Gibco 公司,Matrigel 购自美国BD 公司,Annexin V-FITC/PI 购自北京四正柏公司,Hochst33342、NO 荧光指示染料DAF-FM DA、超氧化物阴离子荧光探针及MTT 购自上海碧云天生物技术有限公司,p-Akt、Akt、Bcl-2、p-ERK、ERK、p-eNOS、eNOS、Actin 及二抗均购自美国CST 公司。
1.2 分组
本研究分为正常组(未做任何处理)、阿霉素组(0.5μg/ml)、阿霉素+Rg1 组(0.5μg/ml 阿霉素+200μg/ml Rg1),阿霉素的用药剂量及作用时间点均参考LORENZO 等[9]的方法。
1.3 MTT 法
待HUVECs 生长至90%~95%丰度时,消化、计数接种于96 孔板中(5 000 个/孔)。各组药物处理48 h 后行MTT 法检测,观察人参皂苷Rg1 对血管内皮细胞增殖的影响。
1.4 划痕实验
将消化、计数的HUVECs 按照4.0×105个/孔接种于6 孔板中,待细胞生长至90%~95%丰度时,用200μl 枪头在培养皿底垂直划一道痕,轻轻吸去细胞碎片及培养基,PBS 冲洗1 遍。分别在药物处理0、48 h 后用倒置显微镜拍照观察人参皂苷Rg1 对血管内皮细胞迁移的影响。
1.5 小管形成实验
提前一晚将小管形成实验所需的Matrigel 基质胶、24 孔板、200μl 枪头放置于4℃冰箱过夜备用。次日,取200μl Matrigel 基质胶缓慢铺于24 孔板中(防止产生气泡),放置培养箱中孵育30 min 后,每孔加入1.0×105个HUVECs 和1 000μl 完全培养基。在37℃、5%二氧化碳条件下孵育6 ~8 h,用倒置显微镜进行跟踪拍照,观察人参皂苷Rg1 对血管内皮细胞小管形成的影响。
1.6 流式细胞术
将HUVECs 按4.0×105个/孔接种于6 孔板中,药物处理48 h 后进行Hochst33342 染色,观察人参皂苷Rg1 对阿霉素引起的血管内皮细胞凋亡的影响。为进一步明确人参皂苷Rg1 对阿霉素引起的血管内皮细胞凋亡的影响,消化并收集血管内皮细胞(5.0×105个/孔),重悬后进行Annexin V-FITC/PI 染色,用流式细胞仪检测人参皂苷Rg1 对血管内皮细胞凋亡的影响。
1.7 NO 及ROS 检测
将HUVECs 按4.0×105个/孔接种于6 孔板中,药物处理48 h 后进行NO 和ROS 检测。检测NO 时,将HUVECs 加入含DAF-FMDA(5μmol/L)的溶液,在室温下孵育30 min。检测ROS 时,将HUVECs 加入含超氧化物阴离子荧光探针(5μmoL/L)的溶液,室温下孵育30 min,在倒置荧光显微镜下观察拍照。
1.8 Western blotting 检测
将培养的HUVECs 用药物处理48 h 后,收取细胞并提取蛋白,进行BCA 蛋白定量及制样。依据不同目的蛋白分别配置10%或12% SDS-PAGE,PVDF 膜转膜,洗膜液清洗1 次,5 min/次,封闭2 h,分别加入Bcl-2、ERK、p-ERK、Akt、p-Akt、eNOS 及p-eNOS一抗4℃孵育过夜,次日洗膜液清洗3 次,5 min/次,加入辣根过氧化物酶标记的二抗,室温孵育2 h,洗膜液清洗3 次,5 min/次,加入化学发光液曝光显影,观察人参皂苷Rg1 对凋亡通路及p-Akt/p-eNOS 信号通路的影响。
1.9 统计学方法
数据分析采用SPSS 17.0 统计软件。计量资料以均数±标准差(±s)表示,比较用方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 人参皂苷Rg1 提高阿霉素损伤的血管内皮细胞的活性
MTT 法结果显示,正常组、阿霉素组和阿霉素+Rg1组细胞活性分别为(100.00±0.00)%、(37.89±6.17)%和(56.51±7.23)%,经方差分析,差异有统计学意义(F=179.649,P=0.000)。与正常组比较,阿霉素组细胞活性降低(P<0.05);与阿霉素组比较,阿霉素+Rg1 组能提高血管内皮细胞的活性(P<0.05)。见图1。
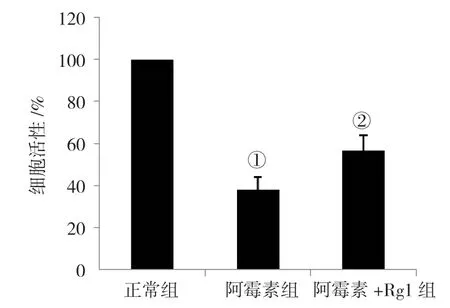
图1 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞活性的影响 (±s)
2.2 人参皂苷Rg1 改善阿霉素损伤的血管内皮细胞迁移及小管形成状态
各组细胞迁移率、血管形成交叉点数比较,差异有统计学意义(P<0.05)。与正常组比较,阿霉素组细胞迁移率、血管形成交叉点数降低(P<0.05);与阿霉素组比较,阿霉素+Rg1 组能够改善受损伤血管内皮细胞的迁移及小管形成状态(P<0.05)。见表1和图2、3。
表1 各组细胞迁移率、血管形成交叉点数比较 (±s)

表1 各组细胞迁移率、血管形成交叉点数比较 (±s)
注: ①与正常组比较,P <0.05;②与阿霉素组比较,P <0.05。
组别 迁移率/% 血管形成交叉点数正常组 81.598±4.416 122.600±10.615阿霉素组 49.211±3.181① 46.800±5.973①阿霉素+Rg1 组 72.132±6.655② 108.200±7.302②F 值 103.463 144.003 P 值 0.000 0.000

图2 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞迁移的影响 (×40)

图3 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞小管形成的影响 (×40)
2.3 人参皂苷Rg1 减少阿霉素损伤的血管内皮细胞的凋亡
Hochst33342 染色显示,药物作用48 h 后,正常组细胞核呈浅蓝色;阿霉素组细胞核染色质浓缩并分裂,明显发亮;阿霉素+Rg1 组相对于阿霉素组,亮蓝色斑点明显减少。提示人参皂苷Rg1 对阿霉素损伤的血管内皮细胞的凋亡有保护作用。见图4。
流式细胞术结果显示,正常组、阿霉素组和阿霉素+Rg1 组细胞凋亡率分别为(2.16±0.36)%、(17.07±1.30)%和(6.65±0.47)%,经方差分析,差异有统计学意义(F=259.132,P=0.000)。与阿霉素组比较,阿霉素+Rg1 组减少阿霉素引起的细胞凋亡(P<0.05)。见图5、6。
2.4 人参皂苷Rg1 对阿霉素损伤后血管内皮细胞ROS 及NO 水平的影响

图4 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞的Hochst33342 染色结果 (×200)

图5 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞凋亡的影响

图6 各组细胞凋亡率比较 (±s)
DAF-FMDA 是一种NO 定量检测的荧光探针,NO 含量越高绿色荧光表达越强。超氧化物阴离子荧光探针是最常用的检测细胞内超氧化物阴离子水平的荧光探针,当细胞内的超氧化物阴离子水平较高时,红色荧光较强,反之则较弱。各组药物处理48 h 后NO 及ROS 平均荧光强度比值比较,差异有统计学意义(P<0.05)。与阿霉素组比较,阿霉素+Rg1 组阿霉素损伤后的血管内皮细胞NO 升高,ROS 减少。见表2和图7。
表2 各组药物处理48 h 后NO 及ROS 水平比较 (±s)
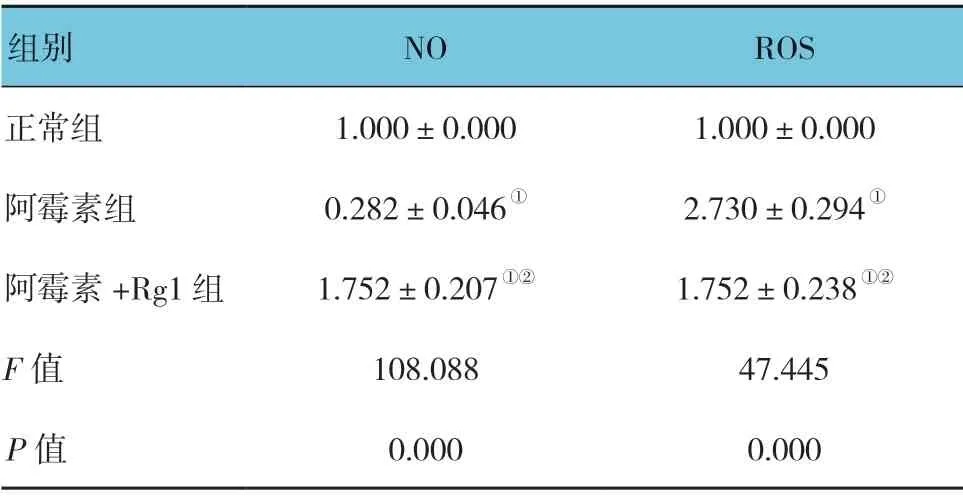
表2 各组药物处理48 h 后NO 及ROS 水平比较 (±s)
注: ①与正常组比较,P <0.05;②与阿霉素组比较,P <0.05。
组别 NO ROS正常组 1.000±0.000 1.000±0.000阿霉素组 0.282±0.046① 2.730±0.294①阿霉素+Rg1 组 1.752±0.207①② 1.752±0.238①②F 值 108.088 47.445 P 值 0.000 0.000
2.5 人参皂苷Rg1 对阿霉素损伤后血管内皮细胞Bcl-2、p-ERK、p-Akt 及p-eNOS 蛋白相对表达量的影响
药物作用48 h 后,各组Bcl-2、p-ERK、p-Akt及p-eNOS 蛋白相对表达量比较,差异有统计学意义(P<0.05)。阿霉素组较正常组低(P<0.05),阿霉素+Rg1 组较阿霉素组高(P<0.05)。见表3和图8。

图7 人参皂苷RG1 对阿霉素所致血管内皮细胞损伤后ROS 及NO 水平的影响 (×200)
表3 各组Bcl-2、p-ERK、p-Akt 及p-eNOS 蛋白相对表达量比较 (±s)

表3 各组Bcl-2、p-ERK、p-Akt 及p-eNOS 蛋白相对表达量比较 (±s)
注: ①与正常组比较,P <0.05;②与阿霉素组比较,P <0.05。
组别 Bcl-2 p-ERK p-Akt p-eNOS正常组 0.605±0.025 1.750±0.228 1.056±0.121 0.870±0.054阿霉素组 0.261±0.015① 0.522±0.062① 0.418±0.085① 0.187±0.021①阿霉素+Rg1 组 0.390±0.015② 0.858±0.115② 0.794±0.057② 0.866±0.054②F 值 263.263 70.621 37.745 222.906 P 值 0.000 0.000 0.000 0.000

图8 人参皂苷Rg1 对阿霉素损伤的血管内皮细胞相关蛋白的影响
3 讨论
阿霉素对心脏的毒性作用表现为急性和慢性损害,导致左心功能下降、扩张型心肌病和心力衰竭。心肌细胞的ROS 及凋亡是阿霉素诱导的细胞损伤的主要特征[3-4]。多种药物可预防阿霉素引起的心脏毒性,如抗氧化剂、金属螯合剂、血管紧张素转换酶和β 受体阻滞剂,并取得了一定程度的成功[4、10-12]。有学者报道,药用植物能预防阿霉素引起的心脏毒性[13-15]。从植物中寻找防止阿霉素心脏毒性的天然化合物,对降低阿霉素对化疗患者心脏毒性具有重要的临床意义。
人参是一种著名的传统中药,因具有强身健体及滋补作用而被人们广泛使用。人参的主要活性成分是人参皂苷,包括Rg1、Rg3、Rh1、Re 和Rd。一些研究表明,Rg1 能防止心脏缺血再灌注损伤,缩小心脏的梗死面积,防止心脏病理性重塑[16-18]。最近研究发现Rg1 可以防止阿霉素引起的心脏毒性。其通过促进Akt 和ERK 的磷酸化,增加Bcl-2 和Bax 的比例,减少细胞色素C 从线粒体释放入胞浆,从而抑制阿霉素引起的心脏细胞凋亡[8]。
既往研究主要注重阿霉素对心肌细胞的损伤,而对血管内皮细胞损伤的研究较为少见。因为血管内皮细胞在心脏病理、生理过程中起重要作用,而阿霉素对血管内皮细胞也具有毒性作用,所以减轻阿霉素引起的血管内皮细胞损伤对保护心脏具有重要意义。RÄSÄNEN 等[5]报道,VEGF-B基因可以通过保护血管内皮细胞抑制阿霉素引起的心脏毒性。而有学者报道Rg1 对血管内皮细胞具有保护作用[6-7]。提示Rg1可以通过保护血管内皮细胞防止阿霉素引起的心脏损伤。本研究发现人参皂苷Rg1 可防止阿霉素引起的心脏血管内皮细胞损伤,包括促进血管内皮细胞增殖、迁移及小管形成,减少ROS 及阿霉素引起的血管内皮细胞凋亡。
ROS 在细胞凋亡中起重要作用。BUCCELLATO等[19]发现,鼠原始细胞上皮细胞暴露于高氧状态导致ROS 产生,同时导致线粒体膜上BAX 的激活、细胞色素C 的释放和细胞凋亡。BAI 等[20]发现,芝麻素通过激活Akt 和ERK,防止因ROS 产生的结肠炎。NO作为一种信号分子,在细胞的生理和病理过程中起重要作用;eNOS 作为NO 诱导合成的限速酶,在抑制细胞凋亡中起重要作用[21]。MU 等[22]研究发现,阿霉素抑制eNOS 表达,引起ROS 增多,而熊果酸通过升高eNOS,抑制ROS,保护阿霉素引起的心脏损伤。活化Akt/eNOS,减少ROS,减少炎症引起的血管内皮细胞凋亡[23];而ERK 通路活化在碱性成纤维细胞生长因子保护脑微血管细胞中起重要作用[24]。本研究发现人参皂苷Rg1 提高Bcl-2、p-Akt、p-ERK 及p-eNOS 的相对表达量,提示人参皂苷Rg1 可能通过增加Bcl-2、p-Akt、p-ERK 及p-eNOS 表达从而减轻阿霉素对血管内皮细胞的损伤。
综上所述,人参皂苷Rg1 可减轻阿霉素引起的血管内皮细胞损伤,可能的机制为通过增加Bcl-2、p-Akt、p-ERK 及p-eNOS 表达从而减轻阿霉素对血管内皮细胞的损伤。
