海胆黄多糖SEP抑制高糖高胰岛素诱导的大鼠乳鼠心肌细胞肥大
2015-04-21周庆峰刘纯慧王洪新
周庆峰,刘纯慧,王洪新
(1.商丘师范学院生物技术药物重点实验室,河南商丘 476000;2.山东大学药学院,山东济南 250100; 3.辽宁医学院药理学教研室,辽宁锦州 121001)
海胆黄多糖SEP抑制高糖高胰岛素诱导的大鼠乳鼠心肌细胞肥大
周庆峰1,刘纯慧2,王洪新3
(1.商丘师范学院生物技术药物重点实验室,河南商丘476000;2.山东大学药学院,山东济南250100; 3.辽宁医学院药理学教研室,辽宁锦州121001)
摘要:目的观察海胆黄多糖SEP对高糖高胰岛素诱导的肥大心肌细胞的影响,并初步探索其作用机制。方法利用高糖高胰岛素模拟糖尿病机体微环境诱导乳鼠心肌细胞肥大模型,选择不同剂量海胆黄多糖SEP分组给药处理后,采用Lowrys法检测心肌细胞蛋白质含量;利用计算机图像分析系统检测心肌细胞表面积变化;采用RT-PCR法检测给药前后心肌细胞ANF和PPAR-α mRNA表达变化。结果与正常对照组相比,高糖高胰岛素组蛋白含量、细胞表面积、ANF和PPAR-α mRNA表达均明显增加;与高糖高胰岛素组相比,低、中、高给药组剂量依赖性降低了高糖高胰岛素诱导的肥大心肌细胞的蛋白含量、细胞表面积、以及ANF和PPAR-α mRNA表达。结论SEP对高糖高胰岛素诱导的乳鼠心肌细胞肥大具有一定的抑制作用,PPAR-α信号通路可能参与了这一过程。
关键词:心肌细胞;肥大;乳鼠;高糖高胰岛素;多糖;SEP
糖尿病心肌病主要表现为心肌细胞肥大和纤维化,是糖尿病的常见并发症之一,发病率高,危害性大[1]。海胆黄多糖(polysaccharide from the eggs of S.nud?us,SEP)是从光棘球海胆的卵中分离到的一种水溶性多糖,具有明显促脾淋巴细胞增殖和抗肿瘤作用[2-3]。已有研究表明,黄芪多糖、人参多糖等多糖类药物可产生抑制心肌细胞肥大作用[4-5],然而海胆黄多糖SEP是否对糖尿病诱导的心肌细胞肥大也具有保护作用,目前仍尚不明确。
糖尿病患者长期处于高糖和高胰岛素内环境,可直接促进心肌细胞蛋白的合成进而诱发心肌细胞肥大,故采用高糖和高胰岛素处理体外培养的心肌细胞,可在一定程度上模拟糖尿病心肌肥大的病理环境[6]。因此,本研究首先采用高糖高胰岛素体外培养大鼠乳鼠心肌细胞来诱导心肌细胞肥大,进而采用海胆黄多糖SEP处理高糖高胰岛素培养下所诱导的肥大心肌细胞,观察海胆黄多糖SEP对肥大心肌细胞的蛋白含量、细胞表面积以及心房利钠因子(atrial natriuretic factor,ANF) mRNA表达的影响,而ANF是心肌细胞肥大的标志性因子[7]。
最新研究表明过氧化物酶体增殖物激活受体-α (peroxisome pro1iferator-activated receptors,PPAR-α)参与了高糖高胰岛素诱导的心肌细胞肥大过程[8],因此,本研究采用定量PCR技术分析SEP对RRAR-α mRNA表达的影响,初步探索SEP影响心肌细胞肥大的可能信号通路。
1 材料与方法
1.1实验动物出生2 d的SD大鼠乳鼠,♀♂不拘,由商丘师范学院生科院提供。
1.2药品与试剂Trypsin、SDS、DMEM培养基、葡萄糖、胰岛素均为Sigma公司产品;牛血清白蛋白为北京化学试剂公司产品;小牛血清为杭州四季青生物材料研究所产品; TRIozol Reagent为宝生物工程有限公司产品;引物合成由南京金斯瑞上生物技术有限公司完成,其它试剂均为国产分析纯。
1.3海胆黄多糖SEP的制备海胆黄多糖多糖SEP的制备按照刘纯慧等[8]研究方法完成。
1.4体外乳鼠心肌细胞原代培养取出生2-3 d 的SD大鼠乳鼠,无菌条件下开胸取出心脏,DHanks液冲洗3次后剪成约1 mm3大小的碎块,加入0.6 g·L-1胰蛋白酶消化细胞,根据差速贴壁法获得较纯的心肌细胞,以1×108·L-1的密度送入通以体积分数为0.05 CO2及0.95空气的二氧化碳孵箱中培养[9]。
1.5实验分组及给药方法常规培养心肌细胞48 h后,换液为无血清的DMEM培养基。将培养板上的细胞分为6组,换培养基的同时给药,每组给药如下:第1组为正常对照组;第2组为给予25.5 mmol·L-1葡萄糖和0.1μmol·L-1胰岛素的高糖高胰岛素组;第3组为在第2组基础上加入1 mg·L-1的低剂量SEP组;第4组为10 mg·L-1的中剂量SEP 组;第5组为100 mg·L-1的高剂量SEP组;第6组为100 mg·L-1的高剂量黄芪多糖(APS)组;给药48 h后 进行各项指标的测定。
1.6培养心肌细胞蛋白质含量的测定吸去培养板各孔中的培养液,用D-Hanks液快速冲洗3次后,加入10 g·L-1SDS (十二烷基硫酸钠) 0.5 mL溶解细胞,根据计数,每孔细胞数约为1×105个,Lowrys法测每孔细胞蛋白质含量。
1.7培养心肌细胞表面积测量采用计算机CIAS大恒细胞图像分析系统(400×)测量单个细胞的直径,进而计算出细胞的表面积。每孔随机选择7个视野,每个视野测10个细胞。
1.8ANF和PPAR-α mRNA的表达检测分析心肌细胞肥大通常伴有ANF的表达,因此本研究通过RT-PCR法检测心肌细胞肥大时ANF mRNA的表达,作为反映观测心肌细胞肥大的参考指标[10]。参照文献及GenBank中大鼠相应基因序列,采用TRIzol提取心肌细胞总RNA,按说明书操作进行逆转录反应,通过琼脂糖凝胶电泳对扩增产物分析,以β-actin为内参,采用ANF和PPAR-αmRNA与β-actin吸光度比值变化来衡量SEP对目标基因mRNA表达的影响,比值越高,代表基因表达量越高。
2 结果
2.1SEP对高糖高胰岛素诱导的肥大心肌细胞的蛋白含量的影响各组间分别加入不同影响因素处理48 h后,用Lowrys法测定每孔细胞的OD值。与正常对照组相比,高糖高胰岛素组心肌细胞蛋白含量增加了38.8% (P<0.01),与高糖高胰岛素组相比,SEP低、中、高剂量组心肌细胞蛋白含量分别减少了5.6% (P<0.05)、13.8% (P<0.01)和15.5%(P<0.01),差异具有显著性,表明不同剂量组SEP均能有效减少肥大心肌细胞的蛋白含量,随着给药剂量的增加,SEP抑制肥大心肌细胞蛋白含量的能力逐步增强,APS处理组与高糖高胰岛素组相比,心肌细胞蛋白含量减少了24.0%(P<0.01),差异亦有显著性。与同剂量SEP组相比,APS给药组的蛋白含量减少了10.1%,抑制效果更为明显(P <0.01),见Tab 1。

Tab 1 Effects of SEP on cellular protein content of hypertrophic heartcells of neonatal rats induced with high glucose and high insulin
2.2SEP对高糖高胰岛素诱导的肥大心肌细胞的细胞表面积的影响各组间分别加入不同影响因素处理48 h后,用图像处理系统测定心肌细胞的表面积。结果表明,与正常对照组相比,高糖高胰岛素组心肌细胞表面积增加了39.9 % (P<0.01) ;与高糖高胰岛素组相比,1、10、100 mg·L-1剂量SEP给药组的心肌细胞表面积分别减少了6.2 %、8.5 %和9.7 %(P<0.01),差异有显著性; APS处理组与高糖高胰岛素组相比,心肌细胞表面积减少了15.3% (P<0.01),差异亦有显著性。以上数值表明各剂量组SEP均能有效减少肥大心肌细胞的表面积。与同剂量SEP给药组相比,100 mg·L-1APS给药组的蛋白含量减少了6.2%,抑制能力更为明显,P <0.01,见Tab 2。

Tab 2 Effects of SEP on cellular volume of hypertrophic heart cells of neonatal rats induced with high glucose and high insulin
2.3SEP对高糖高胰岛素诱导的肥大心肌细胞ANF mRNA表达的影响在细胞培养液中加入不同剂量SEP和黄芪多糖作用48 h后。结果显示,与对照组相比,高糖高胰岛素组ANF/β-actin吸光度比值升高了83%,表明ANF mRNA表达量明显升高。同时,与高糖高胰岛素组相比,不同浓度SEP给药组ANF/β-actin吸光度比值分别减少了15%、37%和39% (P<0.01),表明随着给药剂量的增加,1、10、100 mg·L-1剂量SEP给药组抑制ANF mRNA表达效果逐渐升高(Fig 1)。
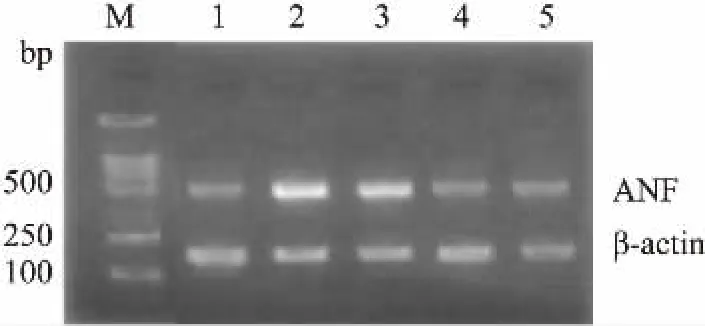
Fig 1 Effect of SEP on expression ANF mRNA of hypertrophic heart cells of neonatal rats inducedwith high glucose and high insulin
2.4SEP对高糖高胰岛素诱导的肥大心肌细胞PPAR-α mRNA表达的影响在细胞培养液中加入不同剂量SEP和黄芪多糖作用48 h后,结果显示,与对照组相比,高糖高胰岛素诱导的心肌细胞PPAR-α mRNA/β-actin吸光度比值升高了79%。与对照组相比,1、10、100 mg·L-1剂量SEP给药组PPAR-α mRNA/β-actin吸光度比值分别降低了21%、43%和62%(P<0.01),表明随着给药剂量的升高,PPAR-α mRNA表达量逐渐降低(Fig 2)。
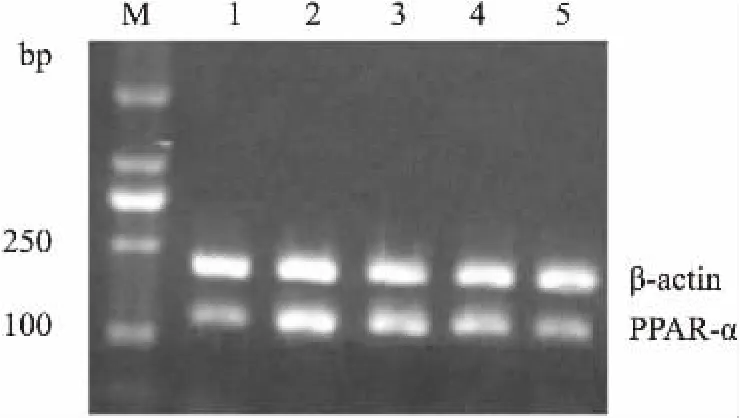
Fig 2 Effect of SEP on expression PPAR-α mRNA of hypertrophic heart cells of neonatal rats induced withhigh glucose and high insulin
3 讨论
既往研究表明,高糖高胰岛素直接参与了诱发心肌细胞肥大的形成过程[11]。因此,本实验采用25.5 mmol·L-1葡萄糖与0.1 μmol·L-1的胰岛素体外模拟高糖高胰岛素血症环境,来观察海胆黄多糖SEP是否对高糖高胰岛素诱导的心肌细胞肥大的影响。结果表明,海胆黄多糖SEP能剂量依赖性减少肥大心肌细胞蛋白含量、细胞表面积和ANF mRNA的表达。同时,我们选择了黄芪多糖作为阳性对照组,与海胆黄多糖SEP相比,黄芪多糖对肥大心肌细胞的抑制作用更为明显,但海胆黄多糖SEP在体外糖尿病心肌细胞肥大模型中也展现了一定的抑制细胞肥大作用,这一结果提示我们SEP有潜力成为一种糖尿病心肌肥大治疗的辅助药物。
PPAR-α是一种主要分布在心脏、肝脏、肾脏等重要器官的核转录因子,对细胞生长、分化、心血管氧化应激等过程具有一定的调控作用[12],有研究表明其可通过抑制NF-κB而减轻心肌肥厚[13]。然而海胆黄多糖SEP是否也通过影响PPAR-α信号通路来产生抑制心肌细胞肥大的作用?目前仍尚不明确。为进一步探索SEP影响高糖高胰岛素诱导的心肌细胞肥大的作用机制,我们同时在实验中检测了不同剂量组SEP给药情况下PPAR-α mRNA的表达水平变化,结果表明,SEP给药后可一定程度上改善了心肌细胞肥大情况,同时PPAR-αmRNA的表达水平也随着SEP给药剂量逐渐减少,这表明PPAR-α信号通路很可能参与了高糖高胰岛素诱导的心肌细胞肥大的发生。
总之,本实验首次在细胞水平上证明了海胆黄多糖SEP对高糖高胰岛素诱导的心肌细胞肥大的抑制作用,并初步探讨了SEP抑制心肌细胞肥大的作用机制可能与PPAR-α有关。但除PPAR-α信号途径外,是否仍有其它信号通路直接参与或与PPAR-α信号通路交互作用影响心肌细胞肥大过程?仍有待于我们进一步的研究。后续的实验将采用基因表达丰度分析和Western blot技术等手段对SEP对肥大心肌细胞抑制作用的具体机制进行深入探索。
(致谢:本研究由商丘师范学院生物技术制药实验室完成,部分研究工作得到山东大学刘纯慧教授和辽宁医学院王洪新教授的指导,特表示感谢! )
参考文献:
[1]Huynh K,Bernardo B C,McMullen J R,Ritchie R H.Diabetic cardiomyopathy: mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacol Ther,2014,142 (3) : 375-415.
[2]王冬,王政乾,田红伟,等.海胆的研究进展及其应用现状[J].中国海洋药物杂志,2006,25(4) : 52-4.
[2]Wang D,Wang Z Q,Tian H W,et al.Research progress and current application of sea Urchin[J].Chin J Mar Drugs,2006,25 (4) : 52-4.
[3]刘纯慧,奚涛,林亲雄,等.海胆黄多糖的分离、纯化及免疫活性测定[J].中国海洋药物杂志,2006,25 (3) : 7-11.
[3]Liu C H,Xi T,Lin Q X,et al.Extraction,purification and immunological activity assay of a polysaccharide from eggs of sea urchin Strongylocentrotus nudus[J].Chin J Mar Drugs,2006,25(3) : 7-11.
[4]Dai H,Jia G,Liu X,et al.Astragalus polysaccharide inhibits isoprenaline induced cardiac hypertrophy via suppressing Ca2+-mediated calcineurin/NFATc3 and CaMKII signaling cascades[J].Environ Toxicol Pharmacol,2014,38(1) : 263-71.
[5]张东莲,王洪新,梁灵君,张晶.人参多糖对腹主动脉缩窄大鼠心肌肥厚及心肌能量代谢的影响[J].中国现代应用药学,2013,30 (6) : 571-5.
[5]Zhang D L,Wang H X,Liang L J,Zhang J.Inhibitory effect of Ginseng polysaccharide on energy metabolism of myocardia hypertrophy induced by abdominal aorta constriction in rats[J].Chin JMAP,2013,30 (6) : 571-5.
[6]周庆峰,王洪新,王桂君,杨育红.高糖对高浓度胰岛素诱导的心肌细胞肥大的促进作用[J].中国药理学通报,2003,19 (9) :1054-7.
[6]Zhou Q F,Wang H X,Wang G J,Yang Y H.Effect of high glucose and high insulin on NE-induced cardiac hypertrophy of the cultured myocardial cells[J].Chin Pharmacol Bull,2003,19 (9) :1054-7.
[7]Wang M,Wang J,Tan R,et al.Effect of Berberine on PPARα/NO activation in high glucose and insulin-induced cardiomyocyte hypertrophy[J].Evid Based Complement Alternat Med,2013,2013: 285489.
[8]刘纯慧,叶亮,林亲雄,奚涛.海胆黄多糖SEP的制备及其抗肿瘤作用研究[J].药物生物技术,2006,13 (6) : 429-32.
[8]Liu C H,Ye L,Lin Q X,Xi T.Studies on preparation and antitumor activity of the polysaccharide from the eggs of Strongylocentrotus Nudus (SEP)[J].Curr Pharm Biotechnol,2006,13 (6) : 429-32.
[9]梁春光,黄雷,戴红良,刘涛.尿皮质素诱导心肌细胞内钙离子升高与兰尼碱受体活化的关系研究[J].中国药理学通报,2013,29(10) :1401-3.
[9]Liang C G,Huang L,Dai H L,Liu T.Relationship between urocortin enhanced[Ca2+]i of neonatal rat cardiomyocytes and ryanodine receptor activation[J].Chin Pharmacol Bull,2013,29 (10) :1401-3.
[10]吕昕瞳,杨丹莉,邓江,黄燮南.人参总皂苷对血管紧张素Ⅱ所致乳大鼠心肌细胞肥大的抑制作用[J].中国药理学与毒理学杂志,2013,27 (4) : 641-5.
[10]Lyu X T,Yang D L,Deng J,Huang X N.Inhibitory effect of total ginsenosides on cardiomyocyte hypertrophy induced by angiotensin Ⅱin neonatal rats[J].Chin J Pharmacol Toxicol,2013,27 (4) : 641-5.
[11]周庆峰,王洪新,王怡薇,等.吡格列酮对高糖高胰岛素诱导的心肌细胞肥大的影响[J].中国药理学通报,2004,20 (7) : 818-21.
[11]Zhou Q F,Wang H X,Wang Y W,et al.Effects of pioglitazone on hypertrophic myocardial cell ls induced with high glucose and high insulin[J].Chin Pharmacol Bull,2004,20 (7) : 818-21.
[12]Le K,Li R,Xu S,et al.PPARα activation inhibits endothelin-1 induced cardiomyocyte hypertrophy by prevention of NFATc4 binding to GATA-4[J].Arch Biochem Biophys,2012,518 (1) : 71-8.
[13]Meng R,Pei Z,Zhang A,et al.AMPK activation enhances PPARα activity to inhibit cardiac hypertrophy via ERK1/2 MAPK signaling pathway[J].Arch Biochem Biophys,2011,511 (1-2) : 1-7.
Polysaccharide from eggs of S.nudus (SEP) prevents cardiomyocyte hypertrophy induced by high glucose and high insulin in vitro in neonatal rat
ZHOU Qing-feng1,LIU Chun-hui2,WANG Hong-xin3
(1.Key Laboratory of Biotechnology Drug,Shangqiu Normal College,Shangqiu Henan 476000,China; 2.School of Pharmaceutical Sciences,Shandong University,Jinan 250100,China; 3.Dept of Pharmacology,Liaoning Medical College,Jinzhou Liaoning 121001,China)
Abstract:AimTo study the protective effects of SEP on the hypertrophic myocardial cells induced with high glucose and high insulin and the mechanism.Methods
The protein content was assayed with Lowrys method; the cardiomyocytes area was measured by computer photograph analysis system; the expression of ANF and PPAR-α was determined by RT-PCR; APS was selected as control drug.ResultsCompared with conctrol group,the protein content,cardiomyocytes area and the expression of ANF and PPAR-α of high glucose and high insulin group were significantly increased.Compared with conctrol group,the SEP of different dosages were able to decrease the protein content,area,the expression of ANF mRNA and PPAR-α mRNA of cultured hypertrophic myocadial cells induced with high glucose and high insulin.ConclusionSEP can prevent cardiomyocyte hypertrophy induced by high glucose and high insulin,which is related to its inhibition on PPAR-α signaling path.
Key words:myocardial cell; hypertrophy; neonatal rat; high glucose and high insulin; polysaccharide; SEP
作者简介:周庆峰(1977-),男,博士,副教授,研究方向:糖尿病生化药物,E-mail: zhouqingfeng715@163.com
基金项目:国家自然科学基金资助项目(No 30901877) ;河南省教育厅重点科技攻关项目(No 13B310196)
收稿日期:2015-01-07,修回日期:2015-03-30
文献标志码:A
文章编号:1001-1978(2015) 06-0844-04中国图书分类号: R-332; R282.74; R322.11; R542.2; R587.2
doi:10.3969/j.issn.1001-1978.2015.06.021