Alport综合征患儿血清可溶性尿激酶型纤溶酶原激活物受体水平变化的临床意义
2016-06-01张琰琴丁方睿肖慧捷
张琰琴 丁方睿 王 芳 肖慧捷 姚 勇 丁 洁
Alport综合征患儿血清可溶性尿激酶型纤溶酶原激活物受体水平变化的临床意义
张琰琴 丁方睿 王 芳 肖慧捷 姚 勇 丁 洁
目的:初步探讨Alport综合征患儿血清可溶性尿激酶型纤溶酶原激活物受体(suPAR)的水平及其临床意义。 方法:入选34例Alport综合征患儿,11例原发性局灶节段性肾小球硬化(FSGS)患儿疾病对照以及13例健康对照儿童,采用ELISA法检测血清suPAR的浓度,并收集患儿同期临床资料。 结果:Alport综合征患儿平均年龄(9.56±4.65)岁,男性28例、女性6例,X连锁显性遗传型24例、常染色体隐性遗传型10例。Alport综合征组血清suPAR浓度显著高于健康对照组[(3 896.65±979.34) pg/mlvs(2 747.62±277.59) pg/ml,P<0.000 1],但低于原发性FSGS组(4 619.27±1 043.56) pg/ml(P=0.042)。Alport综合征患儿血清suPAR浓度与24h尿蛋白定量(r=0.400,P=0.021)、血清肌酐(SCr)水平(r=0.410,P=0.016)呈正相关。Alport综合征Ccr<90 ml/(min·1.73m2)组患儿的血清suPAR的浓度显著高于Ccr≥90 ml/(min·1.73m2)组(P<0.000 1)。Alport综合征患儿血清suPAR浓度与年龄、性别、遗传型等无明显相关性。原发性FSGS患儿血清suPAR浓度与Ccr呈负相关(r=-0.833,P=0.008),与24h尿蛋白定量、SCr水平无明显相关性。 结论:Alport综合征患儿血清suPAR浓度升高,提示该指标是一种新的标志物,可与蛋白尿、SCr共同用来反映肾脏损伤程度。
Alport综合征 可溶性尿激酶型纤溶酶原激活物受体 慢性肾脏病 蛋白尿
近年来研究报道可溶性尿激酶型纤溶酶原激活物受体(suPAR)与局灶节段性肾小球硬化(FSGS)相关,血清高浓度suPAR是肾移植后FSGS复发的危险因素[1]。然而,也有研究发现与非肾小球性肾脏疾病患者和健康对照组相比,FSGS患者血清suPAR浓度并未升高[2]。还有研究者认为肌酐清除率(Ccr)降低是血清suPAR浓度升高的主要原因[3]。因此,suPAR是否与肾脏疾病相关及其在肾脏疾病的临床意义尚不完全清楚。本研究选择病因明确的Alport综合征,一种由于COL4A3/A4/A5基因突变导致的遗传性进行性肾炎,旨在进一步分析血清suPAR水平及其临床意义。
对象和方法
研究对象 选取2012年7月至2013年6月在北京大学第一医院儿科诊断Alport综合征的患儿,并符合以下条件:(1)均检出COL4A3/A4/A5基因突变;(2)生物标本库中有患儿血清标本;(3)排除临床资料不全的患儿。选择同期住院行肾活检诊断原发性FSGS的11例患儿作为疾病对照,以及来自体检中心的13例健康儿童作为正常对照。
研究方法
临床资料收集 患儿留存血清标本时间对应的临床资料,包括收集患儿性别、年龄、诊断、24h尿蛋白定量、血清肌酐(SCr)、血清尿素氮、Ccr、肾脏病理等。Ccr是采用碱性苦味酸法检测,并应用体表面积进行校正。
血清中suPAR浓度的检测 ELISA法检测血清中suPAR的浓度,参照试剂盒说明书(R&DSystems, Catalog Number DUP00)进行操作,使用酶标仪在450/570 nm处读取各样本吸光度值,绘制suPAR标准曲线,计算各样本的suPAR浓度值。
统计学方法 应用统计软件SPSS 19.0进行数据分析,符合正态分布的计量资料以均数±标准差表示,两组间比较采用非配对t检验,两变量间相关性分析采用Spearman’s correlation test。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
临床资料 本研究共入选34例Alport综合征患儿。男28例,女6例,平均年龄(9.56±4.65)岁。遗传型分别是X连锁显性遗传型(XLAS)24例、常染色体隐性遗传型(ARAS)10例。Alport综合征患儿和疾病对照组的11例原发性FSGS患儿的临床资料见表1。
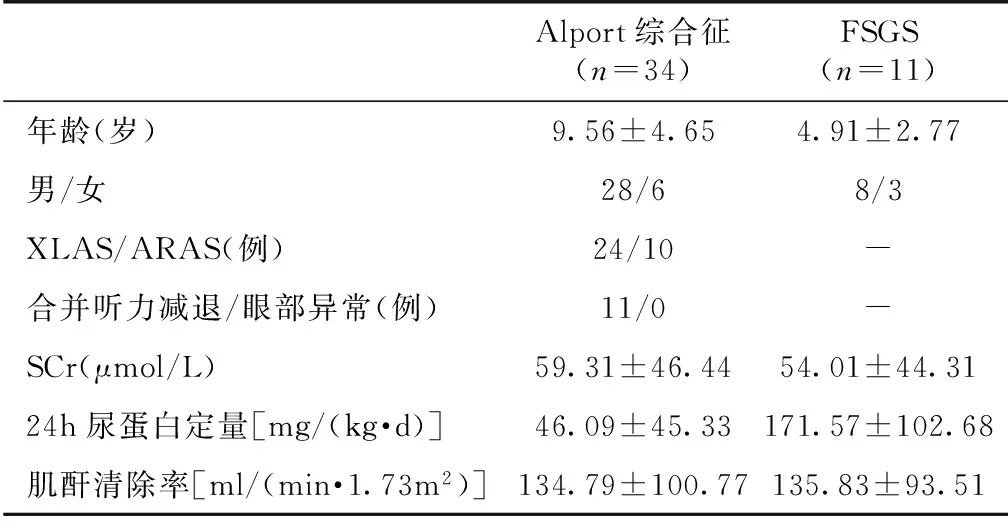
表1 Alport综合征患儿与原发性FSGS患儿的临床特点
XLAS:X连锁显性遗传型Alport综合征;ARAS:常染色体隐性遗传型Alport综合征;FSGS:局灶节段性肾小球硬化;SCr:血清肌酐
Alport综合征患儿血清suPAR浓度 正常对照组儿童、原发性FSGS患儿及Alport综合征患儿血清中suPAR的平均浓度分别为(2 747.62±277.59) pg/ml、(4 619.27±1 043.56) pg/ml和(3 896.65±979.34) pg/ml。与正常对照儿童相比,原发性FSGS患儿及Alport综合征患儿血清中suPAR的浓度均显著升高(图1)。与原发性FSGS患儿相比,Alport综合征患儿血清中suPAR的浓度较低(P=0.042)。
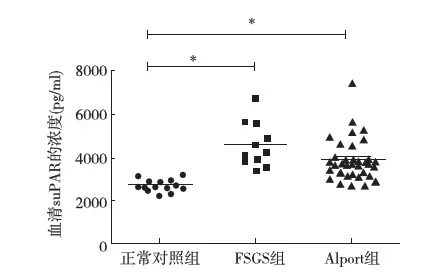
图1 各组患儿血清中suPAR的浓度suPAR:可溶性尿激酶型纤溶酶原激活物受体;FSGS:局灶节段性肾小球硬化;*:P<0.000 1
Alport综合征患儿血清suPAR浓度与尿蛋白、SCr及Ccr相关性分析 34例Alport综合征患儿中,25例(73.5%)尿蛋白定量<50 mg/(kg·d),9例(26.5%)尿蛋白定量≥50 mg/(kg·d),两组血清suPAR浓度分别是(3 693.25±993.78) pg/ml和(4 244.00±687.00) pg/ml(P=0.138)。34例Alport综合征患儿中,慢性肾脏病(CKD)1期25例(73.5%),CKD 2期6例(17.6%),CKD 3期3例(8.9%)。血清suPAR浓度与尿蛋白定量呈正相关,与SCr水平呈正相关,与Ccr无明显相关性(图2A~C)。但是在Ccr<90 ml/(min·1.73m2)的Alport综合征患儿,血清suPAR的平均浓度为(4 780.22±1 319.69) pg/ml,显著高于Ccr≥90 ml/(min·1.73m2)组患儿血清suPAR的浓度(3 492.17±400.21) pg/ml(图3)。此外,Alport综合征患儿血清中suPAR浓度与年龄、性别、遗传型均无明显相关性。
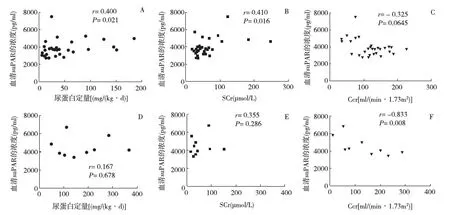
图2 血清suPAR浓度与尿蛋白、SCr及Ccr相关性SCr:血清肌酐;suPAR:可溶性尿激酶型纤溶酶原激活物受体;FSGS:局灶节段性肾小球硬化;Ccr:肌酐清除率;Alport综合征患儿血清suPAR浓度与尿蛋白(A)、SCr(B)及Ccr(C)相关性,FSGS患儿血清suPAR浓度与尿蛋白(D)、SCr(E)及Ccr(F)相关性
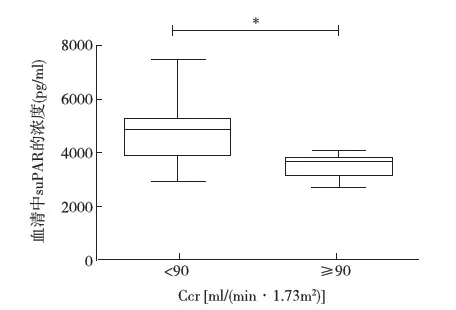
图3 不同Ccr的Alport综合征患儿血清suPAR的浓度suPAR:可溶性尿激酶型纤溶酶原激活物受体;Ccr:肌酐清除率;*:P<0.000 1
FSGS患儿血清suPAR浓度与尿蛋白、SCr及Ccr相关性分析 在FSGS患儿,血清中suPAR浓度与24h尿蛋白定量、SCr水平无明显相关性,与Ccr呈负相关(图2D~F)。
Alport综合征患儿血清suPAR浓度与肾脏病理 共12例Alport综合征患儿进行了肾脏病理检查。轻度系膜增生性肾小球病6例,血清suPAR浓度为(4 035.33±820.48) pg/ml;肾小球轻微病变2例,血清suPAR浓度为(3 732.00±141.42) pg/ml;FSGS样病变2例(2/12,16.7%),血清suPAR浓度为(5 142.00±197.99) pg/ml;不典型膜性肾病1例,血清suPAR浓度为3 722 pg/ml;膜增生样肾小球病变,伴部分新月体形成1例,血清suPAR浓度为4 862 pg/ml(表2)。不同肾脏病理改变的Alport综合征患儿血清中suPAR浓度差异无统计学意义(P>0.05)。
表2 12例Alport综合征患儿肾脏病理与血清中suPAR浓度

肾脏病理n(%)血清suPAR浓度(pg/ml)轻度系膜增生性肾小球病6(50.0)4035.33±820.48肾小球微小病变2(16.7)3732.00±141.42FSGS样病变2(16.7)5142.00±197.99不典型膜性肾病1(8.3)3722.00膜增生样肾小球病变1(8.3)4862.00
suPAR:可溶性尿激酶型纤溶酶原激活物受体;FSGS:局灶节段性肾小球硬化
讨 论
suPAR属于尿激酶型纤溶酶原激活剂系统,是尿激酶型纤溶酶原激活物受体(uPAR)去除糖基磷脂酰肌醇锚链结构产生的可溶性小分子蛋白(分子量约22~45 kD)。在生理条件下,人血清中存在低浓度的suPAR,是一种循环蛋白,参与中性粒细胞转运和干细胞动员。大量研究发现在疾病条件下,人血清suPAR浓度升高,在炎症、动脉粥样硬化及肿瘤浸润转移等方面具有重要的意义[4-7]。
2011年,Wei等[1]研究发现FSGS患者血清中suPAR浓度较正常对照组显著升高,而肾小球微小病变及膜性肾病患者血清suPAR浓度无明显升高。并且发现FSGS患者行肾移植治疗1年后,复发FSGS的患者血清suPAR浓度显著高于移植后肾功能正常的患者。因此Wei等认为血清suPAR是导致FSGS发生的循环因子。2013年我国研究者Huang等[8]同样发现原发性FSGS和继发FSGS患者血浆suPAR浓度升高,而肾小球微小病变及膜性肾病患者血浆suPAR浓度无明显改变。在FSGS之外的其他肾脏病方面,2015年我国研究者Zhao等[9]发现IgA肾病患者血浆suPAR浓度较正常对照人群、肾小球微小病变及膜性肾病患者明显升高,但低于原发性FSGS患者的suPAR浓度。然而,也有研究发现与上述报道不同。2013年,Bock等[2]对20例原发FSGS、24例非FSGS肾小球病、26例非肾小球肾脏疾病及29例健康对照进行血清suPAR浓度检测发现,各组患者血清suPAR浓度无显著差异。可见目前对suPAR与多种CKD的相关性的研究结果并不一致,对suPAR在CKD的意义的认识尚不清楚。
基于目前suPAR在肾脏疾病研究的发现尚存在争议,因此本研究检测Alport综合征患儿血清suPAR浓度,并以原发FSGS患儿和健康儿童分别为疾病对照和正常对照。Alport综合征是一种病因明确,由编码Ⅳ型胶原α3、α4、α5链相应的基因突变导致的遗传性肾脏疾病。本研究发现Alport综合征患儿与原发性FSGS患儿血清suPAR浓度均较正常对照显著升高,说明血清suPAR不仅与FSGS相关,而且可能也参与了Alport综合征疾病过程。
Alport综合征病因明确,如何确定suPAR参与其疾病过程?是否与肾脏疾病相关新的分子标志物?因此有必要进一步探讨suPAR在肾脏疾病中的临床意义。2015年Hayek等[10]研究发现血浆suPAR浓度升高是CKD发生及肾小球滤过率(eGFR)加速下降的独立危险因素。2013年我国学者发现血浆suPAR浓度与Ccr呈负相关,与新月体形成呈正相关[8]。同年Morath等[11]报道了通过血浆置换和免疫吸附降低血清中suPAR的浓度,可改善FSGS复发患者的肾脏各项指标。本研究分析发现,Alport综合征患儿血清suPAR浓度与24h尿蛋白定量及SCr水平呈正相关,与Ccr无明显相关性,但是在Ccr<90 ml/(min·1.73m2)的Alport综合征患儿,血清suPAR浓度明显高于Ccr≥90 ml/(min·1.73m2)的患儿。在原发性FSGS患者血清suPAR浓度与Ccr呈负相关。本研究进一步证实血清suPAR与CKD相关,是一种新的标志物,可与蛋白尿、SCr共同用来反映肾脏损伤程度。
suPAR参与肾脏损伤的机制尚不完全清楚。有研究报道血清高浓度suPAR与FSGS患者移植后肾脏足细胞足突融合相关,还发现suPAR是通过激活足细胞整合素β3进而导致足突融合和蛋白尿[12-13]。体外研究发现在人足细胞,suPAR与整合素αⅤβ3 相互作用使足细胞nephrin和WT-1表达下调,提示suPAR引起足细胞损伤[14]。但也有研究发现FSGS患者血清suPAR浓度升高与Ccr呈负相关,肾移植后受者血清suPAR浓度降低,而移植后复发FSGS患者血清suPAR浓度并未升高,研究者认为Ccr降低是血清suPAR浓度升高的主要原因[3]。本研究发现Alport综合征患儿血清suPAR浓度升高,但具体机制尚需要进一步研究。suPAR浓度升高是否只是Ccr下降的结果?而不是肾损伤的原因?
本研究首次报道了Alport综合征患儿血清suPAR浓度升高,通过相关性分析进一步证明suPAR与肾脏损伤程度相关。但由于本研究为横断面研究,未能提供患者血清suPAR浓度与预后的关系,且患儿均来自我院一个中心,样本结果可能存在偏倚。因此需进行大样本、多中心、队列研究,进一步明确suPAR用于肾脏疾病诊断及预后评估的临床价值。
1 Wei C,El Hindi S,Li J,et al.Circulating urokinase receptor as a cause of focal segmental glomerulosclerosis.Nat Med,2011,17(8):952-960.
2 Bock ME,Price HE,Gallon L,et al.Serum soluble urokinase-type plasminogen activator receptor levels and idiopathic FSGS in children:a single-center report.Clin J Am Soc Nephrol,2013,8(8):1304-1311.
3 Harita Y,Ishizuka K,Tanego A,et al.Decreased glomerular filtration as the primary factor of elevated circulating suPAR levels in focal segmental glomerulosclerosis.Pediatr Nephrol,2014,29(9):1553-1560.
4 Maas RJ,Deegens JK,Wetzels JF.Serum suPAR in patients with FSGS:trash or treasure? Pediatr Nephrol,2013,28(7):1041-1048.
5 Wrotek A,Jackowska T.The role of the soluble urokinase plasminogen activator (suPAR) in children with pneumonia.Respir Physiol Neurobiol,2015,209:120-123.
6 Haupt TH,Petersen J,Ellekilde G,et al.Plasma suPAR levels are associated with mortality,admission time,and Charlson Comorbidity Index in the acutely admitted medical patient:a prospective observational study.Crit Care,2012,16(4):R130.
7 Botha S,Fourie CM,Schutte R,et al.Soluble urokinase plasminogen activator receptor as a prognostic marker of all-cause and cardiovascular mortality in a black population.Int J Cardiol,2015,184:631-636.
8 Huang J,Liu G,Zhang YM,et al.Plasma soluble urokinase receptor levels are increased but do not distinguish primary from secondary focal segmental glomerulosclerosis.Kidney Int,2013,84(2):366-372.
9 Zhao Y,Liu L,Huang J,et al.Plasma Soluble Urokinase Receptor Level Is Correlated with Podocytes Damage in Patients with IgA Nephropathy.PLoS One,2015,10(7):e0132869.
10 Hayek SS,Sever S,Ko YA,et al.Soluble Urokinase Receptor and Chronic Kidney Disease.N Engl J Med,2015,373(20):1916-1925.
11 Morath C,Wei C,Macher-Goeppinger S,et al.Management of severe recurrent focal segmental glomerulosclerosis through circulating soluble urokinase receptor modification.Am J Ther,2013,20(2):226-229.
12 Alachkar N,Wei C,Arend LJ,et al.Podocyte effacement closely links to suPAR levels at time of posttransplantation focal segmental glomerulosclerosis occurrence and improves with therapy.Transplantation,2013,96(7):649-656.
13 Huang J,Liu G,Zhang YM,et al.Urinary soluble urokinase receptor levels are elevated and pathogenic in patients with primary focal segmental glomerulosclerosis.BMC Med,2014,12:81.
14 Alfano M,Cinque P,Giusti G,et al.Full-length soluble urokinase plasminogen activator receptor down-modulates nephrin expression in podocytes.Sci Rep,2015,5:13647
(本文编辑 莫 非)
Change of serum soluble urokinase-type plasminogen activator receptor in children with Alport syndrome
ZHANGYanqin,DINGFangrui,WANGFang,XIAOHuijie,YAOYong,DINGJie
DepartmentofPediatrics,PekingUniversityFirstHospital,Beijing100034,China
Correspondingauthor:DINGJie(E-mail:djnc_5855@126.com)
T Objective:To investigated the role of serum levels of soluble urokinase plasminogen activator receptor (suPAR) in children with Alport syndrome. Methodology:34 children with Alport syndrome were enrolled into this study. 11 children with primary FSGS were as disease controls and 13 healthy children were as normal controls. The clinical and pathological data were collected at the time of take the serum samples. The serum suPAR were measured using commercially available kits. The relationship between levels and protienuria, serum creatinine, creatinine clearance rate, and other clinical and pathological data were analyzed. Results:The average age of children with Alport syndrome was 9.56±4.65 ys. Male and female rate was 28∶ 6. There were 24 children with X-linked Alport syndrome, and 10 with autosomal recessive Alport syndrome. 12 children were combined with hearing loss. The mean level of serum suPAR was significantly elevated in children with Alport syndrome compared to normal controls [(3 896.65±979.34) pg/mlvs(2 747.62±277.59) pg/ml,P<0.000 1]. The mean level of serum suPAR in children with primary FSGS was (4 619.27±1 043.56) pg/ml. Furthermore, the serum suPAR levels in children with Alport syndrome were positively correlated with the 24 hours proteinuria (r=0.400 0,P=0.021 1) and serum creatinine levels (r=0.410 1,P=0.016 0). The serum suPAR level was significantly higher in Alport children with Ccr<90 (ml/min·1.73m2) than in Alport children with Ccr≥90 (ml/min·1.73m2) (P<0.000 1). The serum suPAR levels in children with primary FSGS were negatively correlated with Ccr (r=-0.833 3,P=0.008 3). Conclusion:An elevated level of suPAR was detected in children with Alport syndrome. The serum suPAR level may serve as a new marker associated with renal damage.
Alport syndrome soluble urokinase plasminogen activator receptor chronic kidney disease proteinuria
10.3969/cndt.j.issn.1006-298X.2016.05.004
国家自然科学基金(81070545,81400685),儿科遗传性疾病分子诊断与研究北京市重点实验室(Z141107004414036);北京大学第一医院院级科研基金
北京大学第一医院儿科(北京,100034)
丁 洁(E-mail:djnc_5855@126.com)
2016-05-16
ⓒ 2016年版权归《肾脏病与透析肾移植杂志》编辑部所有
