MIF在Ⅲ型前列腺炎精浆中的表达及与精液质量的相关性研究
2016-06-01左岩梁长春张翼梁立彬马志强刘巍
左岩 梁长春 张翼 梁立彬 马志强 刘巍
050011 河北省石家庄市第三医院泌尿外科
·论著·
MIF在Ⅲ型前列腺炎精浆中的表达及与精液质量的相关性研究
左岩梁长春张翼梁立彬马志强刘巍
050011河北省石家庄市第三医院泌尿外科
【摘要】目的探讨精浆中巨噬细胞移动抑制因子(MIF)在Ⅲ型前列腺炎患者精浆中的表达及对精液质量的影响。方法试验组112例,其中Ⅲa 组64例、Ⅲb组48例,健康对照组18例,测定精液质量参数(精液量、液化时间、精子密度、A级精子活动力、正常精子形态百分率)及精浆中MIF浓度。结果Ⅲa组、Ⅲb组液化时间较对照组延长,a级精子活动率和正常精子形态百分率较对照组降低,差异均有统计学意义(P<0.05);精浆中MIF浓度的测定,Ⅲa组、Ⅲb组均均高于对照组,差异均有统计学意义(P<0.05),Ⅲa组稍高于Ⅲb组,差异无统计学意义(P>0.05);Ⅲa组、Ⅲb组MIF浓度与液化时间、a级精子活动力、正常精子形态百分率呈明显负相关(r值分别为-0.353、-0.426、-0.522、-0.331、-0.412和-0.463,P<0.05)。结论Ⅲ型前列腺炎对精液质量有一定影响;MIF介导的免疫反应可能是原因之一;精浆MIF浓度测定可能作为Ⅲ型前列腺炎并不育的检测指标之一。
【关键词】Ⅲ型前列腺炎;精液;细胞因子;MIF
慢性前列腺炎是男性泌尿生殖系统的常见病之一,依照美国国立卫生研究院 NIH 分类,将前列腺炎分为Ⅰ、Ⅱ、Ⅲ、Ⅳ 4 型,其中Ⅲ型定义为无明确细菌学证据的慢性前列腺炎/慢性骨盆疼痛综合征(chronic prostatitis/chronic pelvic pain syndrome,CP/CPPS) ,Ⅲ型又可进一步分为炎症性(Ⅲa型)和非炎症性(Ⅲb型)2个亚型,2 个亚型各占50%。慢性前列腺炎病例中约90%属于Ⅲ型[1],其临床症状复杂多样,不同程度地影响着患者的生活质量及生殖健康。多项研究表明,免疫因素在Ⅲ型前列腺炎发病过程中起着重要作用[1-3]。此类患者精液、前列腺液及血液中细胞因子的水平不同程度发生变化,进而推断该炎症可能是针对男性泌尿生殖系抗原的一种自身免疫性疾病,并且是由细胞因子介导的一系列级联放大反应。研究证实,巨噬细胞移动抑制因子(MIF)作为一种免疫调节剂,与Ⅲ型前列腺炎发病及临床症状有一定的关系[2]。近年来,慢性前列腺炎与男性生殖能力的研究越来越多。研究表明,Ⅲ型前列腺炎可能对精液参数如液化时间、精子密度等产生影响,进而导致男性不育[3]。但目前对MIF的研究仅限于前列腺液中含量的测定,且主要集中MIF与临床症状的相关性研究,尚无临床研究探讨Ⅲ型前列腺炎患者精浆中MIF浓度变化及与精液质量的相关性。本文通过对Ⅲa、Ⅲb2个亚型的精液质量参数及精浆中的MIF浓度进行检测和比对,进而探讨Ⅲ型前列腺炎对精液质量的影响及机制,报道如下。
1资料与方法
1.1一般资料选取来石家庄市第三医院泌尿外科门诊就诊,且依据《2014年中国泌尿外科疾病诊疗指南》[4]明确诊断为Ⅲ型前列腺炎患者共112例为病例组,其中Ⅲa 组64例,Ⅲb组48例,Ⅲa 组64例,年龄20~45岁,平均(32±6)岁;Ⅲb组48例,年龄22~48岁,平均(33±5)岁;另外选取健康对照组18例为对照组(系来院行婚前检查的健康男性),年龄21~45岁,平均(33±5)岁。3组一般资料有可比性。
1.2入选与排除标准
1.2.1入选标准:临床症状:骨盆区疼痛不适、排尿异常、性生活不适症状;病程:持续3个月以上;细菌学证据:前列腺液及按摩后尿液细菌培养阴性;试验室依据:前列腺按摩液中卵磷脂小体数目减少甚至消失。
1.2.2排除标准:无泌尿生殖系统特异性或非特异性感染、神经源性膀胱、精索静脉曲张、隐睾、前列腺增生、前列腺癌、膀胱结石等疾病。满足以上标准,根据前列腺液每高倍视野下白细胞计数分为Ⅲa(白细胞计数≥10/HPF)和Ⅲb(白细胞计数<10/HPF)。
1.3标本采集及储存采集标本前均需禁欲2~5 d,自慰手淫收集精液至无菌容器中。
1.4精液质量参数依据WHO4标准,计算机辅助精液分析仪检测精液参数指标为液化时间、精子密度、a级精子活动率、正常精子形态百分率。
1.5精浆MIF测定将1.3步骤中剩余的精液标本,以3 000 r/min离心10 min后,取上层精浆保存于-60℃超低温冰箱。精浆中MIF的测定采用双抗夹心酶联免疫吸附法(ELISA),试验步骤按照试剂盒说明依次进行。
2结果
2.13组精液质量参数比较Ⅲa组、Ⅲb组分别与对照组比较:液化时间均长于对照组,a级精子活动率和正常精子形态百分率均低于对照组,差异均有统计学意义(P<0.05);Ⅲa、Ⅲb组间在上述各指标中差异无统计学意义(P>0.05);3组间在精液量、精子密度差异均无统计学意义(P>0.05)。见表1。
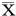
表1 3组精液质量参数比较 ±s
注:与对照组比较,*P<0.05
2.23组精浆中MIF浓度的测定Ⅲa组、Ⅲ b组均高于对照组,差异均有统计学意义(P<0.05);Ⅲa组稍高于Ⅲb组,但差异无统计学意义(P>0.05)。见表2。
表2各组精浆中MIF浓度比较


组别精浆中MIF浓度对照组(n=18)304±62Ⅲb组(n=48)670±120*Ⅲa组(n=64)704±117* F值50.375 P值0.000
注;与对照组比较,*P<0.05
2.3相关性分析Ⅲa组、Ⅲb组MIF浓度与液化时间、a级精子活动力、正常精子形态百分率呈明显负相关(P<0.05);Ⅲa组、Ⅲb组MIF浓度与精液量、精子密度无相关性(P>0.05)。见表3。

表3 Ⅲ型精浆中MIF浓度与精液质量参数相关性分析
3讨论
Ⅲ型前列腺炎是临床上慢性前列腺炎中最常见的类型,中青年好发,此阶段为男性生殖功能活跃期,已有研究表明,Ⅲ型前列腺炎会对精液参数参数如液化时间、精子密度等指标产生一定影响,导致男性不育的发生。同时精浆细胞因子的浓度差异,反映出该类患者精液质量的变化可能与免疫反应介导产生的细胞因子变化有关。
本组研究结果显示,Ⅲa组、Ⅲb组分别与对照组比较,液化时间均长于对照组,a级精子活动率、正常精子形态百分率均低于对照组,差异均有统计学意义(P<0.05),表明Ⅲ型前列腺炎对精液质量有一定的影响。
Ⅲ型前列腺炎病因、发病机制较为复杂,大量研究显示其发病与感染、免疫关系较为密切。免疫因素是其发病重要因素之一。研究表明,免疫反应异常可能在Ⅲ型前列腺炎发生发展中起重要作用[5]。免疫反应的异常包括细胞免疫和体液免疫,细胞免疫异常主要表现为细胞因子含量的变化。细胞因子是一类由免疫细胞及相关细胞产生,且具有调节功能的高活性多功能可溶性蛋白多肽,可通过自分泌、旁分泌或内分泌形式直接或间接调控细胞免疫反应正常进行。细胞因子具有双重的生物学效应,一方面可诱导免疫应答从而抵御肿瘤、感染等,而另一方面细胞因子的异常产生导致机体的免疫性损伤。MIF最初认为仅是一种促炎因子,而进一步研究发现,MIF是一种多功能的细胞因子,参与多种病理生理过程的发生,能够抑制巨噬细胞的游走, 促进巨噬细胞在炎症局部浸润、增生、激活及分泌一些相关细胞因子,在自身免疫性疾病及抗原提呈中起着重要的作用。研究表明,MIF可能参与了慢性前列腺炎发生发展过程[6,7]。MIF是由115个氨基酸残基组成的一种蛋白质, 相对分子量约12 500,人类编码基因位于22号染色体长臂(22q11.2),含有3个外显子、2个内含子。X线晶体衍射图像分析证实人重组MIF分子为一个呈桶状的同型三聚体,三聚体每个亚单位包含2个反向平行的α螺旋和6个β链,其中4个β链组成混合的β折叠,相对复杂的蛋白质结构使其具有一定的催化及结合小分子物质的能力,可能与复杂的生物学功能有关。MIF基因具有多态性,如CATT区和-173位点的多态性变化能通过改变与转录因子结合率进而调节MIF启动子活性[8]。MIF在各组织内广泛存在,参与炎症、免疫反应的发生,涉及免疫、炎症、肿瘤、心血管及自然流产等多种疾病的发病。研究证实,MIF在睾丸、附睾及前列腺等男性生殖系统中均有表达,前列腺上皮可分泌两种形式的MIF蛋白[9]:一种是以前列腺小体相关的MIF,另一种是可溶性MIF。MIF是精液中的一种重要成分,从附睾小体及精子中提取的MIF含量很低,并且目前尚未发现除前列腺外其他男性的附属性腺有分泌MIF的功能,因此推测精液中的MIF主要是由前列腺分泌[10]。同时研究证实精液内前列腺小体相关分泌与可溶性MIF含量无明显差异,两种形式的MIF可能同时发挥重要的作用。MIF作用方式如下:(1)MIF可以通过结合靶细胞结合的膜受体CD74或非经典胞吞途径,发挥其生物学效应;(2)MIF通过激活调控激酶ERK1/2,促进细胞增长,并激活ETS家族转录凋节活化子以促进TLR4表达;(3)通过上调TLR4表达,机体产生内毒素细菌应答;(4)炎性因子的产生,如NO、PEG2等;(5)MIF后续的级联放大反应:上述反应中产生的细胞质磷酸脂酶(cPLA2)、花生四烯酸前列腺素E2 (PGE2)来激活后续反应以进一步放大反应;(6)通过产生的氧化还原酶(NO)及环氧合酶(COX-2)阻止由p53介导的细胞凋亡;(7)MIF可负反馈调节糖皮质激素免疫抑制效应;(8)可抑制激活 JAB-1/CSN5活性,参与细胞生长及炎症的发生。细胞源性MIF主要由免疫系统中的T细胞产生,但免疫系统中的单核细胞、巨噬细胞及多种细胞均可表达MIF。通过MIF的作用方式,可以看出,MIF生物作用的发挥除了通过促进巨噬细胞在炎症局部浸润、增生等参与炎性反应以外,还可通过旁分泌及自分泌方式激活靶细胞通道,促进促炎症因子如TNF-α、IFN-γ、IL-1β、IL-2、IL-6、NO、前列腺素2(PGE2)、COX-2等的合成及释放,促使炎症级联放大,进一步加重炎症[11]。本研究结果显示,精浆中MIF浓度在Ⅲa、Ⅲb组中均较对照组显著升高(P<0.05),而MIF浓度在Ⅲa、Ⅲb组比较差异无统计学意义(P>0.05),仅显示MIF浓度在Ⅲa组稍高于Ⅲb组。推断MIF介导的免疫反应可能是Ⅲ前列腺炎型发病的原因之一,但Ⅲa、Ⅲb浓度的微小差异可能是在免疫反应程度和途径上有所不同,或有其他因素干预该病的发生,有待深入的探究。
在男性精液中,精浆是由前列腺液、精囊腺和尿道球腺等附属腺体分泌液所组成,其中前列腺液约占精液的30%,精囊液占精液的46%~80%,精子在睾丸发育成熟后,存储于附睾内,与精浆共同组成精液。Ⅲ型前列腺炎对精液质量的影响机制主要有以下几方面:(1)精液理化性质的改变:前列腺发生炎症后,前列腺分泌的液化蛋白酶活性降低,相对增加了凝固蛋白,增加了黏稠度,影响了精液的液化,从而限制了精子的活动力;精浆中酸性物质增加,降低了精子适宜生存的酸碱度,增加了精子的死亡数;锌、硒等微量元素降低,限制了精子代谢及前向运动。(2)感染因素:目前对Ⅲ型前列腺炎研究尚未找到明确的感染因素,但诸多学者经过广泛深入研究,发现一种新型病原微生物即纳米细菌与Ⅲ型前列腺炎密切关系[12],作用可能是通过纳米细菌的矿化外膜和脂多糖样内毒素,使与之接触的细胞产生直接细胞毒作用,引起氧化应激反应,产生的氧自由基等产物对精子细胞产生影响。(3)免疫因素:由于Ⅲ型前列腺炎导致的细胞免疫及体液免疫异常,产生的细胞因子及自身抗体可能对精子产生直接和(或)间接的损伤。例如细胞免疫过程中产生的抗精子抗体可直接作用于精子细胞,使其发生凝集或破坏精子细胞膜,造成精子死亡。
精浆作为精子的天然培养基,决定着精液的生化及生物学特征,精液中的细胞因子参与调节睾丸功能、类固醇激素的释放和精子受精等多个重要过程。MIF作为细胞免疫过程的产物,已有国外研究显示,男性精液中MIF含量与精子质量及精子活力有一定相关性,可能对精子的功能造成不利影响[13]。本研究显示,Ⅲa组、Ⅲb组MIF浓度与液化时间、a级精子活动力、正常精子形态百分率呈明显负相关(P<0.05),提示MIF浓度的升高可能引起Ⅲa组、Ⅲb组精液质量参数如液化时间延长、a级精子活动力及正常精子形态百分率降低,从而导致男性精液质量的降低。MIF对精液质量的影响机制:(1)前列腺等附属腺体炎症可能逆行至附睾及睾丸,进而影响精子在睾丸和附睾中发育及成熟的过程。原因在于MIF不直接作用于精子本身,而是作用于睾丸支持细胞,影响其抑制素的分泌,抑制素通过垂体负反馈抑制FSH分泌,从而影响精子的成熟。(2)MIF能降低精子上锌离子含量,而锌离子结合在精子鞭毛的外层致密纤维,阻止精子鞭毛内二硫键的提前形成,影响精子的活力。(3)研究发现,MIF与人精子进行体外共同培养,MIF浓度升高可导致精子获能相关的蛋白质(如p105和p81)磷酸化水平、顶体反应及精子活力下降。精液中MIF浓度对精子获能有重要的生理影响,其水平异常可导致精子的功能障碍。(4)MIF可通过旁分泌及自分泌作用促进其他促炎性因子的合成及释放,细胞因子间的级联及交互加大了细胞免疫的程度及范围,各相关细胞因子发挥其相应的生物学作用,直接或间接对精子产生影响。因此,精液中MIF浓度对精子活力、获能等有着重要的影响[14]。以往研究多侧重于MIF与前列腺炎临床症状如疼痛等相关性的研究,且仅限于前列腺液中MIF的测定[15],本研究除了探讨免疫因素是Ⅲ型前列腺炎发病原因之一外,还研究Ⅲ型前列腺炎精液质量变化及这种变化与精浆中MIF的相关性,从而进一步探讨MIF对精液质量的影响。但本研究尚有不足之处,未对MIF对精液质量的影响机制进行分子水平上的验证及探讨,将在后续研究中进一步完善。
综上所述,Ⅲ型前列腺炎对精液质量产生一定的影响,MIF介导的免疫反应可能是原因之一,但不能除外其他原因的影响;精浆MIF浓度测定可能作为Ⅲ型前列腺炎并免疫性不育的检测指标之一。
参考文献
1Mahal BA,Cohen JM,Allsopsa SA,et al.The role of phenotyping in chronic prostatitis/chronic pelvic pain syndrome.Curr Urol Rep,2011,12:297-303.
2Lundh D,Hedelin H,Jonsson K,et al.Assessing chronic pelvic pain syndrome patients:blood plasma factors and cortisol saliva.Scand J Urol,2013,47:521-528.
3Ko EY,Siddiqi K,Brannigan RE,et al.Emprical Medical Therapy for idiopathic male infertility:a survey of American urological association.The Journal of Urology,2012,187:973-978.
4那彦群,叶章群,孙颖浩主编.2014年中国泌尿外科疾病诊断诊疗指南.北京:人民卫生出版社,2014.442-445.
5Jatapai A.Sirivongrangson P,Lokpichat S,et al.Prevalence and risk factors for Chlamydia trachomatis infection among young Thai men in 2008-2009.Sex Transm Dis,2013,40:241-246.
6Meyer-siegler KL,Vera PL.Intraluminal antibodies to macrophage migration inhibitory factor decrease substance P induced inflammatory changes in the rat bladder and prostate.The Journal of Urology,2004,172:1504-1509.
7Leaver SK,Maccallum NS,Pingle V,et al.Increased plasma thioredoxin levels in patients with sepsis ,positive association with macrophage migration inhibitory factor.Intensive Care Med,2010,36:336-341.
8吴杰,黄承滨,赵育桢,等.MIF基因多态性及其与疾病关系的研究进展.国际遗传学杂志,2009,32:115-119.
9Ronquist G,Nilsson BO.The Janus-faced nature of proatasomes :their pluripotency favours the normal reproductive process and malignant prostate growth.Prostate Cancer Prostatic Dis,2004,7:21-31.
10Frenette G,Lessard C,Sullivan R.Selected proteins of “prostasome-like particles“from epididymal caput spermatozoa in bull.Biol Repord,2001,67:308-313.
11Carli C,Metz CN,Al-abed Y,et al.Up-regulation of cyclooxygen-2 expression and prostaglandin E2 production in human endometriotic cells by macrophage migration inhibitory factor:involvement of novel kinase signaling pathways.Endocrinology,2009,150:3128-3137.
12李军,吕宏迪,明爱民,等.纳米细菌感染致Ⅲ型前列腺炎的临床治疗研究.临床医学,2014,31:389-391.
13Carli C,Leclerc P,Metz CN,et al.Direct effect of macrophage migration inhibitory factor on sperm function:possible involvement in endometriosis-associated infertility.Fertil Steril,2007,88:1240-1247.
14卫冰冰,苏建堂.巨噬细胞移动抑制因子在男性生殖方面的研究进展.生殖医学杂志,2009,18:411-413.
15徐晓龙,陈长宜,王友宝,等. Ⅲ型前列腺炎病人前列腺液MIF表达及意义.青岛大学医学院学报,2015,51:80-82.
Expression of MIF in seminal plasma of patients with type Ⅲ prostatitis and the correlation between expression of MIF and semen quality
ZUOYan,LIANGChangchun,ZHANGYi,etal.
DepartmentofUrinarySurgery,TheThirdHospitalofShijiazhuangCity,Shijiazhuang050011,China
【Abstract】ObjectiveTo investigate the expression of MIF in seminal plasma of patients with type Ⅲ prostatitis and its effects on semen quality.MethodsOne hundred and twelve patients were in trial group in which 64 patients were in type Ⅲa group and 48 patients were in type Ⅲb group,in addition, 18 healthy subjects were in control group. The semen quality parameters including semen volume, liquefaction time, sperm density, grade A sperm motility, percentage of normal sperm morphous and MIF concentration in seminal plasma were detected for all the groups.ResultsThe liquefaction time in type Ⅲa group and type Ⅲb group was obviously prolonged, moreover, grade A sperm motility and percentage of normal sperm morphous were significantly decereased,as compared with those in control group (P<0.05).The MIF concentrations in seminal plasma of type Ⅲa group and type Ⅲb group were significantly higher than those in control group (P<0.05),which in type Ⅲa group were slightly higher than those in type Ⅲb group,however, there were no significant differences between two groups (P>0.05). The MIF concentrations in type Ⅲa group and type Ⅲb group were negatively correlated to liquefaction time, grade A sperm motility, percentage of normal sperm morphous (r=-0.353,-0.426,-0.522,-0.331,-0.412,-0.463,respectively,P<0.05).ConclusionThe type Ⅲ prostatitis has certain effects on semen quality,and MIF-mediated immune response may be one of the reasons.The detection of MIF in seminal plasma can be used as one of the indexes to diagnose type Ⅲ prostatitis complicated by sterility。
【Key words】type Ⅲ prostatitis; semen; cytokine; MIF
(收稿日期:2015-10-08)
【中图分类号】R 691.3
【文献标识码】A
【文章编号】1002-7386(2016)10-1487-04
doi:10.3969/j.issn.1002-7386.2016.10.013
项目来源:石家庄市科学技术研究与发展指导计划(编号:12146493)
