彩色多普勒超声在评价乳腺癌新辅助化疗疗效中的价值
2016-05-14王小东薛改琴
王小东 薛改琴

摘要:目的 彩色多普勒超声在评价乳腺癌新辅助化疗疗效中的价值。方法 回顾性分析108例女性乳腺癌患者(109个病灶)资料,包括化疗前的超声检查、经超声引导下活检病理结果以及术前超声再检查和术后病理资料。总结乳腺癌病灶新辅助化疗前后的超声声像图特征(大小、形态、边界、内部回声、血流等级)变化,同时与病理对比分析。结果 108例患者中的102个病灶新辅助化疗前后的大小及血流等级可进行对比分析,93个病灶新辅助化疗前后的声像图特征(形态、边界、内部回声)可进行对比分析。①大小变化:102个病灶最大切面两径线差异有统计学意义。79.4%病灶体积缩小,11.8%体积增大,8.8%病灶消失。②分组比较疗效:依据病灶最大径线分为四组(≤2cm组、2~3组、3~4组、大于4cm组),有效率依次为57.1%、50%、55.6%、57.71%,四组病灶有效率差异无统计学意义。③声像图特征变化:病灶新辅助化疗前后形态、边界、内部回声无明显变化。④血流等级变化:依据RECIST1.1标准分为有效组和无效组。有效组病灶血流等级变化差异有统计学意义,病灶化疗后血流等级较化疗前下极,化疗前以2、3级为主,化疗后以0、1级。无效组病灶血流等级变化差异无统计学意义,化疗前后血流等级无差异,以2、3级为主。⑤病灶新辅助化疗后超声与术后大体病理比较(病灶是否具体、可测量比较):71.6%病灶化疗后超声和术后大体病理一致,28.4%病灶化疗后超声与术后病理不一致。结论 彩色多普勒超声在乳腺癌新辅助化疗前后分析大小、血流等级变化,有助于临床医生评价新辅助化疗疗效。
关键词:超声;乳腺癌;新辅助化疗;病理
乳腺癌的新辅助化疗是在术前应用化疗药物来缩小病灶、消除全身其他潜在微小转移灶,进而降低临床分期,提高手术成功率以及提高治疗的病理完全缓解率[1],同时还可探测药物敏感性,为临床治疗决策提供帮助的治疗方法。本研究探讨彩色多普勒超声在评价乳腺癌新辅助化疗疗效中的价值。
1资料与方法
1.1一般资料 回顾性分析我院2011年1月~2014年12月108例女性乳腺癌患者的临床资料、病理资料、新辅助化疗前后的超声检查资料。患者年龄26~71岁,平均年龄47.86岁。右侧50例、左侧58例,共109个观察病灶。102例单侧单发,1例单侧多发,5例结构紊乱。所有患者化疗前经超声引导下穿刺活检病理证实为乳腺癌:其中浸润性导管癌99例、浸润性导管癌合并部分导管内癌5例、浸润性小叶癌3例、粘液癌1例,所有患者行2~6疗程的新辅助化疗,用TAC或TA化疗方案,在新辅助化疗结束后均行乳腺癌改良根治术。
1.2 仪器和方法 百胜DU-8、GE Logiq-9、Philips IU22彩色多谱勒超声诊断仪,频率7~17MHZ高频线阵探头。
1.3 评价指标及分组方法
1.3.1超声与病理观察指标 ①超声观察指标:病灶新辅助化疗前后大小(最大切面两个径线)、边界、形态、内部回声、血流等级(Adler[2]的半定量法)。②病理观察指标:大体(最大切面两个径线)及镜下病理描述、病理诊断。
1.3.2 分组方法 依据实体瘤治疗疗效评价标准(RECIST1.1)将病灶分为有效组(CR+PR)和无效组(SD+PD)、分别比较两组病灶新辅助化疗前后血流等级变化。依据病灶新辅助化疗前最大径线分组比较不同大小病灶新辅助化疗疗效。
1.3.3病灶新辅助化疗后超声与术后大体病理比较标准 ①具体病灶组:病灶轮廓清晰,大小可测量;②无病灶组:病灶消失;③不具体病灶组:病灶病灶轮廓不清晰,无法测量大小。
1.4统计学方法 计量资料采用配对样本t检验,计数资料采用?字2检验,以P<0.05差异有统计学意义。
2结果
2.1新辅助化疗前后病灶大小变化
2.1.1本组109个病灶中的102个病灶新辅助化疗前后同一切面两个径线(若化疗后超声病灶消失,两径线均为0)可进行对比。两径线分别经配对样本t检验:病灶较大及较小径线(t=8.553,P=0.000)和(t=11.908,P=0.000),差异有统计学意义,即病灶新辅助化疗前后大小变化有差异。
2.1.2 另外7个病灶新辅助化疗前后的大小难以对比分析(无法统计学检验)。其中5个病灶化疗前超声检查显示结构紊乱区,化疗后1个结构无异常,1个较前具体,其他3个病灶仍然显示结构紊乱区;1例化疗前为单一病灶,而化疗后超声检查显示多个小病灶;1个病灶化疗前较具体,而化疗后显示结构紊乱区。
2.2新辅助化疗前后病灶声像图变化 本组109个病灶其中的93个病灶新辅助化疗前后的声像图特征(形态、边界、内部回声)无明显变化。肿瘤形态均呈无明显变化的不规则;边界均呈无明显变化的不清以及内部均为无明显变化的不均匀低回声。另外16个病灶化疗前后的声像图特征无法进行对比:具体为9个病灶化疗前较具体,化疗后消失;5个病灶化疗前超声检查显示结构紊乱区,化疗后3个仍然显示结构紊乱区,1个消失,1个较前具体;1个病灶化疗前较具体,化疗后超声显示结构紊乱区;1个病灶化疗后显示为多个小病灶。
2.3 新辅助化疗前后病灶血流等级变化 依据RECIST 1.1本组109个病灶中的102个病灶分为有效组56个病灶和无效组46个病灶的血流变化情况见表1。有效组病灶新辅助化疗前后血流等级变化统计学分析(?字2=6.577、P=0.01)差异有统计学意义,即病灶新辅助化疗前后血流等级有差异。无效组病灶新辅助化疗前后血流等级变化统计学分析(?字2=0.087、P=0.768)差异无统计学意义,即病灶新辅助化疗前后血流等级无差异。
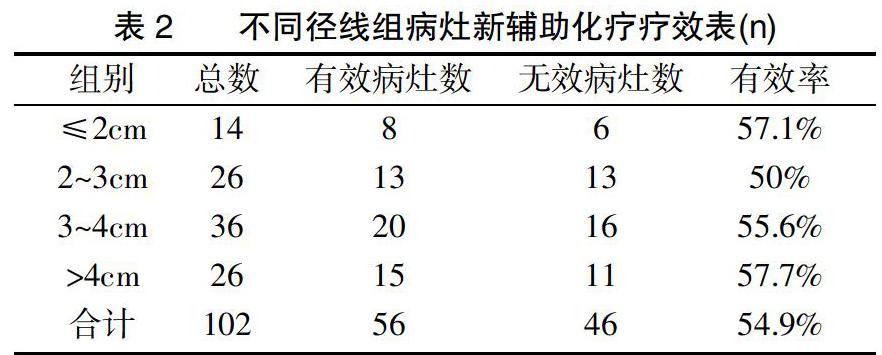
2.4不同大小病灶新辅助疗效比较 依据病灶最大径线将102个病灶分为四组:≤2cm组、2~3cm组、3~4cm组、>4cm组。依据RECIST 1.1分别计算四组病灶有效病灶数(CR+PR)和无效病灶数(SD+PD)。四组病灶新辅助化疗疗效情况见表2。>4cm组的有效率最高,为57.7%;2~3cm组的有效率最低,为50%。四组经统计学分析(χ2=0.369、P=0.947)差异无统计学意义,即四组病灶有效率无差异。
2.5病灶的新辅助化疗后超声与术后大体病理比较 ①新辅助化疗后超声所见具体病灶组96个病灶:73个术后大体病理可见具体病灶,占总体比例66.9%;23个术后大体病理无病灶,占总体比例21.1%。②新辅助化疗后超声所见无病灶组9个病灶:5个术后大体病理无病灶,占总体比例4.6%;4个术后大体病理见具体病灶,占总体比例3.7%。③新辅助化疗后超声所见不具体病灶组4个病灶,2个术后大体病理可见具体病灶、2个术后大体病理见不具体病灶,占总体比例3.7%。
3讨论
3.1超声声像图特征在分析新辅助化疗前后中的价值
3.1.1从资料结果显示 109个病灶中的102个病灶新辅助化疗后,81个缩小,占总体比例81%;12例增大,占总体比例11.8%;9例消失,占总体比例8.8%。即多数病灶新辅助化后缩小,这就能间接帮助临床医评价新辅助化疗疗效、制定治疗方案。另外7个病灶,由于新辅助化疗前或新辅助化疗后的大小无法测量,临床医生无法通过比较病灶化疗前后大小来评价化疗疗效。但是其中1个病灶化疗后消失及1个病灶较化疗前具体是否可以认为化疗有效,有待进一步探讨。
3.1.2 本次结果中显示109个病灶中的93个病灶新辅助化疗前后形态、边界、内部回声无明显变化,说明这些声像图特征不能帮助临床医生评价新辅助化疗疗效,这与一些研究报道一致[3]。这其中的原因可能是化疗前后病灶形态学特征的改变比较细微,声像图难以反映。其余16个病灶新辅助化疗前后形态、边界、内部回声无法对比。
3.1.3 本研究依照化疗前病灶的大小将其分为四组,其结果显示四组病灶有效率无差异,说明疗效与化疗前病灶大小无明显关系。表明临床无法通过治疗前病灶的大小预测其疗效的。
3.2 新辅助化疗前后病灶血流等级变化 乳腺癌为富血供肿瘤,病灶供血动脉增粗增多尤为明显,在肿瘤区形成丰富的血管网络,随着肿瘤的生长不断更新增加血管数目,肿瘤测动脉比检测大3倍[4]。彩色多普勒超声显示病灶的血流丰富程度。因此病灶血流变化能间接反映新辅助化疗疗效。有效组病灶化疗后血流等级较化疗前下降,化疗前以2、3级为主,化疗后病灶血流等级以0、1级,这与孟方、李征毅等学者研究报道结果相似[5]。无效组病灶化疗前后后血流等级无差异,以2、3级为主。这是由于化疗后肿瘤变性坏死,导致肿瘤内部血管的栓塞萎陷、闭塞,肿瘤内血流速度降低,肿瘤供血不足,进一步促进肿瘤变性坏死,肿瘤内血流信号减少或消失,反映有效组病灶化疗后血流等级下降[6]。无效组病灶血流等级下降不明显,分析原因可能与对化疗药物不敏感,肿瘤内部血管的栓塞萎陷、闭塞不明显等有关。为此在病灶新辅助化疗的过程中定期观察病灶血流等级的变化反映所用方案的有效性,提示临床调整用药方案。
3.3 新辅助化疗后超声检查与术后大体病理比较分析。
3.3.1个病灶化疗后超声检查和术后大体病理均可见具体病灶,病灶镜下病理可见癌细胞;5个病灶化疗后超声检查未见具体病灶,同时术后大体病理未见具体病灶,病灶镜下未见癌细胞。这就间接说明超声检查病灶大小有助于临床医生评价化疗疗效。
3.3.2 23个病灶化疗后超声检查可见具体病灶,而术后大体病理未见具体病灶:病灶镜下病理描述多为乳腺小叶间纤维组织增生、玻变,其间可见瘤细胞团呈浸润性生长,部分区域瘤细胞退变固缩。我们通过术后镜下病理描述,认为这可能是因为病灶化疗药物较敏感,化疗后部分坏死,部分退变,坏死部分被慢性炎细胞,灶性肉芽组织形成所取代,或者整体坏死,被其他正常细胞取代,但形态学未见明显变化,所以超声仍然可见具体病灶,这就说明化疗后超声检查误将已经坏死、退变或被肉芽组织取代的组织当做癌组织。超声在评价这些对化疗药物较敏感的病例时,有可能做出错误的判断,导致过低估计新辅助化疗疗效。
3.3.3 4个病灶化疗后超声检查未见具体病灶,而术后大体病理可见具体病灶:回顾这些病灶的术后镜下病理描述,超声未见具体病灶的原因是化疗后残余的肿瘤细胞以单个细胞的形式散在分布,原始的间质框架通常仍然保留完整。这或许可解释新辅助化疗后肿块癌细胞退化但仍有癌残留,超声下却无法识别而认为癌灶完全消失,仅见间质水肿[7]。这时化疗后超声检查所显示的病灶消失并非真正的病灶消失。这就导致过高估计新辅助化疗疗效,进而影响临床决策。
4结论
多数乳腺癌病灶新辅助化疗前后大小、血流等级有变化,这些声像图特征能间接帮助临床医生评价新辅助化疗疗效,但病灶大小与新辅助化疗疗效无明显关系;病灶新辅助化疗在形态、边界、回声无益于临床医生评价新辅助化疗疗效。少数病灶在新辅助化疗前后大小、血流等级来评价存在过低或过高判断新辅助化疗的疗效。
参考文献:
[1]王少华,于泽平,李宁,等.乳腺癌新辅助化疗的现状和展望[J].医学研究生学报,2008,21(09):986-989,993.
[2]Adler DD,Carson PL,Rubin JM,et al.Doppler ultrasound color flow imaging in the study of the breast cancer:preliminary findings[J].Ultrasound Med Biol,1990,16:553.
[3]董婷,魏巍,张聪建.28例乳腺癌新辅助化疗后的超声表现[J].当代医学,2012,18(20):100.
[4]许彪,庄亚强,刘惕生,等.乳腺癌DSA造影及术前超选择性动脉化疗栓塞[J].介入放射学杂志,2011,20(09):696-699.
[5]孟方,李征毅,乔军,等.彩色多普勒超声在乳腺癌新辅助化疗疗效评价中的应用[J].中国超声医学杂志,2010,26(07):612-615.
[6]赵红梅,张恒伟,王雁.应用彩色多普勒超声评价乳腺癌新辅助化疗前后的疗效[J].中国肿瘤临床与康复,2006,13(02):155-156.
[7]陈雅玲,曾炜,常才.乳腺癌新辅助化疗疗效的超声评价及与组织病理学的相关性[J].中华超声影像学杂志,2010,19(12):1059-1063.
编辑/申磊
