艾塞那肽治疗2型糖尿病肥胖及超重患者效果观察
2016-05-12曹淑洁刘霞高燕燕曹彩霞牛佳鹏青岛大学医学院附属医院山东青岛266100
曹淑洁,刘霞,高燕燕,曹彩霞,牛佳鹏(青岛大学医学院附属医院,山东青岛266100)
艾塞那肽治疗2型糖尿病肥胖及超重患者效果观察
曹淑洁,刘霞,高燕燕,曹彩霞,牛佳鹏(青岛大学医学院附属医院,山东青岛266100)
摘要:目的探讨艾塞那肽对2型糖尿病(T2DM)肥胖及超重患者血糖、体质量(BW)及血清补体C(1q)-肿瘤坏死因子相关蛋白3(CTRP3)的影响。方法选取T2DM肥胖及超重患者87例,随机分为观察组42例、对照组45例。对照组采用双胍类、噻唑烷二酮类、促胰岛素分泌剂及胰岛素等治疗,根据血糖水平调整降糖方案。观察组在原降糖方案的基础上加用艾塞那肽10 μg,早晚餐前30 min~1 h皮下注射。两组均治疗12周。治疗前及治疗12周后,抽取空腹静脉血检测空腹血糖(FPG)、糖化血红蛋白(HbA(1c))、空腹C肽、胰岛素水平,计算胰岛素抵抗指数(HOMA-IR),采用酶联免疫吸附法检测血清CTRP3水平。治疗前及治疗12周后,测量身高、BW、腰围(WC)、臀围(HC),计算BMI、腰臀比(WHR)。结果与治疗前比较,治疗后观察组FPG、HbA(1c)降低,CTRP3升高;对照组FPG、HbA(1c)降低(P均<0.05)。治疗后,观察组血清CTRP3高于对照组(P均<0.05)。与治疗前比较,治疗后观察组BW、BMI、WC、WHR降低,而对照组BW、BMI、WC、WHR升高(P均<0.05)。观察组胃肠道反应发生率高于对照组,低血糖发生率低于对照组(P均<0.05)。结论艾塞那肽具有较好的降低血糖作用,且可降低T2DM肥胖或超重患者的BW,其机制可能与升高血清CTRP3水平有关。
关键词:2型糖尿病;肥胖;艾塞那肽;补体C(1q)-肿瘤坏死因子相关蛋白3;血糖;体质量
80%以上的2型糖尿病患者(T2DM)存在肥胖或超重,控制T2DM患者的肥胖、降低体质量(BW)是改善胰岛素抵抗、提高降糖效果的重要方面。艾塞那肽是内源性胰高血糖素样肽-1(GLP-1)类似物,可通过刺激葡萄糖依赖性的胰岛素分泌发挥降糖作用,此外还具有降低BW、改善胰岛素抵抗等作用[1]。补体C1q-肿瘤坏死因子相关蛋白3(CTRP3)是一种新发现的脂肪因子,具有增加胰岛素敏感性、调节肝脏脂肪代谢等多种作用[2]。研究发现,CTRP3水平降低与T2DM患者肥胖的发生有关。2013年10月~2015年6月,我们对T2DM肥胖及超重患者采用艾塞那肽治疗,观察其降低血糖及BW的效果,探讨艾塞那肽在T2DM肥胖及超重患者治疗中的作用。
1资料与方法
1.1临床资料选取同期于我院内分泌科门诊及住院治疗的肥胖及超重T2DM患者87例,男43例、女44例,年龄(53.7±10.6)岁,糖尿病病程1~10年。纳入标准:符合1999年WHO关于T2DM的诊断标准;年龄18~71岁;BMI符合2000年亚洲人群成人肥胖及超重标准;在饮食、运动控制3个月基础上血糖仍不达标。排除标准:糖尿病酮症酸中毒、高血糖高渗状态等糖尿病急性并发症;各种急慢性感染性疾病;胰腺炎及胆囊结石;肝肾功能不全;近期发生过心肌梗死、脑梗死等严重心脑血管疾病;高血压未能控制;肿瘤;骨关节病;妊娠、哺乳期妇女及计划妊娠者。随机分为观察组42例、对照组45例,两组性别、年龄、病程、用药情况等基线资料差异无统计学意义。本研究获得我院伦理委员会批准,患者均知情同意。
1.2治疗方法对照组用双胍类、促胰岛素分泌剂、噻唑烷二酮类及胰岛素等传统降糖药物,根据血糖水平调整降糖方案,可增减甘精胰岛素、餐前短效胰岛素类似物及预混胰岛素皮下注射,使空腹血糖(FPG)<7.2 mmol/L、餐后2 h血糖<10 mmol/L。观察组在原降糖方案的基础上加用艾塞那肽10 μg,早晚餐前30 min~1 h皮下注射,若出现低血糖症状则减少促胰岛素分泌剂类药物或胰岛素。两组均治疗12周。
1.3血糖相关指标检测 治疗前及治疗12周后,抽取空腹静脉血,检测FPG、HbA1c、空腹C肽、胰岛素水平,计算胰岛素抵抗指数(HOMA-IR)=FPG×空腹胰岛素/22.5。
1.4血清CTRP3水平检测治疗前及治疗12周后,抽取空腹静脉血,采用酶联免疫吸附法检测血清CTRP3水平。
1.5BW相关指标测量治疗前及治疗12周后,测量身高、BW、腰围(WC)、臀围(HC)。计算BMI,腰臀比(WHR)=WC/HC。
1.6不良反应观察观察两组治疗过程中低血糖以及恶心、腹泻等胃肠道反应不良反应情况。
2结果
2.1两组治疗前后血糖相关指标及血清CTRP3水平比较与治疗前比较,治疗后观察组FPG、HbA1c均降低,血清CTRP3水平升高;对照组FPG、HbA1c降低(P均<0.05)。治疗后,观察组血清CTRP3水平高于对照组(P<0.05)。见表1。
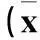
表1 两组治疗前后血糖相关指标及血清CTRP3水平比较±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,﹟P<0.05。
2.2两组治疗前后BW相关指标比较与治疗前比较,治疗后观察组BW、BMI、WHR、降低,对照组BW、BMI、WC、WHR升高(P均<0.05)。见表2。
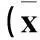
表2 两组治疗前后体质量相关指标比较±s)
注:与同组治疗前比较,*P<0.05;与对照组治疗后比较,﹟P<0.05。
2.3两组不良反应比较观察组、对照组出现胃肠道反应分别为10例(23.8%)、0例,观察组胃肠道反应发生率高于对照组(P<0.05)。观察组、对照组出现低血糖分别为2例(4.7%)、10例(22.2%),观察组低血糖发生率低于对照组(P<0.05)。
3讨论
T2DM传统的降糖方式可能引起低血糖、体质量增加及心血管疾病风险增高等。促胰岛素分泌剂类降糖药可作用于胰岛β细胞上的受体刺激胰岛素分泌,但其促胰岛素分泌作用不依赖于血糖浓度,在进食量减少或运动量增加时易引起低血糖反应,而高浓度的胰岛素水平易加重水钠潴留、促进合成代谢,增加BW。噻唑烷二酮类降糖药物通过激活过氧化物酶增殖物激活受体γ,增加靶组织对胰岛素的敏感性而降低血糖,但易引起水钠潴留导致BW增加,同时与胰岛素或促胰岛素分泌剂联用时也易发生低血糖,目前已发现罗格列酮具有增加糖尿病患者心血管事件的风险。GLP-1类似物及受体激动剂是近年来新发现的一类降糖药物,除具有降血糖作用外,还具有改善胰岛β细胞功能、减轻BW、改善胰岛素抵抗、保护心肌等降糖外作用。GLP-1由肠道L细胞分泌后作用于局部肠壁激活胃肠反射,刺激肠壁上的迷走神经末梢,启动迷走-迷走反射,控制胰腺内分泌功能[3]。GLP-1可作用于胰岛内分泌腺刺激胰岛素释放,同时抑制胰岛α细胞分泌胰高血糖素[4]。
艾塞那肽是一种高度保守的脂联素同源异构物,与GLP-1具有53%的同源性,能作用于GLP-1受体,产生与内源性GLP-1相似的作用,是第一个由FDA批准上市的GLP-1类似物,具有降低血糖、改善胰岛β细胞功能、增加胰岛素敏感性、降低BW等作用[5,6]。艾塞那肽降糖作用的机制主要包括:延缓胃排空,抑制餐后高血糖[7];刺激胰岛β细胞合成和分泌胰岛素,促进外周组织利用葡萄糖降低血糖;抑制胰岛β细胞凋亡,促进其增殖和分化,改善胰岛功能[8];抑制胰岛α细胞分泌胰高血糖素,进而抑制肝糖输出,降低FPG。本研究发现,治疗后观察组FPG、HbA1c均降低,提示艾塞那肽能够降低FPG、HbA1c。
肥胖是代谢综合征的重要组分之一,与T2DM的发生密切相关。肥胖患者体内存在脂肪代谢异常,包括脂肪异常分布和过度堆积,而脂肪代谢异常是导致胰岛素抵抗的主要原因,胰岛素抵抗可又导致T2DM的发生,因此,减轻BW可明显改善胰岛素抵抗。多项研究证实,艾塞那肽具有减轻BW的作用,每周注射1次艾塞那肽可使T2DM患者BW下降2.0~3.7 kg[9,10]。研究证实,艾塞那肽能够减少肝脏脂肪含量,从而减轻胰岛素抵抗[11]。艾塞那肽减轻BW的机制主要包括:作用于胃肠道迷走神经使胃肠道平滑肌松弛及餐后胃容受性舒张,从而减缓胃排空、增加饱腹感[7];作用于脑干孤束核中的GLP-1受体,调控摄食行为,增加饱腹感,抑制食欲,减少摄食量,改善能量代谢平衡[12]。本研究发现,治疗后观察组BW、BMI、WHR降低,提示艾塞那肽具有减轻BW、减少内脏脂肪含量、改善代谢综合征的作用,可能与其发挥降糖作用有关。
CTRP3属于CTRP超家族的一员,是一种脂肪因子分泌的调节因子,具有刺激脂联素和抵抗素的释放的作用,高剂量CTRP3能够增加脂联素和瘦素的分泌,增加胰岛素敏感性[13]。CTRP3在缺乏胰岛素时仍可抑制糖异生基因的表达,活化Akt信号通路,抑制糖异生过程中的6-磷酸葡萄糖激酶及丙酮酸激酶的表达,减少肝糖输出,降低血糖[14]。研究发现,CTRP3能够改善脂代谢、减轻BW,而肥胖患者体内CTRP3水平降低。因此,CTRP3水平降低可能是导致脂代谢紊乱进而导致肥胖的原因之一。本研究发现,治疗后观察组血清CTRP3高于对照组,提示艾塞那肽治疗后可增高血清CTRP3水平,可能是艾塞那肽使T2DM患者体质量下降同时获得良好血糖获益的原因之一。
综上所述,艾塞那肽具有较好的降低血糖作用,且可降低T2DM肥胖或超重患者的BW,其机制可能与升高血清CTRP3水平有关。
参考文献:
[1] Seino Y, Yabe D. Glucose-dependent insulinotropic polypeptide and glucagon-like peptide-1: Incretin actions beyond the pancreas[J]. J Diabetes Investig, 2013,4(2):108-130.
[2] Andreas S, Andrea K. C1q/TNF-related protein-3 (CTRP-3) attenuates lipopolysaccharide(LPS)-induced systemic inflammation and adipose tissue Erk-1/-2 phosphorylation in mice in vivo[J]. Biochem Biophys Res Commun, 2014,452(1):8-13.
[3] Burcelin R. The gut-brain axis: a major glucoregulatory player[J]. Diabetes Metab, 2010,36(Suppl3):54-58.
[4] Butler AE, Campbell-Thompson M, Gurlo T, et al. Marked expansion of exocrine and endocrine pancreas with incretin therapy in humans with increased exocrine pancreas dysplasia and the potential for glucagon-producing neuroendocrine tumors[J]. Diabetes, 2013,62(10):2595-2604.
[5] Naomo J, McKay A, Kanoski M, et al. Glucagon-like peptide-1 receptor agonists suppress water intake independent of effects on food intake[J]. Am J Physiol Regul integr Comp Physiol, 2011,301(6):1755-1764.
[6] Bhavsar S, Mudaliar S, Cherrington A. Evolution of exenatide as a diabetes therapeutic[J]. Curr Diabetes Rev, 2013,9(2):161-193.
[7] Marathe CS, Rayner CK, Jones KL, et al. Effects of GLP-1 and incretin-based therapies on gastrointestinal motor function[J]. Exp Diabetes Res, 2011,2011(9):279530.
[8] Farilla L, Hui H, Bertolotto C, et al. Glucagon-like peptide-1 promotes islet cell growth and inhibits apoptosis in Zucker diabetic rats[J]. Endocrin, 2002, 143(11):4397-4408.
[9] Drucker DJ, Buse JB, Taylor K, et al. Exenatide once weekly versus twice daily for the treatment of type 2 diabetes: a randomised, open-label, non-inferiority study [J]. Lancet, 2008,372(9645):1240-1250.
[10] Blevins T, Pullman J, Malloy J, et al. Duration-5: exenatide once weekly resulted in greater improvements in glycemic control compared with exenatide twice daily in patients with type 2 diabetes [J]. Clin Endocrinol Metab, 2011,96(5):1301-1310.
[11]孙丽萍,高燕燕,李莉,等.艾塞那肽对肥胖2型糖尿病患者血清nesfatin-1水平及肝脏脂肪含量的影响[J].山东大学学报(医学版),2013,51(6):84-88.
[12]Williams DL, Baskin DG, Schwartz MW. Evidence that intestinal glucagon-like peptide-1 plays a physiological role in satiety[J]. Endocrinology, 2009, 150(4):1680-1687.
[13] Wolfing B, Buechler C, Weigert J, et al. Effects of the new C1q/TNF-related protein(CTRP-3) cartonectin on the adipocytic secretion of adipokines[J]. Obesity, 2008,16(7):1481-1486.
[14] Peterson JM, Wei Z, Wong GW. C1q/TNF-related protein-3 (CTRP3), a novel adipokine that regulates hepatic glucose output[J]. J Biol Chem, 2010,285(51):39691-39701.
(收稿日期:2015-10-09)
中图分类号:R587.1
文献标志码:B
文章编号:1002-266X(2016)14-0057-03
doi:10.3969/j.issn.1002-266X.2016.14.020
通信作者:高燕燕(E-mail: qdygyy@126.com)
