miRNA-455在小鼠心室重构中的作用及机制探讨
2016-05-12吴春涛李拥军河北医科大学第三医院石家庄05007河北医科大学第二医院
吴春涛,李拥军(河北医科大学第三医院,石家庄05007;河北医科大学第二医院)
miRNA-455在小鼠心室重构中的作用及机制探讨
吴春涛1,李拥军2(1河北医科大学第三医院,石家庄050017;2河北医科大学第二医院)
摘要:目的探讨microRNAs-455(miR-455)在心室重构中的作用及其机制。方法 选择小鼠18只,分为miR-455组、GFP组及假手术组各6只。miR-455组、GFP组均行升主动脉缩窄术,术后4周即进展为心室重构模型。假手术组术中仅游离主动脉弓但不结扎。miR-455组于术后第1、8、15、22天尾静脉注射包被miR-455的腺病毒0.1 mL,GFP组及假手术组于同时点尾静脉注射包被GFP的腺病毒0.1 mL。术后4周造模成功,应用心脏超声检查测量各组左心室舒张期内径(LVIDd)、左心室舒张末容积(LVEDV)、左心室舒张期前壁厚度(LVAWd)、左心室射血分数(EF)。处死各组大鼠取心室肌行HE及Masson染色,观察心肌病理改变。采用qRT-PCR法检测各组心肌组织心肌肥厚基因[包括心房钠尿因子(ANF)、骨骼肌肌动蛋白1(ACTA1)、β肌球蛋白重链]及心肌纤维化基因[包括转化生长因子β1(TGF-β1)、结缔组织生长因子(CTGF)]表达。采用Western blot法检测各组心肌细胞中凋亡蛋白Bax及抗凋亡蛋白Bcl-2蛋白的表达。采用TUNEL染色法检测各组心肌细胞凋亡情况,计算凋亡指数。结果与假手术组相比,GFP组LVIDd增加、LVEDV增加、LVAWd增厚、EF降低(P<0.01或0.05);与GFP组相比,miR-455组LVIDd降低、LVEDV降低、LVAWd增厚、EF增加(P<0.01或0.05)。GFP组心肌组织呈心肌肥厚、心肌纤维化病理改变,miR-455组较GFP组心肌肥厚、心肌纤维化病理改变明显减轻。GFP组各心肌肥厚基因及心肌纤维化基因mRNA表达均高于假手术组,miR-455组各心肌肥厚基因及心肌纤维化基因mRNA表达均低于GFP组(P<0.01或0.05)。与假手术组相比,GFP组Bax表达增加、Bcl-2表达降低、心肌细胞凋亡指数增高(P<0.01或0.05);与GFP组相比,miR-455组Bax表达降低、Bcl-2表达增加、心肌细胞凋亡指数降低(P<0.01或0.05)。结论miR-455具有抑制心室重构、改善心功能的作用,可能与其抑制心肌肥厚、心肌纤维化、心肌细胞凋亡有关。
关键词:miR-455;心室重构;心肌肥厚;心肌纤维化;细胞凋亡;小鼠
长期高血压导致的心室重构是心脏不良事件的独立危险因素,与心源性猝死、心律失常、心力衰竭等密切相关。心室重构可导致心肌肥厚、心肌凋亡、成纤维细胞增加、胶原纤维增生、心肌代谢异常及电生理改变等,是导致心力衰竭加重的重要原因。探讨心室重构的机制,对于了解心力衰竭的发生发展具有重要意义。microRNAs(miRNAs)是一类具有转录后调节活性的小分子RNA,可通过转录后负性调节目的蛋白参与多种心血管疾病的发生。但miRNA-455(miR-455)与心室重构的关系尚不明确。2012年7月~2014年12月,我们通过升主动脉缩窄(TAC)术构建了心室重构小鼠模型,观察转染miR-455后心室重构小鼠心肌肥厚、心肌纤维化及心肌细胞凋亡的变化,探讨miR-455在心室重构中的作用及其机制。
1材料与方法
1.1动物与材料雄性、健康昆明小鼠18只,4周龄,体质量(20±2)g,购自河北医科大学。包被miR-455的腺病毒(5.0×109ifu/mL)和包被绿色荧光蛋白(GFP)的腺病毒(1.0×109ifu/mL)均购自Invitrogen公司。抗Bax和抗Bcl-2抗体购自博士德公司。GAPDH抗体购自Bio World公司。TUNEL试剂盒购自Roche公司。
1.2动物分组及心室重构模型制备将小鼠分为miR-455组、GFP组及假手术组各6只。miR-455组、GFP组均通过升主动脉缩窄术(TAC)制备心室重构模型,麻醉后于左胸骨边缘约2 mm处沿第二肋间隙打开胸腔,游离主动脉弓,于锁骨下动脉(第一分支)和左颈总动脉(第二分支)间穿0号线,然后平行于主动脉弓放置27-gauge(直径0.4 mm)针头,一同结扎后抽出针头,使主动脉缩窄65%~70%。TAC术后4周即进展为心室重构,成为心室重构模型。假手术组手术同上,但术中仅游离主动脉弓而不结扎。
1.3干预方法miR-455组于TAC术后第1、8、15、22天尾静脉注射包被miR-455的腺病毒0.1 mL。GFP组及假手术组于TAC术后第1、8、15、22天尾静脉注射包被GFP的腺病毒0.1 mL。TAC术后4周,应用颈椎脱臼法处死小鼠,取心肌组织标本,行qRT-PCR法检测心肌组织miR-455表达,miR-455组心肌组织miR-455表达高于GFP组,证实miR-455在小鼠体内转染成功。
1.4心功能检测于 TAC术后4周造模成功后,应用心脏超声检查评估各组心功能。氯胺酮麻醉,小鼠仰卧位,剪去心前区毛,应用超声仪频率为30 MHz的探头在胸壁上行胸骨旁长轴、短轴、心尖和剑突切面超声检查,测量左心室舒张期内径(LVIDd)、左心室舒张末容积(LVEDV)、左心室舒张期前壁厚度(LVAWd)、左心室射血分数(EF)。
1.5心肌组织病理改变观察超声检查后应用颈椎脱臼法处死各组小鼠,迅速取出心脏,取心室肌,行HE及Masson染色,应用Motic 6.0分析软件于显微镜下观察心肌病理改变。
1.6心肌肥厚基因及心肌纤维化基因mRNA表达检测采用qRT-PCR法,检测各组心肌组织中心肌肥厚基因包括心房钠尿因子(ANF)、骨骼肌肌动蛋白β1(ACTA1)、β肌球蛋白重链mRNA表达,心肌纤维化基因包括转化生长因子β1(TGF-β1)、结缔组织生长因子(CTGF)mRNA表达。
1.7心肌凋亡蛋白表达检测采用Western blot法检测各组心肌细胞中凋亡蛋白Bax及抗凋亡蛋白Bcl-2蛋白的表达。以兔抗人GAPDH 抗体(1∶5 000)作为内对照。抗原-抗体复合物用双色红外激光扫描仪进行扫膜。采用Image-Pro Plus软件分析蛋白条带积分光密度值(IOD),以靶蛋白与GAPDH的IOD比值反映靶蛋白相对表达量。
1.8心肌细胞凋亡检测将各组心肌组织标本用石蜡包埋后切片,使用TUNEL试剂盒染色,每张切片随机取6个高倍镜视野,检测心肌细胞凋亡情况,计数100个细胞核中凋亡细胞核的个数作为凋亡指数。
2结果
2.1各组心功能比较见表1。
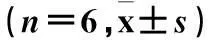
表1 各组心功能结果比较
注:与假手术组比较,*P<0.05,△P<0.01;与GFP组比较,#P<0.01。
2.2各组心肌组织病理改变HE染色:假手术组心室壁厚度正常,心肌细胞排列整齐、大小正常,细胞质均匀,细胞核染色均匀;GFP组心室壁厚度增厚,心肌细胞横截面积增大;miR-455组较GFP组心室壁厚度进一步增厚,心肌细胞进一步增大,心肌细胞排列紊乱,细胞质浓染,细胞间距增大,细胞核空染增多。Masson染色:假手术组可见少量胶原纤维散在分布于心肌细胞间隙,GFP组心肌胶原纤维较假手术组明显增加,miR-455组心肌胶原纤维较GFP组明显减少。
2.3各组心肌肥厚基因及心肌纤维化基因表达比较见表2。
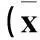
表2 各组心肌肥厚基因、心肌纤维化基因表达比较±s,n=6)
注:与假手术组比较,△P<0.01;与GFP组比较,#P<0.01。
2.4各组心肌细胞凋亡蛋白表达比较详见见表3、图1。
2.5各组心肌细胞凋亡指数比较见表3。

表3 各组心肌细胞凋亡蛋白表达比较±s)
注:与假手术组比较,*P<0.05,△P<0.01;与GFP组比较,▲P<0.05。

图1 各组心肌细胞Bax、Bcl-2蛋白表达
3讨论
miRNAs是长21~25 nt的内源性非编码小分子RNA,通过调节多种基因的表达广泛参与心血管系统细胞的增殖、迁移、分化、凋亡等病理生理过程。研究发现,miR-350、miR-21、miR-23a、miR-24、miR-208、miR-195、miR-19等与心肌肥厚有关[1~3],miR-29及miR-21与心肌纤维化有关[4,5],miR-133a与缺血性心脏病有关[6,7],miR-129与心力衰竭有关[8]。miR-455是一种新发现的miRNAs,其5′端有6个核苷酸序列,与钙网蛋白(Calr)匹配完好,而Calr与心室重构关系密切,这一分子结构提示miR-455可能在心室重构的发生中发挥一定作用。
高血压病时心脏的前后负荷增加,可导致左心室肥厚及心腔扩大,出现左心室重构。早期的左心室重构以心肌细胞肥大为主,是心脏对压力负荷增加的代偿,以降低升高的室壁张力,维持甚至增加射血分数。当病变进展到后期时,左心室重构以心肌凋亡和胶原纤维异常增加为主,出现EF进行性降低,成为导致心功能恶化、心力衰竭加重的重要原因。本研究发现,与假手术组相比,GFP组LVIDd增加、LVEDV增加、LVAWd增厚、EF降低,提示心室重构小鼠的心肌收缩力下降、EF降低,出现心功能降低;与GFP组相比,miR-455组LVIDd降低、LVEDV降低、LVAWd增厚、EF增加,提示miR-455改善了心功能,可能与其抑制心室重构进展有关。
心肌肥厚是心肌组织对高血压时室壁张力增高的一种反应。在离体心肌组织和在体心脏中,室壁张力增高是导致心肌细胞肥大的直接刺激因素。这种效应可能由离子通道介导,通过调节细胞内pH或胞内信使分子如cAMP的浓度,从而使mRNA增多,促使心肌细胞蛋白质合成、出现心肌肥大。此外,心室重构后去甲肾上腺素α受体增多也可刺激心肌细胞增长,使肾素-血管紧张素-醛固酮系统活性增高,加速蛋白质合成,促进心肌肥厚的发生。本研究发现,GFP组心肌组织病理呈心肌肥厚改变,心室壁厚度增厚,心肌细胞横截面积增大,心肌肥厚基因ANF、ACTA1、β肌球蛋白重链mRNA表达均增加,提示心室重构小鼠出现心肌肥厚病理改变;与GFP组相比,miR-455组心肌肥厚病理改变程度减轻,心肌肥厚基因ANF、ACTA1 mRNA表达降低,提示miR-455可能通过抑制心肌肥厚基因的表达抑制心肌肥厚的进展,考虑GFP组可能进入心室重构的心力衰竭阶段,而miR-455组尚停留于心肌肥厚的早期阶段,可能与miR-455延缓心室重构进展有关。
在高血压病血流动力学改变、神经-内分泌-细胞因子激活等作用下发生心脏重构后,可出现心肌间质的重构,主要表现为血管增生、交感神经元轴突增长、成纤维细胞增殖、早期Ⅲ型胶原mRNA表达、后期Ⅰ型胶原及前胶原蛋白mRNA增加等,导致Ⅰ/Ⅲ型胶原比例增加,出现左心室僵硬,影响其舒张功能[9]。本研究发现,GFP组心肌组织呈纤维化样改变,心肌胶原纤维较假手术组明显增加,心肌纤维化基因TGF-β1、CTGF mRNA的表达均增高,提示GFP组发生心肌纤维化;与GFP组相比,miR-455组心肌胶原纤维明显减少,心肌纤维化基因TGF-β1、CTGF mRNA表达降低,提示miR-455抑制了心肌纤维化进展,可能与其抑制心肌纤维化基因表达有关。
细胞凋亡可能是导致心力衰竭的重要原因。心力衰竭终末期,平均每百万个心肌细胞就有2 318个发生凋亡,比正常细胞高232倍[10]。衰竭心脏的特征性变化是由于细胞凋亡和坏死引起的进行性心肌细胞丧失、心肌肥大等。本研究发现,与假手术组相比,GFP组凋亡蛋白Bax表达增加、抗凋亡蛋白Bcl-2表达降低、心肌细胞凋亡指数增高,提示GFP组心肌凋亡现象明显;与GFP组相比,miR-455组凋亡蛋白Bax表达降低、抗凋亡蛋白Bcl-2表达增加、心肌细胞凋亡指数降低,提示miR-455抑制了心室重构后的心肌细胞凋亡,可能与其下调Bax蛋白、上调Bcl-2蛋白表达有关。
参考文献:
[1] 张淑华,吴志婷,张志玲,等.miR-350在腹主动脉部分缩窄大鼠心肌组织中的表达及意义[J].山东医药,2013,53(25):1-3.
[2] Rooij E van, Sutherland LB, Liu N, et al. A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure[J]. Proc Natl Acad Sci USA, 2006,103(48):18255-18260.
[3] van Rooij E, Sutherland LB, Qi X, et al. Control of stress-dependent cardiac growth and gene expression by a microRNA[J]. Science, 2007,316(5824): 575-579.
[4] Thum T, Gross C, Fiedler J, et al. MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J]. Nature, 2008,456(7224):980-984.
[5] van Rooij E, Sutherland LB, Thatcher JE, et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proc Natl Acad Sci USA, 2008,105(35):13027-13032.
[6] 陈丽媛,符春晖,严华,等.外周血单核细胞miRNA-146a与冠状动脉病变复杂性的关系[J]. 山东医药,2015,55(20): 48-49.
[7] 徐冬梅,于立成,楚新梅,等.血清微小RNA可能是急性心肌梗死的标志物[J].山东医药,2011,51(36): 14-16.
[8] Thum T, Galuppo P, Wolf C, et al. MicroRNAs in the human heart: a clue to fetal gene reprogramming in heart failure[J]. Circulation, 2007,116(3):258-267.
[9] Berk BC, Fujiwara K, Lehoux S, et al. ECM remodeling in hypertensive heart disease[J] . J Clin Invest, 2007,117(3):568-575.
[10] Olivetti G, Abbi R, Quaini F, et al. Apopotosis in the human heart[J]. N Engl J Med,1997,336(16):1131-1141.
(收稿日期:2015-08-08)
中图分类号:R542.2;R544.1
文献标志码:A
文章编号:1002-266X(2016)14-0039-03
doi:10.3969/j.issn.1002-266X.2016.14.013
