内蒙紫草总黄酮提取工艺及其抗氧化活性研究
2016-05-11林海桢施胜英李舒婕周溦林敬明南方医科大学珠江医院药剂科广东广州510282
林海桢,施胜英,李舒婕,周溦,林敬明(南方医科大学珠江医院药剂科,广东广州510282)
内蒙紫草总黄酮提取工艺及其抗氧化活性研究
林海桢,施胜英,李舒婕,周溦,林敬明*
(南方医科大学珠江医院药剂科,广东广州510282)
摘要:以内蒙紫草总黄酮得率为指标,在单因素试验基础上,采用响应面法优化超声波辅助提取工艺,并以芦丁为对照,测定内蒙紫草总黄酮的抗氧化活性。结果表明,响应面试验获得的内蒙紫草总黄酮的最佳提取工艺为乙醇体积分数58.57%,料液比1∶43.33(g/mL),超声时间3.33h,此时总黄酮得率4.94%。
关键词:内蒙紫草;总黄酮;超声波辅助提取;响应面法;抗氧化活性
内蒙紫草,又名黄花软紫草、黄紫草、假紫草[1],紫草科软紫草属植物,分布于甘肃,内蒙古等地[2],药用干燥根,主要成分有蒽醌、多糖、黄酮等化合物,具有较好的抗菌、抗炎、抗肿瘤、抗病毒、抗过敏、保肝降酶等作用[3],开发应用前景广阔。超声波能在液体中产生“空穴作用”,破坏植物细胞结构,使提取液不断振荡,有助于黄酮类化合物的溶出和扩散,同时产生的热效应保持一定水温,大大提高了植物中有效成分的得率[4]。响应面法是采用多元二次回归方法作为函数估计的工具,将多因子试验中因素与指标的相互关系用多项式近似拟合,依此可对函数的响应面进行分析,研究因子与响应面之间、因子与因子之间的相互关系[5]。因此,本试验采用超声波辅助提取内蒙紫草中的总黄酮,在单因素试验基础上,通过响应面法获得最佳提取工艺条件,并以芦丁为对照,测定内蒙紫草总黄酮对1,1-二苯-2-苦基肼(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)的清除能力来判定其抗氧化活性,为其药理学研究和野生资源的开发利用提供参考依据。
1 材料与方法
1.1材料与试剂
内蒙紫草:购自南方医科大学珠江医院中药房,经笔者鉴定为真品;芦丁标准品:麦克林公司,批号C10018061,纯度>99 %;DPPH:阿拉丁,批号40248;ABTS:阿拉丁,批号36567;石油醚、亚硝酸钠、硝酸铝、氢氧化钠、过硫酸钾:均为分析纯。
1.2仪器设备
DW-500C密封摇摆式高速粉碎机:浙江省台州市大畏机械厂;KQ-600DE超声波清洗仪:昆山市超声仪器有限公司;BL-2000S电子天平:美国Setra公司;R-200D精密电子天平:Sartorius公司;Lambda-35紫外可见分光光度计:美国Perkin Elmer公司;Centrifuge 5810R离心机:Eppendorf AG公司;DHG-9146A电热恒温鼓风干燥箱:上海精宏实验设备有限公司。
1.3方法
1.3.1标准曲线的绘制[6]
精确称取芦丁标准品31.50 mg,加60 %乙醇溶解并定容至100 mL棕色容量瓶中,量取25 mL于50 mL容量瓶,用水稀释至刻度,制成0.157 5 mg/mL芦丁对照品储备液,精密量取0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0 mL于10 mL具塞试管中,分别加30 %乙醇至5 mL,加5 %NaNO2溶液0.3 mL,摇匀,放置6min,加Al(NO3)3溶液0.3 mL,摇匀,放置6min,加4 % NaOH溶液4 mL,用水稀释至10 mL,于510 nm波长处测定吸光度(A),以浓度C对A进行线性回归,得回归方程A = 9.899 8C + 0.005 7(R2=0.999 5),线性范围0~0.078 mg/mL。
1.3.2总黄酮提取及含量测定
将紫草粉碎,过2号筛,加一定倍量石油醚超声脱脂2次,滤渣烘干,备用。准确称取脱脂后紫草粉末1 g 于100 mL锥形瓶中,以一定料液比加入一定体积分数乙醇溶液,封口塞密封,浸泡过夜。在室温下,超声波辅助提取规定时间,离心,沉淀以同样条件提取和离心,合并两次上清液,并用蒸馏水定容至100 mL容量瓶中[7],取该溶液1 mL,按标准曲线项下测定样品吸光度,计算总黄酮得率。
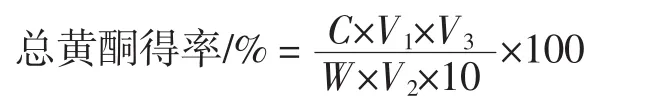
式中:C为黄酮浓度,mg/mL;V1为测定时具塞试管中溶液体积,mL;V2为待测样液分取的体积,mL;V3待测样液的总体积,mL;W为脱脂后的样品重,g。
1.3.3总黄酮响应面试验
根据单因素试验结果,每个因素取3个水平进行优化。以总黄酮得率为指标,采用响应面试验确定最佳提取条件,因素水平如表1。
1.3.4总黄酮抗氧化活性测定
1.3.4.1DPPH自由基清除能力测定[8-10]
移取不同质量浓度(6.25、12.5、25、50、100、200、 400、450 μg/mL)紫草总黄酮溶液各2.5 mL,各加入250 μg/mL DPPH溶液2.5 mL于具塞试管中,振荡摇匀,黑暗处放置30min,于517 nm处测定A1;空白组以95 %乙醇代替样品溶液,测定A0;对照组以95 %乙醇代替DPPH溶液,测定A2。以95 %乙醇调零,平行3次,用同样浓度系列的芦丁溶液作阳性对照。


表1 紫草总黄酮超声提取工艺响应面因素水平Table 1 Factors and levels used in RSM for total flavonoids from Arnebia guttata Bunge
1.3.4.2ABTS+自由基清除能力测定
参照文献方法[11-12]并做改进,移取不同质量浓度(6.25、12.5、25、50、100、200、400、450 μg/mL)紫草总黄酮溶液各0.3 mL,各加入ABTS+工作液3 mL于具塞试管中,振荡摇匀,室温暗处条件下反应6min,于734 nm处测定A1;空白组以95 %乙醇代替样品溶液,测定A0;对照组以95 %乙醇代替ABTS+工作液,测定A2。以95 %乙醇调零,平行3次,用同样浓度系列的芦丁溶液作阳性对照。

2 结果与讨论
2.1单因素试验
2.1.1提取次数对总黄酮得率的影响
固定料液比1∶30(g/mL),乙醇体积分数70 %,超声功率600 W,超声时间0.5 h,考察提取次数对总黄酮得率的影响,结果见图1。

图1 提取次数对总黄酮得率的影响Fig.1 Effects of repeated extraction number on extraction yield of total flavonoids
由图1可知,提取次数从1次增加到2次,提取率升高幅度较明显,继续增加提取次数,提取率无明显提高,这是因为此时内蒙紫草中残留的黄酮类物质已经很少,故从减少操作环节,节约成本考虑,提取次数宜选择2次。
2.1.2乙醇体积分数对总黄酮得率的影响
固定料液比1∶30(g/mL),超声功率600 W,超声时间0.5 h,提取2次,考察乙醇体积分数对总黄酮得率的影响,结果见图2。

图2 乙醇体积分数对总黄酮得率的影响Fig.2 Effect of ethanol concentration on extraction yield of total flavonoids
由图2可知,随着乙醇体积分数升高,得率有一个先升后降的趋势,在乙醇体积分数60 %时得率达最高。这是因为总黄酮为极性化合物,根据相似相溶原理,通过调节乙醇和水的配比改变乙醇溶液的极性,对总黄酮的提取效率有较大影响[13],故选择乙醇体积分数为60 %。
2.1.3料液比对总黄酮得率的影响
固定乙醇体积分数60 %,超声功率600 W,超声时间0.5 h,提取2次,考察料液比对总黄酮得率的影响,结果见图3。

图3 料液比对总黄酮得率的影响Fig.3 Effect of solid-liquid ratio on extraction yield of total flavonoids
由图3可知,随着料液比增大,得率亦逐渐增大,当料液比比达到1∶40(g/mL)时,再增大料液比,得率变化不大,这是因为料液比1∶40(g/mL)时,黄酮类化合物的溶解基本达到完全。通过对得率、溶剂用量、能量耗损和后续工艺简化的综合考虑,选择料液比1:40 (g/mL)进行优化试验。
2.1.4超声功率对总黄酮得率的影响
固定料液比1∶40(g/mL),乙醇体积分数60 %,超声时间0.5 h,提取2次,考察超声功率对总黄酮得率的影响,结果见图4。
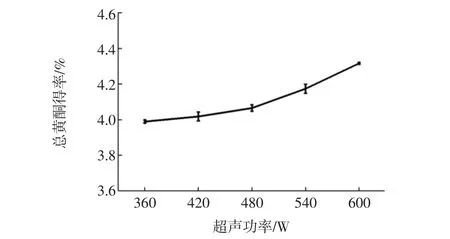
图4 超声功率对总黄酮得率的影响Fig.4 Effect of ultrasonic power on the extraction yield of total flavonoids
由图4可知,随着超声功率增加,得率不断上升,并在600 W时达到极大值,可能是由于超声波的振动,击碎了紫草内部细胞壁,加速了细胞内部黄酮类物质的浸出速率[14],因此提取得率逐渐增大,故选择超声功率为600 W。
2.1.5超声时间对总黄酮得率的影响
固定料液比1∶40(g/mL),乙醇体积分数60 %,超声功率600 W,提取2次,考察超声时间对总黄酮得率的影响,结果见图5。

图5 超声时间对总黄酮得率的影响Fig.5 Effects of extraction time on extraction yield of total flavonoids
由图5可知,在提取3 h前,总黄酮不能充分地转移到溶液中,随着提取时间增加,总黄酮含量也增加,在3 h时达到峰值,之后,继续增加时间,得率有所下降,这可能是因为随着提取时间的增加,温度急剧升高,导致总黄酮分解或挥发所致[13],故选择提取时间为3 h。
2.2响应面试验
响应面试验组合与结果见表2;回归模型的方差分析结果见表3;各因素之间对得率影响的响应面和等高线见图6、图7、图8。

表2 紫草总黄酮超声提取工艺响应面安排Table 2 Response surface design arrangement and experimental results for total flavonoids from Arnebia guttata Bunge
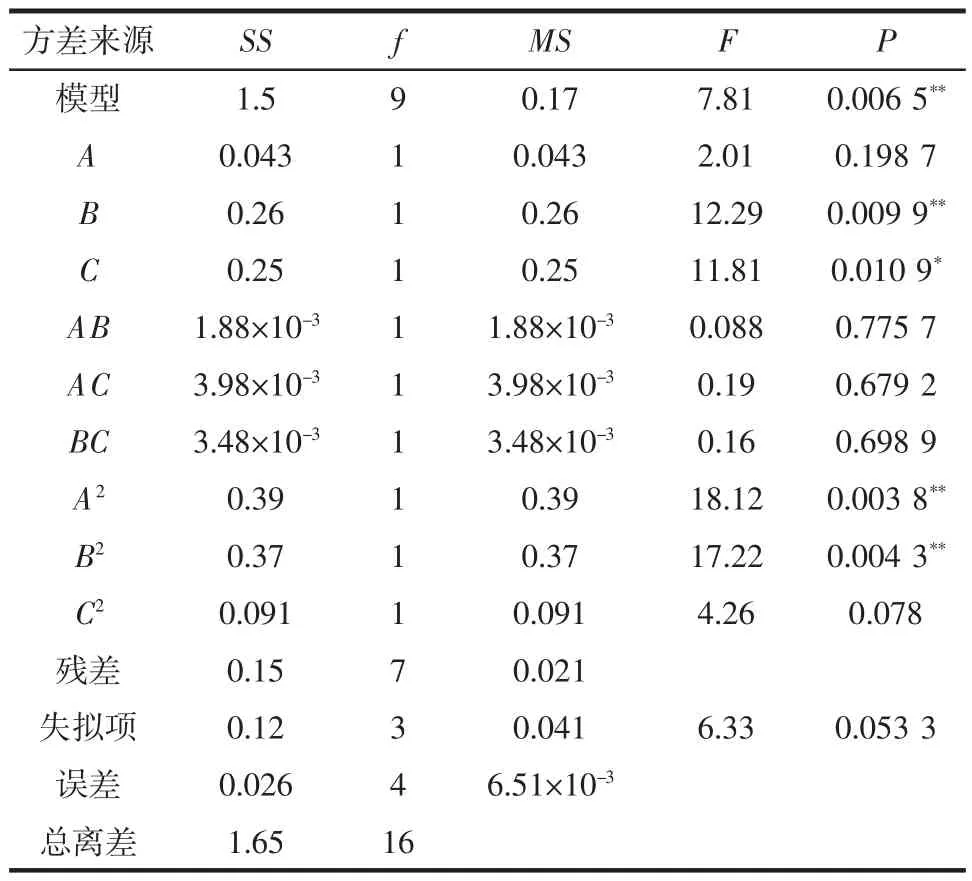
表3 超声提取工艺回归模型方差分析Table 3 Analysis of variance(ANOVA)for the fitted regression model
应用Design-Expert 8.0.6软件对表2中数据进行二次多元回归拟合,得到A、B、C与紫草总黄酮得率的二次多项回归方程:
Y=4.85-0.073A+0.18B+0.18C+0.022AB-0.032AC+ 0.029BC-0.3A2-0.3B2-0.15C2。
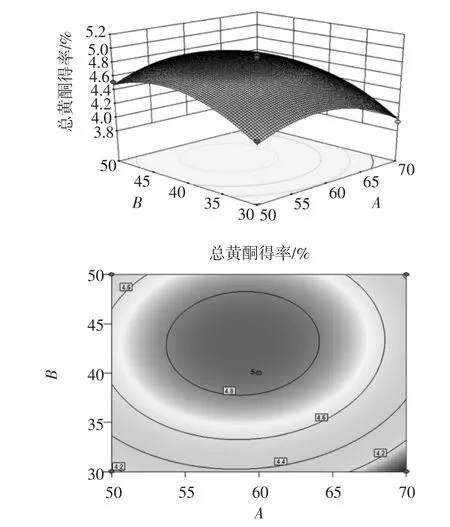
图6 乙醇体积分数和料液比对紫草总黄酮得率的影响Fig.6 Effects of ethanol concentration and solid-liquid ratio on extraction yield of total flavonoids from Arnebia guttata Bunge

图7 乙醇体积分数和超声时间对紫草总黄酮得率的影响Fig.7 Effects of ethanol concentration and extraction time on extraction yield of total flavonoids from Arnebia guttata Bunge
对上述回归模型进行显著性检验,结果见表3,因变量和全体自变量的线性关系显著(r=0.953 6),模型的显著水平远远<0.05,此时二次多项回归方差模型高度显著,说明该试验方法可靠,可用此模型对超声提取内蒙紫草总黄酮的工艺结果进行分析和预测。
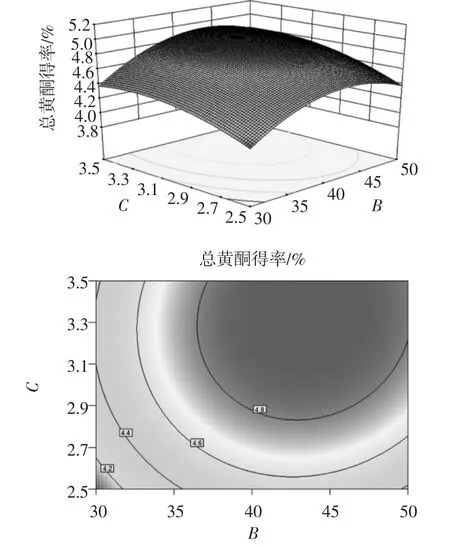
图8 料液比和超声时间对紫草总黄酮得率的影响Fig.8 Effects of solid-liquid ratio and extraction time on extraction yield of total flavonoids from Arnebia guttata Bunge
根据回归方程,作响应曲面图,考察所拟合的响应曲面形状,分析乙醇体积分数、料液比和超声时间对得率的影响。其响应曲面及其等高线如图6~图8所示,3组图直观地反映了各因素对响应值的影响,以料液比、超声时间影响较为显著,乙醇体积分数次之。等高线的形状可反映出交互效应的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反[13]。比较3组图并结合表3中P可知:模型的一次项A(P>0.05)不显著、B(P<0.01)高度显著,C(P<0.05)显著;交互项都不显著;二次项A(P<0.01)和B(P<0.01)均高度显著,表明各因素对得率的影响不是简单的线性关系,其中,料液比、超声时间对总黄酮得率的影响最显著,表现为曲线较陡;而乙醇体积分数次之,表现为曲线较平滑,且随其数值的增加或减少,响应值变化较小。
综上所述,根据回归模型通过Design-Expert软件分析得出,紫草总黄酮最佳提取条件为乙醇体积分数58.57 %,料液比1∶43.33(g/mL),超声时间3.33 h。为实际操作方便,选取乙醇体积分数59 %,料液比1∶43 (g/mL),超声时间3.3 h。
为检验响应面试验设计所得结果的可靠性,采用上述优化出的工艺参数进行3次验证试验,结果总黄酮平均得率4.91 %(RSD=1.46 %),与预测值4.94 %相差不大,说明该方程与实际情况拟合较好,所建模型正确,具有实用价值。
2.3抗氧化活性测定
2.3.1DPPH自由基清除能力测定
不同浓度的内蒙紫草总黄酮和芦丁对DPPH自由基的清除作用如图9所示。

图9 紫草总黄酮和芦丁清除DPPH自由基的能力Fig.9 DPPH radical scavenging activities of total flavonoids and rutin
由图9可知,紫草总黄酮和芦丁对DPPH自由基具有一定的清除能力,且随质量浓度的增加而增强,呈现明显的量效关系,经过计算IC50(半数抑制浓度)值,两者分别为66.76、33.19 μg/mL,表明紫草总黄酮清除DPPH自由基的能力弱于芦丁,这可能是因为紫草总黄酮为混合物,纯度低,杂质较多,抑制了其活性[15]。
2.3.2 ABTS+自由基清除能力测定
不同浓度的内蒙紫草总黄酮和芦丁对ABTS+自由基的清除作用如图10所示。

图10 紫草总黄酮和芦丁清除ABTS+自由基的能力Fig.10 ABTS+radical scavenging activities of total flavonoids and rutin
由图10可知,随着紫草总黄酮和芦丁质量浓度的增加,对ABTS+的清除率亦随之增大,呈现出较明显的量效关系,经过计算IC50(半数抑制浓度)值,两者分别为22.19、30.60 μg/mL,可见紫草总黄酮清除ABTS+自由基的能力稍强于芦丁。
3 结论
通过单因素试验确定各因素的最佳水平,在此基础上采用响应面分析法对内蒙紫草中总黄酮的超声波辅助提取工艺进行优化,得到最佳工艺修正条件为乙醇体积分数59%、料液比1∶43(g/mL),超声时间3.3h。在此条件下,经3次试验验证,总黄酮平均得率4.91%,与模型预测值4.94 %非常接近。说明该工艺科学合理,安全有效,在黄酮类化合物提取过程中具有很好的应用前景。
抗氧化试验表明,紫草总黄酮具有较强的清除DPPH 和ABTS+的能力,其IC50相应为66.76、22.19 μg/mL,分别是芦丁的约2.01倍和0.73倍,可见紫草总黄酮清除DPPH自由基能力小于芦丁,而清除ABTS+自由基的能力却优于芦丁,且始终大于同质量浓度下的芦丁;同质量浓度的总黄酮对ABTS+自由基清除作用大于DPPH自由基,原因可能与提取物中黄酮结构有关及对不同体系的抗氧化作用不同所致[16]。内蒙紫草体外抗氧化活性成分,除与黄酮有关外,还可能与醇提物中复杂的其它成分有关[17],至于抗氧化成分的种类、化学结构及其机理还有待于进一步的研究。
参考文献:
[1]黄艳.藏紫草化学成分及其抑菌活性研究[D].成都:西南交通大学,2012
[2]徐新刚.新疆紫草的化学成分研究[D].北京:北京中医药大学,2009
[3]郭鑫,李治建,古力娜·达吾提,等.新疆紫草化学成分的初步研究[J].时珍国医国药,2012(4):814-815
[4]乔孟,屈晓清,丁之恩.响应面法优化超声波辅助提取湖北海棠叶中总黄酮工艺[J].食品科学,2013,34(2):143-147
[5]汪洪武,刘艳清,汪远红.响应面法优化超声提取波罗蜜叶中总黄酮的工艺[J].中药材,2011,33(7):1125-1129
[6]朱明慧,尹海波,王洪成,等.星点设计-效应面法优化老鹳草总黄酮的提取工艺[J].中国实验方剂学杂志,2013(7):31-34
[7]张生潭,王兆玉,兰新宇,等.响应面法优化麻疯树叶总黄酮提取工艺及其抗菌活性研究[J].中药材,2013(2):308-311
[8] Lan S,Lin J,Zheng N.Evaluation of the Antioxidant Activity of Coreopsis Tinctoria Nuff.and Optimisation of Isolation by Response Surface Methodology[J].Acta Pharmaceutica,2014,64(3):369-378
[9] Zheng N,Wang Z,Chen F,et al.Evaluation to the antioxidant activity of total flavonoids extract from Syzygium jambos seeds and optimization by response surface methodology [J].African Journal of Pharmacy & Pharmacology,2011,5(21):2411-2419
[10] Wootton-Beard P C,Moran A,Ryan L.Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP,DPPH,ABTS and Folin-Ciocalteu methods[J].Food Research International,2011,44(1):217-224
[11] Luo A,He X,Zhou S,et al.Purification,composition analysis and antioxidant activity of the polysaccharides from Dendrobium nobile Lindl[J].Carbohydrate Polymers,2010,79(4):1014-1019
[12] Fan Y,He X,Zhou S,et al.Composition analysis and antioxidant activity of polysaccharide from Dendrobium denneanum[J].International Journal of Biological Macromolecules,2009,45(2):169-173
[13]李姣姣,李超.了哥王总黄酮的超声波协同微波提取工艺及其抗氧化活性研究[J].食品科学,2010(16):101-105
[14]彭爱红,叶鹏,陈素艳,等.食用仙人掌黄酮的超声提取条件及其抗氧化活性的研究[J].食品科学,2006(12):527-530
[15]段宙位,李维国,窦志浩,等.沉香叶黄酮类化合物的提取及其抗氧化活性[J].食品科学,2015(6):45-50
[16]杨岚,李华峰,刁海鹏,等.蒲公英花中总酚酸和总黄酮含量测定及其抗氧化性能研究[J].食品科学,2011(17):160-163
[17]李彩霞,高海宁,焦扬,等.“黑美人”土豆黄酮提取及抗氧化活性[J].食品科学,2013(4):88-93
Study on Extraction Process and Antioxidant Activity of Total Flavonoids from Arnebia guttata Bunge
LIN Hai-zhen,SHI Sheng-ying,LI Shu-jie,ZHOU Wei,LIN Jing-ming*
(Department of Pharmacy,Zhujiang Hospital of Southern Medical University,Guangzhou 510282,Guangdong,China)
Abstract:The objects of this study were to optimize extraction process and to research in vitro antioxidant activity of total flavonoids from Arnebia guttata Bunge.The extraction technology was optimized by single factor experiment and response surface methodology and the antioxidant effect was determined with rutin as positive control.The results had indicated that the extraction optimum technological conditions were the solid -liquid ratio 1∶43.33(g/mL),the concentration of ethanol 58.57 %,the extracting time 3.33 h,and the yield of total flavonoids was 4.94 %.
Key words:Arnebia guttata Bunge;total flavonoids;ultrasonic -assisted extraction;response surface methodology;antioxidant activity
DOI:10.3969/j.issn.1005-6521.2016.05.010
基金项目:广东省自然科学基金项目(S2013010014796);海珠区科普计划项目(2014HZKP-DS-2)
作者简介:林海桢(1988—),男(汉),在读硕士,研究方向:天然产物的研究开发与临床药学研究。
*通信作者:林敬明(1963—),男(汉),教授,博士。
收稿日期:2015-12-17
