新疆伊犁某肉牛场大肠埃希菌及其毒力基因的检测
2016-05-10刘英玉吾买尔江牙合甫张晓红米克热木沙衣布扎提
刘英玉,杨 舟,吾买尔江·牙合甫,张晓红,米克热木·沙衣布扎提,姚 刚
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
新疆伊犁某肉牛场大肠埃希菌及其毒力基因的检测
刘英玉,杨舟,吾买尔江·牙合甫,张晓红,米克热木·沙衣布扎提,姚刚*
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
摘要:为了解新疆伊犁某肉牛场潜在的致病性大肠埃希菌,对新疆伊犁地区某养殖场2013年秋季和2014年夏冬两季的饲草料和粪样及定点屠宰场2013年和2014年秋季屠宰加工环节的样品进行大肠埃希菌的分离鉴定,采用PCR方法检测大肠埃希菌毒力基因(stx1和stx2、eae)存在的数量。结果表明,该养殖场饲草料样品在夏季、秋季、冬季的大肠埃希菌分离率分别为44.8%、31.4%和6.0%,其毒力基因的检出率为3.6%;该养殖场粪样样品在夏季、秋季、冬季的大肠埃希菌分离率分别为70.7%、75.0%和74.4%,其毒力基因的检出率为23.5%;定点屠宰场在加工环节样品中2013年和2014年秋季的大肠埃希菌分离率为32.4%和32.5%,只有1株菌株携带有毒力基因stx1和stx2,检出率为4.2%。新疆伊犁地区不同季节对饲草料中大肠埃希菌的污染分布具有影响,粪样中具有比较稳定的大肠埃希菌数量,其毒力基因的检出率最高。
关键词:大肠埃希菌;毒力基因;饲草料;粪样;屠宰加工环节
食品安全问题是当今世界性的公共卫生问题,而食源性致病菌是引起食源性疾病的主要原因,其中致病性大肠埃希菌是严重威胁人类健康的致病菌之一。无论在发展中国家还是在发达国家由大肠埃希菌所致的腹泻仍然严重威胁着人类健康,并引起患畜生长发育迟缓,生产性能低下,甚至造成死亡,给养殖业带来了严重损失。其中肠出血性大肠埃希菌(Entero-hemorrhagicEscherichiacoli,EHEC)是一种新型的致病性大肠埃希菌,肠出血性大肠埃希菌感染性腹泻对肠道的危害比较严重[1],血清型主要包括O157:NM、O26:H8、O125:NM和O45:p等,其中以O157:H7血清型为主,占90%以上,是出血性肠炎的主要病原体[2],国内外多次暴发EHEC感染事件,均由该血清型引起。多年来对EHEC研究发现,其致病性主要表现在其产生的志贺毒素(Shiga toxin,stx)和黏附力两个方面,主要包括编码志贺毒素的stx1和stx2基因、紧密黏附素的eae基因(主要位于细菌毒力岛内)、肠溶血素(hemolysin,Hly)和肠凝集性热稳定毒素的毒力基因[3],都可对生物体产生一定程度的危害。
动物产业链是集肉牛养殖过程与屠宰加工过程为一体的动物性食品生产模式,也是为了从源头控制肉品质量安全提出的检测体系。新疆伊犁地区是新疆肉牛养殖主产区之一,该地区大多采用暖季放牧、冷季舍饲的集约化或半集约化养殖方式。有报道新疆肉牛规模化屠宰过程中存在有大肠埃希菌的污染[4-5],影响了牛肉的质量安全。本研究对某养殖场2013年秋季和2014年夏冬两季的饲草料和粪样及定点屠宰场2013年和2014年秋季屠宰加工环节的样品进行大肠埃希菌的分离鉴定,进一步采用聚合酶链反应(polymerase chain reaction,PCR)方法检测大肠埃希菌毒力基因(eae、stx1、stx2)的分布情况,分析肉牛养殖过程中饲草料和粪样在不同季节条件下和该养殖场在定点屠宰场中屠宰加工环节的大肠埃希菌污染状况,调查大肠埃希菌携带毒力基因的数量。
1材料与方法
1.1材料
1.1.1样品的采集饲草料和粪样在伊犁地区某规模化养殖场于2013年秋季和2014年夏冬两季采集。饲草料的种类包括精饲料、青贮、青干草和秸秆类,共计194份,饲草料的采集方法和保存方式:按照随机采样原理,采用无菌手套采集饲料库中的备料和饲槽前待喂的饲料约200 g~300g放入自封袋,随即置入已用冰袋预冷的塑料泡沫盒中防止细菌增生。样品带回实验室用粉碎机粉碎后移入4℃冰箱中备用待检。共采集新鲜粪样335份,粪样的采集方法和保存方式:用棉拭子沾取新鲜粪便后放入灭菌的300 mL/L甘油的离心管中。通过保存在4℃车载冰箱中运回实验室。屠宰加工环节是对该规模化养殖场的定点屠宰场2013年和2014年秋季展开的采集,屠宰加工环节中样品的的采集方法:胴体表面和加工用具用棉棒擦拭表面后放入225 mL生理盐水中,牛肉组织用绞肉机绞碎后称取25 g放入225 mL生理盐水中混匀,共采集74份。
1.1.2引物设计合成参考Jianfa Bai的引物设计方法[6]设计引物,由上海生工生物工程技术服务有限公司合成(表1),用1×TE(10 mmol/L Tri-HCl, 1 mmol/L EDTA, pH 8.0)稀释引物为使用浓度10 μmol/L。
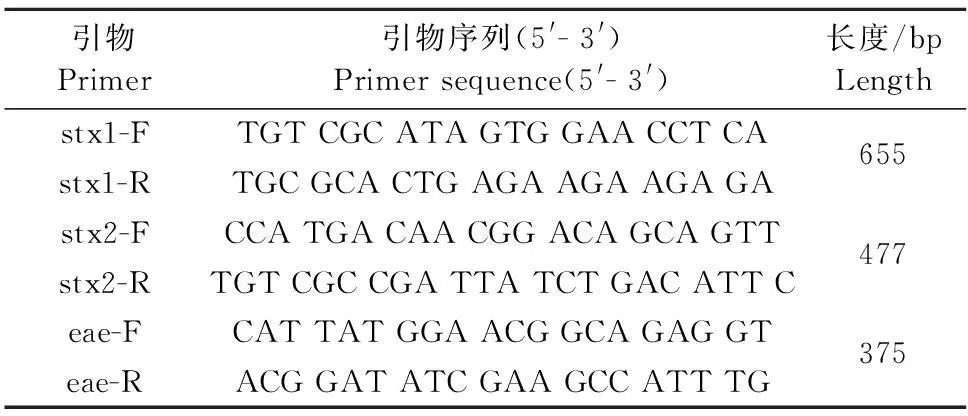
表1 多重PCR引物序列和扩增长度
1.1.3PCR所用试剂TaqMasterMix、DNA Marker DL 2 000、琼脂糖等,购自新疆伟博鑫生物有限公司。
1.2方法
1.2.1菌株的分离和鉴定
1.2.1.1粪样中大肠埃希菌的分离鉴定取粪样液接种到营养肉汤中,37℃培养18 h~24 h,划线接种到伊红美蓝平皿中,观察琼脂上出现紫红色金属光泽菌落后挑取单菌落到麦康凯琼脂中纯化,并对单菌落革兰染色镜检,将鉴定完成的菌株挑取单菌在营养琼脂中培养18 h~24 h后,用300 mL/L甘油进行保菌备用。
1.2.1.2饲草样中大肠埃希菌的分离鉴定按照饲料卫生标准GB/T18869—2002检验方法中规定的大肠菌群检测方法进行分离,同时挑取具有典型大肠埃希菌特征的单菌落用革兰染色法镜检,用300 mL/L甘油进行保菌备用。
1.2.1.3屠宰加工环节中大肠埃希菌的分离鉴定按照食品卫生微生物检验标准GB/T4789.3—2008检验方法中规定的大肠菌群检测方法进行分离,同时挑取具有典型大肠埃希菌特征的单菌落革兰染色镜检,用300 mL/L甘油进行保菌备用。大肠埃希菌CICC21530标准株:由新疆农业大学动物医学学院实验室保存。
1.2.2细菌模板制备分别将分离纯化的大肠埃希菌菌落重悬于100 μL双蒸水,100℃水浴煮沸10 min,再置于冰上5 min,最后10 000 r/min离心10 min,收集上清为细菌模板。
1.2.3毒力基因的PCR检测PCR反应体系为:TaqMasterMix 10 μL,上游引物和下游引物各0.4 μL,细菌DNA模板2 μL,补去离子H2O至25 μL。PCR反应条件:94℃预变性5 min;94℃ 30 s,50℃~60℃ 30 s,72℃ 1 min,共34个循环;72℃ 10 min,4℃终止反应。取10 μL PCR产物于制备好的10g/L琼脂糖凝胶中进行电泳,在EB染色液中进行染色,在凝胶成像系统下记录结果。
2结果
2.1某规模化养殖场饲草料和粪样中大肠埃希菌及毒力基因的检测
伊犁地区某规模化养殖场饲草料样品中大肠埃希菌的检测结果如表2。2013年秋季采集的86份饲草料中分离鉴定出大肠埃希菌27份,分离率为31.4%;2014年夏季采集的58份饲草料中分离鉴定出大肠埃希菌26份,分离率为44.8%;2014年冬季采集的50份饲草料中分离鉴定出大肠埃希菌3份,分离率为6.0%。其志贺毒素毒力基因检测有1株大肠埃希菌携带有stx1和stx2,紧密黏附素毒力基因检测有1株大肠埃希菌携带有eae,饲草料中毒力基因(stx1和stx2、eae)检出率为3.6%(2/56)(表2)。
伊犁地区某规模化养殖场粪样中大肠埃希菌的检测结果如表2。2013年秋季采集的60份粪样中有45份存在大肠埃希菌,分离率为75.0%;2014年夏季采集的150份粪样中有106份存在大肠埃希菌,分离率为70.7%;2014年冬季采集的125份粪样中有93份存在大肠埃希菌,分离率为74.4%。其志贺毒素毒力基因检测有37株大肠埃希菌携带该基因,其中有17株大肠埃希菌携带有毒力基因stx1,检测率为45.9%(17/37),有16株大肠埃希菌携带有毒力基因stx2,检测率为43.2%(17/37),有4株大肠埃希菌携带有毒力基因stx1和stx2,检测率为10.8%(4/37);紧密黏附素毒力基因检测有19株大肠埃希菌携带有eae,总体来看,粪样中检测出携带大肠埃希菌毒力基因(stx1和stx2、eae)的菌株数量较多,检测率为23.5%(56/244)。
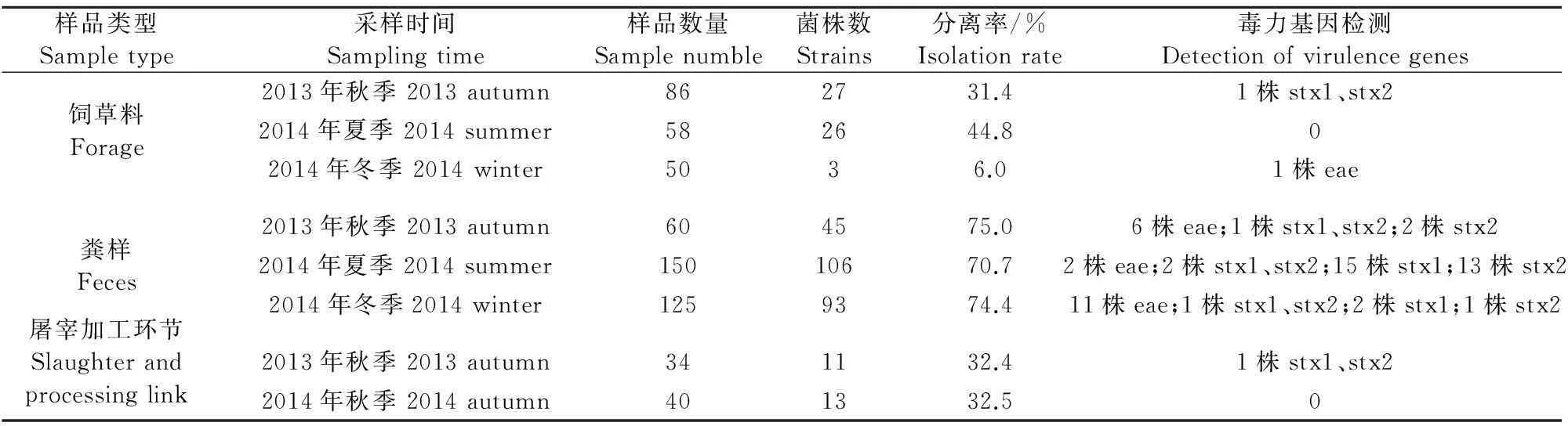
表2 肉牛产业链中牛源大肠埃希菌及毒力基因检测结果
2.2定点屠宰场加工环节中大肠埃希菌及毒力基因的检测
伊犁地区某规模化养殖场在定点屠宰场的加工环节中大肠埃希菌的检测结果如表2。2013年秋季在屠宰场采集的34份样品分离鉴定出大肠埃希菌11份,分离率为32.4%,2014年秋季在屠宰场采集的40份样品分离鉴定出大肠埃希菌13份,分离率为32.5%。大肠埃希菌毒力基因(stx1和stx2、eae)的检测只有1株菌大肠埃希菌携带有毒力基因stx1和stx2,检出率为4.2%(1/24)。
3讨论
饲料中富含有碳水化合物、维生素、蛋白质等营养物质,是大肠埃希菌生长的天然培养基,大肠埃希菌的存在影响了动物饲料的卫生质量。通过检测伊犁地区某规模化养殖场不同季节饲料受大肠埃希菌的污染程度发现,冬季气温较低饲料中大肠埃希菌的数量很少,而夏秋两季的饲料中水分充足,合适的气温使存在饲草料中的大肠埃希菌容易繁殖,这与陈欣[7]报道土壤中大肠菌群数在夏季上升,而冬季下降一致。粪样中存在的大肠埃希菌是饲草料的重要污染源,家畜养殖场所与饲料贮存点较近或将饲料直接存放在自然环境中易导致大肠埃希菌的污染[8],该规模化养殖场粪样中大肠埃希菌的分离率在70%~75 %之间,说明该养殖场的肉牛体内存在比较稳定的大肠埃希菌,需要加强饲草料的管理和监测。肉牛屠宰加工环节中样品包括牛肉、屠宰后胴体表面及加工过程中的工具等,定点屠宰场的大肠埃希菌分离率达到了30%,需要严格控制屠宰加工环节中大肠埃希菌的污染源,来保证牛肉的卫生质量安全。
快速和准确的检测大肠埃希菌的致病性具有重要的公共卫生学意义,其中检测毒力基因是判定致病性大肠埃希菌的一个重要手段。紧密黏附素(eae)的主要致病能力是细菌与肠上皮细胞的刷状缘紧密黏附,导致肠微绒毛损伤消失,肠上皮细胞骨架发生改变,丝状肌动蛋白聚集等。目前研究证据表明,肠致病性大肠埃希菌(EPEC)和肠出血性大肠埃希菌(EHEC)都能引起特征性的黏附与脱落病变[9]。对伊犁地区肉牛产业链中大肠埃希菌进行毒力基因eae的检测,发现饲草料和粪样中存在大肠埃希菌携带毒力基因eae。近年来stx被国际社会列入生物武器核查清单中11种生物毒素之一,成为潜在的生物毒素战剂和生物恐怖病原[10]。志贺毒素是大肠埃希菌中具有溶解致死作用的细胞毒素,stx家族包括stx1、stx2、stx2c、stx2d、stx2e和stx2f等,研究得最多的主要是stx1和stx2两种[11]。有研究表明EHEC能产生stx1和stx2毒素或只产生stx2毒素,因此stx2毒素认为是主要的毒力因子[12]。Dastmalchi S H和Ayremlou N报道[13]伊朗某地区从健康和腹泻的小牛粪样中分离鉴定的产志贺毒素大肠埃希菌(STEC)通过PCR检测出有6株(23.1%)携带stx1基因,有7株(26.9%)携带stx2基因,有13株(50%)携带stx1和stx2基因。伊犁地区不同季节中肉牛粪样中分离鉴定的大肠埃希菌志贺毒素基因检测中17株(45.9%)携带stx1基因,有16株(43.2%)携带stx2基因,有4株(10.8%)携带stx1和stx2基因。说明不同国家不同地区分离鉴定的大肠埃希菌中携带的志贺毒素基因具有明显得差异性。伊犁地区定点屠宰加工场中检测出有1株携带有志贺毒素的大肠埃希菌,与Rogerie F等报道[14]的法国加工厂夏季在胴体加工后非O157 STEC的数量较低(1.9%)一致。同样的,香港被报道[15]胴体加工后非O157 STEC的数量为1.7%。肉牛定点屠宰加工环节对牛肉质量安全具有重要的影响,需要加强大肠埃希菌毒力基因的检测来预防致病性大肠埃希菌的危害。
牛是大肠埃希菌的储存宿主,致病性大肠埃希菌对人类和动物的安全具有潜在的威胁。通过调查新疆伊犁地区某规模化养殖场和定点屠宰场中大肠埃希菌的污染状况,结果表明不同季节对饲草料中大肠埃希菌的污染分布具有影响,粪样中具有比较稳定的大肠埃希菌数量,屠宰加工环节也存在一定程度的大肠埃希菌污染。对分离鉴定的大肠埃希菌进行毒力基因的检测,发现粪样中存在的毒力基因数量最多,饲料和屠宰加工环节中毒力基因数量很低。此结果说明该地区肉牛携带稳定的大肠埃希菌,其毒力基因分布具有一定的地域特点。
参考文献:
[1]刘华.肠出血性大肠杆菌O157:H7病原学及流行病学特征[J].职业与健康,2011,27(14):1661-1663.
[2]冉陆.肠出血性大肠杆菌(EHEC)流行趋势[J].中国食品卫生杂志,1999,11(3):31-34.
[3]郭锐.华中地区猪源与牛源肠出血性大肠杆菌分离鉴定及生物学特性研究[D].湖北武汉:华中农业大学,2014.
[4]王志琴,孙磊,姚刚,等.新疆某屠宰场牛屠宰及分割中微生物污染情况的调查研究[J].动物医学进展,2010,31(7):64-69.
[5]堵淑桐,彭斌,王金泉,等.新疆某现代化肉牛屠宰加工过程中肠杆菌科细菌的检测研究[J].新疆农业科学,2015,52(2):344-348.
[6]Jianfa B,Xiaorong S,Nagaraja T G.A multiplex PCR procedure for the detection of six major virulence genes inEscherichiacoliO157:H7[J].J Microbiol Meth,2010.82(1):85-89.
[7]陈欣.畜禽粪便中粪大肠菌群对蔬菜污染的研究[D].江苏南京:南京师范大学,2007.
[8]刘德阳,王志琴,张晓红,等.肉牛养殖场饲料中的大肠菌群及沙门氏菌的检测与分析[J].畜牧与饲料科学,2013(6):35-37.
[9]Jerse A E,Gicquelais K G,Kaper J B.Plasmid and chromosomal elements involved in the pathogenesis of attaching and effacingEscherrichiacoli[J].Infect Immun,1991,59(11):3869-3875.
[10]喻华英,王景林,高丰.志贺毒素及其分子生物学研究进展[J].生物技术通讯,2004,15(1):86-88.
[11]Bertin Y,Boukhors K,Pradel N,et al.Stx2 subtyping of Shiga toxin producingEscherichiacoliisolated from cattle in France:detection of a new stx2 subtype and correlation with additional virulence factor[J].Clin Microbiol,2001,39:3060-3065.
[12]帅领.重庆市家畜大肠杆菌O157致病性及外膜蛋白的初步研究[D].重庆:西南大学,2008.
[13]Dastmalchi S H,Ayremlou N.Characterization of Shiga toxin-producingEscherichiacoli(STEC) in feces of healthy and diarrheic calves in Urmia region,Iran[J].Iran J Microbiol,2012,4(2):63-69.
[14]Rogerie F,Marecat A,Gambade S,et al.Characterization of Shiga toxin producing O157 serotypeE.coliisolated in France from healthy domestic cattle[J].Int J Food Microbiol,2001,63:217-223.
[15]Leung P H M,Yam W C,Ng W W,et al.The prevalence and characterization of verotoxin-producingEscherichiacoliisolated from cattle and pigs in an abattoir in Hong Kong[J].Epidemiol Infect,2001,126:173-179.
Detection ofEscherichiacoliand Its Virulence Genes in A Beef Cattle Farm in Yili Area of Xinjiang
LIU Ying-yu,YANG Zhou,WUMAIERJIANG·Ya-he-fu,ZHANG Xiao-hong,MIKEREMU· Sha-yi-bu-zha-ti,YAO Gang
(CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China)
Abstract:To explore the potential pathogenic E.coli in the beef industry chain in Yili area of Xinjiang,this study isolated and identified of the E.coli from the samples in Yili area of Xinjiang.The samples included the forage and feces in the farms in autumn of 2013 and in summer and winter of 2014,as well as the slaughter processing link samples in the designated slaughter house in autumn of 2013 and 2014.The PCR method was used to detect the number of E.coli virulence genes (stx1 and stx2,eae).The isolation rates of E.coli from forage in the farms were 44.8%,31.4%,6.0% during the summer,autumn and winter,respectively.The detection rate of E.coli virulence genes from forage was 3.6%.The isolation rates of E.coli from feces in the farms were 70.7%,75.0%, 4.4% during the summer,autumn and winter,respectively.The detection rate of E.coli virulence genes from feces was 23.5%.The isolation rates of E.coli from slaughter processing link samples in the designated slaughter house were 32.4% and 32.5% during the autumn of 2013 and 2014.Only one bacterial strain encodes the virulence genes stx1 and stx2,the detection rate was 4.2%.The pollution distribution of E.coli from forage had affects in different seasons in Yili area of Xinjiang.The feces had the relatively stable numbers of E.coli.The detection rate of E.coli virulence genes was the highest in the feces.
Key words:Escherichia coli; virulence genes; forage; feces; slaughter and processing link
文章编号:1007-5038(2016)04-0045-04
中图分类号:S851.43;S852.612
文献标识码:A
作者简介:刘英玉(1984-),女,重庆涪陵人,博士,主要从事畜产品质量安全研究。*通讯作者
基金项目:国家科技支撑计划项目(2011BAD47B04);基础兽医学新疆普通高等学校重点学科科研启动项目;新疆维吾尔自治区自然科学基金项目(2014211B020);新疆农业大学畜牧学科研流动站博士后经费项目
收稿日期:2015-10-07
