磷脂酶D高产菌株的原生质体紫外诱变选育
2016-04-26杨兰兰张小里封娟娟朱南南赵彬侠
杨兰兰,张小里,封娟娟,朱南南,赵彬侠
(西北大学化工学院,陕西西安710069)
磷脂酶D高产菌株的原生质体紫外诱变选育
杨兰兰,张小里,封娟娟,朱南南,赵彬侠
(西北大学化工学院,陕西西安710069)
摘要:为了获得磷脂酶D高产菌株,由链霉菌野生菌株LD0501出发研究原生质体的制备和再生条件,建立原生质体紫外诱变筛选方案。采用酶解法制备原生质体,用紫外线对原生质体诱变,TLC检测突变株产磷脂酶D活力。原生质体的适宜条件:种子培养基中甘氨酸质量浓度5 g/L,菌龄72 h,用3 mg/mL的溶菌酶在30 ℃下酶解75 min。通过原生质体诱变筛选,得到1株高产菌株,磷脂酶D水解活力达4.29 U/mL,提高幅度为180.4%。该方法有效改善了链霉菌野生菌株原生质体的制备效果,紫外诱变筛选显著提高了磷脂酶D的活力,高产突变株具有较好的稳定性。
关键词:磷脂酶D;原生质体;紫外诱变;筛选
磷脂酶D(phospholipase D,PLD)普遍存在于生物界中,是重要的细胞磷脂代谢酶,通过磷酸二酯键,催化水解卵磷脂(PC)产生磷脂酸(PA)和游离胆碱。PLD亦能在醇类物质存在下催化磷脂酰基转移反应制备(合成)磷脂或稀有磷脂[1-2]。磷脂在食品工业中起到乳化、湿润和分散作用,在医药中是抗肿瘤药物制剂的重要辅料。链霉菌属微生物是常用磷脂酶D的生产菌株,但野生菌株酶活较低(<1.5 U/mL),因此,通过筛选及改良获得高产菌株是提高磷脂酶D活力的重要途径。
目前,国外利用微生物发酵生产PLD的研究报道较多,研究者通过野生菌株筛选、基因重组等方法筛选高产菌株,已经取得了一定的效果[3]。与之相比,国内研究磷脂酶D菌株选育的报道较少,文献报道的磷脂酶D高产菌株酶活为3~3.5 U/mL[4]。笔者所在团队前期采用诱变剂处理孢子来选育磷脂酶D高产菌株,取得了一定效果[5],但变异株稳定性较差,酶活力亦有待进一步提高。由于去除细胞壁的原生质体对诱变剂更加敏感,较易发生突变,目前利用原生质体诱变技术选育竹红菌甲素[6]、β-葡萄糖苷酶、木聚糖酶和柠檬酸[7]等高产菌株已有不少成功报道,但还没有通过原生质体诱变选育PLD优良菌株的报道。本文中,笔者研究产磷脂酶D链霉菌株的原生质体制备和再生,进而对其进行紫外诱变,改良菌株的产酶能力,以期筛选得到磷脂酶D的高产菌株,从而为磷脂酶D的工业化发酵生产奠定基础。
1材料与方法
1.1出发菌株
磷脂酶 D 产生菌Streptomycessp. LD0501,保藏于笔者所在实验室。
1.2培养基、溶液和试剂
PDA培养基、发酵培养基、种子培养基配制参照文献[5];微量元素溶液、TES缓冲液、P溶液、再生培养基配制参照文献[8]。溶菌酶,生工生物工程(上海)股份有限公司。
1.3原生质体的制备与再生
1.3.1单孢子悬浮液的制备
从斜面刮取成熟的孢子到9 mL 无菌生理盐水的试管中,用玻璃珠将其打碎,三层滤纸过滤,无菌生理盐水调整孢子密度106~107个/mL。
1.3.2原生质体的制备
用移液管移取 0.5 mL 的孢子悬浮液接种到含有一定量甘氨酸的20 mL菌丝体培养液体中,28 ℃、200 r/min摇瓶培养48 h,4 000 r/min离心10 min,收集菌丝体,超声30 min,菌丝体振荡打碎,使其便于溶解。然后再用0.3 mol/L 的蔗糖溶液洗1次,P 溶液复洗2次。加入适量的溶菌酶,放入 30 ℃的水浴锅中,每隔 7~8 min拿出来轻轻摇晃一下,60 min后,3 500 r/min离心10 min去除上层清液,最后500 r/min离心5 min保留上层清液,即得到原生质体悬浮液。用 P 缓冲液调整原生质体悬浮液到合适的浓度,接种到再生培养基;用无菌蒸馏水调整原生质体悬浮液到合适浓度,接种到 PDA 培养基平板上,28 ℃培养7 d,计数菌落。
1.4原生质体的计数方法
原生质体的计数按上述方法进行,再按式(1)~(2)计算原生质体的形成率与再生率。
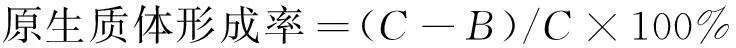
(1)
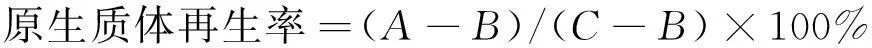
(2)
式中:A为原生质用 P 溶液稀释后涂布于再生平板上存活的菌落数;B为原生质体用无菌水稀释后涂布于 PDA 平板上存活的菌落数;C为酶解前菌丝体涂布于PDA上长出的菌落数。
1.5单孢子及原生质体紫外诱变选育
将制备好的单孢子和原生质体悬浮液各用无菌移液管吸约4 mL,分别滴到含有大头针、直径为6 cm的培养皿中,置于15 W紫外灯下距离30 cm处均匀照射一定时间(0、15、30、45、60、90、120和150 s),然后把照射过的菌悬液稀释于无菌生理盐水中,取合适浓度的0.1 mL 单孢子和原生质体诱变菌分别滴到PDA培养基和再生培养基上并涂匀,每个浓度涂3套平板。将平板用黑塑料袋包严置于28 ℃恒温培养箱中培养3 d,然后再正常培养 3~7 d后计菌落数,统计其致死率。
1.6摇瓶初筛
挑选再生平板上生长饱满且水解圈较大的诱变菌落60株,每个菌落接种于100 mL发酵培养基,28 ℃、200 r/min条件下发酵7 d,离心收集发酵液,对发酵液进行酶活力测定,每样做3个平行,取均值。
1.7分析方法
磷脂酶D水解活力测定采用TLC方法,参照文献[5], 菌丝干质量是用10 mL 发酵液,离心收集沉淀,110 ℃烘至恒质量,称量计算,每样做3个平行,取均值。
2结果与讨论
2.1原生质体的制备与再生
2.1.1甘氨酸浓度对原生质体形成量的影响
甘氨酸分子结构与D-丙氨酸的结构相似,因此在菌丝体培养液中加入甘氨酸可代替D-丙氨酸掺入到细胞壁,干扰细胞壁肽聚糖之间的交联,引起新合成的细胞壁的不完整,有利于提高溶菌酶对链霉菌菌丝体细胞壁的敏感度。然而,甘氨酸浓度过高不仅会影响溶解菌丝体所需的数量,还会影响细胞壁的形成,使得原生质体的再生细胞壁的条件受到一定程度的阻碍。为此,笔者在菌丝体培养基中分别加入不同质量浓度的甘氨酸,测定原生质体的密度和菌丝体生长情况,结果如表1所示。
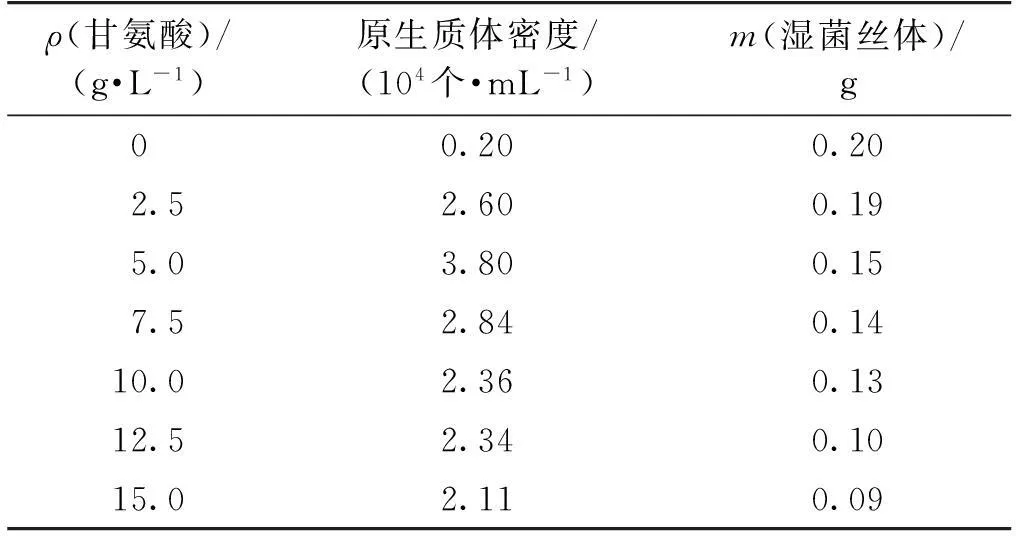
表1 甘氨酸添加量对原生质体形成的影响
注:菌丝体的湿质量以20 mL发酵液中的菌体质量计。
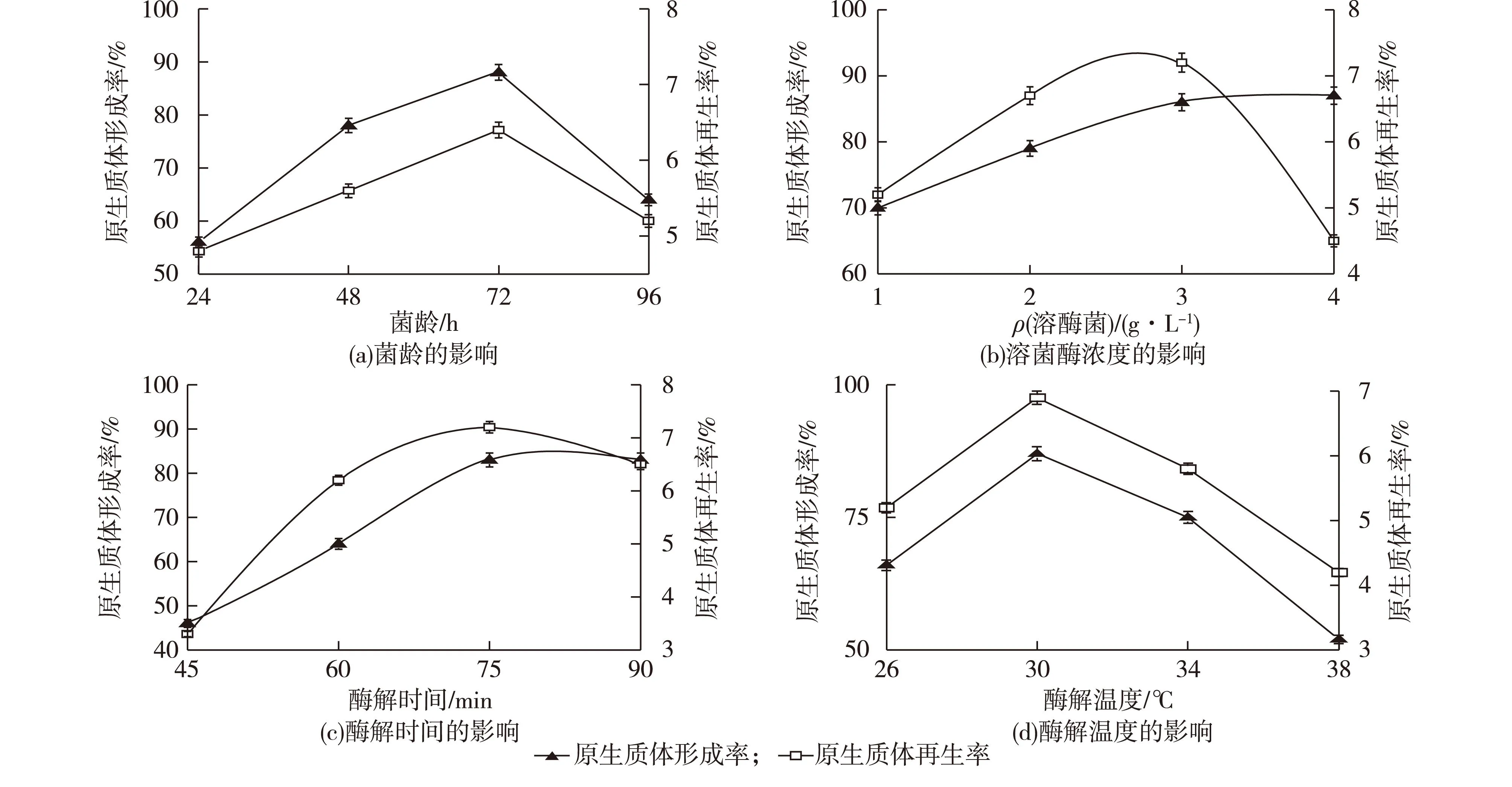
图1 菌龄、溶菌酶浓度、酶解时间、酶解温度对原生质体形成率和再生率的影响Fig.1 Effects of mycelium age,lysozyme concentration,enzymolysis time,enzymolysis temperature on protoplast formation and regeneration
由表1可知:在甘氨酸质量浓度低于5 g/L时,原生质体的形成量随着甘氨酸质量浓度的增加不断增加,但高于5 g/L时,原生质体的形成量开始呈现下降趋势。甘氨酸浓度的持续增加,表现出对菌丝体生长情况的抑制程度不断加强。甘氨酸质量浓度在5 g/L时,原生质体的形成最佳。
2.1.2菌龄、溶菌酶解浓度、酶解温度、酶解时间原生质体形成率和再生率的影响
链霉菌原生质体是通过溶菌酶水解菌丝体细胞壁形成的,不同的链霉菌种属性也不尽相同,还有溶菌酶自身的性质也有差异,所以合适的菌龄和溶菌酶浓度对原生质体的形成有至关重要的作用。不同种龄的菌丝生理活性不同,对溶菌酶的敏感度也有差异,一般处于对数生长期的菌体利于原生质体的制备和再生。研究了菌龄、溶菌酶浓度、酶解温度、酶解时间原生质体形成率和再生率的影响,结果如图1所示。由图1(a)可以看出:菌龄为72 h时,原生质体的形成率和再生率达到最高。溶菌酶浓度太低,水解缓慢,会影响原生质体的形成和再生,但溶菌酶浓度过高,酶解时间过长,就会导致脱壁现象太彻底,破坏了原生质体再细胞壁所需的引物,虽然原生质体的形成率会不断增加,但严重影响了原生质体的再生率。由图1(b)和图1(c)可以看出:溶菌酶浓度越大,酶解时间越长,原生质体形成率越大。兼顾原生质体形成率和再生率,溶菌酶最佳质量浓度为3 mg/mL,最适酶解时间为75 min。温度对酶的活性有很大影响,在一定范围内,温度升高,溶菌酶活性越好,原生质体形成量也会增加,但温度达到一定程度,会使溶菌酶的活性钝化,原生质体的形成量也会减少。由图1(d)可以看出酶解温度为30 ℃时,原生质体的形成率和再生率效果最好,即30 ℃为最佳酶解温度。
2.2单孢子和原生质体的紫外剂量的确定
原生质体没有细胞壁的保护,应该能更敏感接受紫外线的照射,但是实验结果表明,同一紫外诱变下,原生质体较单孢子有更强的紫外线耐受能力。 可能是由于原生质体悬于含有黏性很大的P缓冲液中,原生质体聚集成团,所以致死需要更长的诱变时间。研究了单孢子和原生质体的紫外剂量,结果如图2所示。
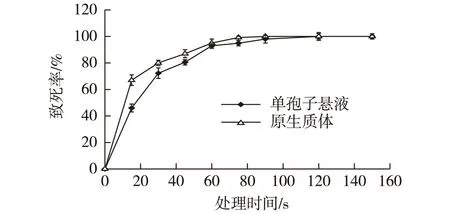
图2 紫外线处理的诱变致死率Fig.2 Death rate of UV mutation
由图2可知:单孢子悬液和原生质体经紫外照射后,随照射时间的增加,致死率上升;0~30 s范围内,曲线急剧上升,致死率变化显著,30 s以后,曲线上升趋于平缓。但原生质体较单孢子紫外线耐受能力更强,单孢子随诱变剂量的增加,致死率上升更迅速,单孢子在90 s时,致死率为100%,而原生质体在120 s为100%。大量实验研究表明[9-10],致死率为80%左右的正突变率相对较高,因此,采用45 s为最合适的诱变剂量。
2.3初筛和摇瓶复筛
经过初筛得到6株高产突变株,接种于发酵培养基进行摇瓶复筛,设置3个摇瓶平行实验,在28 ℃、200 r/min条件下发酵7 d,测定其产酶能力,结果见图3。
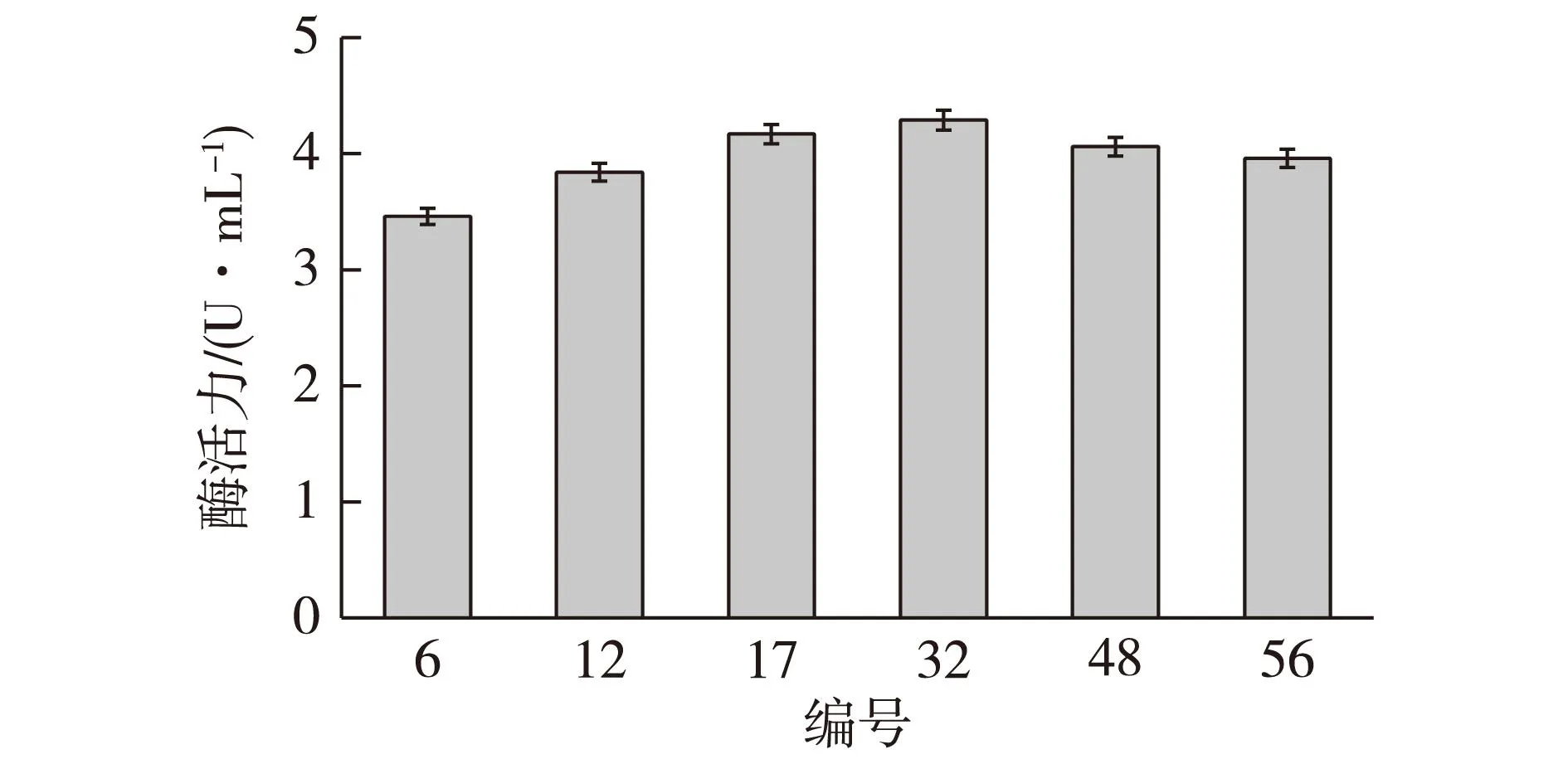
图3 突变株紫外诱变结果Fig.3 Enzyme activity of mutant strains during fermentation
由图3可知,经过初筛选出的6株高产菌株有较高的酶活,其中编号32号仍是酶活最高的突变菌株,酶活力为4.29 U/mL。
2.4突变株的遗传稳定性测定结果
将编号32突变株连续摇瓶传代5代,每代培养时间为7 d,测定每代的发酵液,结果见表2。由表2可知,该菌株传代5代后,其相对酶活力为原菌株的97.2%,说明该菌株有稳定的遗传特征。
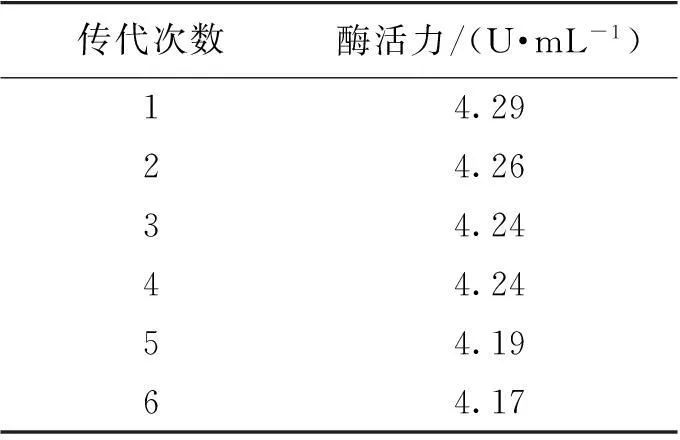
表2 编号32菌株的遗传稳定性
2.5链霉菌PLD0501形态学特征
观察原生质体诱变后再生平板上的成熟菌落,同时观察摇瓶发酵对数生长期时菌丝体的生长状况,如表3所示。
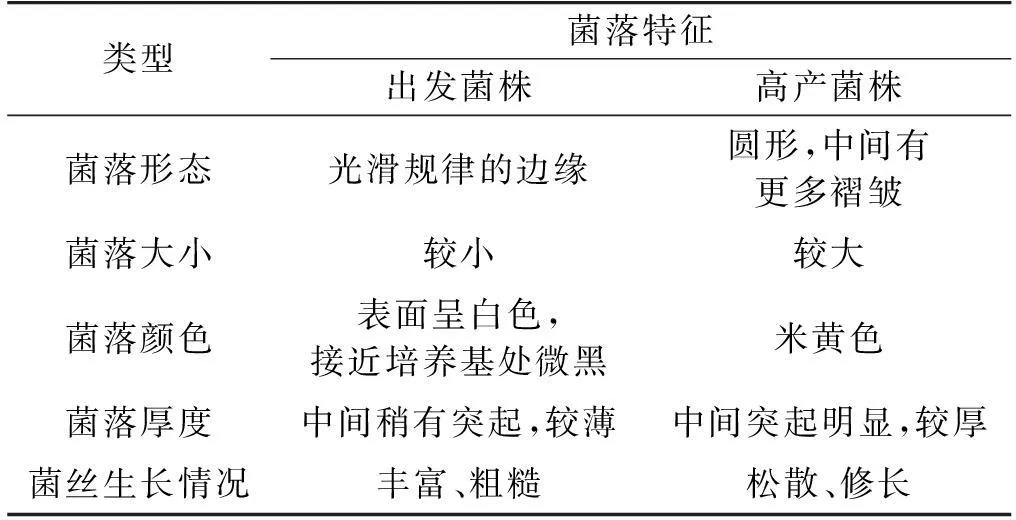
表3 出发菌株和高产菌株菌落的形态
2.6高产菌株磷脂酶D的发酵特性
突变菌株和出发菌株随时间变化的发酵性能如图4所示。由图4可知:链霉菌在发酵的进程中,基本在对数生长期才开始有磷脂酶D出现,在稳定期(第6天)时,磷脂酶D的水解活力达到最高,突变菌株的磷脂酶D水解活力(4.29 U/mL)大约是出发菌株水解活力(1.53 U/mL)的3倍,除此之外,突变菌株磷脂酶D水解活力的增长速率(0.086 U/(mL·h))(在对数期初期,第3天)是出发菌株的(0.035 U/(mL·h))2.5倍。但在稳定期之后磷脂酶D水解活力有下降的趋势,可能是由于发酵液的酸碱度对酶蛋白质活性的影响。

图4 突变菌株及出发菌株磷脂酶D水解活力、 干菌体质量随时间变化关系Fig.4 Time courses of enzyme activity of phospholipase D and dry cell weight of mutant strain and the initial strain
在磷脂酶D发酵过程中,突变菌株较出发菌株的代谢速度快,由图4可知,在前2 天,突变菌株菌丝干质量的增加比出发菌株稍快,但在对数生长初期(第3天),突变菌株的菌丝干质量的增加速率(0.018 g/h)是出发菌株0.008 g/h)2.25倍,3~6 d是链霉菌的对数生长期,链霉菌菌丝干质量在前6 d迅速积累,达到最大,突变菌株(0.835 g)是出发菌株(0.574 g)的1.45倍。生长至6 d以后是稳定期和衰亡期,并且菌丝体生长基本处于停滞状态。
3结论
原生质体的制备的影响因素很多,本文选取了链霉菌原生质体的制备和再生过程中几个主要的影响因素:甘氨酸浓度、菌龄、酶解温度、酶解时间、溶菌酶浓度进行研究,发现甘氨酸浓度 5 g/L,菌龄为72 h,酶解温度30 ℃,酶解75 min,溶菌酶质量浓度3 mg/mL时,原生质体的形成率和再生率都比较合适,因此,以此条件为基础进行后续原生质体的紫外诱变。
原生质体没有细胞壁的保护较单孢子悬液,对紫外线更敏感,能较好的改变菌株的遗传性能。本文中,笔者利用原生质体紫外诱变选育技术,得到一株磷脂酶D的水解活力为4.29 U/mL高产菌株,(较出发菌株(1.53 U/mL)提高大约3倍)。
原生质体诱变技术大大提升了磷脂酶D的水解活力,但诱变后菌株遗传性状的改变是随机性的,同时液体发酵筛选高产菌工作量很大,周期很长。为了进一步提高该菌的生产经济效益,今后的研究中可以通过基因重组改良菌株的代谢途径,加快生长速度,也可以构建高通量筛选方法缩短优良菌株产磷脂酶D的发酵周期。
参考文献:
[1]LIU Y,ZHANG T,QIAO J,et al.High-yield phosphatidylserine production via yeast surface display of phospholipase D fromStreptomyceschromofuscusonPichiapastoris[J].J Agric Food Chem,2014,62(23):5354-5360.
[2]HATANAKA T,NEGISHI T,KUBOTA-AKIZAWA M,et al.Purification,characterization,cloning and sequencing of phospholipase D fromStreptomycesseptatusTH-2[J].Enzyme Microb Technol,2002,31(3):233-241.
[3]Simkhada J R,Cho S S,Lee H J,et al.Purification and biochemical properties of phospholipase d(PLD57)produced byStreptomycessp.CS-57[J].Arch Pharma Res,2007,30(10):1302-1308.
[4]梁丽敏,刘春凤,杜阳吉.产磷脂酶D链霉菌发酵条件优化[J].粮食与油脂,2015,28(2):55-58.
[5]刘嫒媛,张小里,姚娜,等.磷脂酶D的紫外诱变选育及发酵条件的优化[J].化工进展,2012,31(9):2036-2038.
[6]潘魏松,嵇源源,杨珠英,等.原生质体紫外诱变选育竹红菌甲素高产菌株[J].生物加工过程,2012,10(6):18-23.
[7]徐凯,张伟国.原生质体融合选育耐高温柠檬酸生产菌[J].生物加工过程,2015,13(5):26-30.
[8]诸葛健,王正详.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:460.
[9]段向东,贾啸静,陈丽华,等.原生质体紫外诱变选育达托霉素高产菌株[J].化学与生物工程,2014,31(5):51-62.
[10]胡艳丽,钟添华,产竹华,等.原生质体紫外诱变选育可利用廉价碳源的高产油新菌株[J].微生物学通报,2014,41(5):881-890.
(责任编辑荀志金)
Breeding of high phospholipase D-producing strain through mutation ofprotoplasts induced by UV radiation
YANG Lanlan,ZHANG Xiaoli,FENG Juanjuan,ZHU Nannan,ZHAO Binxia
(School of Chemical Engineering,Northwest University,Xi′an 710069,China)
Abstract:In order to screen a high-yielding phospholipase D strain from Streptomyces sp. LD0501,we studied the conditions for its protoplasts′ preparation and regeneration, and mutagenized its protoplasts by UV radiation as well. The protoplasts were prepared by enzyme and mutagenized with UV irradiation. The mutation result was determined by TLC. The optimum conditions for the preparation of the protoplasts were as follows:the Streptomyces LD0501 was inoculated into mycelia medium with 0.5% glycine and cultured for 72 h.The mycelia were processed with 3 mg/mL lysozyme at 30 ℃ for 75 min. Protoplasts of Streptomyces sp. LD0501 were induced by UV radiation to obtain a high phospholipase D-producing strain,whose phospholipase D′s enzyme activity reached 4.29 U/mL, increased by 180.4% compared with the initial strain. The method improved the preparation effect of protoplasts from Streptomyces LD 0501 effectively and enhanced phospholipase D strain′s vitality greatly by UV irradiation of the protoplasts,the production of the high-yielding mutant strain was verified to be genetically stable.
Keywords:phospholipase D;protoplast;UV mutagenesis;screening
中图分类号:Q93
文献标志码:A
文章编号:1672-3678(2016)02-0022-05
作者简介:杨兰兰(1990—),女,陕西榆林人,研究方向:微生物发酵;张小里(联系人),教授,E-mail:xlzhang@nwu.edu.cn
基金项目:陕西省自然科学基础研究计划(2014JM2057)
收稿日期:2015-12-07
doi:10.3969/j.issn.1672-3678.2016.02.005
