运动复合颗粒物影响神经系统病变的机制辨析
2016-04-08钱帅伟张瑞萍张安民
钱帅伟 张瑞萍 张安民
摘要:颗粒物是严重损害神经系统健康的重要危险因子,其主要通过系统性氧化应激、炎症反应和细胞Ca2+失稳态等病理机制对神经系统产生毒性效应,导致认知功能损伤或衰退,甚至诱发或加重神经退行性疾病。规律性运动是增益健康最积极、最经济的手段,可有效防治多种神经系统疾病,因此,二者交互叠加对神经系统健康的影响是急需研究与探讨的重要问题。从神经退行性疾病和认知功能等角度对运动复合颗粒物影响神经系统病变的机制进行评述,发现:颗粒物暴露下进行不同形式运动均可对神经系统造成严重损害,导致认知功能损伤或衰退,甚至诱发或加重神经退行性疾病;但慢性颗粒物暴露致神经系统病变之后进行规律性运动却可适度改善疾病进程,抑制健康过度流失。
关键词: 颗粒物;运动;氧化应激;炎症反应;神经退行性疾病;认知功能
中图分类号: G 804文章编号:1009783X(2016)02018305文献标志码: A
Abstract:Particulate matter is an extremely dangerous factor which poses a serious threat to nervous system.It exerts toxic effects to nervous system via a great many pathological mechanism,such as systematic oxidative stress,inflammation,disorder of Ca2+ and what not.Regular exercise is a very active and economical means which can improve health a great deal,as well as harbor a potential ability to prevent or treat the development of a variety of nervous system diseases.Therefore,the effect of particulate matter combined with exercise on nervous system is in urgent need to discuss and solve.From the perspective of neurodegenerative diseases and cognitive function,This review tried to analyze the mechanism of exercise combined with particulate matter on lesions of nervous system,and eventually found that exposure to air pollution during different forms of exercise could do harm to nervous system,and even induced or aggravated neurodegenerative diseases.However,regular exercise could moderately improve these nervous system diseases induced by long term particulate matter exposure,and eventually inhibited health loss.
Keywords:particulate matter;exercise;oxidative stress;inflammation;neurodegenerative diseases;cognitive function
近年来,随着经济的快速发展和城市化进程的加快,特别是机动车数量的增加及尾气的排放,城市颗粒物浓度逐年升高,空气质量严重下降,对健康的负面效应也日渐突出;因此,颗粒物的健康效应日益成为政府和社会各界关注的焦点。2012年,国际著名医学权威期刊《柳叶刀》(Lancet)杂志发表的《全球疾病负担2010年评估报告》[1]指出,在全球范围内所有健康危险因子中,细颗粒物排在第7位;而在中国,细颗粒物的健康危险仅次于不良膳食习惯、高血压和吸烟,成为严重危害公众健康的第4大风险因子[1]。由此可见,颗粒物的健康损害效应已经成为我国重要的公共卫生问题。研究已经充分证实,急性或慢性颗粒物暴露均可引起系统性氧化应激和炎症反应,对全身组织、器官和系统产生毒性效应,并可促进多种慢性疾病的发生发展[2]。鉴于颗粒物与空气质量、健康效应之间的紧密性关系,在2006年,世界卫生组织推荐采用细颗粒物作为衡量空气环境质量的重要指标[3]。
众所周知,规律性适量运动是增进健康最积极、最经济的一种手段。长期规律性运动不仅能提高中枢神经系统功能、改善内脏器官结构和机能、增强自身免疫力、延缓衰老,还能有效降低阿尔茨海默病(alzheimers disease,AD)、帕金森综合征(parkinsons disease,PD)、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)等多种神经退行性疾病的发病率和死亡率[4];但由于多种形式的运动,例如步行、跑步、骑自行车等都是在户外环境(例如道路两旁)中进行的,这就决定了运动参与者不可避免地受到颗粒物暴露的影响,从而可能重塑运动所固有的积极健康效应。一般来说,随着运动强度的增大和运动时间的延长,呼吸频率加快,肺通气量增加,气体扩散能力增强,颗粒物吸入量也随之增多[5]。有研究[6]指出,颗粒物在进入肺之后,可与肺上皮和肺巨噬细胞相互作用,释放大量细胞因子和ROS,并伴随颗粒物本身及其携带的毒性物质,穿过血脑屏障,进入脑,引起脂质过氧化反应,造成脑氧化损伤,影响神经系统功能,甚至导致神经退行性病变;然而,颗粒物污染与规律性运动交互叠加时,后者是发挥其本质的、固有的、积极的健康效应,还是对颗粒物所致的神经系统损害起协同作用?这是目前急需探讨的重要问题。基于此,本文特从颗粒物损害健康效应的细胞毒性机制为基本切入点,以期从细胞或分子层面阐释颗粒物复合运动影响神经系统健康的具体分子机制。
1颗粒物损害健康效应的毒性机制
颗粒物损伤健康的毒性作用机制目前尚未完全阐明,但其诱导的氧化应激、局部和系统炎症、细胞钙失稳态、自主神经功能紊乱、巨噬细胞损伤及其直接的毒性作用是目前公认的毒性效应机制[7]。其中氧化应激和炎症反应被认为是影响健康效应最重要的病理机制。
1.1氧化应激
自由基产生的氧化损伤是颗粒物损害健康效应的重要病理机制之一。基础状态下,内源性氧化/抗氧化系统之间处于动态平衡状态。当细胞受到氧化损伤信号(能量匮乏、高强度运动、颗粒物等)刺激时,自由基产生增多,导致氧化应激损伤。颗粒物诱导自由基增多的主要途径包括:颗粒物中多环芳羟类有机物和重金属诱导产生;吞噬细胞在吞噬颗粒物过程中产生;巨噬细胞损伤后崩解释放[7]。产生的自由基可引起细胞周期改变,并攻击DNA、RNA、脂质、蛋白质等生物大分子,产生氧化损伤反应,导致细胞凋亡或癌变。
颗粒物中的多环芳羟是一种具有致癌、致畸、致突变作用的毒性物质,可与臭氧、氮氧化合物发生反应,转为毒性更强的致癌物,导致DNA损伤。颗粒物表面结合的重金属也可促进自由基产生,并诱发脂质过氧化反应,导致细胞毒性。Kouassi等[8]研究也证实,细颗粒物携带的多环芳羟和重金属可通过氧化应激通路对肺上皮细胞产生明显的毒性效应,8羟基脱氧鸟苷(8hydroxy2 deoxyguanosine,8OHdG)是衡量DNA氧化损伤的敏感标志物。Wei等[9]研究表明,细颗粒物慢性暴露可使受试者尿液8OHdG含量显著增多,导致DNA氧化损伤。Mehta等[10]研究表明,颗粒物慢性暴露可上调氧化应激水平,促使DNA氧化损伤及修复能力下降,甚至增加DNA错误片段复制,导致基因突变或细胞癌变。另外,颗粒物所致的脂质过氧化反应也可破坏细胞膜结构,使膜通透性增强,引起气道炎症或其他病理改变[11]。
以上研究表明,颗粒物及其表面吸附的有毒有害物质可通过氧化应激产生毒性效应,致使DNA、RNA、脂质、蛋白质等物质氧化损伤,甚至导致细胞凋亡或癌变。
1.2炎症反应
流行病学统计表明,颗粒物的细胞毒性与炎性因子的释放及其调节密切相关。颗粒物可刺激一系列编码转录因子、炎症因子的基因转录,导致炎性损伤。其中,核因子κB(nuclear factor kappa B,NFκB)和肿瘤坏死因子α(tumor necrosis factorα,TNFα)作为炎症级联放大反应的前炎性因子,在炎症启动控制方面具有中心调控作用[12]。
NFκB是一种具有多向转录调控功能的核蛋白因子,在免疫应答、炎症反应、细胞存活、增殖分化、凋亡等方面均具有重要的调控作用。在正常的生理情况下,胞浆NFкB与抑制蛋白IκB结合,形成静息复合物[13];但颗粒物可诱导NFκB异常活化及其核移位,随后特异性识别并结合靶基因κB序列,调节多种靶基因转录,启动TNFα、白细胞介素1β(interleukin1β,IL1β)、IL6、IL8、环氧合酶2(cyclooxgenase,COX2)、诱导型一氧化氮合酶(inducible nitricoxide synthase,iNOS)、巨噬细胞炎性蛋白2(macrophage inflammatory protein 2,MIP2)、细胞间粘附分子1(intercellular adhesion molecular1,ICAM1)等多种炎症相关因子或介质的表达,导致炎性损伤[12]。机动车尾气颗粒(diesel exhaust particles,DEP)被认为是大气颗粒物的“头号元凶”,研究表明,DEP可促进支气管上皮IL8的表达和NFκB的激活,诱发炎症反应。IL8作为一种重要的炎性介质,可促进炎症细胞趋化和增殖,其转录依赖于NFκB信号通路的激活[13];但Nam等[14]研究发现,细颗粒物也可上调肺上皮细胞ROS和RNS水平,导致NFκB通路激活,诱发炎症反应。
TNFα也是炎症级联反应的始动因子,可促进IL6、IL8、MIP2、单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP1)等因子释放,使中性粒细胞、单核细胞和巨噬细胞异常聚集,导致炎症反应。TNFα也可促进NFκB表达和自由基增多,导致炎症损伤。Bourgeois等[15]研究表明,细颗粒物可增强肺上皮细胞TNFα、NFκB、IL6、IL8、激活蛋白1(activator protein1, AP1)等炎症因子的释放,诱发炎症反应。Phipps等[16]研究发现,慢性颗粒物暴露可促进小鼠肺IL1β、IL6、IL8、TNFα的表达,抑制IL10的表达。IL10作为一种多功能负性调节因子,可显著抑制IL6、IL8、TNFα等炎性介质的活性,其表达下降提示炎症反应加剧。
可知,NFκB 和TNFα作为颗粒物诱导炎症损伤反应的初始信号因子,是炎性细胞因子网络调节的核心机制。
1.3细胞Ca2+失稳态
Ca2+是介导细胞生理过程与病理作用的重要信号使者。在正常的生理情况下,细胞Ca2+保持基础水平,表现为胞外Ca2+内流,胞内钙库Ca2+释放及其正常摄取的动态平衡过程,但颗粒物可刺激细胞Ca2+升高,造成Ca2+失稳态,使线粒体结构与功能受损,自由基增多,致使DNA氧化损伤或细胞凋亡[12]。有研究表明,交通相关细颗粒物可引起T淋巴细胞Ca2+大量释放,使钙调神经磷酸酶(calcineurin,CaN)活性增强,活化T细胞核因子(nuclear factors of activated T cells,NFAT)mRNA和蛋白表达增加,TNFα水平升高,导致细胞损伤和凋亡[17]。这说明,Ca2+的异常释放是颗粒物诱导细胞毒性的重要病理机制。
2运动复合颗粒物影响神经系统病变的分子机制
颗粒物可进入中枢神经系统,并对其功能造成损害。颗粒物主要通过2种途径进入中枢神经系统:颗粒物首先进入肺,与肺上皮和肺巨噬细胞相互作用,释放大量细胞因子和ROS,这些因子伴随颗粒物本身及其携带的毒性物质,穿过血脑屏障,进入脑,引起脂质过氧化反应,造成脑氧化损伤,影响神经系统功能;颗粒物及其表面活性物质也可直接作用于肺神经末梢,诱发神经炎症反应[2,4]。目前,有关颗粒物复合运动影响神经系统健康的研究主要集中在神经退行性疾病和认知功能等方面。
2.1神经退行性疾病
颗粒物可诱导脑氧化应激和炎症反应,并促进AD、PD等神经退行性疾病的发生、发展。通过对长年居住在墨西哥市交通相关高污染区并发生意外死亡的健康青少年进行尸检研究,发现其额叶皮层、海马、嗅球神经元超细颗粒物沉积,氧化应激水平升高,COX2、IL1β和CD14等因子表达增加,a突触核蛋白(asynuclein)、tan蛋白和β淀粉样蛋白42(βamyloid protein,Aβ42)异常聚集,提示颗粒物可促进神经退行性疾病的发生发展[1819]。Ranft等[20]研究表明,交通相关颗粒物慢性暴露可增强老年女性脑源性神经炎症反应,并显著促进AD的病理进程。Campbell等[21]研究发现,颗粒物慢性暴露可使小鼠脑IL1α、AP1、TNFα和NFκB等炎症标志物水平显著增高,并出现神经退行性病变。也有研究[22]表明,鼻腔煤烟灌注可使小鼠嗅球神经元IL1β mRNA表达和脂磷壁酸(lipoteichoic acid,LTA)水平同步升高,并有神经退行性症状。Kleinman等[23]研究发现,载脂蛋白E基因敲除(ApoE/)小鼠超细颗粒物慢性暴露后,脑NFκB、AP1、TNFα和IL1β等炎症因子表达增加,黑质致密部多巴胺能神经元数目减少。Veronesi等[24]研究也表明,颗粒物慢性暴露可使ApoE/小鼠脑氧化应激水平上升,多巴胺能神经元变性、缺失,并出现静止震颤、运动迟缓、平衡机能紊乱和肌肉僵直等症状,提示颗粒物可显著促进PD的病理进程。上述研究充分表明,颗粒物可通过诱导氧化应激和炎症反应,促进神经退行性疾病的发生发展。
虽然目前研究认为慢性颗粒物暴露可诱发或加重神经退行性疾病,但随后进行的规律性运动却可能适度改善相关疾病进程。Shahandeh等[25]研究认为,颗粒物慢性暴露可导致神经退行性病变,但随后进行长期有氧运动却可降低脑氧化应激水平,降低神经毒性,增强大脑可塑性,抑制神经退行性疾病的发生发展,而急性力竭运动的效果却不甚明显。Migliore等[26]研究认为,颗粒物和遗传因素均是诱发AD、PD和ALS等神经退行性疾病的重要危险因子,而随后进行中、高强度的体力活动却可显著改善颗粒物所致的神经退行性疾病;但有关颗粒物预暴露致神经退行性疾病后,再进行规律性运动改善该疾病进程的机制还知之甚少,需要进一步进行研究。另外,目前尚未发现颗粒物暴露下运动影响神经退行性疾病发生发展的相关研究或报道。
2.2认知功能损伤或衰退
颗粒物慢性暴露也可严重影响认知功能。有研究[27]发现,墨西哥城区颗粒物慢性暴露可引起儿童全身性炎症反应,采用韦氏儿童智力量表测试,发现认知功能严重衰退。Weuve等[28]研究表明,老年女性在交通相关颗粒物慢性暴露后,嗅球功能紊乱,语言记忆、语言流畅性、工作记忆、注意力等认知功能均出现不同程度衰退;因此,有关流行病学的研究表明,颗粒物可导致认知功能严重损伤或衰退。
为了进一步阐明颗粒物诱导认知功能损伤的病理机制,有学者建立动物实验模型,发现颗粒物慢性暴露可使小鼠海马氧化应激和炎症因子水平上升,CA1、CA3区椎体细胞顶树突萎缩,轴突末梢结构改变,表现为顶树突分枝数目减少、总长度缩短,学习记忆能力下降,产生焦虑和抑郁行为,提示认知功能严重衰退[29]。颗粒物慢性暴露可使小鼠侧脑室扩张,表现为短期记忆、学习能力和冲动控制能力降低,这些病理改变与神经发育障碍、自闭症和精神分裂症的发生密切相关[30]。另外,颗粒物也可通过调节海马N甲基D天冬氨酸受体 (NmethylDaspartic acid 1,NMDRA1)、NMDAR2A、NMDAR2B、钙调蛋白依赖性蛋白激酶IV(CaMKIV)、兴奋性氨基酸转运体4(excitatory amino acid transporter 4,EAAT4)、谷氨酸脱羧酶65(glutamate decarboxylase 65,GAD65)、神经元谷氨酸受体1(glutamate receptor,GluA1)等因子的表达,抑制神经可塑性,导致认知功能衰退[4]。以上动物实验研究表明,颗粒物可通过多种病理机制引起认知功能损伤和衰退。
目前有关颗粒物复合运动影响认知功能的研究主要围绕脑源性神经营养因子(brain derived neurotrophic factor,BDNF)而展开。BDNF是神经营养家族的重要成员之一,对中枢神经元具有重要调节作用,可促进多种神经元的生存、分化、再生和功能执行,并能提高学习记忆能力[31]。有氧运动、自主跑轮和强迫跑台运动均可改善大鼠学习记忆能力,这与海马蛋白激酶B(protein kinase B,Akt/PKB)、环磷腺苷反应元件结合蛋白(cAMPresponse element binding protein,CREB)和BDNF蛋白表达呈正相关[4],而阻断海马BDNF信号却可抑制运动诱导的学习记忆能力提高。这表明,运动诱导的学习记忆改善与BDNF表达密切相关,但颗粒物暴露下运动却可抑制BDNF的表达,从而可能影响学习记忆等认知功能。Bos等研究[31]发现,健康受试者在清新环境进行自行车运动(30 min),可出现血清BDNF浓度升高,但交通拥堵地段进行同种运动却不能升高BDNF水平。动物实验进一步发现,跑台运动(20 m/min、90 min)可显著增强大鼠海马BDNF mRNA表达,并可维持到运动后恢复期24 h,而颗粒物暴露下进行同种运动未见BDNF的表达,却可增强IL1α、eNOS3的表达,降低核因子E2相关因子2(nuclear factor erythroid2related factor 2,NFE2L2)的表达[32]。IL1α、NOS3表达升高提示神经炎症反应加剧,而NFE2L2作为氧化应激的重要抑制因子,可启动下游多种抗氧化基因的表达,增强抗氧化防御功能。其表达降低提示海马线粒体功能受损,氧化应激水平升高。
为了进一步揭示颗粒物暴露下运动BDNF表达降低与认知功能损伤的相关性,Bos等[33]让健康受试者在城市交通高污染区和乡村环境分别进行持续12周的耐力性有氧运动,之后进行执行功能检测(斯特鲁色词测验),发现在乡村环境运动可显著提高受试者执行功能,但在城区环境运动却出现执行功能的显著降低。Bos等[33]认为,这与系统性氧化应激和炎症标志物水平升高、白细胞和中性粒细胞数目增加及BDNF表达受到抑制有关。
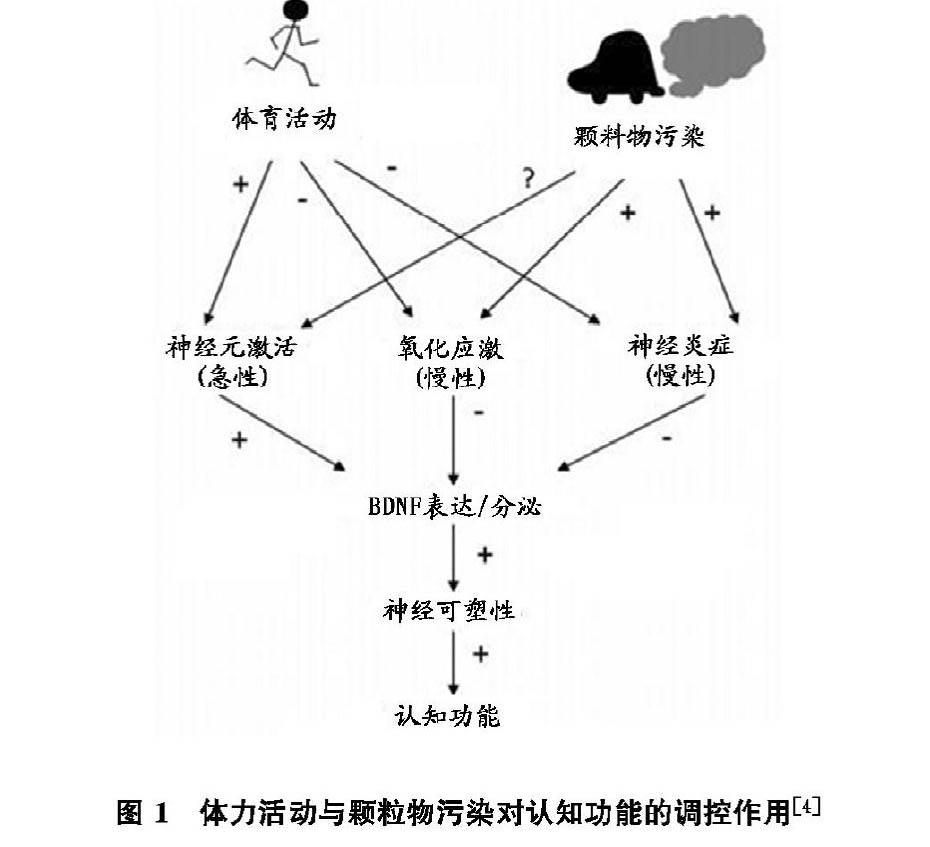
可知,颗粒物暴露下进行不同形式运动诱导的氧化应激和炎症反应是抑制BDNF表达、导致认知功能损伤或衰退的重要病理机制,如图1所示。
3结束语
综上所述,颗粒物暴露下进行不同形式运动均可对神经系统造成严重损害,导致认知功能损伤或衰退,甚至诱发或加重AD、PD等神经退行性疾病,这与颗粒物诱导的氧化应激和炎症反应有关;但慢性颗粒物暴露致神经退行性疾病之后进行规律性运动却可适度改善疾病进程,抑制健康过度流失。目前,研究尚存在一些问题:1)许多人体实验均建立颗粒物暴露下进行一次急性运动的研究模型,较少建立长期运动的人体实验模型,这可能基于人体实验伦理道德的考虑,今后可通过建立动物实验的长期运动模型来弥补这种缺憾;2)由于颗粒物暴露致神经退行性疾病后进行规律性运动可适度改善疾病进程,因此,今后探讨运动抵抗颗粒物污染对健康影响的相关机制可能显得尤为重要。3)人体实验和动物实验的充分结合或许更能有效揭示运动复合颗粒物影响神经系统健康的内在机制。因此,未来在充分考虑颗粒物主要来源、理化性质、户外气候条件、暴露浓度,以及不同运动方式、运动强度、持续时间、个体差异、健康状况(如心肺疾病等)等诸多因素的基础上,逐步建立人体实验和动物实验有机结合并相互印证的整合性研究模式。这将会进一步揭示运动复合颗粒物影响健康的内在机制,并为公众科学合理地规划户外运动和出行提供更多理论依据。
参考文献:
[1]LOZANO R,NAGHAVI M,FOREMAN K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095.
[2]GILES L V,KOEHLE M S.The health effects of exercising in air pollution[J].Sports Med,2014,44(2):223.
[3]WORLD H O.WHO Europe Air quality guidelines for particulate matter,ozone,nitrogen dioxide and sulfur dioxide.Global Update 2005[EB/OL].[20160115] http://www.euro.who.int/document/e90038.pdf.2006.
[4]BOS I,DE BOEVER P,INT P L,et al.Physical activity,air pollution and the brain[J].Sports Med,2014,44(11):1505.
[5]CAIGLE C C,CHALUPA D C,GIBB F R,et al.Ultrafine particle deposition in humans during rest and exercise[J].Inhal Toxicol,2003,15(6):539.
[6]COSTA L G,COLE T B,COBUM J,et al.Neurotoxicants are in the air:convergence of human,animal,and in vitro studies on the effects of air pollution on the brain[J].Biomed Res Int,2014(1):103.
[7]CUTRUFELLO P T,SMOLIGA J M,RUNDELL K W.Small things make a big difference:particulate matter and exercise[J].Sports Med,2012,42(12):1041.
[8]KOUASSI K S,BILLET S,GARCON G,et al.Oxidative damage induced in A549 cells by physically and chemically characterized air particulate matter (PM2.5) collected in Abidjan,Cote d'Ivoire[J].J Appl Toxicol,2010,30(4):310320.
[9]WEI Y,HAN I K,SHAO M,et al.PM2.5 constituents and oxidative DNA damage in humans[J].Environ Sci Technol,2009,43(13):47574762.
[10]MEHTA M,CHEN L C,GORDON T,et al.Particulate matter inhibits DNA repair and enhances mutagenesis[J].Mutat Res,2008,657(2):116121.
[11]MARTIN L D,KRUNKOSKY T M,DYE J A,et al.The role of reactive oxygen and nitrogen species in the response of airway epithelium to particulates[J].Environ Health Perspect,1997,105(l 5):1301.
[12]VAN BERLO D,HULLMANN M,SCHINS R P.Toxicology of ambient particulate matter[J].EXS,2012(101):165.
[13]LI Y J,SHIMIZU T,HIRATA Y,et al.EM,EM703 inhibit NFkB activation induced by oxidative stress from diesel exhaust particle in human bronchial epithelial cells:importance in IL8 transcription[J].Pulm Pharmacol Ther,2013,26(3):318.
[14]NAM H Y,CHOI B H,LEE J Y,et al.The role of nitric oxide in the particulate matter (PM2.5)induced NFkappaB activation in lung epithelial cells[J].Toxicol Lett,2004,148(1):95.
[15]BOURGEOIS B,OWENS J W.The influence of Hurricanes Katrina and Rita on the inflammatory cytokine response and protein expression in A549 cells exposed to PM2.5 collected in the Baton RougePort Allen industrial corridor of Southeastern Louisiana in 2005[J].Toxicol Mech Methods,2014,24(3):220.
[16]PHIPPS J C,ARONOFF D M,CURTIS J L,et al.Cigarette smoke exposure impairs pulmonary bacterial clearance and alveolar macrophage complementmediated phagocytosis of Streptococcus pneumoniae[J].Infect Immun,2010,78(3):1214.
[17]TONG G Q,ZHANG Z H,ZHAO Y,et al.Trafficrelated PM2.5 induces cytosolic [Ca(2)(+)] increase regulated by Orai1,alters the CaNNFAT signaling pathway,and affects IL2 and TNFalpha cytoplasmic levels in Jurkat Tcells[J].Arch Environ Contam Toxicol,2015,68(1):31.
[18]CALDERONGARCIDUENAS L,KAVANAUGH M,BLOCK M,et al.Neuroinflammation,hyperphosphorylated tau,diffuse amyloid plaques,and downregulation of the cellular prion protein in air pollution exposed children and young adults[J].J Alzheimers Dis,2012,28(1):93.
[19]CALDERONGARCIDUENAS L,SOLT A C,HENRIQUEZROLDAN C,et al.Longterm air pollution exposure is associated with neuroinflammation,an altered innate immune response,disruption of the bloodbrain barrier,ultrafine particulate deposition,and accumulation of amyloid beta42 and alphasynuclein in children and young adults[J].Toxicol Pathol,2008,36(2):289.
[20]RANFT U,SCHIKOWSKI T,SUGIRI D,et al.Longterm exposure to trafficrelated particulate matter impairs cognitive function in the elderly[J].Environ Res,2009,109(8):1004.
[21]CAMPBELL A,ARAUJO J A,LI H,et al.Particulate matter induced enhancement of inflammatory markers in the brains of apolipoprotein E knockout mice[J].J Nanosci Nanotechnol,2009,9(8):5099.
[22]TINTINWINSHWE,MITSUSHIMA DY,YAMAMOTO S,et al.Changes in neurotransmitter levels and proinflammatory cytokine mRNA expressions in the mice olfactory bulb following nanoparticle exposure[J].Toxicol Appl Pharmacol,2008,226(2):192.
[23]KLEINMAN M T,ARAUJO J A,NEL A,et al.Inhaled ultrafine particulate matter affects CNS inflammatory processes and may act via MAP kinase signaling pathways[J].Toxicol Lett,2008,178(2):127.
[24]VERONESI B,MAKWANA O,POOLER M,et al.Effects of subchronic exposures to concentrated ambient particles.VII.Degeneration of dopaminergic neurons in Apo E/ mice[J].Inhal Toxicol,2005,17(45):235.
[25]SHAHANDEH M,ROSHAN V D,HOSSEINZADEH S,et al.Chronic exercise training versus acute endurance exercise in reducing neurotoxicity in rats exposed to lead acetate[J].Neural Regen Res,2013,8(8):714.
[26]MIGLIORE L,COPPEDE F.Genetics,environmental factors and the emerging role of epigenetics in neurodegenerative diseases[J].Mutat Res,2009,667(12):82.
[27]CALDERONGARCIDUENAS L,ENGLE R,MORATISCARENO A,et al.Exposure to severe urban air pollution influences cognitive outcomes,brain volume and systemic inflammation in clinically healthy children[J].Brain Cogn,2011,77(3):345.
[28]WEUVE J,PUETT R C,SCHWARTZ J,et al.Exposure to particulate air pollution and cognitive decline in older women[J].Arch Intern Med,2012,172(3):219.
[29]FONKEN L K,XU X,WEIL Z M,et al.Air pollution impairs cognition,provokes depressivelike behaviors and alters hippocampal cytokine expression and morphology[J].Mol Psychiatry,2011,16(10):987.
[30]ALLEN J L,LIU X,PELKOWSKI S,et al.Early postnatal exposure to ultrafine particulate matter air pollution:persistent ventriculomegaly,neurochemical disruption,and glial activation preferentially in male mice[J].Environ Health Perspect,2014,122(9):939.
[31]BOS I,JACOBS L,NAWROT T S,et al.No exerciseinduced increase in serum BDNF after cycling near a major traffic road[J].Neurosci Lett,2011,500(2):129.
[32]BOS I,DE BOEVER P,INT P L,et al.Negative effects of ultrafine particle exposure during forced exercise on the expression of BrainDerived Neurotrophic Factor in the hippocampus of rats[J].Neuroscience,2012(223):131.
[33]BOS I,DE BOEVER P,VANPARIJS J,et al.Subclinical effects of aerobic training in urban environment[J].Med Sci Sports Exerc,2013,45(3):439.
