仔猪小肠平滑肌细胞体外培养方法的建立
2016-03-31瞿俊勇欧阳芬张明军
田 梦,黄 勇,瞿俊勇,欧阳芬,邓 梁,张 玲,潘 多,张明军
(1.湖南农业大学动物医学院,湖南长沙410128;2.湖南省兽药饲料监察所,湖南长沙410006)
仔猪小肠平滑肌细胞体外培养方法的建立
田梦1,黄勇2,瞿俊勇1,欧阳芬1,邓梁1,张玲1,潘多1,张明军1
(1.湖南农业大学动物医学院,湖南长沙410128;2.湖南省兽药饲料监察所,湖南长沙410006)
摘要:为了建立简便、高效的仔猪小肠平滑肌细胞体外培养方法,为相关研究提供试验材料,采用组织贴块法和酶消化法进行原代培养,胰酶消化传代,并应用倒置显微镜和SABC试剂盒对细胞进行形态学和免疫组化鉴定。结果采用组织块贴块法培养的仔猪肠平滑肌细胞有90%的组织块接种存活,初次传代后的平滑肌细胞纯度达95%以上。免疫组化染色显示胞浆内α平滑肌肌动蛋白阳性表达。而酶消化法培养的仔猪肠平滑肌细胞,生长缓慢甚至死亡。表明组织块贴块法是为简便、可靠,短期内可获大量高纯度的仔猪小肠平滑肌细胞的原代培养方法。
关键词:仔猪;小肠平滑肌细胞;组织贴块法;酶消化法;细胞培养
肠平滑肌细胞(Intestinal smooth muscle cells,ISMC)是肠道的重要功能细胞,肠平滑肌细胞的收缩、舒张等活动受到神经递质、胃肠激素和药物等因素的调节[1]。体外培养细胞,由于影响因素单一,是研究细胞功能以及相应的细胞信号转导机制的基础。相关文献报导的平滑肌细胞的培养多是关于大鼠的研究,而对于仔猪胃肠道平滑肌培养的研究,基本处于空白。为了探索一套简易实用的仔猪肠道平滑肌细胞的分离、培养方法,参照有关文献[2-3],我们分别采用贴块法和酶消化法进行了仔猪小肠平滑肌细胞的体外培养,现将试验情况,报告如下。
1 材料与方法
1.1试验材料DMEM培养基(Hyclone公司);胎牛血清(杭州四季青生物工程材料研究所);胰蛋白酶(Trypsin,Sigma公司);青、链霉素;Ⅱ型胶原酶(MP公司);胰蛋白酶抑制剂(Amersco公司);二甲基亚砜(DMSO)(Sigma公司);Trypan(北京鼎国昌盛生物技术有限责任公司);鼠抗α-action克隆抗体、SABC免疫组化试剂盒和DAB显色试剂盒(武汉博士德公司)。PBS缓冲液的配置:NaCl 7.9 g/L,KCl 0.2 g/L,NaH2PO40.24 g/L,K2HPO41.8 g/L,用NaOH调pH值到7.4。
1.2仪器MCO-18AC型二氧化碳培养箱;VS-840K-U型洁净工作台;Z323K型低温冷冻高速离心机;LDZX-30FB型高温灭菌器;DHG-9240A型电热恒温鼓风干燥箱;倒置相差显微镜和常用移液器具等。
1.3试验动物刚出生未进食未喝水的仔猪,由永州佳和农牧有限公司提供。
2 试验方法
2.1仔猪小肠平滑肌细胞的体外培养方法
2.1.1组织贴块法分离仔猪小肠平滑肌细胞参考Bitar方法加以改进[4]。将刚出生且未进食未吃奶的仔猪放血处死,立即无菌剖开腹腔,取十二指肠10 cm左右,生理盐水中反复灌肠冲洗,剪开后移入含300 IU/mL青霉素、300 μg/mL链霉素的PBS缓冲液中浸泡15 min后,取出,移入含PBS缓冲液的玻璃培养皿中,在解剖显微镜下用皮内针固定好四角,仔细剥离黏膜层,翻转至外侧,小心地撕去肠系膜,再仔细刮去浆膜层,反复用摄子侧脚刮肠段的内外层,直至在显微镜下观察到肠段呈透明的一层为止。将组织层剪碎成l~2 mm3的小肌块,用PBS冲洗3次后,将剪碎的小肌块放入60 mm培养皿中(培养皿底部先用含20%胎牛血清的DMEM湿润),间距约为0.4 cm左右,用吸管均匀摆放瓶内组织块,轻轻翻转培养皿,使培养皿底部朝上,放入37℃CO2培养箱内培养2~3 h后,待组织块干涸并与皿底贴附后,翻转培养皿,轻柔地加入3 mL DMEM培养基,使组织块完全浸入培养液中,继续静止培养,2 d后换液,期间不要动培养皿,以免组织块浮起,以后每2~3天换液1次。当组织块周围有细胞游出并达到1定密度时,将小肌块取出,继续培养,只到形成单层致密细胞。
2.1.2酶消化法小肠段的前处理同组织贴块法,将组织块剪碎后放入10 mL离心管内,加入含0.1 %Ⅱ型胶原酶和0.01%胰蛋白酶抑制剂的PBS 10 mL,37℃下消化15 min,每2 min摇动离心管,使组织充分与酶反应。当组织块变白松软,且液体浑浊后,加培养液终止消化,l 000 r/min离心5 min,弃去上清液,用含20%胎牛血清的DMEM培养基重新悬浮,60目筛网过筛,即得到游离的仔猪肠平滑肌细胞。放入37℃CO2培养箱内培养,每天观察细胞生长情况,每2~3天换液1次。
2.2传代培养与细胞鉴定细胞培养14 d后,倒置显微镜下观察细胞长成致密单层时,即可用胰酶消化传代;取原代长至融合的仔猪肠平滑肌细胞接种于预置有多聚赖氨酸涂布的盖玻片的六孔培养板,培养5 d后进行α-actin免疫组织化学染色。同时设阴性对照组。采用免疫组织化学ABC法对传代细胞进行鉴定。
3 结果
3.1细胞形态学观察
3.1.1组织贴块法组织贴块5 d后,在组织块边缘幵始有细胞游出,呈长梭状,比较稀疏。在第l0天时,组织块周围长满细胞,不均匀排列,呈簇状,细胞形态不一,有梭状、椭圆状、圆形等(图1-A)。第12天时,细胞均匀密集的从组织块周围长出,且铺满皿底(图1-B)。传代培养24 h后,细胞开始贴壁,以后几天细胞生长较慢,第11天在培养皿内才长出稀疏平滑肌细胞,细胞呈长梭状,有的呈放射状或漩涡状。存活率达90%以上。

图1 贴块法原代培养仔猪肠平滑肌细胞(40×)A:组织块周围长满仔猪肠平滑肌细胞;B:铺满皿底的仔猪肠平滑肌细胞
3.1.2酶消化法刚分离出来时,在倒置显微镜下可以看到有单个的圆形的细胞,也伴有部分杂质,见图2A。经过10 d的培养后,仍不见细胞贴壁,且原本能清楚看到的圆形细胞也不见了,只剩下一些类似杂质的黑点,见图2B。
3.2免疫组化鉴定应用(α-actin单克隆抗体免疫组化染色,可见细胞被染成棕色或浅棕色,核不着色,呈浅蓝色阳性反应;阴性对照组,细胞不被染色。见图3(A、B)。经免疫组化鉴定,组织贴块法原代培养仔猪肠平滑肌细胞可获得高纯度(免疫组化鉴定α-actin的阳性率达95%以上)的细胞,且生长良好。为研究药物对细胞的作用及信号传导提供基础。

图2 酶消化法原代培养仔猪肠平滑肌细胞A:酶消化法分离仔猪肠平滑肌细胞(40×);B:仔猪肠平滑肌细胞培养10 d后(40×)
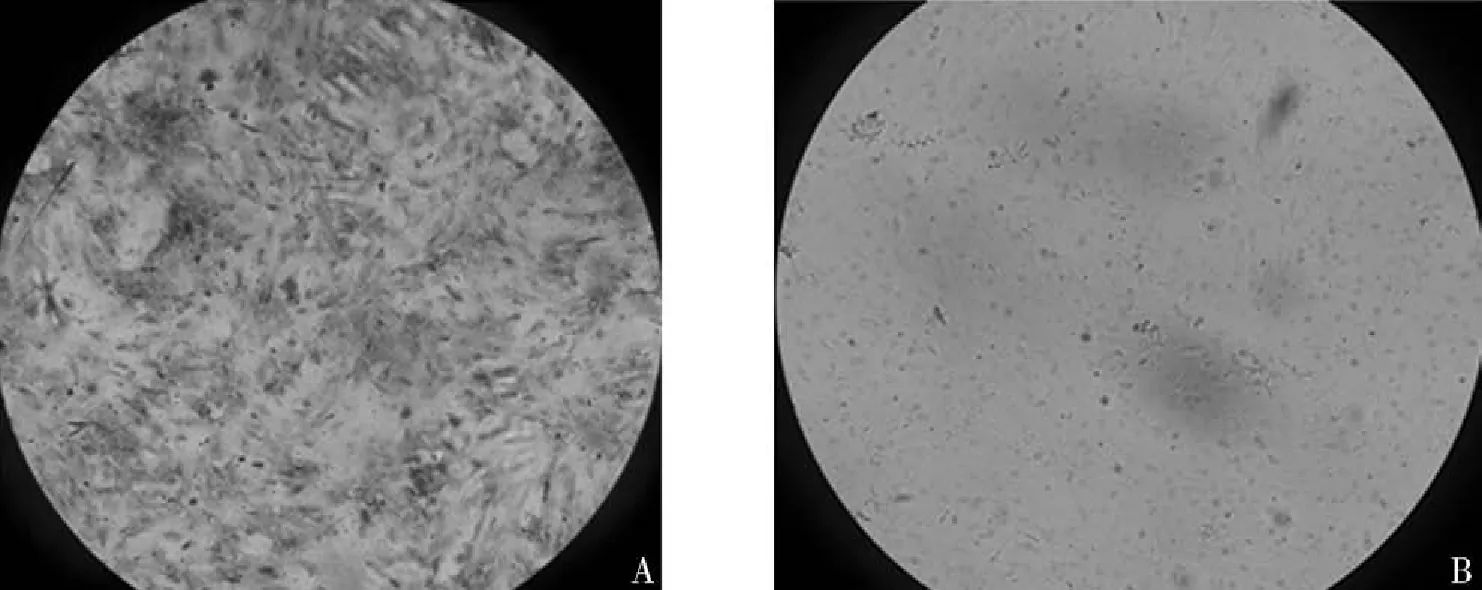
图3 仔猪肠平滑肌细胞免疫组化鉴定A:组织块培养法的仔猪肠平滑肌细胞免疫组化(40×);B:组织块培养法的仔猪肠平滑肌细胞免疫组化阴性对照(40×)
4 讨论
关于平滑肌细胞培养的研究有不少报道,但大多都是关于血管平滑肌细胞。一方面因为肠道属于消化器官,与细菌的接触机会较大,容易污染;另一方面,仔猪不似一般试验动物,成本较高。此外,肠道的结构不同于血管。肠道分为黏膜层、黏膜下层、肌层和浆膜层,而血管分为外膜、中膜和内膜,中膜较厚,主要由大量环形排列的平滑肌纤维组成。在分离肌层时,肠道与血管比较,操作更加复杂。所以,在分离结肠平滑肌层时应尽可能仔细、反复地刮除黏膜、黏膜下层及浆膜层,在体视显微镜下操作更能确保分离、得到的组织是较纯的平滑肌组织。
笔者尝试的酶消化法,虽然其培养周期短,但酶作用时间不易掌握,且消化酶本身对细胞有一定的损伤作用,导致培养失败;虽然组织块法培养周期较长,但操作相对简便,污染机会小,培养效率高[5-6]。根据本试验结果,我们更推荐用组织块培养法进行仔猪平滑肌细胞的原代培养。
笔者将试验中的一些体会及需注意的要点总结如下:首先必须在无菌条件下取材,取材后小肠立即置入含300 IU/mL青霉素、3000 μg/mL链霉素的PBS中,肠段从离体到完成原代培养的时间要尽量短(本试验时间均控制在1 h以内),以保证细胞能在最快的时间获得营养,植块体积以0.5~1 mm3/块为宜,如果植块过大,贴壁后植块内部的平滑肌细胞因营养摄取不足,而不易迁出向外生长,剪切植块的边缘要尽量整齐,有利于细胞的游出。植块贴壁干涸3~4 h后再加培养基,这既可使植块贴壁较紧,又不会因干涸贴壁时间太长使细胞缺乏营养而影响生长。在原代培养初期,培养液用量不应超过1 mL(以60 mm培养皿为例),以0.5~1 mL为佳,仅够保持植块湿润即可。培养液量太多,会使植块漂浮而贴壁失败。培养开始时必须绝对静置3 d,培养瓶不能震动和移动,以防刚贴壁的细胞重新漂浮而死亡,影响存活率。
参考文献:
[1]梁宁霞,衣兰娟,田琳,等.鼠结肠平滑肌细胞的分离、培养与鉴定[J].江苏医药,2005,6(31):6.
[2]王慧.血根碱对大鼠小肠平滑肌收缩的抑制作用及信号传导通路研究[D].长沙:湖南农业大学,2012:28-29.
[3]周晓莉,雷寒,柳青,等.血管平滑肌细胞的培养及鉴定[J].重庆医学,2005,6(34):6.
[4] Bitar K N,Makltlouf G M . Receptors on smooth muscle cells:charactarization by contraction and specific antagonists[J] . Am J Physiol,1982,242:400-407.
[5]周昕,耿红全,吴湘如,等.尿路平滑肌细胞的培养和鉴定[J].中华泌尿外科杂志,2003,24(5):348.
[6]梁若斯,陈德.成人动脉平滑肌细胞体外培养模型的建立[J].中国现代医学杂志,2002,12(10):31.
Establishment of methods on culturing And Identificating Piglet′s intestinal smooth musclecells in vitro
TIAN Meng1,HUANG Yong2,QU Jun-yong1,OUYANG Fen1,DENG Liang1,ZHANG Ling1,PAN Duo1,ZHANG Ming-jun1
(1.College of Veterinary Medicine,Hunan Agricultural University,Changsha 410128,China;2.Hunan Provincial Institute of Veterinary Drug and Feed Control,Changsha 410006,China)
Abstract:In order to establish a simple and effective method of culturing piglet′s intestinal smooth muscle cells in vitro,and to provide test material for the related studies,tissue-piece inoculation and collagenase digestion were adopted to culture the primary piglet′s intestinal smooth muscle cells,respectively,and then rypsin digestion was used to transfer them.The cultured cells were identified by morphology and immunohistochemistry with inverted microscope and SABC kit.The result showed that about 90%inoculated tissue pieces survived through tissue-piece inoculation and the purity of the piglet′s intestinal smooth muscle cells by the first passage was more than 95%.And these cells were positive with the immunohistochemically staining against mouse SM-α-actindemonstrated by specific mAb.At the same time,the cells cultured by collagenase digestion grew very slowly,or even died.Our results indicate that tissue-piece inoculation is a simple and reliable method to obtain highly purified pigler’s intestinal smooth muscle cells in short term.
Key words:Piglet;intestinal smooth cells;tissue-piece inoculation;collagenase digestion;cell culture
Corresponding author:ZHANG Ming-jun
通讯作者:张明军,E-mail:zhmj6997@163.com
作者简介:田梦(1990-),女,硕士生,从事兽医临床药学研究,E-mail:554231628@qq.com
收稿日期:2014-04-03
中图分类号:S828.9
文献标志码:A
文章编号:0529- 6005(2016)01- 0038- 03
