绵羊PRKAG3基因SNPs与肉质性状的相关性分析
2016-03-18魏玉兵童建伟张明军王建福王欣荣成述儒
王 华,魏玉兵,童建伟,张明军,王建福,王欣荣,成述儒
(1.甘肃农业大学 动物科学技术学院,甘肃 兰州 730070;2.甘肃省张掖市甘州区平山湖乡畜牧站,甘肃 张掖 734000)
绵羊PRKAG3基因SNPs与肉质性状的相关性分析
王华1,魏玉兵2,童建伟2,张明军1,王建福1,王欣荣1,成述儒1
(1.甘肃农业大学 动物科学技术学院,甘肃 兰州730070;2.甘肃省张掖市甘州区平山湖乡畜牧站,甘肃 张掖734000)
摘要:为从分子水平研究甘肃境内典型养殖模式下甘肃高山细毛羊、小尾寒羊、藏羊、蒙古羊和滩羊5个绵羊品种的PRKAG3基因多态性与屠宰性能和肉品质的相关性,探讨以PRKAG3为候选基因,提高绵羊屠宰性能和肉品质的可能性。采用PCR-SSCP技术对5个绵羊品种的PRKAG3基因外显子4,5和内含子4多态性进行检测,并就PRKAG3基因多态性与9月龄屠宰性能和肉品质进行相关性分析。结果表明,在PRKAG3基因2 689 bp处发生了A>G的突变,位于第4内含子第23 bp处,表现出3种基因型,AA、AB和BB。纯合度(Ho)分别为0.67,0.69,0.76,0.69,0.59,杂合度(He) 分别为0.333 3,0.306 1,0.244 9,0.307 7,0.408 2,有效等位基因(Ne)分别为1.62,1.66,1.69,1.48,1.79,多态信息含量(PIC)分别为0.31,0.32,0.33,0.27,0.34。除藏羊外其他4个绵羊品种均处于Hardy-Weinberg平衡状态。关联分析表明,5个绵羊品种 PRKAG3基因此变异位点的3个基因型间失水率性状差异显著(P<0.05);BB基因型个体的胴体重显著高于AA型(P<0.05),滩羊为极显著(P<0.01),BB基因型个体的眼肌面积显著大于AA型(P<0.05)(藏羊除外)。因此说明PRKAG3 基因可作为候选基因用于绵羊产肉性能和肉品质的分子标记辅助选择。
关键词:绵羊;PCR-SSCP;PRKAG3基因;肉质性状;关联性分析
羊肉的嫩度、多汁性和风味等是消费者对其品质评价的首要指标。可靠的自然变异的表型差异为育种选择提供了重要依据。在家畜基因组研究中从复杂的表型特征中找出这些变异并阐明如何控制这些指标是分子育种的主要目标之一[1]。骨骼肌代谢是一个非常复杂的生物过程,与能量的摄取、利用和环境因素等紧密相关,它对肌肉的结构和生化特征都产生影响,因此,它对肉品质有很大的影响。腺嘌呤核糖核苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)是调控细胞内能量代谢的主要参与者之一[2]。AMPK在真核生物的能量平衡调节中起了非常重要的作用[3],它是由催化亚基α(α1、α2)[4]以及调节亚基β(β1、β2)[5]和γ(γ1、γ2、γ3)组成,其中γ3亚基由具有肌肉特异表达特性的PRKAG3(AMP-activated protein kinase γ3)基因编码[6]。有报道表明,AMPK的亚基发生变异与生理效应显著相关。Fontanesi等[7]对7个不同品种的猪进行了PRKAG3基因在骨骼肌中对能量平衡和糖原调节过程所起作用的研究结果表明,PRKAG3基因的突变与肉质颜色相关性为显著 (P<0.01)。Milan等[8]对汉普夏猪的PRKAG3基因研究,结果表明,PRKAG3基因的第200个密码子发生了错义突变(Arg200>Gln200),从而使AMPK活性降低,促使骨骼肌中糖原含量显著升高,最终导致猪肉pH降低,从而造成了RN-效应。Ciobanu等[9]又证实,PRKAG3中紧邻Arg200的Val199>I1e199 突变具有与RN-效应相反的效应,它使骨骼肌中糖原含量显著降低,因而有利于肉质的改善。Rothschild等[10]利用等位基因分子标记技术对PRKAG3进行分析并关联分析其与繁殖和肉质性状的关系,并申请了美国国家专利。又有报道证实,猪的PRKAG3基因表达对肉质最终pH 、色度等性状存在一定的影响[11-12]。李梦云等[13-14]研究结果发现,PRKAG3基因表达量与营养水平有关系,但未达到显著水平。Yu等[15]分析了韩牛PRKAG3基因的结构与序列,并发现PRKAG3基因在牛的体内亦只在骨骼肌中高度表达,并可能与肉品质和肌肉相关的遗传病有一定的关系。Matthieu等[16]对总长8 048 bp的CDS序列进行研究,结果表明,序列共存在32个SNPs位点,平均每250 bp就有1个SNP存在,其中有5个使氨基酸发生了改变的突变,这表明PRKAG3基因在牛上有很高的变异频率。由此表明,PRKAG3 基因可能是一个影响肉质的候选基因。
本试验以甘肃境内典型养殖模式下甘肃高山细毛羊、小尾寒羊、藏羊、蒙古羊和滩羊5个绵羊品种为研究对象,以PRKAG3基因为候选基因,采用PCR-SSCP的方法分析其多态性,并与屠宰性能和肉质性状进行相关性分析。目的是进一步认识绵羊的种质特性,希望对甘肃绵羊品种的杂交、选种和早期选育提供基础参数和试验基础。
1材料和方法
1.1试验动物
本试验选用3月龄甘肃本地5个绵羊品种共245只,静脉采血,所采血样均为6 mL/只,用ACD 抗凝,-20 ℃冻存。9月龄时对各绵羊品种的每个基因型随机选取3只按统一标准进行屠宰,测定肉质品质。
1.2主要试剂
TaqDNA聚合酶、非变性聚丙烯酰胺凝胶、琼脂糖和琼脂粉、蛋白酶K、Tris饱和酚、三氯甲烷、异戊醇、无水乙醇、甲醛、乙酸、三羟甲基氨基甲烷(Tris)、硼酸乙二胺四乙酸二钠(EDTA)、DNA Marker、去离子甲酰胺、溴酚蓝等。
1.3性状测定
主要测定剪切力(Shear force,SF)、蒸煮损失率(Cooking loss rate,CLR)、pH值(pH value)、失水率(Drip loss,DP)、胴体重(Carcass weight,CW)、净肉重(Net meat weight,NMW)、屠宰率 (Dressing percentage,DP)、净肉率(Meat percentage,MP)和眼肌面积(Loin muscle area,LMA)。以上性状依据国家标准GB/T17238-1998进行测定。
1.4引物设计
根据GenBank数据库绵羊PRKAG3的登录号(FJ685774.1)通过Primer 5.0对PRKAG3进行引物设计,并由上海生工生物工程有限公司合成。引物序列:P5E5-F-5′-GGTGAACCCCACTCCTCT-3′;P5E5-R-5′-CATCCTCTACCCTGGGTCCTT-3′。
1.5DNA提取及 PCR反应体系和程序
采用常规的酚-氯仿抽提法[17]从血样中提取基因组DNA 。
PCR反应体系为25 μL,其中模板DNA 1 μL(100 μmol/L),上游引物1 μL(10 μmol/L),下游引物1 μL(10 μmol/L),mixTaq酶12.5 μL(1.25 U),最后加ddH2O至总反应体系25 μL。
扩增程序:94 ℃预变性4 min;94 ℃变性30 s,退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。
1.6PCR-SSCP分析
PCR检测完成后,取PCR产物2 μL与 8 μL的上样缓冲液混匀,然后98 ℃变性10 min,迅速冰浴5 min,用移液枪将变性样品点于12%非变性聚丙烯酰胺凝胶[m(Acr):m(Bis)=39∶1]中,180 V,8 ℃电泳16 h,硝酸银染色[18]判型。
1.7数据统计分析
采用SPSS19.0软件对PRKAG3基因外显子4,5和内含子4基因多态性位点在不同绵羊群体中的基因型进行统计分析,根据下列模型进行最小二乘分析,比较各项观察值在PRKAG3基因型之间的差异。
Yijkm=u+Gi+BFj+Lk+Sm+eijkm
式中:Yijkm为个体某性状表型值,u为总体均值,Gi为基因型效应,BFj为第j个品种和羊场的合并固定效应,Lk为地区效应,Sm为性别效应,eijkm为随机误差。
2结果与分析
2.1PCR产物检测结果
对PRKAG3基因进行扩增,随机选择若干个样品的PCR产物用2%的琼脂糖凝胶电泳进行检测(图1),结果表明,扩增片段与目的片段(321 bp)大小一致,且特异性好,可用于SSCP分析。

图1 PCR扩增
2.2SSCP检测与判型
对外显子4,5和内含子4的扩增产物进行SSCP分析发现3种基因型(图2),并将不同基因型个体挑选几个进行测序,测序结果表明(图3),第2 689 bp位点处即内含子4第23 bp处存在A>G突变,其中将位点为A碱基的带型命名为AA型,为G碱基的命名为BB型,杂合子为AB型,测序结果与电泳结果一致。

图2 扩增序列SSCP检测
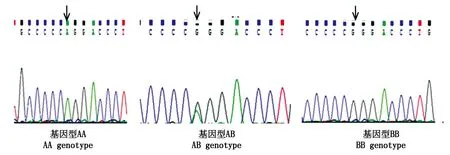
图3 测序结果对比
2.3PRKAG3基因型频率和基因频率分析
采用群体遗传学方法,对5个绵羊品种PRKAG3基因变异位点的基因型频率和基因频率进行分析(表1),结果表明,小尾寒羊AA基因型频率最高为0.80,滩羊最低为0.48。小尾寒羊等位基因A基因频率最高0.89,滩羊最低为0.68。在不同的绵羊群体中等位基因A的频率都在0.5以上,为优势等位基因。AA基因型频率除滩羊外都在0.5以上,为优势基因型。
2.4纯合度、杂合度、有效等位基因数、多态信息含量和哈代-温伯格平衡检验分析
对5个绵羊品种进行纯合度(Ho)、杂合度(He)、有效等位基因(Ne)、多态信息含量(PIC)和χ2检验分析,结果表明(表2),滩羊的杂合度最高,其次为甘肃高山细毛羊,5个绵羊品种的PIC值均为0.25~0.50,为中度多态。经χ2检验,藏羊偏离哈代-温伯格平衡状态,其余绵羊品种在该位点均处于哈代-温伯格平衡状态。

表1 基因型频率和基因频率
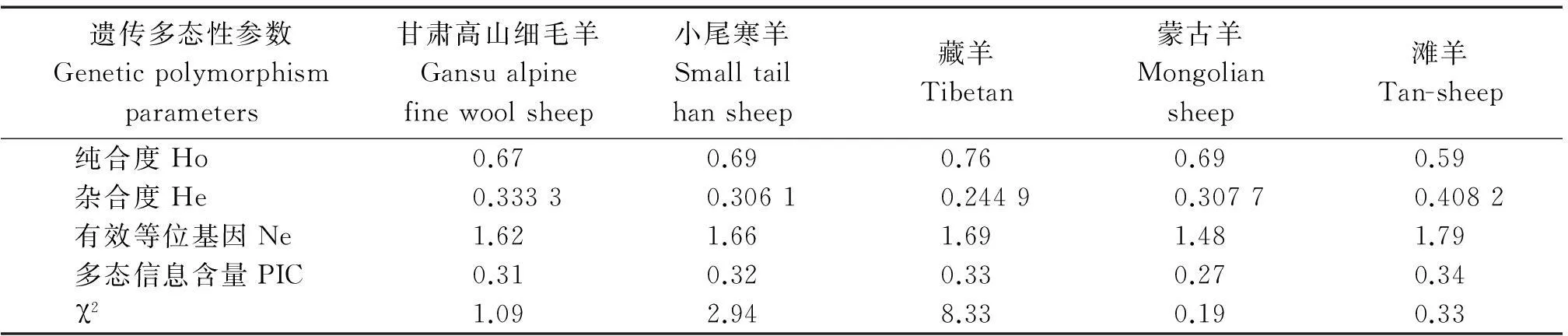
表2 五个绵羊品种纯合度、杂合度、有效等位基因数、多态信息含量和哈代-温伯格平衡检验分析
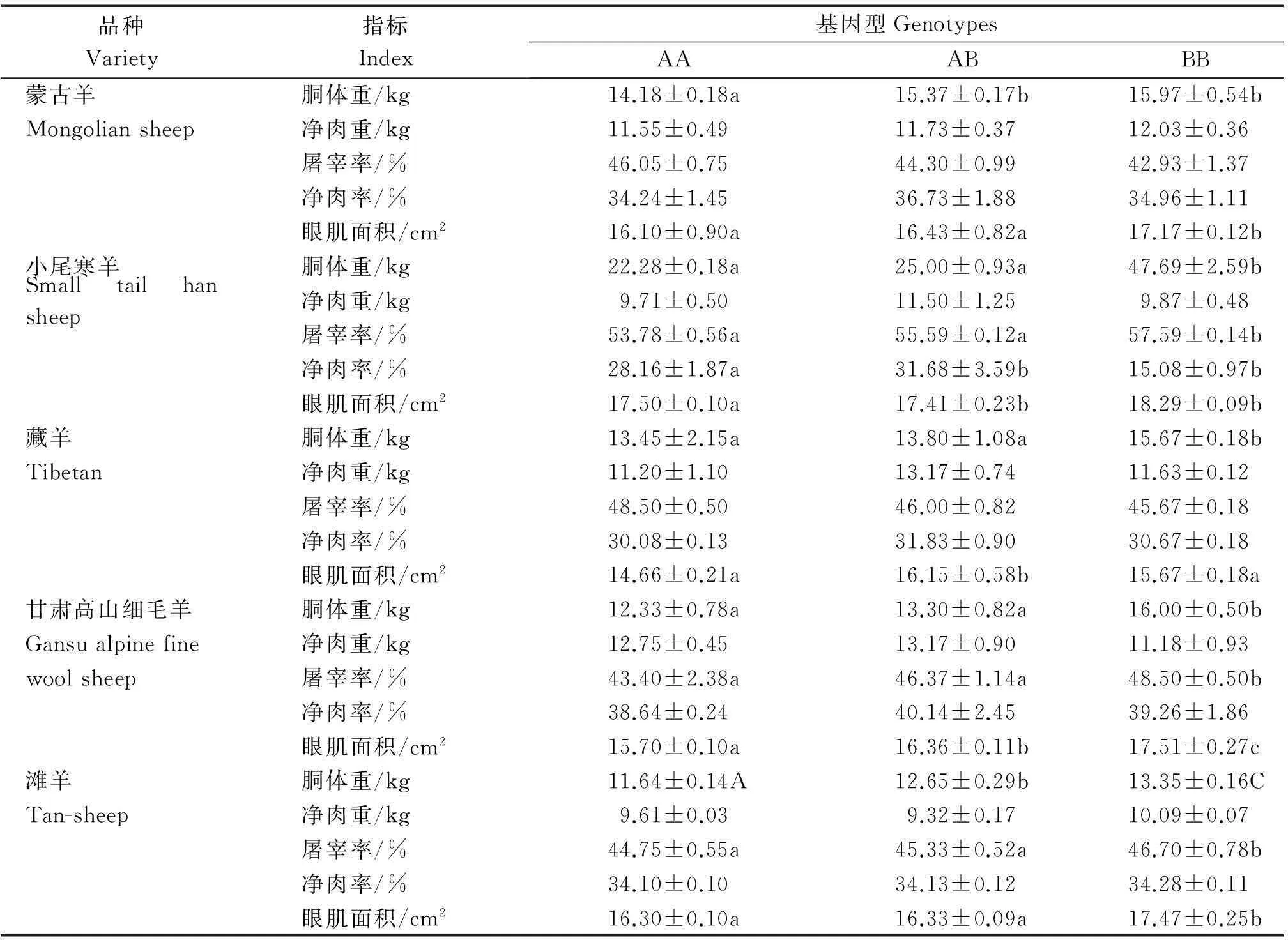
表3 不同基因型屠宰性状关联分析
注:同行不同大写字母表示差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)。表4同。
Note:In the same line,values with different letter mean very significant difference(P<0.01);Values with different capital lowercase mean significant difference(P<0.05).The same as Tab.4.
2.5PRKAG3不同基因型屠宰性状关联分析
PRKAG3基因第4,5外显子和第4内含子突变位点不同基因型屠宰性状分析(表3),结果表明,各个品种蒙古羊、小尾寒羊、藏羊和甘肃高山细毛的基因型间BB型个体的胴体重最小二乘均值显著高于 AA型(P<0.05),滩羊为极显著(P<0.01)。对于净肉重各基因型之间没有显著差异,对于净肉率除小尾寒羊各基因型之间没有显著差异。对于眼肌面积除藏羊外其他4个绵羊品种基因型BB个体显著大于基因型AA个体(P<0.05)。对于屠宰率指标藏羊和蒙古羊之间各基因型间没有显著性,但其他3个绵羊品种间的BB型屠宰率最小二乘均值显著高于AA型(P<0.05)。
2.6PRKAG3不同基因型肉质性状关联分析
PRKAG3基因第4,5外显子和第4内含子突变位点不同基因型肉质性状分析(表4),结果表明,突变位点对5个绵羊品种的失水率有显著影响(P<0.05)。蒙古羊和滩羊的剪切力基因型BB个体显著低于AA型个体(P<0.05)。滩羊与甘肃高山细毛羊的基因型BB个体与AA型个体pH值有显著差异(P<0.05),但总的趋势是BB型优于AA型,其失水率较高,剪切力较低。
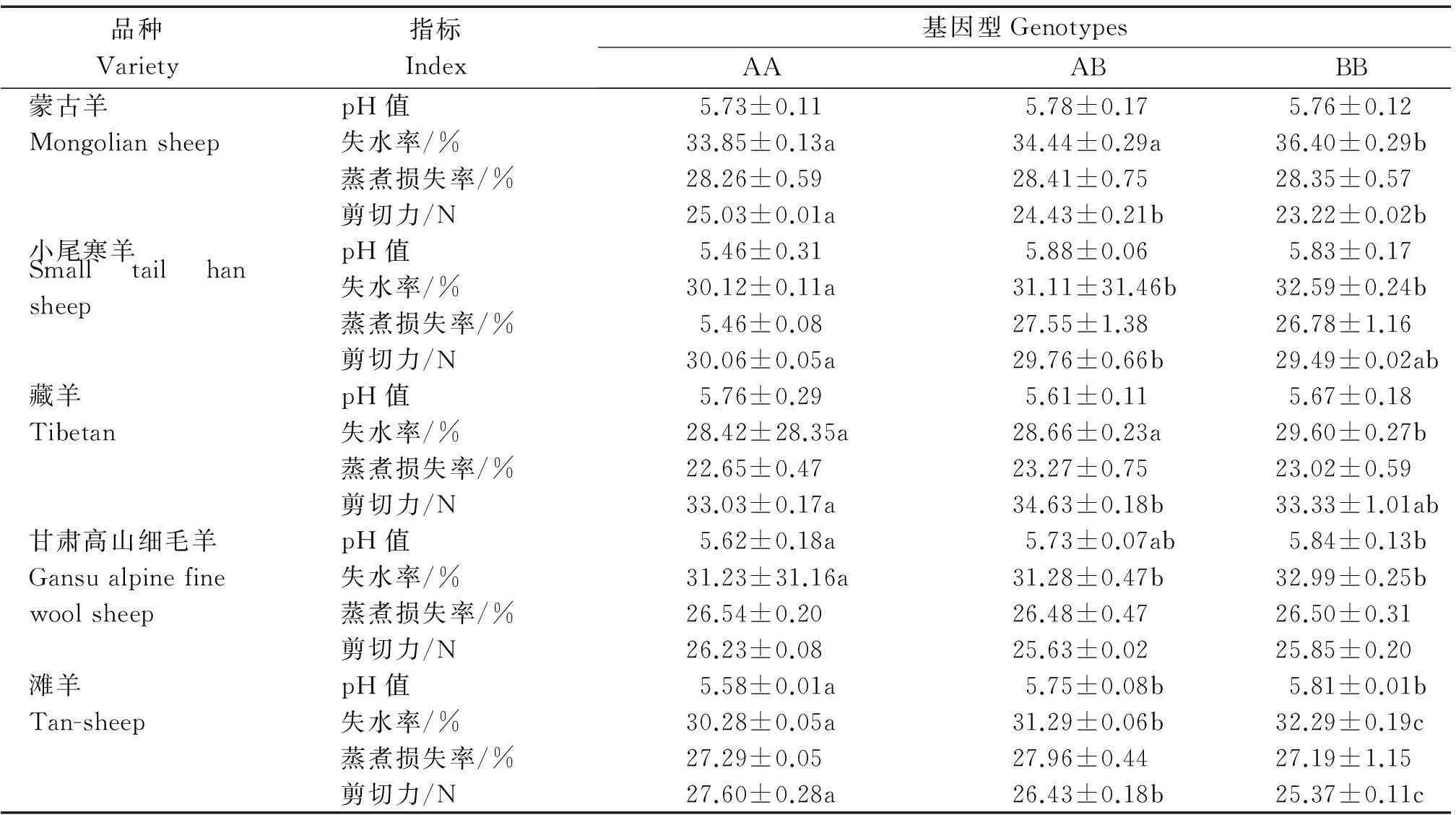
表4 不同基因型肉质性状关联分析
3讨论与结论
自20世纪初,随着生活水平的提高以及对食品安全的考虑,人们对草食畜肉类的需求量呈逐年增加,导致羊肉价格不断上扬,绵羊的发展方向由毛用转向肉毛兼用或肉用,绵羊的品种和类型的结构相应的发生了变化。自改革开放以来,受世界养羊业由毛用向肉用转型的趋势影响,以及国内羊肉需求量增加、羊肉价格不断攀升等市场因素推动,羊肉生产得到迅速发展。甘肃省作为我国五大牧区之一,肉羊生产发展迅猛,但随着社会经济的发展和人们生活质量的提高,人们也越来越关注羊肉的品质,PRKAG3基因是影响羊肉品质的候选基因,它主要在骨骼肌中特异性表达,目前已被作为影响肉质性状的一个主要基因在家畜上广泛研究。
李梦云等[19]研究表明,二甲双胍可激活PRKAG3基因的表达,进而影响猪生长性能和肉质,同时马琳旭等[20]证实,日粮中添加甜菜碱可以不同程度地提高育肥猪PRKAG3基因的表达量。哈桑·阿巴克等[21]对鸡的PRKAG3研究发现其变异对pH值有显著影响。李静[22]对延边黄牛研究发现PRKAG3基因突变对天冬氨酸有一定的正面影响,对谷氨酸、丙氨酸、脯氨酸、精氨酸和缬氨酸含量均有一定的负面影响。田万强[23]在牛PRKAG3基因上共检出45个SNPs位点,关联分析表明,突变位点对牛的不同性状均有影响。靳海等[24]研究表明,山羊的PRKAG3基因5′调控区和外显子13存在大量变异位点。王耀武[25]研究表明在脂肪生成以及脂肪沉积组织中,不同绵羊PRKAG3基因的表达水平上有显著差异。陶晓臣等[26-27]研究结果表明不同绵羊PRKAG3基因mRNA表达量差异不显著。卢亚洲[28]对PRKAG3基因外显子多态位点与绵羊肉品质性状指标关联性进行了分析发现,PRKAG3多态位点与滩羊肉质颜色和pH值存在互作效应,差异极显著。
本研究在绵羊的PRKAG3基因外显子4,5和内含子4进行多态位点分析,在内含子4的第23 bp处发现一个A>G碱基突变所造成AA、AB、BB 3种基因型,AA为优势基因型,A为优势等位基因。对5个绵羊品种进行纯合度(Ho)、杂合度(He)、有效等位基因(Ne)、多态信息含量(PIC)和χ2检验分析结果表明,5个绵羊品种的PIC值均为0.25~0.50,为中度多态,PIC值分析说明,本研究所检测到的变异位点在各个绵羊群体中都存在一定的遗传变异。经χ2检验,藏羊偏离哈代-温伯格平衡状态,这可能是由于人工饲养选育结果而改变的,其余绵羊品种在该位点均处于哈代-温伯格平衡状态。滩羊的杂合度比其他各品种高,表明滩羊PRKAG3 基因的多态性相对较高。
对各个基因型进行屠宰及肉品质性状关联性分析,屠宰性状表明各个品种蒙古羊、小尾寒羊、藏羊和甘肃高山细毛的基因型间BB型个体的胴体重最小二乘均值显著高于AA型(P<0.05),滩羊为极显著(P<0.01)。说明在屠宰方面,此变异位点对滩羊的影响更大一些。净肉重性状指标没有显著性差异,净肉率指标除小尾寒羊其他各基因型之间没有显著差异,说明此变异位点对净肉重和净肉率的影响不大。肉品质关联分析发现多态位点所对应的失水率基因型效应有达到显著水平的趋势,此多态位点所对应的失水率BB基因型最小二乘均值显著高于AB或AA基因型最小二乘均值(P<0.05)。对于剪切力除甘肃高山细毛羊外其他4个品种均有显著性影响趋势,说明此变异位点对甘肃高山细毛羊剪切力影响较小。卢亚洲[28]对PRKAG3基因外显子多态位点与绵羊肉品质性状指标关联性进行了分析发现,PRKAG3多态位点与滩羊肉质颜色和pH值存在互作效应,差异极显著。本研究所出现的性状差异可能是由于多数性状存在品种与基因型的互作效应所致,但这也可能是由于屠宰个体数少所造成的抽样误差。尽管如此,笔者仍可以看出,PRKAG3 不同基因型个体的各屠宰指标确有明显差异。因此,PRKAG3 基因有可能作为一个候选基因用于绵羊产肉性能的分子标记辅助选择。
在甘肃境内典型养殖模式下甘肃高山细毛羊、小尾寒羊、藏羊、蒙古羊和滩羊5个绵羊品种的PRKAG3基因产生了不同的多态性,基因型和品种间的互作效应可能造成了不同绵羊品种的屠宰性能和肉品质性能的差异性。但总的来说,PRKAG3基因的变异引起了绵羊肉品质的变化。
参考文献:
[1]Roux M,Nizou A,Forestier L,et al.Characterization of the bovinePRKAG3 gene:structure,polymorphism,and alternative transcripts[J].Mammalian Genome:Official Journal of the International Mammalian Genome Society,2006,17(1):83-92.
[2]Carling D.The AMP-activated protein kinase cascade-a unifying system for energy control[J].Trends in Biochemical Sciences,2004,29(1):18-24.
[3]Kahn B B,Alquier T,Carling D,et al.AMP-activated protein kinase:ancient energy gauge provides clues to modern understanding of metabolism[J].Cell Metabolism,2005,1(1):15-25.
[4]Gao G,Fernandez C S,Stapleton D,et al.Non-catalytic beta-and gamma-subunit isoforms of the 5′-AMP-activated protein kinase[J].The Journal of Biological Chemistry,1996,271(15):8675-8681.
[5]Stapleton D,Woollatt E,Mitchelhill K I,et al.AMP-activated protein kinase isoenzyme family:subunit structure and chromosomal location[J].FEBS Letters,1997,409(3):452-456.
[6]Cheung P C,Salt I P,Davies S P,et al.Characterization of AMP-activated protein kinase gamma-subunit isoforms and their role in AMP binding[J].The Biochemical Journal,2000,346(Pt 3):659-669.
[7]Fontanesi L,Scotti E,Buttazzoni L,et al.The porcine fat mass and obesity associated (FTO) gene is associated with fat deposition in Italian Duroc pigs[J].Animal Genetics,2009,40(1):90-93.
[8]Milan D J T,Jeon C,Looft V,et al.A mutation in PRKAG3 associated with excess glycogen content in pig skeletal muscle[J].Science,2000,288:1248-1251.
[9]Ciobanu D,Bastiaansen J,Malek M,et al.Evidence for new alleles in the protein kinase adenosine monophosphate-activated gamma(3)-subunit gene associated with low glycogen content in pig skeletal muscle and improved meat quality[J].Genetics,2001,159(3):1151-1162.
[10]Rothschild M F,Ciobanu D C,Malek M,et al.PRKAG3 alleles and use of the same as genetic markers for reproductive and meat quality traits[P].United States Patent:6919177,July 19,2005.
[11]Lindahl G,Enfält A C,Seth G V,et al.A second mutant allele (V199I) at the PRKAG3 (RN) locus-Ⅱ.Effect on colour characteristics of pork loin[J].Meat Science,2004,66(3):621-627.
[12]Plastow G S,Carron D, et al.Quality perk genes and meat production[J].Meat Science,2005,70:409-421.
[13]李梦云,陈代文,张克英.PRKAG3基因在骨骼肌中的营养代谢调节作用及其对肉质的影响[J].动物营养学报,2006,18(2):131-136.
[14]李梦云,余冰,张克英,等.营养水平对PRKAG3基因表达量及对肉质影响的研究[J].畜牧兽医学报,2008,39(8):1056-1061.
[15]Yu S L,Kim J E,Chung H J, et al.Molecular cloning and characterization of bovinePRKAG3 gene:structure,expression and single nucleotide polymorphism detection[J].Journal of Animal Breeding and Genetics,2005,122(5):294-301.
[16]Matthieu R,Angelique N,lionel F,et a1.Transcripts and polymorphisms of the bovinePRKAG3 gene[J].Msmmalian Genome,2006,17:83-92.
[17]Kanain N,Fujii T,Saito K,et al.Rapid and simple method for preparation of genomic DNA from easily obtainable clotted blood[J].Journal of Clinical Pathology,1994,47(11):1043-1044.
[18]Byun S O,Fang Q,Zhou H,et al.An effective method for silver-staining DNA in large numbers of polyacrylamide gels[J].Analytical Biochemistry,2009,385(1):174-175.
[19]李梦云,余冰,陈代文.饲料中添加二甲双胍对猪PRKAG3基因表达量及肉质的影响[J].畜牧兽医学报,2012,43(10):1566-1572.
[20]马琳旭,边连全,刘显军.甜菜碱对育肥猪生长性能和PRKAG3基因相对表达量的影响[J].中国畜牧兽医文摘,2013,3:25-25.
[21]哈桑·阿巴克,张永宏,郭将,等.芦花鸡PRKAG3单核苷酸多态性及肉质相关性分析[J]黑龙江畜牧兽医,2012,7:12-13.
[22]李静.边黄牛TCAP、DECR1、PRKAG3基因SNP检测及与肉质性状的关联分析[D].陕西:延边大学,2010.
[23]田万强.牛AMPK家族7个基因SNP检测及其与生长和肉质性状的关联分析[D].杨凌:西北农林科技大学,2013.
[24]靳海,陈宏权,黄生强,等.5个山羊品种PRKAG3基因5′调控区和外显子13杂合度分析[J].安徽农业大学学报,2012,39(2):165-169.
[25]王耀武.阿勒泰羊脂肪沉积相关基因的多态性与表达研究[D].北京:中国农业科学院,2014.
[26]陶晓臣,兴亮,爱琴,等.不同品种绵羊背最长肌PRKAG3和LPL基因的表达差异[J].中国草食动物科学,2012(z1):81-82.
[27]陶晓臣.昭乌达羊肉与乌拉特羊肉肉品质特性及其PRKAG3、LPL、PPAR基因表达差异的研究[D].呼和浩特:内蒙古农业大学,2011.
[28]卢亚洲.绵羊PRKAG3基因的克隆表达及多态性与滩羊肉质品质的关联分析[D].北京:中国农业科学院,2009.
PRKAG3 Gene SNPs of Sheep and Correlation Analysis of Meat Quality Traits
WANG Hua1,WEI Yubing2,TONG Jianwei2,ZHANG Mingjun1,WANG Jianfu1,WANG Xinrong1,CHENG Shuru1
(1.Faculty of Animal Science and Technology,Gansu Agricultural University,Lanzhou730070,China;2.Pingshanhu Animal Husbandry Station of Ganzhou Country,Zhangye City,Gansu Province,Zhangye734000,China)
Abstract:In order to study the relationship between the PRKAG3 gene polymorphism and slaughter performance,meat quality of 5 sheep breeds(Gansu alpine fine wool sheep,Small tail han sheep,Tibetan,Mongolian sheep and Tan-sheep which were fed in a typical farming mode of Gansu province) in Gansu province at the molecular level and to explore the possibility of improving the slaughter performance and quality of sheep meat by using PRKAG3 as candidate gene,the polymorphism of exon 4,5and introns 4,a total of 321 bp,of PRKAG3 gene was detected by PCR-SSCP in 5 sheep breeds,and the association between PRKAG3 gene polymorphism and slaughter performance,meat quality in aged 9 month were analyzed.The results showed:that B allele had a base transformation of A>G at the 2 689th bp in intron 4 formed AA,AB and BB genetypes.The gene homozygosity (Ho)were 0.67,0.69,0.76,0.69 and 0.59 respectively;the heterozygosity were 0.333 3,0.306 1,0.244 9,0.307 7 and 0.408 2,respectively;the effective number of alleles (Ne) were 1.62,1.66,1.69,1.48 and 1.79;the polymorphism information content (PIC) were 0.31,0.32,0.33,0.27 and 0.34,respectively.In addition to the Tibetan sheep other four sheep breeds on this loci in a Hardy-Weinberg equilibrium state by Chi-square test.Association analysis of the SNPs with meat quality traits was carried out.The result showed that the mutation loc of PRKAG3 gene was significantly associated (P<0.05) with meat water loss rate,genotype BB between individual′s body weight was significantly higher than AA type (P<0.05),Tan-sheep was very significant(P<0.01).The eye muscle area was significantly greater between a BB genotype and AA type (P<0.05).So,PRKAG3 gene can be used as a candidate gene for marker-assisted selection of sheep meat performance and meat quality.
Key words:Sheep;PCR-SSCP;PRKAG3 gene;Meat quality traits;Association analysis
doi:10.7668/hbnxb.2016.01.022
中图分类号:Q78;S858.03
文献标识码:A
文章编号:1000-7091(2016)01-0134-07
作者简介:王华(1990-),男,山东临沂人,在读硕士,主要从事动物遗传育种与繁殖研究。通讯作者:成述儒(1976-),男,甘肃张掖人,副教授,博士,硕士生导师,主要从事生物技术与动物育种研究。
基金项目:甘肃省农业生物技术研究与应用开发项目(GNSW-2012-26)
收稿日期:2015-11-23
