靶向S1PR3基因shRNA慢病毒表达载体构建及功能鉴定
2016-03-06王航黄浩蔡克银丁世芳
王航,黄浩,蔡克银,丁世芳
(1.广州军区武汉总医院心血管内科,湖北 武汉 430070;,2.广州军区武汉总医院干部病房二科,湖北 武汉 430070;3.深圳市合一康生物科技股份有限公司临床医学中心,广东 深圳 513000)
·论 著·
靶向S1PR3基因shRNA慢病毒表达载体构建及功能鉴定
王航1,2,黄浩3,蔡克银2,丁世芳1
(1.广州军区武汉总医院心血管内科,湖北 武汉 430070;,2.广州军区武汉总医院干部病房二科,湖北 武汉 430070;3.深圳市合一康生物科技股份有限公司临床医学中心,广东 深圳 513000)
目的 构建靶向小鼠S1PR3基因的shRNA慢病毒表达载体,并验证其对内皮祖细胞迁移能力的影响。方法依照shRNA设计原则,合成对应的shRNA序列,将其克隆到PHBLV载体中,使用三载体系统进行病毒包装,收集制备成功的病毒,并用荧光显微镜法测定病毒滴度,使用病毒感染EPC后,测定各组细胞中S1PR3蛋白表达情况,选择合适的病毒感染EPC后,测定其对EPC迁移能力的影响。结果成功将shRNA序列克隆到慢病毒表达载体PHBLV-U6-RFP,表达质粒与辅助质粒共转染293细胞后48 h就可以看到细胞中成功表达红色荧光。收集培养成功病毒感染小鼠EPC,可以不同程度干扰细胞中S1PR3蛋白表达,S1PR3蛋白表达受到抑制后,EPC的迁移能力明显减弱。结论我们成功构建了可以有效干扰S1PR3表达的慢病毒载体,并初步观察了其对EPC细胞的迁移能力的影响,为后续进一步调控S1PR3相关的细胞功能的研究奠定了基础。
慢病毒;1-磷酸鞘氨醇受体3;内皮祖细胞;细胞迁移
成年人体内血管结构相对稳定,生理情况下,仅在伤口愈合、组织再生或女性月经期出现新生血管形成,而病理情况下,比如肿瘤、心血管损伤后修复时会经历较长期的血管新生过程[1],1-磷酸鞘氨醇(Sphingosine-1-phosphate,S1P)及其受体信号通路在其中有重要作用。我们的前期研究中发现:S1P可以通过其3型受体(S1PR3)增强内皮组细胞(Endothelial precursor cells,EPCs)的迁移、血管生成能力[2],并成功构建了高表达S1PR3的慢病毒载体[3],为进一步研究S1PR3信号通路的作用模式,我们设计并制备了靶向S1PR3基因的特异性小发夹RNA(Short hairpin RNA,shRNA),构建了慢病毒表达载体,用于后续研究。
1 材料与方法
1.1 材料与试剂 载体PHBLV-U6-RFP、转染用LipofiterTM购自上海汉恒生物,胎牛血清、胰蛋白酶、DMEM、磷酸盐缓冲液(PBS)、大肠杆菌菌株DH5α购自美国Invitrogen公司,限制性内切酶、T4连接酶、DNAladder购自加拿大Fermentas公司,质粒DNA小,大量抽提试剂盒为北京康为世纪公司产品,凝胶回收试剂盒为美国Axygen公司产品,琼脂糖、琼脂粉为上海生工生物公司产品,包装细胞293T细胞株购自美国ATCC。
1.2 靶向S1PR3的干扰序列和引物设计 根据GenBank公布的基因序列,设计3条siRNA靶点序列及3对shRNA序列引物,所设计的siRNA序列针对靶基因的ORF区域,GC含量为30%~50%,并在目的片段上下游添加酶切位点BamHⅠ和EcoRⅠ。引物由上海锐赛生物科技公司合成,见表1。

表1 靶向S1PR3的siRNA序列和shRNA引物序列
1.3 慢病毒的构建 依照shRNA设计原则,合成对应的shRNA序列。PCR退火获得目的片段shRNA,具体条件:95℃,10 min;75℃,10 min;55℃,10 min;35℃,10 min;15℃,10 min;处理好的目的片段shRNA通过T4连接酶将其与BamHⅠ和EcoRⅠ双酶切后的载体pHBLV-U6-RFP连接,4℃过夜。连接产物转化感受态细胞DH5α,提取转化子,使用pHBLV载体通用引物,PCR鉴定。阳性产物经过上海桑尼生物技术有限公司测序确认。
1.4 慢病毒的包装 慢病毒包装使用三载体系统,制备慢病毒穿梭质粒及辅助包装原件载体质粒pSPAX2、pMD2G,三种质粒载体分别进行高纯度无内毒素抽提,共转染293T细胞,转染后6 h更换为完全培养基,培养48 h和72 h后收集培养细胞上清液,0.45µm滤器(Millpore公司)过滤,通过超离心浓缩病毒,浓缩后得到高滴度的慢病毒浓缩液。
1.5 慢病毒的滴度测定 荧光显微镜观察法:将生长状态良好的293T细胞消化计数后稀释为1×104/mL,接种于96孔板中,100µL每孔,为每个病毒准备6个孔,放入37℃、5%CO2的培养箱内培养。第二天,收集制备好的病毒浓缩液,10倍倍比稀释(10~3.3×10-2),将稀释好的病毒加入对应的96孔中。转染后72 h,可见细胞中有红色荧光,第五天,在显微镜下观察结果,RFP荧光细胞在10%~30%的孔计算病毒滴度。滴度(PFU/mL)=细胞数×百分比×MOI(1)×病毒稀释倍数×103。
1.6 慢病毒对EPC细胞表达S1PR3蛋白表达水平的影响 按照我们既往方法制备小鼠脾源性EPC[4],无菌条件下,取出小鼠脾脏,充分剪碎后,200目筛网过滤,密度梯度离心法分离,获取小鼠单核细胞,稀释为按4×106/mL后接种于经过纤连蛋白包被后的细胞培养板,加入DMEM/F-12培养液(添加20%优质胎牛血清、VEGF 10 ng/mL、青霉素100 U/mL、链霉素100 U/mL),置于细胞培养箱中诱导培养;48 h后PBS洗涤除去未贴壁细胞,继续培养,每3 d换液、传代。选择细胞融合度达50%的细胞,分别加入1µL目的或对照病毒液,同时加入终浓度为8µg/mL的Polybrene促进感染。收集培养的实验组、对照组,空白组细胞,PBS冲洗后收集、重悬,冰浴15 min,加入25µLNP-40,振荡10 s;离心15 min(14 000×g),收集离心后上清,用BAC蛋白质检测试剂盒定量,-70℃冰箱保存备用。用12%SDS-PAGE电泳(90 V,50 min;110 V,2 h),半干式电转移(1 mA/cm2,1 h),一抗浓度:抗小鼠S1PR3多抗(1:200),抗β-actin单抗(1:1 000),4℃过夜;二抗(1:4 000),37℃,2 h;ECL显色,X片曝光,洗片。
1.7 转染后EPC细胞迁移能力的影响 shRNA对EPCs迁移能力的影响:选择干扰效果较佳,对细胞损伤较小的shRNA-2作为实验组,阴性对照病毒感染正常EPCs为对照组,转染后的EPCs继续培养两周,并加入终浓度分别为10 ng/mL的S1P,共同培养48 h后将EPCs分别重悬,按2×105/孔悬浮于200 μL无血清培养液,加入Transwell小室(8.0 μm),继续培养16 h,弃去小室里的培养液,用PBS轻轻漂洗两次,无水乙醇固定10 s,PBS漂洗两次并用棉签轻柔地擦掉滤膜表面未迁移的细胞,PBS漂洗1次,1%结晶紫染色3 min,PBS漂洗3次,随机选择6个显微镜视野(×200)计数迁移细胞。
2 结果
2.1 重组成功的PHBLV-RFP-S1PR3测序结果 将PCR阳性克隆进行DNA测序,结果与设计DNA序列相符,表明重组质粒构建成功(见图1~图3)。
2.2 靶向S1PR3的shRNA慢病毒滴度测定 倍比稀释后依照显微镜观察结果测定慢病毒滴度。结果:对照病毒滴度为2×108PFU/mL(见图4),S1PR3 shRNA1滴度为1×108PFU/mL(见图5),S1PR3 shRNA2滴度为1×108PFU/mL(见图6),S1PR3 shRNA3滴度为2×108PFU/mL(见图7)。
2.3 shRNA慢病毒感染EPC后,各组细胞S1PR3蛋白表达情况 使用shRNA慢病毒感染EPC后,shRNA1、2、3均可以不同程度的抑制EPC中S1PR3蛋白表达(见图8),但是shRNA1、3对细胞损伤较大,选择shRNA-2进行后续实验。
2.4 慢病毒感染后EPC的迁移能力改变 使用干扰效果较佳,对细胞损伤较小的shRNA-2作为实验组感染EPC后,实验组EPC对S1P诱导后迁移能力明显下降(见图9)。
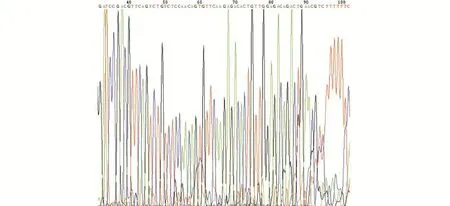
图1 重组质粒PHBLV-RFP-S1PR3-1测序结果
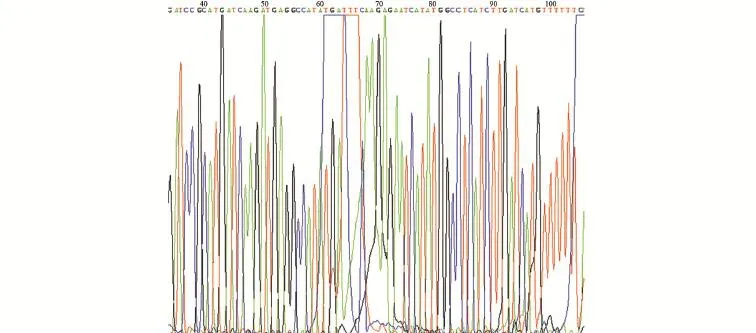
图2 重组质粒PHBLV-RFP-S1PR3-2测序结果
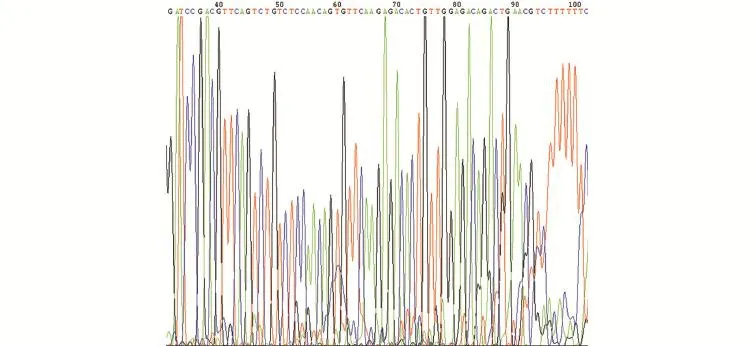
图3 重组质粒PHBLV-RFP-S1PR3-3测序结果
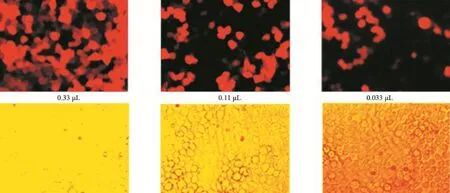
图4 对照组病毒滴度测定:选取0.033 μL病毒孔(×200)
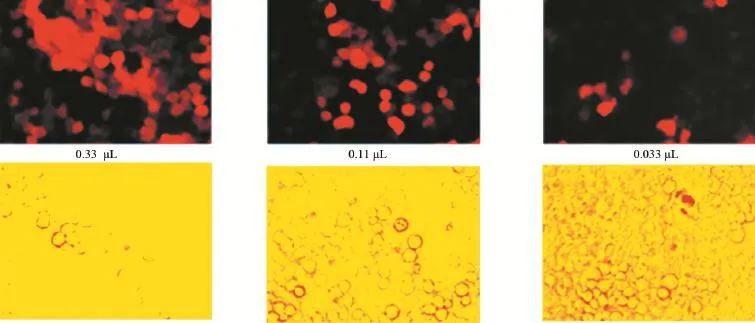
图5 重组S1PR3 shRNA1滴度测定(×200)
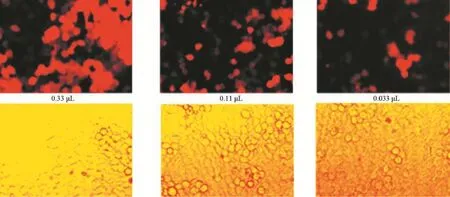
图6 重组S1PR3 shRNA2滴度测定(×200)
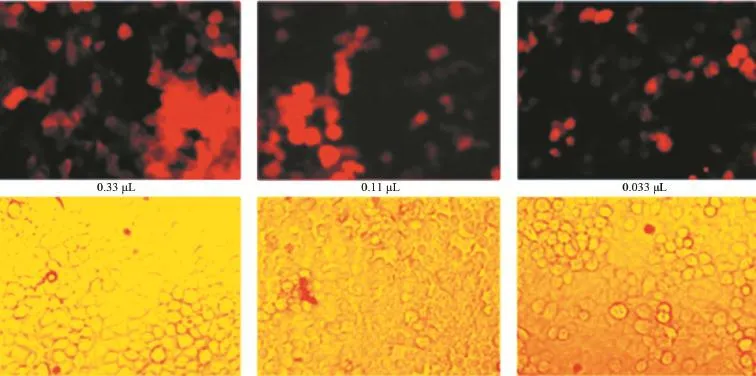
图7 重组S1PR3 shRNA3滴度测定(×200)
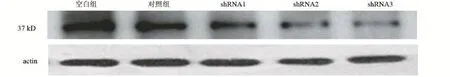
图8 重组病毒感染EPC后S1PR3蛋白表达情况
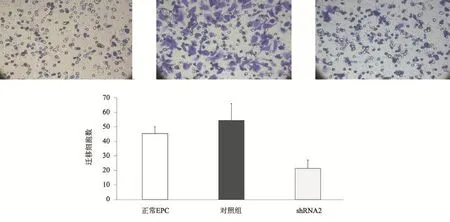
图9 重组病毒感染EPC后迁移能力改变(×200)
3 讨 论
EPC是一种特殊类型的骨髓祖细胞,包括了从血管母细胞到成熟ECs之间多个阶段的细胞,它能够进入血液循环,一定条件下可以增殖并分化为ECs,但并未表达成熟血管ECs表型。生理情况下,早期EPCs主要参修复血管内皮,而晚期EPCs增殖能力明显增强,在血管生成中发挥重要作用[5]。既往的许多基础和临床研究已经证实EPCs可以自主迁移至血管损伤的部位、分化为ECs,进而修复受损伤的内皮[6]。然而,病理情况下,比如PCI术后、肿瘤患者,体内EPC数量和功能的混乱,既是造成损伤难以痊愈,甚至是肿瘤发生发展的重要因素,因此,对于EPC功能的调控研究一直是临床的热点问题之一[7-8]。
由于EPCs体内受到多种因素影响,目前调控EPCs生物学功能的具体分子机制和参与血管损伤后修复的机制尚未阐明[9]。深入研究EPCs增殖、迁移等生物学功能的调控机理,找到影响EPCs增殖、迁移的关键分子,或者促进EPCs向损伤血管优势分布的措施,对血管损伤后良性再生修复、甚至抗肿瘤治疗都具有重要意义。
S1P是鞘磷脂代谢的中间产物之一,广泛存在于血液和多种细胞中,既可以作为第二信使传递多种生物学信号,又可以同细胞表面的多种特异性受体(S1PR1-5)结合,发挥作用[10]。血管损伤的病理过程中,S1PR3参与调节AS过程中损伤部位中性粒细胞和巨噬细胞的募集[11],促进小鼠胚胎纤维母细胞生长和增殖[12]。
前期研究中,我们制备了过表达S1PR3的EPC,结果发现EPC的增殖、迁移、血管生成等能力明显增强,而本次实验中,我们使用构建好的shRNA慢病毒抑制了EPC内的S1PR3表达,结果发现,同样给予S1P刺激后,低表达S1PR3的EPC迁移能力也被明显抑制了,说明EPC对于S1P诱导后的迁移能力,很大程度上同EPC上S1PR3的表达相关。同时也表明我们的靶向S1PR3基因的慢病毒构建成功。
随着技术的进步,多种基因工程载体被用于临床上信号通路的研究,慢病毒的宿主细胞广泛,细胞毒性小,又可以整合到宿主基因组中,实现长时间的表达,因此,本实验也选用了慢病毒载体构建shRNA来干扰S1PR3基因的表达。
总之,笔者构建了可以有效干扰S1PR3表达的慢病毒载体,并初步观察了其对EPC细胞的迁移能力的影响,为更深入研究S1PR3基因对EPC生物学功能打下了基础。
[1]Paauwe M,Heijkants RC,Oudt CH et al.Endoglin targeting inhibits tumor angiogenesis and metastatic spread in breast cancer[J].Oncogene,2016,25.[Epub ahead of print]
[2]Wang H,Cai KY,Li W,et al.Sphingosine-1-phosphate induces the migration and angiogenesis of epcs through the Akt signaling pathway via sphingosine-1-phosphate receptor 3/platelet-derived growth factor receptor-β[J].Cell Mol Biol Lett,2015,20(4):597-611.
[3]王航,蔡克银,黄浩.小鼠S1PR3慢病毒表达载体的构建及表达[J].海南医学,2015,18(26):2653-2656
[4]Wang H,Yin Y,Li W,et al.Over-expression of PDGFR-β promotes PDGF-induced proliferation,migration,and angiogenesis of EPCs through PI3K/Akt signaling pathway[J].PLoS One,2012,7(2): e30503.
[5]王航,黄浩,尹扬光,等.过表达血小板衍生生长因子受体β的小鼠内皮祖细胞有助于损伤后血管的再内皮化[J].中华心血管病杂志, 2014,42(3):214-218.
[6]Williams PA,Silva EA.The role of synthetic extracellular matrices in endothelial progenitor cell homing for treatment of vascular disease [J].Ann Biomed Eng,2015,43(10):2301-2313.
[7]Pezzoli G,Cavanna F,Cassani E,et al.Endothelial progenitor cells: Cardiovascular protection in Parkinson's disease?[J].Int J Cardiol, 2015,197:200-202.
[8]Kim J,Kim M,Jeong Y,et al.BMP9 induces cord blood-derived endothelial progenitor cell differentiation and ischemic neovascularization via ALK1[J].Arterioscler Thromb Vasc Biol,2015,35(9): 2020-2031.
[9]de la Puente P,Muz B,Azab F,et al.Cell trafficking of endothelial progenitor cells in tumor progression[J].Clin Cancer Res,2013,19 (13):3360-3368.
[10]Ramos-Perez WD,Fang V,Escalante-Alcalde D,et al.A map of the distribution of sphingosine 1-phosphate in the spleen[J].Nat Immunol,2015,16(12):1245-1252.
[11]Keul P,Lucke S,von Wnuck Lipinski K.Sphingosine-1-phosphate receptor 3 promotes recruitment of monocyte/macrophages in inflammation and atherosclerosis[J].Circ Res,2011,108(3):314-323.
[12]Ishii I,Ye X,Friedman B,et al.Marked perinatal lethality and cellu-Lar signaling deficits in mice null for the two sphingosine 1-phosphate(S1P)receptors,S1P(2)/LP(B2)/EDG-5 and S1P(3)/LP(B3)/ EDG-3.J Biol Chem,2002,277(28):25152-25159.
Construction and function identification of short hairpin RNA lentiviral vector targeting S1PR3.
WANG Hang1,2, HUANG Hao3,CAI Ke-yin2,DING Shi-fang1.1.Department of Cardiovasology,Wuhan General Hospital of Guangzhou Military,Wuhan 430070,Hubei,CHINA;2.Second Department of Geratology,Wuhan General Hospital of Guangzhou Military,Wuhan 430070,Hubei,CHINA;3.Clinical Medical Center,Shenzhen Hornetcorn Biotechnology Co.Ltd.,Shenzhen 513000,Guangdong,CHINA
ObjectiveTo construct the short hairpin RNA(shRNA)lentiviral vector targeting sphingosine-1-phosphate receptor 3(S1PR3)gene and then detect the effect of shRNA on the migration of endothelial precursor cells(EPCs).MethodsThree siRNA interference sequences targeting S1PR3 gene were designed,synthesized and cloned into the lentivirus vector respectively.Recombinant lentivirus and control were extracted from the 293T cells,and the viral titer was checked by observing the expression of red fluorescent protein.The lentivirus with the best interferine effect was detected by Western-blot.Transwell assay was used to detect the migration of EPCs.ResultsRecombinant lentivirus with a high title and efficient infection were obtained by the lentivirus vectors system PHBLV-U6-RFP.48 h after plasmids and helper plasmids were co-transfected to 293T cells,the expression of red fluorescent protein was observed.Mouse EPCS could be efficiently infected.The expressions of S1PR3 in EPCS were significantly reduced,and its migration ability was significantly inhibited.ConclusionThe recombinant shRNA lentivirus targeting the S1PR3 gene were constructed successfully,and the effect of shRNA on the migration of EPCs was observed,which lays the groundwork for subsequent study of the role of S1PR3 in the repair process after vascular endothelial injury.
Lentivirus;Sphingosine-1-phosphate receptor 3(S1PR3);Endothelial precursor cells(EPCs);Cell migration
R-332
A
1003—6350(2016)10—1721—06
10.3969/j.issn.1003-6350.2016.11.001
2016-01-31)
国家自然科学基金(编号:81300153)
丁世芳。E-mail:didigoe@163.com
