肺动脉平滑肌细胞上TMEM16A的表达及其阻滞剂对细胞增殖的作用
2016-03-06张锋庞玉生劳金泉
张锋,庞玉生,劳金泉
(广西医科大学第一附属医院儿科,广西 南宁 530021)
肺动脉平滑肌细胞上TMEM16A的表达及其阻滞剂对细胞增殖的作用
张锋,庞玉生,劳金泉
(广西医科大学第一附属医院儿科,广西 南宁 530021)
目的 研究TMEM16A在大鼠肺动脉平滑肌细胞(PASMCs)上的表达及其阻滞剂(T16Ainh-A01)对PASMCs增殖的作用。方法组织块贴壁法分离正常大鼠PASMCs,原代培养。光镜下观察细胞形态,细胞免疫化学和细胞免疫荧光进行鉴定。细胞免疫荧光检测TMEM16A在PASMCs上表达。原代培养的3~6代PASMCs分别在10 μmol/L T16Ainh-A01、20 μmol/L T16Ainh-A01和50 μmol/L T16Ainh-A01下培养24 h,用CCK-8法检测细胞增殖情况。结果倒置显微镜下PASMCs以长梭形为主,细胞核卵圆形,部分细胞重叠区域呈典型的“峰-谷”状结构。免疫学检测显示胞浆内与细胞长轴平行的肌丝被染成棕黄色,标记肌丝的红色荧光也与细胞长轴平行,标记细胞膜上的TMEM16A的绿色荧光可见表达,而细胞核不染色。CCK-8实验检测,相对于对照组,10 μmol/L T16Ainh-A01组细胞活力均数为(96.74±0.92)%,20 μmol/L T16Ainh-A01组均数为(92.21±1.25)%,50 μmol/L T16Ainh-A01组均数为(87.41±3.27)%,差异均具有统计学意义(P<0.01)。结论正常大鼠PASMCs表达TMEM16A;T16Ainh-A01可抑制PASMCs增殖,其抑制作用呈浓度依赖性;TMEM16A可能参与调控PASMCs增殖。
TMEM16A;肺动脉平滑肌细胞;阻滞剂;细胞增殖;原代培养
肺动脉高压(Pulmonary arterial hypertension,PAH)是一种与肺血管痉挛和肺血管重塑形成导致肺血管阻力持续增加密切相关的异常血流动力学疾病[1]。研究表明各种离子通道引起的膜电位变化调节着细胞增殖[2]。肺动脉中层的肺动脉平滑肌细胞(Pulmonary arterial smooth muscle cells,PASMCs)膜上的离子通道[如钙激活性氯离子通道(CaCC)]参与调控PAH的发生。近年来发现CaCC的分子基础是一种称为跨膜蛋白16A(Transmembrane protein 16A,TMEM16A)[3-5]的物质。有研究初步证实TMEM16A在PASMCs上的表达,并通过膜片钳实验记录到了可靠的IClCa[6]。其特异性阻滞剂(TMEM16A inhibitor,T16Ainh-A01)主要用于PASMCs的电生理活动[7-8]及Cajal细胞及胰腺癌等癌细胞增殖的研究[9],而对正常PASMCs增殖的作用尚未报道。因此本研究目的在于进一步探究TMEM16A在正常大鼠PASMCs上表达情况以及首次用T16Ainh-A01干预PASMCs,观察对细胞增殖的作用,为寻找PAH治疗靶点提供理论依据。
1 材料与方法
1.1 材料 180~220 g清洁级SD大鼠,6~7周龄,雄性SD大鼠(广西医科大学实验动物中心提供,许可证号:SCXK桂2009-0002),胎牛血清(FBS,澳洲)、高糖DMEM培养基、含0.1%EDTA胰酶和青霉素-链霉素溶液(Wisent公司),一抗α-actin(Santa公司),二抗羊抗鼠lgG(H+L)PE标记(SBA公司),一抗兔抗TMEM16A、二抗羊抗兔lgG FITC标记和T16Ainh-A01(Sigma公司),PBS磷酸盐、DMSO、DAPI溶液和4%多聚甲醛(Solarbio公司),Triton X-100(Biosharp公司),DAB试剂盒和羊血清(索莱宝公司),CCK-8试剂盒(Vazyme公司),普通倒置显微镜和荧光倒置显微镜(OLYMPUS公司),CO2细胞培养箱(Thermo公司),酶标仪(Bio-tek公司)等。
1.2 方法
1.2.1 PASMCs的提取 参照文献[10]并加以改进,置于4°C聚苯乙烯磺酸(PSS)液中在显微镜下小心分离肺动脉(第2~4分支肺动脉)。将已分离的肺动脉用眼科剪纵向剪开,内膜面朝上,用眼科弯镊背面来回刮几次以去除内膜,再将外膜面朝上,同样方法刮去外膜。然后漂洗3次肺动脉中膜,直到液体清亮,以减少其他细胞混入。将中膜转移至盛有0.5 mL的含10%胎牛血清的DMEM培养皿中,用眼科剪反复剪成约1 mm×1 mm的小组织块。用滴管将小组织块转移至25T的细胞培养瓶中,均匀滴放至瓶底,间距约5 mm。加入4 mL含10%胎牛血清的DMEM培养液,瓶底朝上,置于37℃、5%CO2的细胞培养箱中孵育约2 h。待小组织块干涸后,轻翻转培养瓶,让培养基慢慢浸润瓶底上的小组织块。然后继续静置培养箱内培养。
1.2.2 原代培养 前4~6 d不动培养瓶,以防止组织块漂浮,1周左右换液。待细胞从组织块周围游离爬出来并直至生长融合成片,此时用胰酶消化传代。传代后一般2~3 d更换培养基,提取和培养PASMCs时都是用含10%胎牛血清的DMEM培养液。采用生长状态较好的3~6代细胞进行后续试验。
1.2.3 PASMCs的鉴定 (1)细胞形态学鉴定:在倒置相差显微镜下观察提取PASMCs的形态;(2)细胞免疫化学鉴定:将第3代的PASMCs接种于24孔板内的盖玻片上,单层铺满后,收集细胞爬片。经清洗、固定后,用SP法进行α-actin免疫化学染色,其工作滴度是1:400,DAB试剂盒显色,苏木精复染,脱水、透明、中性树胶封片,镜下观察拍片;(3)细胞免疫荧光鉴定:用同样方法收集细胞爬片。经清洗、4%多聚甲醛固定、0.1%TritonX-100透化和10%山羊血清封闭后加入α-actin一抗4℃孵育过夜,工作浓度为1:100,再滴加lgG(H+L)-PE标记荧光二抗,工作浓度为1:400,DAPI(0.5 μg/mL)染核,最后盖玻片倒置于滴有甘油的载玻片上,荧光下拍片。
1.2.4 TMEM16A在PASMCs上表达的检测 免疫荧光法:参照文献[11]并加以改进,前面步骤同PASMCs免疫荧光鉴定。加入一抗兔抗TMEM16A,4℃孵育过夜,工作浓度为1:1,再滴加羊抗兔lgG FITC标记二抗,工作浓度为1:5 000,DAPI(0.5 μg/mL)染核,最后盖玻片倒置于滴有甘油的载玻片上,荧光下拍片。
1.2.5 实验分组 选用第3~6代生长良好的PASMCs进行实验。实验处理前换用无血清的DMEM继续培养24 h,使细胞周期同步化,再随机分成6组:对照组与10 μmol/L T16Ainh-A01组、对照组与20 μmol/L T16Ainh-A01组和对照组与50 μmol/L T16Ainh-A01组。
1.2.6 CCK-8法对PASMCs增殖的检测 每孔约5×103个细胞,将100 μL PASMCs接种至96孔板(边缘孔用PBS液填充),设置空白孔(无细胞)、对照孔(有细胞,不加药)和干预孔(有细胞,加不同浓度T16Ainh-A01),每孔设3个复孔。置于37°C、5%CO2培养箱过夜,第二天倒置显微镜观察基本贴壁。每孔换加入90 μL含10%FBS DMEM培养基和10 μL T16Ainh-A01 (最终浓度为10 μmol/L、20 μmol/L和50 μmol/L),孵育24 h后每孔加入10 μL的CCK-8液,37°C孵育1 h,用酶联免疫检测仪测定450 nm各孔的吸光度值(OD值)。结果分析:细胞活力%=(干预组OD-空白组OD)/ (对照组OD-空白组OD)×100%。实验重复7次。
1.3 统计学方法 应用SPSS16.0统计分析软件进行数据处理,计量数据以均数±标准差(±s)表示,两组均数比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 原代PASMCs的形态学鉴定 贴壁的小组织块4~6 d后逐渐有细胞从周围爬出来,以爬出点为中心放射性贴壁生长,细胞以长梭形为主,也有星形或不规则形,细胞核呈卵圆形(图1A)。8~12 d后细胞大部分铺满瓶底,重叠区域有典型的“峰-谷”生长特性(图1B)。
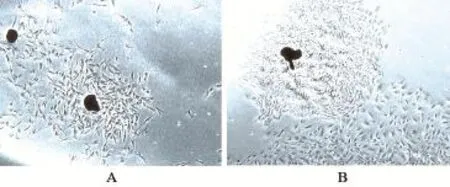
图1 原代PASMCs的形态学鉴定
2.2 原代PASMCs的细胞免疫化学和免疫荧光鉴定 α-actin的细胞免疫化学显示,细胞质有较多被染成棕黄色与细胞纵轴相平行的丝状物,即为平滑肌细胞特有的肌动蛋白(图2)。随机选择5个视野计300个细胞,见13个细胞没有着色,判断PASMCs的阳性率达95.66%。细胞免疫荧光显示胞浆内有与细胞纵轴平行的较强的红色荧光,呈丝状排列,而细胞核未染色,表明为目标细胞PASMCs(图3)。
2.3 TMEM16A在原代PASMCs上表达检测 免疫荧光显示标记PASMCs膜上的TMEM16A可见绿色荧光,较暗,胞核不染色,证实正常PASMCs上有TMEM16A的表达(图4)。
2.4 CCK-8细胞增殖抑制实验结果 试验发现随着T16Ainh-A01的浓度不断增高,所测OD值逐渐减小。相对对照组,10 μmol/L T16Ainh-A01组细胞活力均数为(96.74±0.92)%,差异有显著统计学意义(P<0.01);相对于对照组,20 μmol/L T16Ainh-A01组细胞活力均数为(92.21±1.25)%,差异有显著统计学意义(P<0.01);相对于对照组,50 μmol/L T16Ainh-A01组细胞活力均数为(87.41±3.27)%,差异有显著统计学意义(P<0.01),见图5。
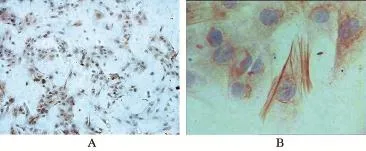
图2 PASMCs的免疫细胞化学鉴定
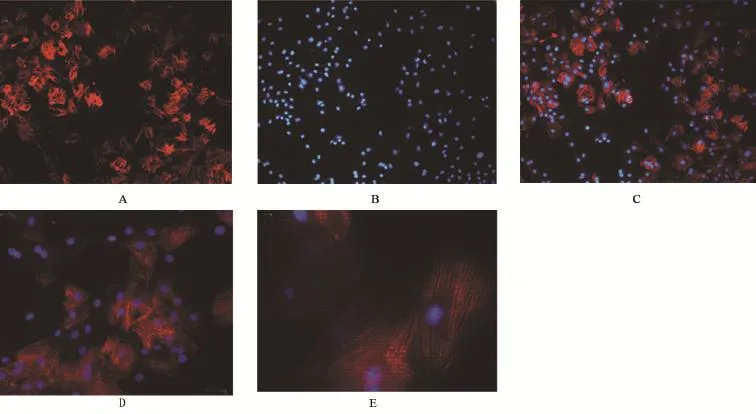
图3 PASMCs的细胞免疫荧光鉴定
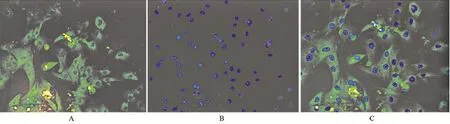
图4 TMEM16A在PASMCs上表达鉴定
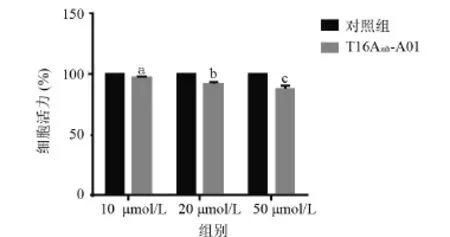
图5 不同浓度T16Ainh-A01干预后细胞活力的比较
3 讨 论
目前国内外原代PASMCs的获取常用的方法有两种,即酶消化法和组织块贴壁法。酶消化法虽然有操作简便、培养周期短、产量较高等优点,但所需消化酶价格昂贵、消化时间难以把握,最主要的细胞相对不纯影响后续实验。本研究采取组织块贴壁法获得PASMCs[12],用α-actin的细胞免疫化学鉴定发现,第三代的PASMCs纯度达到95.66%。说明该方法原代培养PASMCs仍然不可避免的混杂有其他细胞,但经过一两次消化传代后纯度就已较高,基本满足后续实验的需求。TMEM16A是一种跨膜蛋白,其表达广泛,多种细胞组织都有表达,参与多项病理生理活动。本研究应用细胞免疫荧光方法检测发现正常大鼠PASMCs胞膜上存在TMEM16A的表达,该结论也进一步证实了Manoury等[6]和Forrset等[11]的发现,即TMEM16A在PASMCs上其RNA和蛋白都有表达,可能参与相应疾病的发生发展。T16Ainh-A01是直接作用于TMEM16A的特异性阻滞剂,其对TMEM16A的Cl-电流能明显抑制并未干扰细胞信号通路上游的Ca2+信号,抑制IC50仅1 μmol/(Lol·L)左右,而相比于会产生抑制和刺激双重作用的尼氟灭酸(Niflumic acid,NFA),其只产生抑制效应[7-8,13]。本研究首次使用T16Ainh-A01干预PASMCs后发现其可抑制PASMCs的活力,从而抑制PASMCs增殖。进一步使用不同浓度的T16Ainh-A01时发现阻滞剂浓度与抑制作用呈明显的正相关,即呈明显的浓度依赖性。曾有研究发现运用膜片钳技术使用10 μmol/L T16Ainh-A01即可完全抑制细胞膜上的IClCa[7]。随着进一步深入研究,Mazzone等[9]采用膜片钳技术运用 10 μ mol/L T16Ainh-A01干预原代培养的Cajal细胞电流IClCa受到抑制,与此同时运用T16Ainh-A01干预原代培养的Cajal细胞和胰腺癌癌细胞,发现其能够抑制Cajalx细胞和胰腺癌癌细胞的增殖,这证实TMEM16A可能通过调控膜电流参与细胞增殖。同时也证实了慢性低氧性肺动脉高压和野百合碱介导的肺动脉高压的研究,TMEM16A的表达增高使得PASMCs上IClCa的密度和强度增加,可能致肺血管重塑和增强血管收缩张力,最终导致PAH的发生。而加入尼氟灭酸(NFA),PASMCs上IClCa的密度和强度都会减弱,且血管张力舒张明显[11]。然而,近来有一研究脑血管疾病的报道发现TMEM16A通过减少平滑肌细胞内周期蛋白D1和周期蛋白E的表达来使细胞停留在G0/G1时期,从而抑制细胞增殖,这也说明了在不同的细胞组织其可能发挥着不同的功能[14]。
综上所述,本研究证实了TMEM16A在PASMCs上的表达,T16Ainh-A01的作用也为TMEM16A在细胞周期中起的作用提供了强有力的证据。但该抑制剂只是针对离体正常的PASMCs,而在肺动脉高压下其对PASMCs作用以及TMEM6A是以怎样的信号通路调控细胞增殖及重塑的还需日后进一步研究。
[1]McLaughlin VV,Archer SL,Badesch DB,et al.ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians;American Thoracic Society,Inc.;and the Pulmonary HypertensionAssociation[J].JAm Coll Cardiol,2009,53(17):1573-1619.
[2]Blackiston DJ,McLaughlin KA,Levin M.Bioelectric controls of cell proliferation:ion channels,membrane voltage and the cell cycle[J]. Cell Cycle,2009,8(21):3527-3536.
[3]Yang YD,Cho H,Koo JY,et al.TMEM16A confers receptor-activated calcium-dependent chloride conductance[J].Nature,2008,455 (7217):1210-1215.
[4]Schroeder BC,Cheng T,Jan YN,et al.Expression cloning of TMEM16A as a calcium-activated chloride channel subunit[J].Cell, 2008,134(6):1019-1029.
[5]Caputo A,Caci E,Ferrera L,et al.TMEM16A,a membrane protein associated with calcium-dependent chloride channel activity[J].Science,2008,322(5901):590-594.
[6]Manoury B,Tamuleviciute A,Tammaro P.TMEM16A/anoctamin 1 protein mediates calcium-activated chloride currents in pulmonary arterial smooth muscle cells[J].J Physiol,2010,588(Pt 13):2305-2314.
[7]Namkung W,Phuan PW,Verkman AS.TMEM16A inhibitors reveal TMEM16A as a minor component of calcium-activated chloride channel conductance in airway and intestinal epithelial cells[J].J Biol Chem,2011,286(3):2365-2374.
[8]Davis AJ,Shi J,Pritchard HA,et al.Potent vasorelaxant activity of the TMEM16A inhibitor T16A(inh)-A01[J].Br J Pharmacol,2013, 168(3):773-784.
[9]Mazzone A,Eisenman ST,Strege PR,et al.Inhibition of cell proliferation by a selective inhibitor of the Ca(2+)-activated Cl(-)channel,Ano1 [J].Biochem Biophys Res Commun,2012,427(2):248-253.
[10]王静,戴爱国.原代大鼠肺动脉平滑肌细胞的提取和鉴定以及缺氧对其增殖的影响[J].中国呼吸与危重监护杂志,2012,11(2): 147-152.
[11]Forrest AS,Joyce TC,Huebner ML,et al.Increased TMEM16A-encoded calcium-activated chloride channel activity is associated with pulmonary hypertension[J].Am J Physiol Cell Physiol,2012,303 (12):C1229-1243.
[12]易斌,钱桂生,白莉,等.不同方法培养大鼠肺动脉平滑肌细胞的差异[J].第三军医大学学报,2005,27(24):2425-2427.
[13]Piper AS,Greenwood IA,Large WA.Dual effect of blocking agents on Ca2+-activated Cl(-)currents in rabbit pulmonary artery smooth muscle cells[J].J Physiol,2002,539(Pt 1):119-131.
[14]Wang M,Yang H,Zheng LY,et al.Downregulation of TMEM16A calcium-activated chloride channel contributes to cerebrovascular remodeling during hypertension by promoting basilar smooth muscle cell proliferation[J].Circulation,2012,125(5):697-707.
Expression of TMEM16A in pulmonary arterial smooth muscle cells and effect on cell proliferation by a selective TMEM16A inhibitor.
ZHANG Feng,PANG Yu-sheng,LAO Jin-quan.Department of Pediatrics,the First Affiliated Hospital of Guangxi Medical University,Nanning 530021,Guangxi,CHINA
ObjectiveTo explore the expression of TMEM16A in rat pulmonary arterial hypertension (PASMCs)and effect of a TMEM16A inhibitor(T16Ainh-A01)on cell proliferation.MethodsTissue block anchorage was employed for the primary culture of rat PASMCs.Under light microscope,cell morphology was observed and identified by immunocytochemistry and immunofluorescence.The expression of TMEM16A in PASMCs was detected by immunofluorescence.The 3~6 passages of primary cultured PASMCs were respectively exposed to 10 μmol/L T16Ainh-A01,20 μmol/L T16Ainh-A01 and 50 μmol/L T16Ainh-A01 for 24 hours.Cell proliferation was detected by cell counting kit-8(CCK-8)assay.ResultsPASMCs tended to be long spindle,nuclear oval,and partial overlapping regions of the cells grew in a typical"peak-valley"mode under light microscope.Immunology results showed that the filaments in cytoplasm paralleled to cell long axis were stained brownish yellow and the red fluorescent marked filament paralleled to cell long axis were also showed.Meanwhile,TMEM16A marked with green fluorescence were visible,and the nuclear were non-staining.In CCK-8 assay,compared to control group,mean cell viability of 10 μmol/L,20 μmol/L, 50 μmol/L T16Ainh-A01 group was(96.74±0.92)%,(92.21±1.25)%,(87.41±3.27)%,respectively,and the differences were statistically significant(P<0.01).ConclusionTMEM16A were exactly expressed in normal PASMCs.T16Ainh-A01 could inhibit the proliferation of PASMCs,and its inhibitory effect was concentration-dependent.TMEM16A may regulate PASMCs proliferation.
TMEM16A;Pulmonary arterial smooth muscle cells;Inhibitor;Cell proliferation;Primary culture
R-332
A
1003—6350(2016)11—1727—04
10.3969/j.issn.1003-6350.2016.11.002
2016-03-02)
国家自然科学基金(编号:81160040);广西自然科学基金(编号:2013GXNSFAA019177)
庞玉生。E-mail:pangyush@163.com
