螺旋藻多糖对阿尔茨海默病模型小鼠脑线粒体氧化应激保护
2016-03-06林智君陈煜森郑选梅尹小健刘洲贾真赵江浩赵斌
林智君,陈煜森,郑选梅,尹小健,刘洲,贾真,赵江浩,赵斌
(1.广东医学院附属医院神经内科,广东 湛江 524001;2.岭南师范学院体育科学学院,广东 湛江 524048)
螺旋藻多糖对阿尔茨海默病模型小鼠脑线粒体氧化应激保护
林智君1,陈煜森1,郑选梅2,尹小健1,刘洲1,贾真1,赵江浩1,赵斌1
(1.广东医学院附属医院神经内科,广东 湛江 524001;2.岭南师范学院体育科学学院,广东 湛江 524048)
目的 探索螺旋藻多糖对D-半乳糖联合亚硝酸钠诱导的阿尔茨海默病(AD)模型小鼠脑线粒体损伤的抗氧化保护作用。方法小鼠腹腔注射D-半乳糖120 mg/kg和亚硝酸钠100 mg/kg制备AD模型。将40只小鼠按数字编号随机分为正常组(C组)、模型组(M组)以及3个剂量实验组,每组8只,3个剂量实验组分别给予螺旋藻多糖灌胃低剂量(El组)6.7 mg·kg-1·d-1,中剂量(Em组)67.0 mg·kg-1·d-1,高剂量(Eh组)134.0 mg·kg-1·d-1,连续8周,在给药第8周后,进行Morris水迷宫实验和生化指标测试。结果与M组相比,Em组、Eh组120 S内跨越平台的次数和在目标象限的探索时间均明显增加(P<0.05);小鼠脑部β淀粉样蛋白(Aβ1~42)含量减少,依次是M组>El组>Em组>C组>Eh组。氧化应激指标:与M组相比,锰超氧化物歧化酶(Mn-SOD)活性均有提高(P<0.05),依次是C组(64.22±22.31)Um/mg>Eh组(58.36±21.30)Um/mg>Em组(56.58±15.66)Um/mg>E1组(55.32±21.25)Um/mg>M组(42.68±11.58)Um/mg;活性氧(NOS)含量Eh组(30.70±4.68)mmol/L显著下降(P<0.05),丙二醛(MDA)活性Em、Eh组[(35.55±7.97)nmol/mg、(30.51±8.74)nmol/mg]显著下降;与E1组相比,Eh组抗氧化效果最好。结论螺旋藻多糖对阿尔茨海默病模型小鼠脑线粒体氧化应激有保护作用,是脑线粒体营养素,高剂量效果最佳。
脑线粒体;螺旋藻多糖;阿尔茨海默病;氧化应激
β淀粉样蛋白(Aβ)沉积和神经元纤维缠结以及突触和神经元的缺失是阿尔茨海默病(Alzheimer disease,AD)的主要病理特征,主要集中在大脑皮质和海马,而且Aβ在本病形成的过程中起到了重要作用[1-2]。Aβ含有40~43个氨基酸残基的多肽,具有神经毒性。线粒体是细胞有氧呼吸的主要细胞器,是细胞的动力工厂,线粒体提供细胞生命活动所需80%以上能量,线粒体作为细胞的能量供应站,供给神经元几乎全部能量需求,研究表明AD患者体内均存在线粒体功能和线粒体结构的异常导致线粒体损伤。同时线粒体损伤能诱导自由基的产生和氧化应激,最终导致神经元凋亡。刘健康教授[3]把这些能促进线粒体生成并改善或者修复线粒体功能的天然产物称为线粒体营养素,近年的研究提示线粒体是AD防治的新思路、新靶点。因此,寻找修复脑线粒体损伤的营养素对当前研究AD的防治方法具有重要作用。本文就以螺旋藻多糖对阿尔茨海默病模型小鼠脑线粒体氧化应激保护展开分析。
1 材料与方法
1.1 实验动物分组与造模 清洁级昆明小鼠,4周龄,体质量(40.1±4.3)g,雄性,由广东医学院实验动物中心提供(合格证号:44006400000035),在自由摄食、饮水环境中适应3 d后,用于实验。将40只小鼠随机分5组:正常组、模型组以及3个剂量实验组分别为低剂量、中剂量、高剂量,各8只。除正常组以外,各组小鼠每天腹腔注射D-半乳糖120 mg/kg和亚硝酸钠100 mg/kg,连续8周,制备AD小鼠模型。
1.2 药物制备与给药 螺旋藻多糖提取[4-5]螺旋藻干粉冻融、破壁、抽提取后离心去残渣,上清液采用三氯乙酸沉淀去蛋白,用无水乙醇将上清液析出多糖淀,再用有机溶剂洗涤沉淀物,真空干燥得螺旋藻多糖粉末。正常组(腹腔注射同体积生理盐水),模型组(灌胃给予同体积生理盐水)和低中、高3个剂量实验组(灌胃同体积的螺旋藻多糖溶液(6.7 mg·kg-1·d-1,67.0 mg·kg-1·d-1,134.0 mg·kg-1·d-1),于造模当天的每天下午4点开始灌胃给药,连续8周(El组和Eh组实验中各死1只)。
1.3 行为学测试 在实验的第8周结束后采用Morris水迷宫检测各组小鼠定位航行和空间探索行为能力。定位航行实验:将小鼠从4个标记的入水点依次朝向池壁轻轻放入水中记录小鼠寻找到并爬上平台所用时间(120 s内),即逃避潜伏期。空间探索实验:撤除平台,将小鼠放入水池中,记录小鼠在穿越平台的次数(120 s)。
1.4 小鼠脑线粒体样本组织制备 根据朱宏亮文献[6],将小鼠麻醉后断头处死,取脑组织(海马与皮质)加入分离介质匀浆(测定Aβ1~42含量);取部分脑组织匀浆液低温离心,取上清液低温离心弃上清,加入缓冲液,制成脑组织线粒体悬液。测定线粒体NOS,Mn-SOD,MDA酶活性。
1.5 统计学方法 应用SPSS17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间两两比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 螺旋藻多糖对小鼠学习记忆能力的影响 与M组比较,C、Em、Eh组潜伏期显著缩短,跨越平台次数显著增多(P<0.05);,与E1组相比,Em组潜伏期显著缩短(P<0.05);Eh组潜伏期显著缩短,跨越平台次数显著增多(P<0.05),见表1。
表1 对小鼠学习记忆能力的影响(±s)
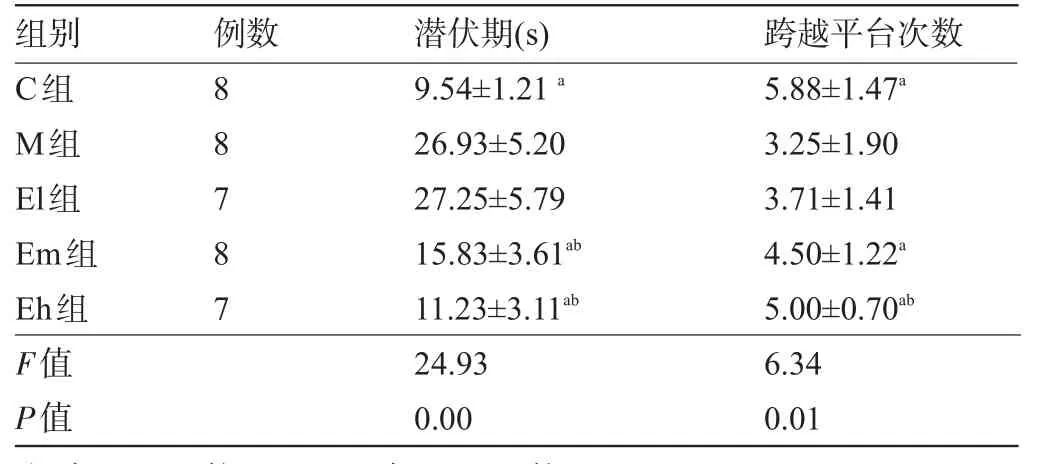
表1 对小鼠学习记忆能力的影响(±s)
注:与M组比较,aP<0.05;与E1组比较,bP<0.05。
组别 例数 潜伏期(s)跨越平台次数C组M组El组Em组Eh组F值P值8 8 7 8 7 9.54±1.21a26.93±5.20 27.25±5.79 15.83±3.61ab11.23±3.11ab24.93 0.00 5.88±1.47a3.25±1.90 3.71±1.41 4.50±1.22a5.00±0.70ab6.34 0.01
2.2 螺旋藻多糖对小鼠脑线粒体的Aβ1~42含量变化 与M组比较,C、Eh组脑线粒体Aβ1~42含量显著降低(P<0.05);其他组间差异无统计学意义(P>0.05),见图1。
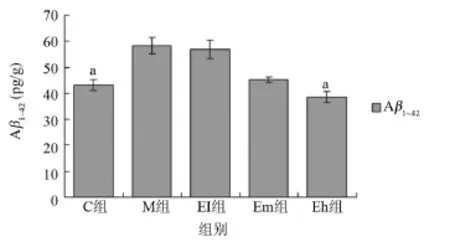
图1 各组小鼠脑线粒体Aβ1~42含量变化
2.3 螺旋藻多糖对小鼠脑线粒体氧化应激指标影响 与M组相比较,C组NOS,Mn-SOD,MDA差异有统计学意义(P<0.05);E1组Mn-SOD酶活性显著上升,差异有统计学意义(P<0.05);Em组Mn-SOD,MDA差异有统计学意义(P<0.05);Eh组NOS,Mn-SOD,MDA差异有统计学意义(P<0.05);与E1组比较,Eh组MDA显著下降,差异有统计学意义(P<0.05);其他组间差异无统计学意义,见表2。
表2 各组小鼠脑线粒体NOS、Mn-SOD、MDA的含量(±s)
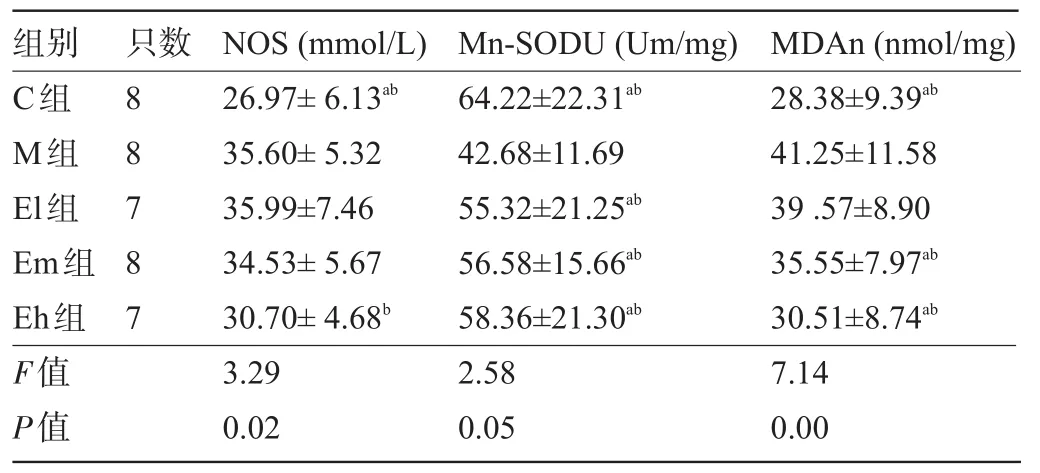
表2 各组小鼠脑线粒体NOS、Mn-SOD、MDA的含量(±s)
注:与M组比较,aP<0.05;与E1组比较,bP<0.05。
组别 只数NOS(mmol/L)Mn-SODU(Um/mg)MDAn(nmol/mg) C组M组El组Em组Eh组F值P值8 8 7 8 7 26.97±6.13ab35.60±5.32 35.99±7.46 34.53±5.67 30.70±4.68b3.29 0.02 64.22±22.31ab42.68±11.69 55.32±21.25ab56.58±15.66ab58.36±21.30ab2.58 0.05 28.38±9.39ab41.25±11.58 39.57±8.90 35.55±7.97ab30.51±8.74ab7.14 0.00
3 讨 论
AD是进行性神经退变性疾病,目前病因尚未明确,其发病率随着年龄的增长而上升[7],其主要病理特征是脑神经元细胞内Aβ沉淀[8]。研究发现脑内Aβ的异常沉积导引起神经系统功能障碍,表现出明显的神经毒性,可引起膜脂质过氧化和通透性增加,诱发钙离子内流和升高钙离子对各种刺激的反应,最终导致神经细胞凋亡。此外,Aβ还可增强或放大各种伤害性刺激,产生间接神经毒性,会引起脑细胞氧化应激反应,破坏脑细胞内钙稳态,激活胶质细胞,产生炎症物质从而诱导脑细胞凋亡等。研究表明Aβ从脑细胞内特别是在内质网和高尔基体中产生,然后会逐渐在这些部位堆积,最后导致线粒体结构损伤和功能障碍[9-12]。自由基是导致线粒体功能损伤的直接原因,正常情况下自由基的产生和清除保持动态平衡,然而,线粒体结构和功能损伤打破了这种平衡,使大量自由基堆积,而过多的自由基或抗氧化物质减少又可与线粒体膜脂蛋白相互作用进一步加重线粒体和细胞的损伤。本实验结果显示M组的Aβ1~42含量都高于其他4组,而且除E1组以外其他三组(C、Em、Eh)与M组比较差异均有统计学意义(P<0.05),再一步证明本实验的模型是成功的,同时也表明螺旋藻多糖对清除Aβ的堆积和沉淀有显著作用。
脑组织是人体内氧负荷最大的器官之一,尽管人脑仅大约总重量的3%,却消耗机体20%的氧,而且脑部的糖代谢、呼吸代谢、不饱和脂肪酸组成脑神经元的膜结构,以及反应铁离子较机体其他组织都高,这使得人体脑组织更容易受到氧化应激的损伤,以及有一些抗氧化物质不容易透过血脑屏障,因而也使得脑组织对氧化应激特别敏感。线粒体是体内生成脑细胞内活性氧(ROS)的主要场所,研究已证实Aβ可以导致氧化应激及ROS生成增加[13],人体正常情况下线粒体在氧化磷酸化的过程中也会产生少量ROS,但在AD患者脑神经元细胞内因Aβ的沉积,ROS会大量生产,就会产生大量的脂质过氧化产物MDA,而体内重要的抗氧化酶如Mn-SOD清除能力下降,当机体自由基增多,超过了机体的清除能力,使得氧自由基的产生和抗氧化酶是处于一种动态失衡状态,从而破坏细胞膜的结构,最后导致脑线粒体损伤。而本实验结果显示Eh的NOS含量低于M组(P<0.05),而且El、Em组也有下降趋势,但差异无统计学意义,而从Mn-SOD、MDA的实验数据表明,3个实验组抗氧化能力从强到弱依次是Eh组>Em组>El组,其中Eh组甚至逼近C组,表明服用螺旋藻多糖后,小鼠脑内线粒体Mn-SOD活性增加,而MDA、NOS产物下降。从结果来看螺旋藻多糖AD小鼠的脑线粒体抗氧化性,清除自由基效果较好,其中高剂量组的效果最好,从而对小鼠的皮质和海马细胞起到保护作用。说明服用螺旋藻多糖可以提高脑组织中某些抗氧化酶的活性,降低脂质过氧化产物对细胞膜的毒性效应,从而保护因神经毒性以及自由基产物损伤的脑线粒体损伤,脑部线粒的功能得到一定的修复。
螺旋藻是营养全面、均衡的生物,是一种极具开发潜力的水生生物资源,被誉为21世纪最理想的绿色食品。螺旋藻含有多种生物活性,可促进细胞生长,提高免疫力,抗损伤、抗辐射、抗衰老、抗疲劳,对核酸内切酶和DNA修复合成有增强作用。本实验AD小鼠服用不同剂量的的螺旋藻多糖,而且通过自身所含抗氧化物和提高机体Mn-SOD活性和降低MDA含量,达到减弱脂质过氧化反应有效清除自由基来延缓机体衰老,减少Aβ对脑的神经毒性的效果,而且是高剂量的效果最佳。因此,螺旋藻多糖是作为抗氧化性获得天然活性抗氧化剂的潜在宝贵资源,是AD脑线粒体的营养素,被誉为微型绿色功能型营养宝库;同时本实验提示利用线粒体作为药物运载的靶点,修复线粒体损伤以及人为调整线粒体功能是治疗AD的关键所在。
[1]赵美顺,陈敬荣,杨红.β淀粉样蛋白神经毒性与线粒体功能异常研究进展[J].广东药学学报,2012,28(6):599-692.
[2] Unnomura A,Tamaoki T,Tanaka K,et al.Intraneuronal amyloid of Alzheimer disease[J].Neurobill Dis,2010,37(3):731-737
[3]王逊,龙建纲,刘健康.运动和营养素的细胞内作用靶点——线粒体:阿尔茨海默病防治的新思路[J].体育科研,2013,34(6):49-53.
[4]庞辉,汤桂芳,玉艳红.螺旋藻多糖对大鼠肝脏线粒体氧化损伤的保护作用[J].广东医学,2006,27(12):1786-1787.
[5]杜玲,扈瑞平,敖长金,等.螺旋藻多糖活性炭脱色方法的研究[J].饲料工业,2010,31(8):34-36.
[6]朱宏亮,万立华.小鼠脑组织细胞色素C氧化酶活性、线粒体细胞色素含量与年龄关系[J].重庆医科大学学报,2012.37(12): 1041-1043.
[7] 廖珏,董雯.多奈哌齐联合维拉帕米对阿尔茨海默病模型大鼠学习记忆功能的保护作用[J].四川生理科学杂志,2012,34(2):58-60.
[8]Blennow K,de Leon MJ,Zetterberg H.Alzheimer's disease[J].Lancet,2006,368(9533):387-403.
[9]高欣,唐希灿.神经退行性疾病的早期信号:线粒体功能障碍[J].生命科学,2006,18(2):138-144.
[10]Chan PH.Mitochondria and neuronal death survival signaling pathways in cerebral ischemia[J].Neurochem Research,2004,29(11): 1943-1949.
[11]Maria M,Anekonda TS,Henson E,et al.Mitochondria are a direct site of Aβaccumulation in Alzheimer's disease neurons:implications for free radical generation and oxidative damage in disease progression[J].Human Mol Genetics,2006,15(9):1437-1449.
[12]Sandra MC,Isabel S,Russell HS,et al.Mitochondria dysfunction of Alzheimer's disease cybrids enhances Aβtoxicity[J].Neuro Chem, 2004,89(6):1417-1426.
[13]Shacka JJ,Roth KA,Zhang.The autophagy-Iysosomal degradation phathway:role in neurodegenerative disease and therapy[J].Front Biosci,2008,13(2):718-736
Protective effect of spirulina polysaccharide against cerebral mitochondrial oxidative stress in Alzheimer's disease mice model.
LIN Zhi-jun1,CHEN Yu-sen1,ZHENG Xuan-mei2,YIN Xiao-jian1,LIU Zhou1,JIA Zhen1,ZHAO Jiang-hao1,ZHAO Bin1.1.Department of Neurology,the Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,Guangdong,CHINA;2.College of Physical Education,Lingnan Normal University,Zhanjiang 524048,Guangdong, CHINA
ObjectiveTo study the protective effect of spirulina polysaccharide against cerebral mitochondrial oxidative stress induced by D-galactose and sodium nitrite in Alzheimer's disease(AD)mice model.MethodsA total of 40 mice were randomly divided into the normal group(C),model group(M),and other three experimental groups(spirulina polysaccharide,El group of 6.7 mg·kg-1·d-1,Em group of 67.0 mg·kg-1·d-1,and Eh group of 134.0 mg·kg-1·d-1,8 weeks), with 8 mice in each group.The model group and three experimental groups were injected with D-galactose 120 mg/kg and sodium nitrite 100 mg/kg for AD model.Morris water maze(MWM)experiment and Biochemical index test were performed after 8 weeks.ResultsCompared with group M,the number of crossed platform in 120 s and target exploration time in Em group and Eh group were significantly increased(P<0.05);While the Aβ1~42content in brain were decreased with the order:M>El>Em>C>Eh.Compared with group M,the activity of manganese superoxide dismutase(MnSOD) were improved with the order:C[(64.22±22.31)Um/mg]>Eh[(58.36±21.30)Um/mg]>Em[(56.58±15.66)Um/mg]>E1[(55.32±21.25)Um/mg]>M[(42.68±11.58)Um/mg].The activities of reactive oxygen species(ROS)in Eh group [30.70±4.68 mmol/L]and Malondialdehyde(MDA)in Em group[(35.55±7.97)nmol/mg]and Eh group[(30.51±8.74)nmol/mg] were significantly decreased(P<0.05).Compared with El group,Eh group had the best protective effect against oxidative stress.ConclusionSpirulina polysaccharide can protect AD model mice from the damage of cerebral mitochondrial oxidative stress,which is the nutrients of cerebral mitochondria,and high dose of spirulina polysaccharide has the best protective effect.
Cerebral mitochondria;Spirulina polysaccharide;Alzheimer's disease;Oxidative stress
R-332
A
1003—6350(2016)11—1731—03
10.3969/j.issn.1003-6350.2016.11.003
2016-01-05)
国家自然科学基金(编号:81400986);广东省自然科学基金(编号:2014A030313541);广东省湛江市科技攻关项目(编号:2014B01201)
陈煜森。E-mail:chenyusen925@163.com
