CXCL16缺失缓解STZ诱导的糖尿病小鼠的肾脏病变*
2016-03-05赵乐萍金雷钢施立华张赛赛潘薛波林灼锋龚方华
赵乐萍, 金雷钢, 施立华, 张赛赛, 潘薛波, 林灼锋, 龚方华△
(温州医科大学1附属乐清医院,2药学院,浙江 温州 325035)
CXCL16缺失缓解STZ诱导的糖尿病小鼠的肾脏病变*
赵乐萍1,金雷钢2,施立华2,张赛赛2,潘薛波2,林灼锋2,龚方华2△
(温州医科大学1附属乐清医院,2药学院,浙江 温州 325035)
[摘要]目的: 探索CXCL16基因缺失对链脲佐菌素(STZ)引发的糖尿病小鼠肾脏病变的影响。方法: 选取8周龄雄性C57BL/6JCXCL16基因缺失(C16 KO)小鼠,以及相同年龄及背景的野生型(WT)小鼠,采用STZ诱导的方式,建立糖尿病小鼠模型,观察CXCL16基因缺失对糖尿病肾病发生发展的影响。结果: 在糖尿病病变方面,与STZ处理的WT小鼠相比,STZ诱导C16 KO糖尿病小鼠的空腹血糖显著降低,并且其葡萄糖耐受能力得到显著改善。在糖尿病引发的肾脏病变方面,STZ处理后,C16 KO糖尿病小鼠的尿蛋白量显著低于WT糖尿病小鼠,此外,C16 KO糖尿病小鼠的肾小球损伤也明显低于WT糖尿病小鼠。与此同时,与WT糖尿病小鼠相比,C16 KO糖尿病小鼠肾脏组织活性氧簇(ROS)、丙二醛(MDA)、氧化低密度脂蛋白(ox-LDL)水平及凝集素样氧化低密度脂蛋白受体 1(Lox-1)的mRNA表达水平均显著下调。此外,在STZ处理后,C16 KO糖尿病小鼠肾组织中的巨噬细胞移动抑制因子(MIF)、炎症因子TNF-α 和IL-6以及黏附因子ICAM-1和CXCL1的mRNA表达水平均显著低于WT糖尿病小鼠。结论:CXCL16基因缺失能显著抑制STZ诱导的糖尿病小鼠肾脏病变。
[关键词]CXCL16基因; 糖尿病肾病; 基因缺失
糖尿病(diabetes mellitus,DM)是一种威胁全人类健康的疾病,是当今医学界的3大顽症之一,其引发的各种并发症是导致老年人群致残及致死的最主要原因。糖尿病性肾病(diabetic nephropathy,DN) 是糖尿病患者合并有肾小球硬化、肾动脉硬化及肾盂肾炎的合称,是糖尿病的主要并发症之一,也是糖尿病的重要致死原因之一。早期的研究表明,糖尿病性肾病的发病率占糖尿病患者的30% 以上,发病年龄以40岁以上者较为显著,发病高峰在糖尿病后15年左右。目前,多数专家认为该病的发病进展阶段包括:(1) 肾脏肥大和高滤过状态;(2) 正常蛋白尿; (3)早期DN;(4) 显性DN;(5) 肾衰竭。由于该病起病隐匿,易被漏诊或误诊而延误治疗,且其预后恶劣,患者多死于尿毒症,临床尚无特效治疗方法[1]。因此,DN的早期诊断与治疗,显得尤为重要。目前,DN的诊断主要根据临床症状的表现(如水肿、皮肤黏膜苍白、视物模糊、血压升高等)和实验室的检查(其中包括蛋白尿、肾功能等)来确定[2]。然而,这些诊断均未能及时反映DN病情发生发展的状况。此外,有研究认为,遗传易感性及高血糖(环境因素)是DN发生的启动因素,它们间的相互作用导致DN的发生与发展[3]。但由于DN的病因和发病机制相当复杂,至今尚有许多问题未能完全阐明。因此,探索新型的生物标记物对探索与DN病情发生发展相关的新型标记,对监测和预警DN的发生发展以及探索其具体的发病机制均具有重要的临床价值和意义。
趋化因子CXCL16是一个跨膜分子,并具有受体的功能被命名为磷脂酰丝氨酸和氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)的清道夫受体[4]。趋化因子CXCL16参与炎症和免疫应答过程[5]。早期的研究发现,CXCL16在包括冠心病(coronary heart disease,CHD)、慢性肾脏病(chronic kidney disease,CKD)等多种疾病的发病过程中扮演着重要的角色[6-7],CHD和CKD是糖尿病的2个主要并发症。因此,CXCL16是否直接参与调节糖尿病及其相关并发症的发生发展还有待进一步深入研究。本文采用CXCL16 基因敲除 (CXCL16 gene knockout,C16 KO)小鼠糖尿病模型,探索CXCL16基因缺失对DN发生发展的影响。
材料和方法
1动物与材料
1.1动物C16 KO小鼠由首都医科大学安贞医院杜杰教授惠送。C57BL/6J野生型(wild- type,WT)小鼠由北京维通利华实验技术有限公司提供。为消除C16 KO与WT小鼠的遗传差异,C16 KO与野生型WT小鼠进行杂交,经过5~6代的杂交筛选,获得具有相同遗传背景的C16 KO与WT小鼠进行实验研究。所有小鼠均饲养在温州医科大学SPF级别的动物实验中心。
1.2材料血糖试纸购于Roche;尿蛋白、甘油三酯、胆固醇生化试剂盒购于南京建成生物工程研究所;苏木素伊红(HE)染色试剂盒购于碧云天生物技术公司;链脲佐菌素(streptozocin,STZ)和活性氧簇(reactive oxygen species,ROS)的荧光检测试剂二氢乙啶(dihydroethidium,DHE)购于Sigma;丙二醛(malondialdehyde,MDA)检测试剂盒购于碧云天生物技术公司;ox-LDL ELISA Kit购于联世生物科技有限公司;抽提小鼠肾脏总RNA的TRIzol试剂、cDNA的逆转录试剂盒及相关引物购自Invitrogen。
2方法
2.1动物处理将8~9周龄雄性C16 KO随机分成2组,一组给予45 mg/kg的STZ进行腹腔注射,另外一组给予安慰剂处理作为对照组。同时取年龄相同的WT雄性小鼠,随机分成2组后分别给予同样剂量的STZ及安慰剂进行处理。STZ注射3 d后,空腹血糖高于16.7 mmol/L即确定为糖尿病。本实验中,成功构建C16 KO小鼠DN模型8只,WT小鼠DN模型成功7只。STZ注射后,每周检测小鼠体重变化状况,在第12周检测各组小鼠的空腹血糖值、24 h尿蛋白量之后处死动物、收集血样及肾脏组织,采用迈瑞全自动生化分析仪检测血清中的甘油三酯和总胆固醇水平,观察肾脏损伤状况。
2.2静脉葡萄糖耐量试验(intravenous glucose tole-rance test,IGTT)在STZ注射7周后进行,将上述4组动物在前1天下午5点禁食前称重,禁食至次日上午8时,按2 g/kg的剂量腹腔注射葡萄糖,分别检测0、10、30、60和120 min的血糖值。
2.3HE染色将各组小鼠肾脏通过甲醛固定后进行石蜡包埋,切片,采用HE染色法进行肾脏组织染色,观察肾脏形态学的变化。
2.4ROS的DHE染色将各组小鼠的组织切片经过二甲苯、梯度乙醇脱蜡以后,PBS清洗2次,暗室条件下滴加DHE染色液30 min后脱水固定封片。
2.5MDA检测将各组小鼠的肾脏组织裂解、匀浆取上清液,按照BCA法利用酶标仪检测匀浆浓度,参照MDA试剂盒检测吸光度。
2.6ox-LDL的ELISA检测将约100 mg肾组织加入到100 mL PBS溶液中,匀浆取上清,-20 ℃过夜,反复冻融2次,使细胞膜破碎,5 000×g离心5 min,按ELISA试剂盒检测相关浓度。
2.7Real-time PCR检测肾脏相关基因的表达RNA抽提和逆转录等具体方法均按操作说明进行。用于real-time PCR扩增的引物序列见表1。

表1 Real-time PCR的引物序列
F: forward; R: reverse.
3统计学处理
采用GraphPad统计软件对数据进行分析。统计值以均数±标准差(mean±SD)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结果
1CXCL16缺失对STZ诱导糖尿病病变小鼠体重变化的影响
STZ注射后第3天,C16 KO小鼠有8只空腹血糖量高于16.7 mmol/L,WT小鼠有7只小鼠的空腹血糖量高于16.7 mmol/L,达到糖尿病的血糖标准(本部分数据未提供)。在实验过程中,对照组的WT小鼠及C16 KO小鼠的体重均逐渐升高,但两组间差异无统计学意义;而STZ诱导糖尿病病变过程中,野生型小鼠及C16 KO小鼠体重的差异无统计学意义,见表2。
表2各组小鼠体重、空腹血糖、24 h尿蛋白、甘油三酯和总胆固醇含量的变化
Table 2.The changes of body weight, fasting blood glucose (FBG), 24 h urinary protein, triglycerides (TG) and total cholesterol (TC) among wild- type (WT) andCXCL16 knockout (C16 KO) mice treated with or without STZ (Mean±SD)

AnimalTreatmentnBodyweight(g)FBG(mmol/L)24hurinaryprotein(μmol/24h)TG(mmol/L)TC(mmol/L)WTVehicle830.2±0.64.8±1.00.30±0.060.36±0.281.78±0.29STZ725.8±0.7*22.6±2.3*11.32±0.09*1.26±0.45*2.85±0.68*C16KOVehicle831.2±0.34.6±1.10.25±0.030.35±0.211.66±0.27STZ826.3±0.6*17.8±1.6*#9.36±0.03*#1.17±0.38*2.55±0.57*
*P<0.05vsvehicle;#P<0.05vsWT.
2CXCL16缺失对小鼠空腹血糖、24 h尿蛋白、甘油三酯和总胆固醇水平的影响
如表2所示,STZ造模12周后,与注射柠檬酸缓冲液的对照组小鼠相比,STZ处理组的WT和C16 KO小鼠的空腹血糖、24 h尿蛋白、甘油三酯和总胆固醇水平均显著上调(P<0.05)。此外,在STZ处理的WT和C16 KO小鼠之间,C16 KO小鼠空腹血糖和24 h尿蛋白的上升幅度则显著低于WT小鼠(P<0.05)。
3CXCL16缺失增强STZ诱导糖尿病小鼠的葡萄糖耐受能力
2组小鼠在注射葡萄糖后血糖浓度持续上升,且在120 min时依然处于较高水平,且C16 KO小鼠的血糖水平始终要低于WT小鼠,其糖耐受的曲线下面积亦显著低于WT小鼠(P<0.05),该结果也预示了CXCL16基因缺失可能具有改善葡萄糖耐量的作用,见图1。
4CXCL16缺失缓解STZ诱导糖尿病小鼠的肾脏损伤
在柠檬酸缓冲液注射的对照组小鼠中,WT及C16 KO小鼠肾小球形态完整,未发生明显的病理变化。在STZ诱导糖尿病肾病小鼠模型中,与C16 KO小鼠相比较,WT小鼠的肾小球出现肥大现象,此外基膜也明显增厚,并出现系膜溶解现象,见图2。
5CXCL16缺失降低STZ诱导糖尿病小鼠肾脏组织的氧化应激压力
STZ诱导的WT及C16 KO糖尿病小鼠肾脏组织中ROS的含量明显增加。然而,与WT小鼠相比较,C16 KO小鼠肾脏中ROS的升高水平显著低于WT小鼠,见图3。

Figure 1.Glucose tolerance curve (A) and the area under glucose tolerance curve (B) in WT and C16 KO mice treated with or without STZ. Mean±SD.n=4.*P<0.05vsWT.
图1葡萄糖耐受量曲线及其葡萄糖耐受量曲线下面积
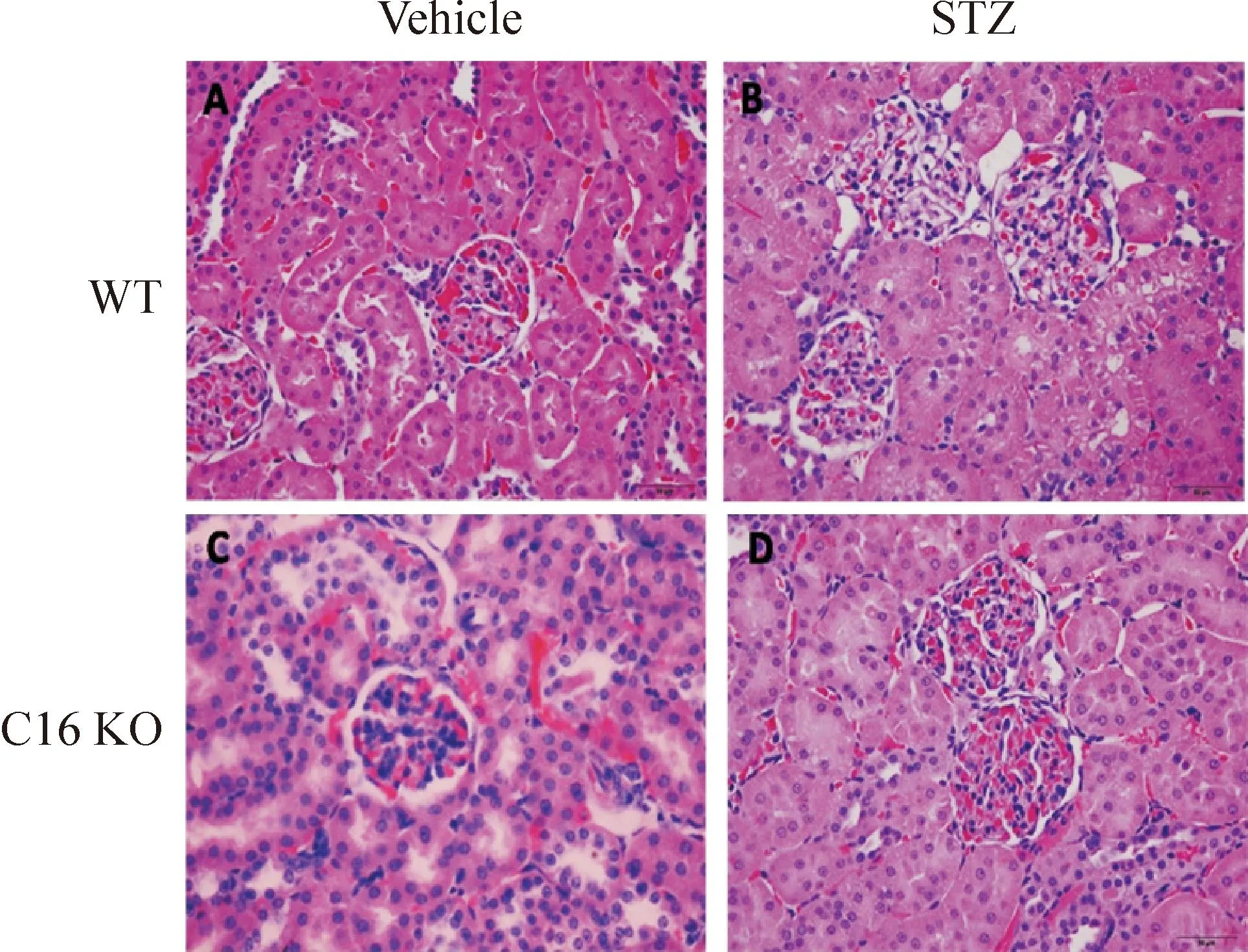
Figure 2.HE staining analysis of kidney sections in WT and C16 KO mice after STZ or vehicle injection (×400).
图2WT小鼠和C16 KO小鼠注射STZ或vehicle后的肾组织HE染色图
此外,MDA的检测结果也表明,在STZ诱导的糖尿病小鼠中,小鼠肾脏组织MDA含量显著上升;然而,与WT小鼠相比,C16 KO糖尿病肾病小鼠肾脏组织中的MDA水平明显低于WT小鼠(P<0.01)。STZ诱导的糖尿病小鼠肾脏组织的ox-LDL含量大幅度上升;然而,与WT小鼠相比,CXCL16基因缺失明显降低小鼠肾脏组织的ox-LDL含量(P<0.01)。此外,real-time PCR检测也获得了相类似的结果,即STZ诱导的糖尿病小鼠肾脏组织Lox-1 的mRNA表达水平显著上升,但CXCL16基因缺失小鼠的Lox-1表达水平上调幅度明显低于WT小鼠(P<0.05),见图4。
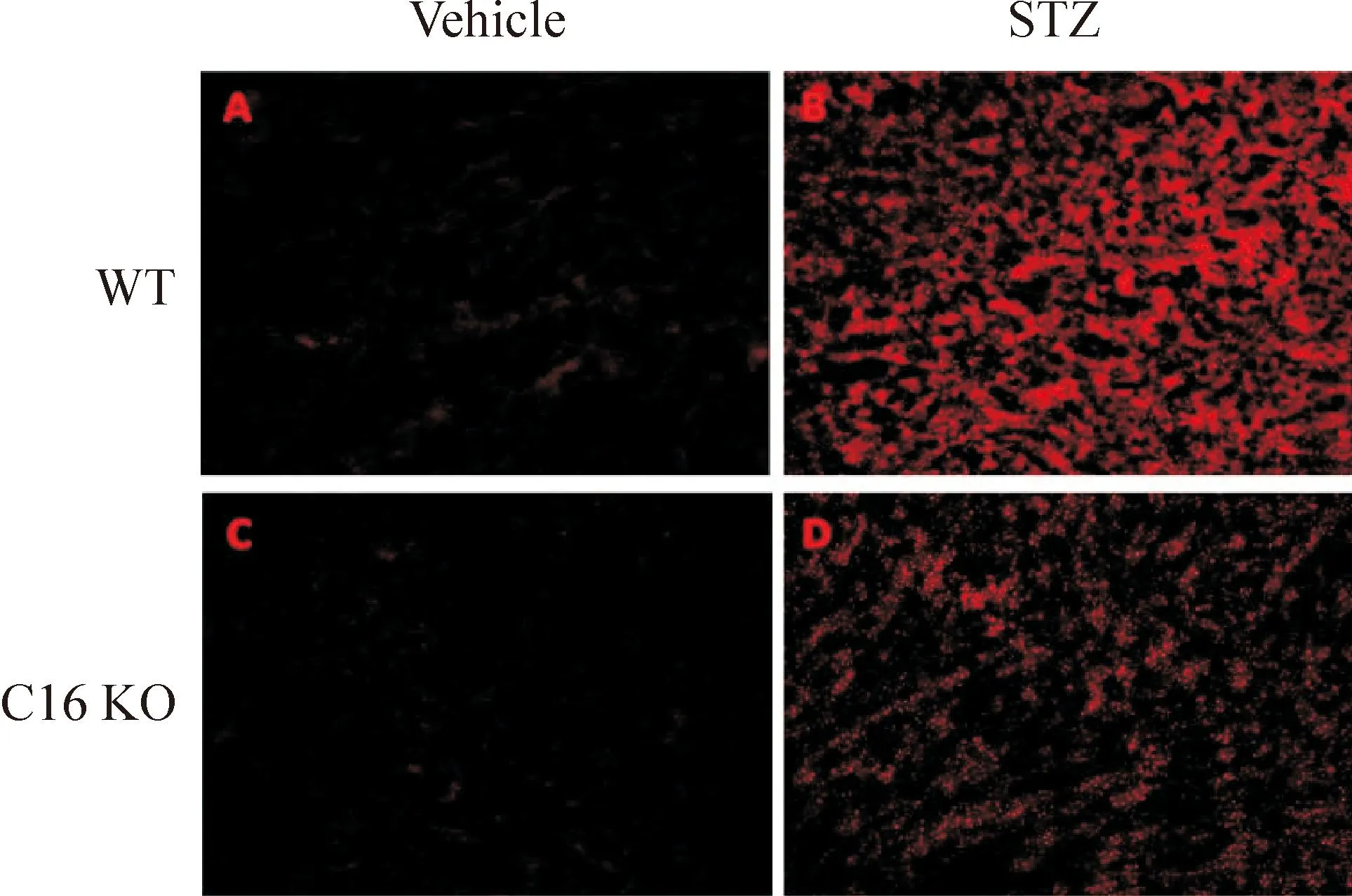
Figure 3.DHE staining analysis of ROS production in WT and C16 KO mice after STZ or vehicle injection (×200).
图3WT小鼠和C16 KO小鼠注射STZ或vehicle后肾脏中DHE染色检测ROS
6CXCL16缺失抑制STZ诱导糖尿病小鼠肾脏组织炎症因子的表达
在STZ诱导的糖尿病小鼠肾脏组织中,MIF的mRNA表达水平迅速上调(P<0.01);与此同时,TNF-α和IL-6表达水平也显著上调。然而,这些细胞炎症因子在C16 KO小鼠肾脏组织中的上调幅度则明显低于WT小鼠,见图5。
7CXCL16缺失抑制STZ诱导糖尿病小鼠肾脏组织细胞黏附因子的表达
小鼠肾脏组织中ICAM-1和CXCL1的mRNA表达水平在STZ诱导的糖尿病小鼠肾脏组织显著上调;而CXCL16基因的缺失则明显抑制这些黏附因子的表达,见图6。

Figure 4.The levels of MDA (A) and ox-LDL (B), and mRNA expression of Lox-1 (C) in mouse kidney. Mean±SD.n=4.*P<0.05,**P<0.01vsWT mice.
图4小鼠肾脏中MDA、 ox-LDL水平以及Lox-1的mRNA表达情况.
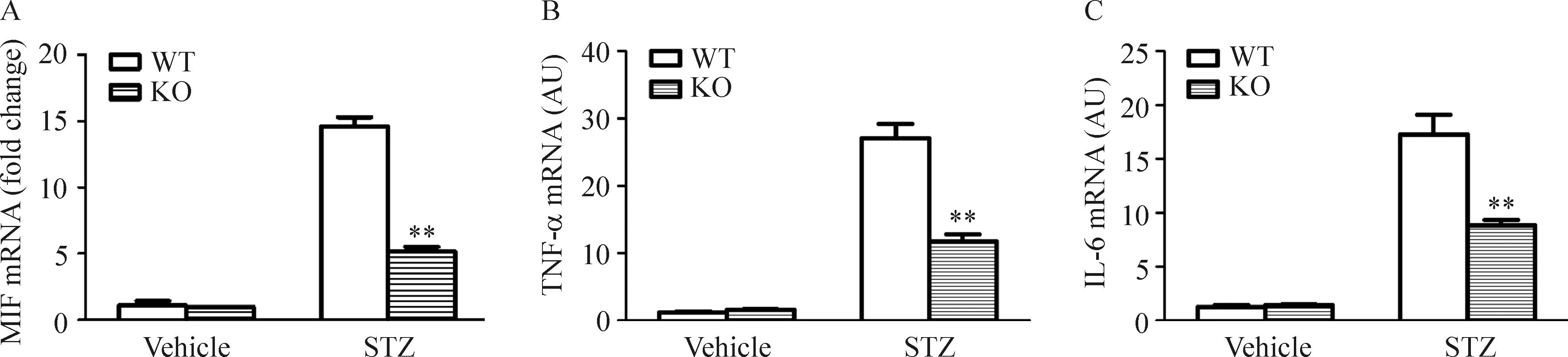
Figure 5.The mRNA expression of MIF (A), TNF-α (B) and IL-6 (C) in mouse kidney. Mean±SD.n=4.**P<0.01vsWT mice.
图5小鼠肾脏MIF、TNF-α及IL-6 的mRNA表达水平
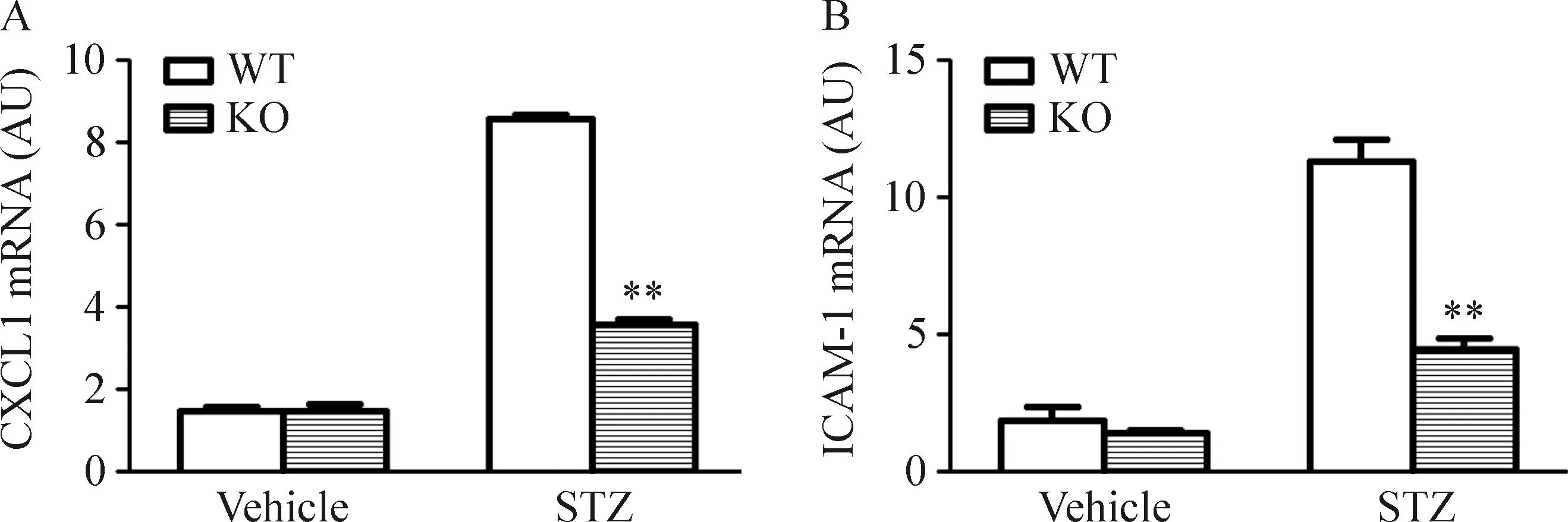
Figure 6.The mRNA expression of CXCL1 (A) and ICAM-1 (B) in mouse kidney. Mean±SD.n=4.**P<0.01vsWT mice.
图6小鼠肾脏CXCL1和ICAM-1的 mRNA表达水平
讨论
DN是糖尿病发生发展过程中常见的慢性并发症之一,严重的甚至会导致肾功能衰竭。伴随着糖尿病发病趋势的日益上升,DN在糖尿病患者中的发病比例也在逐年增加,而使其成为了糖尿病致死的主要因素。DN的发病过程会导致肾小球肥大硬化、小管间质纤维化等,继而损害正常的肾结构改变,使肾功能丧失[8]。由于DN是机体多因素综合作用的结果,因而其相关的发病机制至今尚未探明。
CXCL16是主要由免疫细胞产生的趋化因子,同时也是机体的清道夫受体。早期研究发现,CXCL16在动脉粥样硬化的发病扮演着重要的角色[9]。作为清道夫受体,CXCL16可以介导巨噬细胞吞噬ox-LDL,形成泡沫细胞,促进动脉粥样硬化的发生[10]。在机体内,CXCL16通过与配体结合,引发细胞吞噬ox-LDL,激活炎症反应等一系列反应,从而促进动脉粥样硬化的发生发展[11]。此外,基因敲除小鼠实验结果显示:CXCL16是一个动脉粥样硬化的促进因子,在动脉粥样硬化发展过程中发挥着至关重要的作用[12]。最近研究发现,CXCL16与急性冠脉综合征患者死亡率密切相关,可能是急性冠状动脉综合征新的生物标记[13]。
动物研究发现,CXCL16在高胆固醇血症导致的严重肾损伤,以及单侧输尿管梗阻(单侧输尿管结扎)诱导产生ox-LDL的过程中扮演着重要的角色[14]。作为ox-LDL的趋化因子受体,CXCL16在原发性肾小球疾病引发的肾病中尤其是膜性肾病[15]存在较多表达。我们的前期研究发现,CXCL16与糖尿病肾病的发生发展也存在密切的关系[16]。在Ⅱ型糖尿病患者中,CXCL16的表达水平并未出现明显上调,但在慢性肾病及糖尿病肾病患者中显著升高;同时糖尿病肾病患者的CXCL16血清水平要明显高于单纯慢性肾病患者,并与患者的肾功能损害存在密切的关系[16],提示CXCL16与糖尿病肾病的发生发展存在着某种特别的关系。
在本项目研究过程中,我们采用基因敲除的模式,探索CXCL16基因缺失与糖尿病肾病发生发展之间的关系。结果显示CXCL16基因缺失小鼠显著抑制了STZ诱导的糖尿病小鼠的肾脏病变状况,CXCL16基因缺失后,STZ诱导的糖尿病小鼠的空腹血糖及24 h蛋白尿量均明显降低,同时,小鼠的葡萄糖耐受能力也有显著改善。此外,组织形态学染色也发现,CXCL16基因缺失显著改善STZ诱导糖尿病小鼠的肾小球病变。这些结果说明CXCL16基因在糖尿病肾病发病中具有明显的促进作用。早期的研究发现,糖尿病肾病发病主要集中在肾脏足细胞中的病变[17]。在高糖环境的刺激下,机体细胞内产生大量ROS,进而引发LDL被氧化成ox-LDL。这些ox-LDL在CXCL16作用下,引发肾脏组织相关细胞对ox-LDL的摄取,从而造成肾脏损伤。我们将WT小鼠和C16 KO小鼠成功构建成DN模型后,C16 KO小鼠肾脏中ox-LDL的表达水平相比于WT小鼠明显降低,提示CXCL16基因的缺失降低了肾脏对ox-LDL的摄取能力,从而缓解了糖尿病引发肾脏损伤的病变状况。与此同时,ox-LDL的下游效应因子巨噬细胞移动抑制因子的表达水平在C16 KO小鼠中显著降低,这或许直接或间接地缓解了肾脏组织中相关炎症因子和细胞浸润因子的表达,从而缓解高血糖对肾脏细胞损伤的发生发展。
综上所述,CXCL16在糖尿病肾病发病中扮演着重要角色,CXCL16基因的缺失能有效缓解糖尿病肾病的发生发展。这为开发新型的糖尿病肾病药物提供了靶点及思路。
[参考文献]
[1]李克兰. 糖尿病性肾病的早期诊断与治疗[J]. 吉林医学, 2007, 28(7):934.
[2]赵晓霞. 糖尿病性肾病的诊断与治疗进展[J]. 医学理论与实践, 2010, 23(7):795-797.
[3]王有德. 糖尿病肾病发病机制的研究进展[J]. 当代医学, 2010, 16(7):36-40.
[4]Matloubian M, David A, Engel S, et al. A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J]. Nat Immunol, 2000, 1(4):298-304.
[5]胡要, 全智华, 刘江华. 趋化因子CXCL16研究新进展[J]. 医学综述, 2010, 16(8):1140-1143.
[6]李定良. 冠心病患者CXCL16的水平测定及临床意义[D].南宁: 广西医科大学, 2011.
[7]Lin Z, Gong Q, Zhou Z, et al. Increased plasma CXCL16 levels in patients with chronic kidney diseases[J]. Eur J Clin Invest, 2011, 41(8):836-845.
[8]Zhu SS, Ren Y, Zhang M, et al.WldSprotects against peripheral neuropathy and retinopathy in an experimental model of diabetes in mice[J]. Diabetologia, 2011, 54(9): 2440-2450.
[9]吕永青, 卜培莉. CXCL16与动脉粥样硬化的研究关系[J]. 中国实用医药, 2009, 4(9):60-62.
[10]Ludwig A, Weber C. Transmembrane chemokines: versatile ′special agents′ in vascular inflammation[J]. Thromb Haemost, 2007, 97(5):694-703.
[11]陈静文, 严激. CXC趋化因子配体16与冠心病关系的研究进展[J]. 中国实用医药, 2010, 5(9):246-248.
[12]Yi GW, Zeng QT, Mao XB, et al. Overexpression of CXCL16 promotes a vulnerable plaque phenotype in apolipoprotein E-knockout mice[J]. Cytokine, 2011, 53(3):320-326.
[13]王梦非, 孙建辉, 白江涛, 等. CXCL16与急性冠脉综合征的相关性分析[J]. 中国心血管病研究, 2010, 8(10): 756-760.
[14]左洋洋, 付蕾, 王文健, 等. 清道夫受体:脂质肾损伤的关键[J]. 中国肾脏病杂志, 2014,30(2):155-158.
[15]朱晓燕. CXCL16在原发性肾病综合征中的变化及其临床意义[D].济南: 山东大学, 2012.
[16]Zhao L, Wu F, Jin L, et al. Serum CXCL16 as a novel marker of renal injury in type 2 diabetes mellitus[J]. PLoS One, 2014, 9(1):e87786.
[17]Lewko B, Stepinski J. Hyperglycemia and mechanical stress: targeting the renal podocyte[J]. J Cell Physiol, 2009, 221(2): 288-295.
(责任编辑: 陈妙玲, 罗森)
CXCL16 deficiency attenuates STZ-induced diabetic nephropathy in miceZHAO Le-ping1, JIN Lei-gang2, SHI Li-hua2, ZHANG Sai-sai2, PAN Xue-bo2, LIN Zhuo-feng2, GONG Fang-hua2
(1TheAffiliatedYueqingHospital,2SchoolofPharmacy,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:gongwenheng@163.com)
[ABSTRACT]AIM: To explore the effect ofCXCL16 deficiency on streptozocin (STZ)-induced diabetic nephropathy in mice. METHODS:CXCL16 knockout (C16 KO) mice (8 years old) were used to build up diabetes model by treating with STZ.Age- and gender-matched wild-type (WT) C57BL/6J mice treated with STZ were used as control. All mice were fed with chow diets for 12 weeks, and the development of diabetic nephropathy was evaluated. RESULTS: Compared with the WT mice treated with STZ, C16 KO mice treated with STZ presented lower fasting glucose levels and better glucose tolerance power. C16 KO mice treated with STZ also had lower urine protein levels and smaller areas of glomerular injury as compared with WT mice treated with STZ. Furthermore,CXCL16 deficiency decreased the contents of renal reactive oxygen species (ROS), malondialdehyde (MDA) and oxidized low-density lipoprotein (ox-LDL) and the mRNA expression of lectin-like oxidized low-density lipoprotein receptor 1 (Lox-1), and attenuated the expression of renal inflammatory factors including tumor necrosis factor α (TNF-α) and interleukin 6 (IL-6), as well as chemokines including intercellular cell adhesion molecular 1 (ICAM-1) and chemokine C-X-C motif ligand 1 (CXCL1). CONCLUSION:CXCL16 deficiency obviously inhibits the development of STZ-induced diabetic nephropathy in mice.
[KEY WORDS]CXCL16 gene; Diabetic nephropathy; Gene deficiency
doi:10.3969/j.issn.1000- 4718.2016.02.023
[中图分类号]R363; R587.1
[文献标志码]A
通讯作者△Tel: 0577-86699350; E-mail: gongwenheng@163.com
*[基金项目]浙江省自然科学基金资助项目(No. LY12H07002);浙江省大学生科技创新活动计划(新苗人才计划)(No. 2014R413066)
[收稿日期]2015- 09- 21[修回日期] 2015- 12- 08
[文章编号]1000- 4718(2016)02- 0327- 06
