1-磷酸鞘氨醇在高糖诱导血管内皮细胞功能损伤中的作用*
2016-03-05刘慰华林双峰石吉相陈秋梅王烁婷
刘慰华, 林双峰, 石吉相, 潘 婷, 陈秋梅, 王烁婷, 尚 慧
(1广州医科大学附属第二医院,广州心血管疾病研究所,广东 广州 510260;2广州中医药大学第一附属医院,广东 广州 510405)
1-磷酸鞘氨醇在高糖诱导血管内皮细胞功能损伤中的作用*
刘慰华1△,林双峰2,石吉相1,潘婷1,陈秋梅1,王烁婷1,尚慧1
(1广州医科大学附属第二医院,广州心血管疾病研究所,广东 广州 510260;2广州中医药大学第一附属医院,广东 广州 510405)
[摘要]目的: 探讨1-磷酸鞘氨醇(S1P)在高糖诱导血管内皮细胞功能损伤中的作用及其机制。方法: 在高糖培养的人主动脉内皮细胞模型中,分别或同时给予S1P、鞘氨醇激酶1抑制剂和Akt抑制剂处理后,观察一氧化氮(NO)、粒细胞-内皮细胞黏附率、细胞间黏附分子1(ICAM-1)蛋白表达、内皮细胞迁移以及Akt/内皮型一氧化氮合酶(eNOS)信号途径的改变。结果: S1P明显降低高糖诱导的内皮细胞培养上清液中NO含量,促进粒细胞与内皮细胞黏附,显著增加内皮细胞ICAM-1蛋白表达,抑制内皮细胞迁移和Akt/eNOS信号通路激活。鞘氨醇激酶1抑制剂减少S1P生成后上述内皮细胞功能指标得以明显改善,Akt/eNOS信号通路恢复激活。结论: S1P促进高糖培养的内皮细胞功能障碍的形成,可能与其抑制Akt/eNOS信号通路激活有关。抑制S1P生成有望成为减轻内皮细胞功能损伤的治疗策略之一。
[关键词]1-磷酸鞘氨醇; 内皮细胞; 内皮型一氧化氮合酶; 细胞间黏附分子1
血管内皮细胞损伤是高血压、糖尿病血管并发症等多种类型心血管疾病的早期表现和共同的病理生理基础。内皮细胞功能障碍早期体现为内皮依赖性血管舒张功能下降,主要与内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性降低进而一氧化氮(nitric oxide,NO)合成减少有关[1-2]。慢性高血糖是糖尿病导致血管内皮细胞损伤最重要的元凶之一。除高糖外,研究发现1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P)亦参与糖尿病血管并发症的发生发展过程。S1P是一种有生物活性的溶血磷脂,膜磷脂类神经酰胺分解代谢产物鞘氨醇在限速酶鞘氨醇激酶作用下生成S1P。内皮细胞、单核细胞、血小板等可生成释放S1P[3]。近年来研究显示糖尿病患者和糖尿病动物循环中S1P含量增加,S1P参与糖尿病伤口愈合、糖尿病肾病、动脉粥样硬化、急性血管炎症等病理进程[4-7]。然而S1P在糖尿病诱导内皮细胞功能损伤的作用及其机制目前还未完全阐明。
本研究采用高糖培养人主动脉内皮细胞,构建高糖诱导内皮细胞损伤的体外细胞模型,并分别给予S1P、鞘氨醇激酶 1抑制剂和Akt抑制剂处理,观察NO含量、粒细胞-内皮细胞黏附率、细胞间黏附分子 1(intercellular adhesion molecule-1, ICAM-1)表达、内皮细胞迁移及Akt/eNOS信号通路的改变,探讨S1P在高糖培养的内皮细胞功能障碍中的作用及其机制,为探寻S1P作为可能的新的药物干预靶点防治糖尿病内皮细胞功能损伤奠定实验基础。
材料和方法
1内皮细胞培养、传代和处理
人主动脉内皮细胞(human aortic endothelial cells,HAECs)购于ScienCell Research Laboratories。内皮细胞用含10%胎牛血清及多种生长因子的EBM-2培养基培养。采用0.25%胰蛋白酶和0.02%EDTA混合液消化、传代。培养细胞2~6代用于实验。
高糖培养内皮细胞:正常培养内皮细胞接近汇合状,无血清同步化处理12 h后更换成含22 mmol/L高糖培养基,即正常糖培养基(含5.5 mmol/L葡萄糖)中添加16.5 mmol/L 葡萄糖至终浓度为22 mmol/L 为高糖培养。22 mmol/L甘露醇(mannitol)作为高渗对照。实验分为正常组、甘露醇组、高糖(high glucose, HG)组、高糖+S1P(1 μmol/L)组、高糖+二甲基鞘氨醇(N,N-dimethylsphingosine,DMS;2.5 μmol/L)组和高糖+MK2206(0.5 μmol/L)组和高糖+ MK2206+DMS组。S1P和鞘氨醇激酶 1抑制剂DMS 购于Sigma, Akt抑制剂MK2206 购于MedChem Express。
2实验方法
2.1培养液NO含量的检测内皮细胞接种于24孔板中,分别给予正常糖、甘露醇、高糖、高糖+S1P和高糖+DMS处理24 h后收集培养液,每组4个复孔。实验独立重复4次。根据NO检测试剂盒(购于南京建成生物工程研究所)说明书要求,采用呈色反应和比色方法测定细胞培养液中NO含量,用分光光度计测定波长550 nm处各组吸光度值(A)并进行计算。
2.2粒细胞-内皮细胞黏附实验内皮细胞接种于48孔I型胶原酶包被的无菌培养板中,分别给予正常糖、甘露醇、高糖、高糖+S1P和高糖+DMS处理24 h后,无血清培养液洗涤3次,每孔加入新鲜分离的中性粒细胞1×105个,37 ℃ 孵育30 min,无血清培养液轻柔洗涤2次,去除未结合的粒细胞。每组4个复孔。实验独立重复3次。根据髓过氧化物酶(myeloperoxidase,MPO)活性变化对黏附于内皮细胞上的粒细胞进行定量分析。粒细胞黏附率(%) = 黏附粒细胞MPO活性/总粒细胞数(1×105个)MPO活性。
2.3Western blot实验用三去污裂解液裂解内皮细胞,收集细胞裂解液移至1.5 mL EP管中,采用BCA蛋白定量试剂盒(Thermo)测定各组细胞裂解液中蛋白质含量。经12% SDS-PAGE分离蛋白质,每孔蛋白总量40 μg。在Bio-Rad电转仪上转膜。5%脱脂奶粉室温封闭1 h,相应的Ⅰ抗[ICAM-1 1∶5 000,p-eNOS(Ser1177) 1∶5 000,t-eNOS 1∶5 000,p-Akt(Ser473)1∶5 000,t-Akt 1∶5 000,tubulin 1∶10 000;均购于Abcam 公司]4 ℃孵育过夜,次日辣根过氧化物酶标记的相应 II 抗室温孵育1 h,加入ECL化学发光试剂,X光胶片曝光。UVP GDS8000系统拍摄图像,应用ImageJ软件分析并计算各组条带灰度值。
2.4内皮细胞划痕实验内皮细胞以每孔2×105的密度接种24孔板中。分组培养,每组3个平行孔。实验至少重复3次。细胞生长近融合80%~90%时,换用无血清培养基培养12 h使细胞同步化。用200 μL无菌枪头垂直在24孔板内底部正中划痕1次,PBS轻洗去除划痕处细胞。各组相应加入新鲜培养基和药物处理后继续培养,显微镜下拍照,分别观察记录0 h、24 h时划痕宽度。细胞迁移距离(μm)= 划痕后0 h宽度(μm)-24 h时划痕宽度(μm)。
3统计学处理
每组实验至少重复3次以上,实验结果用均数±标准差(mean±SD)表示。采用SPSS 11.5统计软件行统计学分析。多组比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1S1P对高糖培养内皮细胞NO含量的影响
高糖组培养液中NO含量较正常组显著减少(P<0.05)。S1P刺激后高糖培养内皮细胞NO含量减少更加明显(P<0.05)。鞘氨醇激酶 1抑制剂DMS减少S1P生成后高糖条件下内皮细胞NO含量明显增加(P<0.05)。高渗对照甘露醇组NO含量与正常组相比无明显改变,见图1。
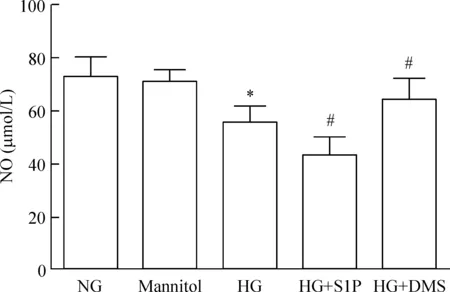
Figure 1.The effect of S1P on NO content in endothelial cells exposed to high glucose. NO: nitric oxide; NG: normal glucose; HG: high glucose; S1P: sphingosine 1-phosphate; DMS:N,N-dimethylsphingosine. Mean±SD.n=4.*P<0.05vsNG;#P<0.05vsHG.
图1S1P对高糖培养下内皮细胞NO含量的影响
2S1P对高糖培养内皮细胞黏附功能的影响
正常培养仅有少量多形核中性粒细胞(polymorphonuclear neutrophils,PMN)黏附于内皮细胞表面。高糖培养的PMN-内皮细胞黏附率显著增加(P<0.05)。S1P刺激进一步提高高糖培养PMN-内皮细胞黏附率(P<0.05)。给予鞘氨醇激酶 1抑制剂DMS后发现高糖条件下PMN-内皮细胞黏附率显著降低(P<0.05)。高渗对照甘露醇组PMN黏附率与正常组相比较无显著变化,见图2。
我们还检测内皮细胞黏附分子ICAM-1蛋白表达的变化情况。高糖培养的内皮细胞ICAM-1蛋白表达较正常组明显增加(P<0.05)。S1P进一步促进高糖培养内皮细胞ICAM-1蛋白的表达(P<0.05)。鞘氨醇激酶 1抑制剂DMS则抑制高糖条件下内皮细胞ICAM-1的表达(P<0.05)。高渗对照甘露醇对ICAM-1蛋白表达无明显影响,见图3。
3S1P对高糖培养内皮细胞迁移的影响
如图4所示,正常组和高渗对照甘露醇组内皮细胞迁移较快,培养24 h后几乎覆盖划痕区。高糖组细胞迁移减慢,迁移距离明显小于正常组(P<0.05)。S1P刺激后高糖培养内皮细胞迁移距离进一步缩短(P<0.05)。鞘氨醇激酶 1抑制剂DMS处理后,高糖下内皮细胞迁移加快,迁移距离明显增加(P<0.05)。
4S1P对高糖培养内皮细胞Akt/eNOS信号通路激活的影响
图5所示,与正常组相比,高糖组内皮细胞Akt和eNOS磷酸化蛋白水平均明显减少(P<0.05)。
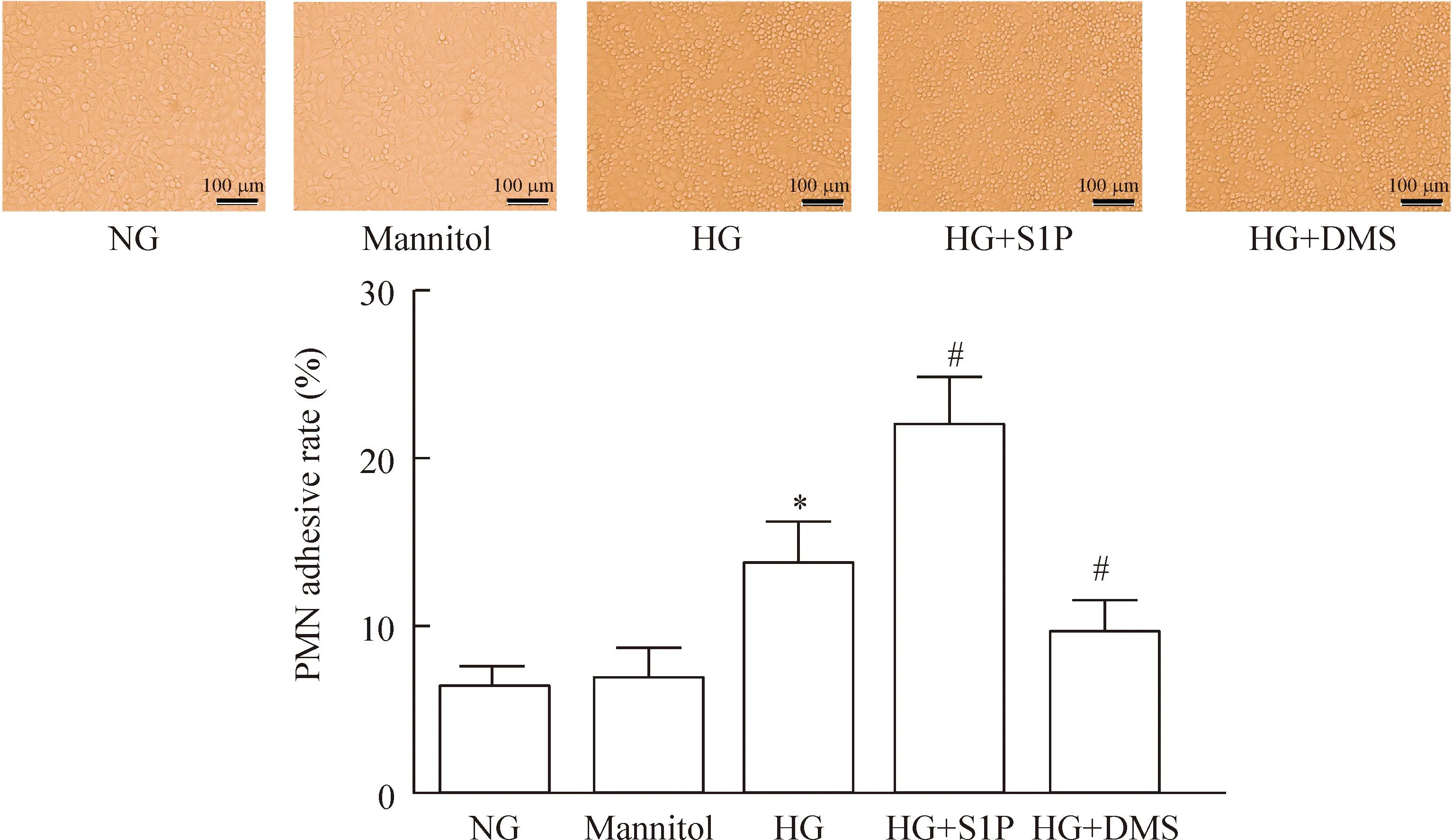
Figure 2.The effect of S1P on PMN-endothelial cell adhesive rate exposed to high glucose (×200). PMN: polymorphonuclear neutrophils; NG: normal glucose; HG: high glucose; S1P: sphingosine 1-phosphate; DMS:N,N-dimethylsphingosine. Mean±SD.n=4.*P<0.05vsNG;#P<0.05vsHG.
图2S1P对高糖培养下粒细胞-内皮细胞黏附率的影响
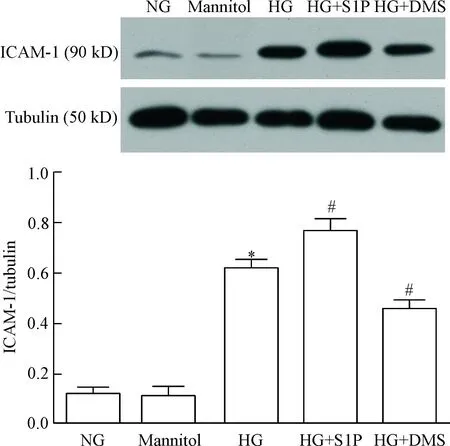
Figure 3.The effect of S1P on ICAM-1 protein level in endothelial cells exposed to high glucose. NG: normal glucose; HG: high glucose; S1P: sphingosine 1-phosphate; DMS:N,N-dimethylsphingosine. Mean±SD.n=3.*P<0.05vsNG;#P<0.05vsHG.
图3S1P对高糖培养下内皮细胞ICAM-1蛋白表达的影响
与Akt 抑制剂MK2206相似,S1P刺激使高糖培养的内皮细胞磷酸化Akt和磷酸化eNOS蛋白水平降低更加明显(P<0.05)。鞘氨醇激酶-1抑制剂DMS干预后显著增加高糖诱导的内皮细胞Akt和eNOS磷酸化蛋白水平(P<0.05)。内皮细胞先加入Akt 抑制剂MK2206预处理后再给予DMS干预,结果发现DMS上调Akt磷酸化和eNOS磷酸化水平作用明显减弱(P<0.05)。高渗对照甘露醇对Akt/eNOS信号通路激活没有明显影响。
讨论
内皮细胞作为血管壁的第一道渗透屏障,衬于血管腔最内层,还分泌多种血管活性物质如NO、前列环素、抗凝和纤溶因子等。NO在维持血管稳态中作用至关重要,包括介导内皮依赖性血管舒张,促进内皮细胞增殖、迁移,抑制血小板聚集,抑制中性粒细胞趋化及粘附于血管内皮等[1]。内皮细胞损伤是糖尿病血管并发症发生的起始环节和最早期病理表现。内皮细胞损伤及其功能障碍可进一步诱发和加速动脉粥样硬化和血栓形成[8]。糖尿病状态下除了高血糖外,血小板活化等亦参与内皮功能障碍发生发展进程。血小板作为循环中S1P主要来源,在高血糖、胰岛素抵抗和氧化应激等病理性因素刺激后活化生成并释放大量S1P[9-10]。近年来研究显示糖尿病患者和糖尿病动物血清中S1P含量明显增加,与糖尿病肾病、动脉粥样硬化、急性血管炎症等病程发展密切相关[4-7]。然而S1P在高糖诱导内皮细胞损伤中的作用及机制目前还未完全阐明。本研究观察到高糖培养的内皮细胞NO含量减少、粘附作用增强和迁移能力下降,表明我们成功构建高糖诱导内皮细胞功能障碍的体外细胞模型。S1P刺激明显降低高糖培养的内皮细胞NO含量,增加PMN粘附率和粘附分子ICAM-1蛋白表达,抑制内皮细胞迁移,提示S1P促进高糖诱导的内皮细胞功能障碍,进一步加重内皮细胞损伤。给予鞘氨醇激酶 1抑制剂DMS减少S1P生成后,发现高糖条件下内皮细胞NO含量明显增加,PMN粘附率和ICAM-1蛋白表达显著下降,内皮细胞迁移加速,表明鞘氨醇激酶1抑制剂可改善内皮细胞功能,减轻高糖诱导的内皮细胞损伤。
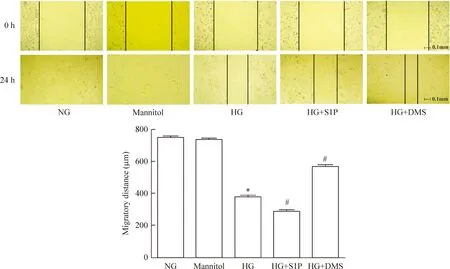
Figure 4.The effect of S1P on migration of endothelial cells exposed to high glucose (×40). NG: normal glucose; HG: high glucose; S1P: sphingosine 1-phosphate; DMS:N,N-dimethylsphingosine. Mean±SD.n=3.*P<0.05vsNG;#P<0.05vsHG.
图4S1P对高糖培养下内皮细胞迁移的影响
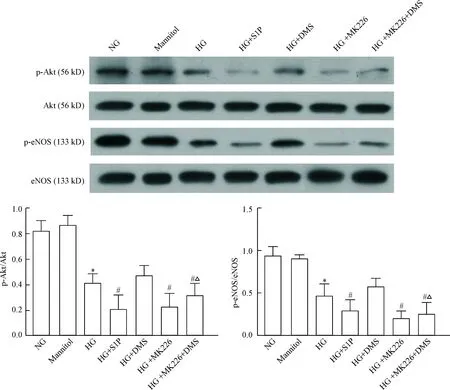
Figure 5.The effect of S1P on the phosphorylated protein levels of Akt and eNOS in endothelial cells exposed to high glucose. NG: normal glucose; HG: high glucose; S1P: sphingosine 1-phosphate; DMS:N,N-dimethylsphingosine. Mean±SD.n=3.*P<0.05vsNG;#P<0.05vsHG;△P<0.05vsHG+DMS.
图5S1P对高糖培养下内皮细胞Akt/eNOS信号通路的影响
Akt(又称蛋白激酶B) 作为细胞内关键信号分子之一,在细胞增殖、迁移、分化、凋亡和物质代谢等一系列生理和病理进程中发挥重要调节作用[10]。Akt Ser473位点磷酸化后被活化,可使相应底物蛋白如eNOS、GSK-3等特定部位的丝/苏氨酸发生磷酸化,从而激活或抑制其下游靶蛋白功能。eNOS是NO合成过程的关键酶,是血管内皮功能完整的标志之一。在血管内皮细胞中,活化的Akt 可导致eNOS-Ser1177 位点磷酸化,进而激活eNOS,后者催化L-精氨酸与氧分子经氧化还原反应产生并释放NO。eNOS活性降低、NO合成减少是导致血管内皮功能障碍的主要原因[11]。在本研究中,我们进一步考察S1P加重高糖下内皮细胞功能障碍的作用是否与其影响Akt/eNOS信号通路激活有关。结果显示高糖培养的内皮细胞p-Akt(Ser473)和p-eNOS(Ser1177)蛋白水平显著降低,提示高糖抑制内皮细胞 Akt/eNOS信号通路激活。S1P刺激进一步抑制高糖条件下Akt/eNOS信号通路激活。鞘氨醇激酶 1抑制剂明显上调p-Akt(Ser473)和p-eNOS(Ser1177)的水平,表明鞘氨醇激酶 1抑制剂可减轻高糖对Akt/eNOS信号通路的抑制效应,Akt/eNOS信号通路激活得以部分恢复。
简言之,本研究结果显示S1P加重高糖诱导的内皮细胞功能损伤,包括减少NO含量、增强粘附作用和抑制内皮细胞迁移。鞘氨醇激酶 1抑制剂减少S1P生成后上述内皮细胞功能得以明显改善,激活Akt/eNOS信号通路可能是鞘氨醇激酶 1抑制剂改善高糖诱导内皮细胞损伤的作用机制之一。S1P通过何种途径影响内皮细胞Akt/eNOS信号通路以及其他作用机制是我们将进一步深入研究的内容,以期探明糖尿病内皮细胞功能障碍发生机制和寻找可能新的干预靶标。
[参考文献]
[1]Sena CM, Pereira AM, Seiça R. Endothelial dysfunction: a major mediator of diabetic vascular disease [J]. Biochim Biophys Acta, 2013, 1832(12):2216-31.
[2]Paneni F, Beckman JA, Creager MA, et al. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy: part I[J]. Eur Heart J, 2013, 34(31):2436-2443.
[3]Knapp M, Zendzian-Piotrowska M, Blachnio-Zabielska A, et al. Myocardial infarction differentially alters sphingoli-pid levels in plasma, erythrocytes and platelets of the rat[J]. Basic Res Cardiol, 2012, 107(6):294.
[4]Lan T, Liu W, Xie X, et al. Sphingosine kinase-1 pathway mediates high glucose-induced fibronectin expression in glomerular mesangial cells[J]. Mol Endocrinol, 2011, 25(12):2094-2105.
[5]Zhang G, Yang L, Kim GS, et al. Critical role of sphingosine-1-phosphate receptor 2 (S1PR2) in acute vascular inflammation [J]. Blood, 2013, 122(3):443-455.
[6]景小东,佘强. 1-磷酸鞘氨醇在心血管系统中作用的研究进展[J]. 医学综述, 2013, 19(15):2719-2721.
[7]Lan T, Bi H, Liu W, et al. Simultaneous determination of sphingosine and sphingosine 1-phosphate in biological samples by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2011, 879(7-8):520-526.
[8]Kim JH, Bae HY, Kim SY. Clinical marker of platelet hyperreactivity in diabetes mellitus [J]. Diabetes Metab J, 2013, 37(6):423-428.
[9]臧婵媛,康毅,温克,等. 1-磷酸鞘氨醇对血小板活化因子所致大鼠肠系膜微血管通透性增高的影响[J]. 中国病理生理杂志, 2010, 26(4):681-685.
[10]储佳佳,李积东,雷霖,等.柚皮苷对高糖诱导的血管内皮细胞损伤及PI3K/AKT/eNOS信号通路的影响[J]. 中国病理生理杂志, 2015, 31(4):625-629.
[11]丁菁,陆德琴,王胜男, 等. 糖尿病大鼠动脉血管内皮型一氧化氮合酶丝氨酸磷酸化水平降低[J]. 基础医学与临床, 2013, 33(10):1322-1323.
(责任编辑: 林白霜, 罗森)
Role of sphingosine 1-phosphate on high glucose-induced vascular endothelial cell dysfunctionLIU Wei-hua1, LIN Shuang-feng2, SHI Ji-xiang1, PAN Ting1, CHEN Qiu-mei1, WANG Shuo-ting1, SHANG Hui1
(1TheSecondAffiliatedHospitalofGuangzhouMedicalUniversity,GuangzhouInstituteofCardiovascularDisease,Guangzhou510260,China;2TheFirstAffiliatedHospital,GuangzhouUniversityofChineseMedicine,Guangzhou510405,China.E-mail:liuweihua.96@163.com)
[ABSTRACT]AIM: To explore the role of sphingosine 1-phosphate (S1P) in the dysfunction of vascular endothelial cells exposed to high glucose. METHODS: In human aortic endothelial cells cultured under high-glucose (22 mmol/L glucose) medium, nitric oxide (NO) level, polymorphonuclear neutrophil-endothelial cell adhesion rate, protein level of intercellular adhesion molecule-1 (ICAM-1), migration of endothelial cells and Akt/endothelial nitric oxide synthase (eNOS) pathway activation were observed after S1P, sphingosine kinase-1 inhibitor and/or Akt inhibitor treatments. RESULTS: S1P decreased NO level, increased polymorphonuclear neutrophil adhesive rate, enhanced ICAM-1 protein level, and inhibited migration of endothelial cells and activation of Akt/eNOS pathway in endothelial cells cultured under high-glucose condition. Sphingosine kinase-1 inhibitor, which reduced S1P content, significantly improved the above endothelial cell function indexes and restored the activation of Akt/eNOS pathway. CONCLUSION: S1P promoted high glucose-induced dysfunction of endothelial cells probably by inhibiting the activation of Akt/eNOS signal pathway. Targeting S1P is expected to become one of potential treatment strategies to reduce endothelial cell dysfunction.
[KEY WORDS]Sphingosine 1-phosphate; Endothelial cells; Endothelial nitric oxide synthase; Intercellular adhesion molecule-1
doi:10.3969/j.issn.1000- 4718.2016.02.009
[中图分类号]R363.21
[文献标志码]A
通讯作者△Tel: 020-34153256; E-mail: liuweihua.96@163.com
*[基金项目]国家自然科学基金资助项目(No. 81400234);广东省科技计划(No. 2013B021800182);广州市属高校科技计划(No. 1201410344)
[收稿日期]2015- 08- 20[修回日期] 2015- 12- 10
[文章编号]1000- 4718(2016)02- 0245- 06
