辛菌胺在土壤中降解的影响因素
2016-03-01金明姣吴增雪潘思竹胡德禹
金明姣, 吴增雪, 钟 蕾, 潘思竹, 胡德禹
(贵州大学 精细化工研发中心, 绿色农药与农业生物工程国家重点实验室培育基地, 教育部重点实验室, 贵州 贵阳 550025)
辛菌胺在土壤中降解的影响因素
金明姣, 吴增雪, 钟 蕾, 潘思竹, 胡德禹*
(贵州大学 精细化工研发中心, 绿色农药与农业生物工程国家重点实验室培育基地, 教育部重点实验室, 贵州 贵阳 550025)
为了解辛菌胺在土壤中的降解规律,采用室内模拟降解方法,用液相色谱三重串联四级杆质谱(LC-MS/MS)检测法,对影响辛菌胺在土壤中的降解因素(浓度,土壤是否去有机质,土壤类型及土壤含水率)进行研究。结果表明:土壤中辛菌胺的降解速率随着土壤中药剂浓度的减小而增大;土壤有机质含量越高,辛菌胺的降解越快;山东(棕壤)和广西(红壤)土壤中辛菌胺降解较快;土壤含水率越高,辛菌胺降解越快。
辛菌胺; 土壤; 降解; LC-MS/MS
农药使用后,80%~90%的药量最终进入土壤。农药对土壤的污染与农药的理化性质、自然环境条件以及农药使用的历史等因素密切相关[1-2]。农药在土壤中的降解是评价农药环境安全性的重要指标,对农药的持效性及在环境中的残留消解动态有直接影响[3]。辛菌胺的化学名称为N,N-二正辛基二乙烯三胺,是我国开发的广谱、低毒杀菌剂,对导致作物病害的多种植物真菌、细菌和病毒均有显著的杀灭和抑制作用[4-5]。可破坏病菌的细胞膜,抑制呼吸系统,凝固蛋白质,使酶变性而产生抑菌和杀菌作用。适用于烟草、苹果、水稻、辣椒、棉花的多种病害,尤其是病毒类病害的防治[6-7]。辛菌胺作为一种新型杀菌剂,目前国内外尚无关于其在土壤中降解的研究。因此,笔者通过室内模拟试验,以液相色谱三重串联四级杆质谱(LC-MS/MS)检测法[8-11]对辛菌胺在不同条件土壤中的降解进行测定,探讨其影响因素及其降解规律,为生产上的安全使用提供参考。
1 材料与方法
1.1 材料
1.1.1 供试药剂 辛菌胺标准品(纯度95%)购于北京勤诚亦信科技开发公司,色谱纯甲醇为美国霍尼韦尔公司生产,分析纯乙腈购于成都金山化学试剂有限公司。
1.1.2 仪器设备 液相色谱质谱/质谱联用仪:液相(岛津LC-20A),质谱(美国Applied Biosystems公司4000 QTRAP质谱仪),涡旋混合器(QL-901型,江苏海门市麒麟医用仪器厂),电子天平(ALC-210.4型,德国Sartorius公司),超声波清洗器(KQ-100B型,昆山市超声仪器有限公司)。
1.1.3 土壤 选取贵州、山东和广西3地的空白土壤,自然风干并碾碎,过2 mm土壤筛备用。供试土样的基本理化性质见表1。
表1 各地供试土壤中的有机质含量及pH
Table 1 Content of organic matter and pH in different soils
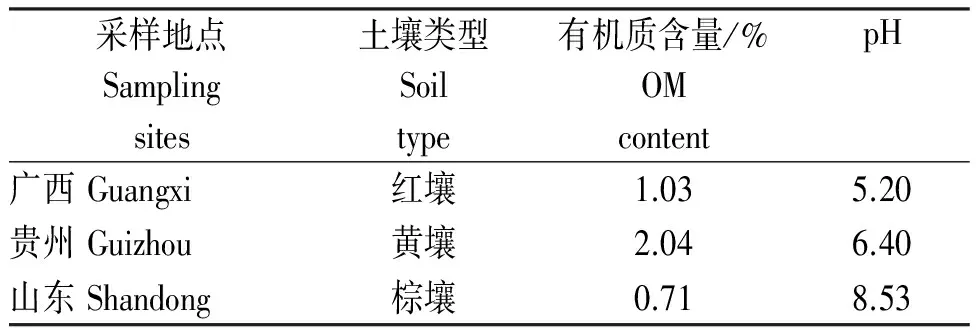
采样地点Samplingsites土壤类型Soiltype有机质含量/%OMcontentpH广西Guangxi红壤1.035.20贵州Guizhou黄壤2.046.40山东Shandong棕壤0.718.53
1.2 土壤中辛菌胺的测定方法
1.2.1 土壤前处理 称取10.0 g土壤样品于50 mL离心管中,加入30 mL乙腈涡旋3 min,超声30 min,加入5 g无水硫酸镁和5 g氯化钠,6 000 r/min离心5 min,取1 mL上清液过0.22 μm滤膜,LC-MS/MS检测。
1.2.2 仪器条件
质谱条件:离子源为电喷雾离子源ESI;正离子扫描模式为离子源气体(GS1)50.0 psi,离子源气体(GS2)50.0 psi,离子喷雾电压5 500 V,气帘气30 psi,离子源温度550°C。检测方式为多重反应监测(MRM)(表2)。
液相条件:色谱柱为Ultra AQ C18(2.1×100 mm,3 μm),进样量5.0 μL,柱温40℃,流速0.2 mL/min,流动相中A相为甲醇,B相为0.1%三氟乙酸水溶液梯度洗脱。辛菌胺的标样色谱见图1。

表2 辛菌胺的多重反应监测数据
图1 辛菌胺的标样色谱
Fig.1 Standard sample chromatograms of Xinjunan
1.2.3 检测方法的验证 准确称取10 g土壤样品于50 mL离心管中,分别添加3个浓度(0.1 μg/mL,1 μg/mL,10 μg/mL)的辛菌胺标准溶液,每个浓度设5个平行,按照1.2中的方法测定回收率,按照1.2.2中的仪器条件检测。计算辛菌胺在土壤中的回收率及其RSD,验证方法的可行性。
1.3 不同因素对辛菌胺在土壤中降解的影响试验
1.3.1 药剂浓度 准确称取10 g贵州土壤于50 mL离心管中,用无菌蒸馏水调节其含水率为60%。分别加入1 μg/mL、10 μg/mL辛菌胺标准样品溶液,使土壤中样品的初始浓度为0.1 mg/kg和1 mg/kg,每个样品设3次重复,并置于25°C避光恒温箱中培养,于加药后2 h、1 d、3 d、5 d、7 d、10 d和14 d取样,按1.2中的方法测定辛菌胺在土壤中的残留量。
1.3.2 是否去有机质 取一定量的贵州土壤置于500 mL玻璃杯中,加入少量蒸馏水侵润土壤,加入一定量的H2O2溶液,搅拌使其氧化。将去有机质的土壤放入烘箱烘干。准确称取10 g去有机质与未去有机质土壤于50 mL离心管中,用无菌蒸馏水调节其含水率为60%。分别加入10 μg/mL辛菌胺标准样品溶液,使土壤中样品的初始浓度为1 mg/kg,每个样品3次重复,置于25°C避光恒温箱中培养,于加药后2 h、1 d、3 d、5 d、7 d、10 d和14 d取样,按照1.2中的方法测定辛菌胺在土壤中的残留量。
1.3.3 不同类型土壤 分别准确称取10 g贵州(红壤)、广西(黄壤)、山东(棕壤)土壤于50 mL离心管中,用无菌蒸馏水调节其含水率为60%。分别加入10 μg/mL辛菌胺标准样品溶液,使土壤中样品的初始浓度为1 mg/kg,每个样品3次重复,并置于25°C避光恒温箱中培养,于加药后2 h、1 d、3 d、5 d、7 d、10 d和14 d取样,按照1.2中的方法测定辛菌胺在土壤中的残留量。
1.3.4 土壤含水率 准确称取10 g贵州土壤于50 mL离心管中,用无菌蒸馏水分别调节其含水率为30%、60%和90%。分别加入10 μg/mL辛菌胺标准样品溶液,使土壤中样品的初始浓度为1 mg/kg,每个样品3次重复,置于25°C避光恒温箱中培养,于加药后2 h、1 d、3 d、5 d、7 d、10 d和14 d取样,按照1.2中的方法测定辛菌胺在土壤中的残留量。
2 结果与分析
2.1 检测方法的可行性
表3结果表明,辛菌胺在土壤中的回收率为81.24%~107.5%,RSD为1.19%~6.75%,符合农药残留分析要求,方法可行。

表3 辛菌胺在土壤中的添加回收率
2.2 不同条件下辛菌胺在土壤中的降解情况
2.2.1 辛菌胺浓度 降解曲线(图2)表明,随着时间的推移,辛菌胺在土壤中的残留呈下降趋势。辛菌胺的降解符合一级反应动力学方程。从表4得知,当添加1 mg/kg辛菌胺标准溶液时,半衰期为7.4 d,而当添加0.1 mg/kg时,半衰期降为6.1 d,表明辛菌胺在土壤中的降解速率随着药剂质量的减小而增大,原因可能是辛菌胺的浓度对土壤中微生物的影响较大,当浓度较高时,生物活性受到抑制[12]。
2.2.2 去有机质土壤 从图2看出,辛菌胺在去有机质土壤中的降解比未去有机质土壤中的慢,其残留的降解符合一级反应动力学方程。根据表4结果,辛菌胺在去有机质的土壤中半衰期为8.0 d,在未去有机质的土壤中半衰期为7.4 d,说明,辛菌胺在有机质含量丰富的的土壤中降解较快,其原因可能是有机质含量高的土壤中微生物数较多,可加速对辛菌胺的降解。
2.2.3 土壤类型 从图2看出,辛菌胺在贵州(红壤)和山东(棕壤)的土壤中降解较快,符合一级反应动力学方程。从表4可知,辛菌胺在山东土壤中的半衰期为6.9 d,在广西的为7.0 d,在贵州的为7.4 d,表明辛菌胺在不同类型土壤中的降解存在一定的差异。
2.2.4 土壤含水率 辛菌胺的降解符合一级反应动力学方程(图2)。从表4结果可知,辛菌胺在30%含水率的土壤中半衰期为7.9 d,在60%含水率的土壤中半衰期为7.4 d,在90%含水率的土壤中半衰期为5.9 d,表明土壤中含水率越高,辛菌胺降解得越快,原因可能是土壤中的水分有利于土壤中微生物的活动以及酶活性的发挥[13-14]。
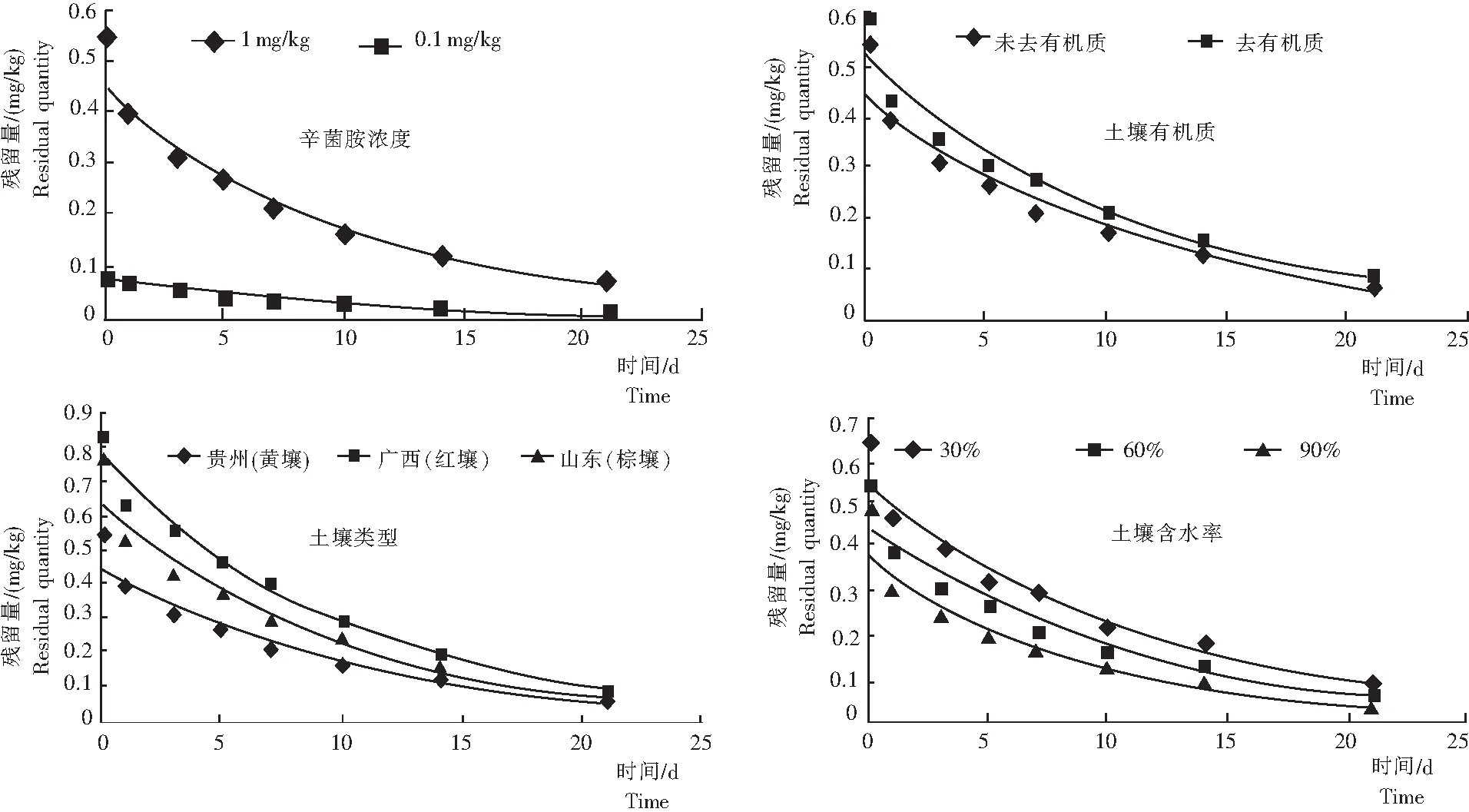
图2 辛菌胺浓度、土壤去有机质、土壤类型和土壤含水率条件下辛菌胺的残留量
Fig.2 Residual quantity of Xinjunan in the residual concentrations, removing OM or not, different soil type and soil moisture content
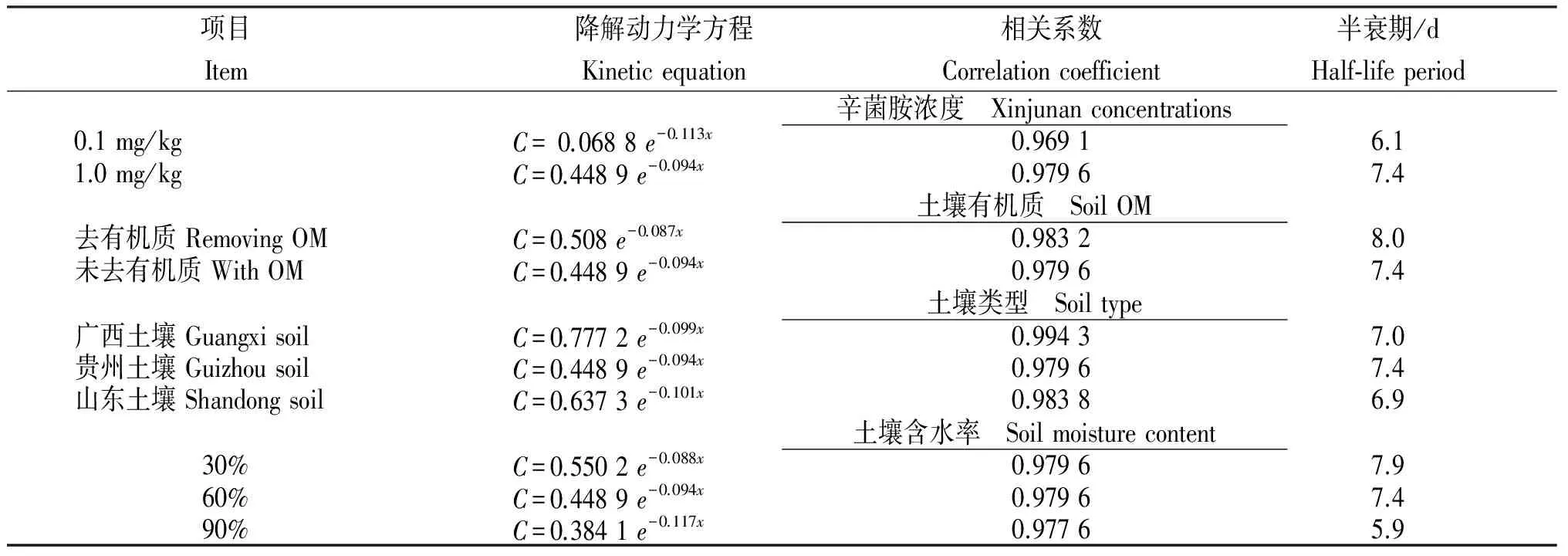
表4 不同条件下辛菌胺土壤中降解的动力学参数
3 结论与讨论
降解是农药在土壤环境中最主要的转化方式,其降解速率主要与农药本身的理化性质和施药地区的自然环境条件等因素有关[15],农药在农田使用后,约有70%~80%的药剂进入土壤中,影响农药在土壤中的降解因素较多[16]。本研究结果表明,土壤中辛菌胺的降解速率随土壤中辛菌胺含量的减小而增大,有机质含量多的土壤其降解也越快,辛菌胺在贵州(红壤)和山东(棕壤)的土壤中降解较快,土壤中含水率越高,辛菌胺降解也越快。
[1] 王 军,温家钧,边侠玲.我国农药生产、苯醚甲环唑在土壤中的降解动力学及其影响因子[J].西北农业学报,2009,18(6):342-346.
[2] 王玉杰.农药残留预测模型的可靠性分析[J].植物保护学报,1999,26(4):363-366.
[3] Ma X L, Yu P B, Gao H N, et al. Bioremediation of exogenous degrading bacteria to the nicosulfuron-contaminated soil[J].Journal of Safety and Environment,2011,11(4):44-47.
[4] 潘灿平.菌毒清-辛菌胺结构鉴定与分析方法建立[C].第九届全国农药质量管理与分析技术交流会,2008.
[5] 李雪生,徐 军,潘灿平,等.辛菌胺有效成分结构鉴定,母药组成与产品定量分析方法的建立[J].农药科学与管理,2009,30(4):8-13.
[6] 蔡建和,周兴华,黄福新,等.广西烟草病毒病发生相关因素分析及综合防治研究[J].广西农业科学,2009,11(2):159-163.
[7] 周建国,肖启明,刘双清,等.烟草花叶病毒病发生及防治研究进展[J].安徽农业科学,2013,41(1):121-122.
[8] Chen X S,Biao Z Y,Hou H W,et al.Development and validation of a Method for the Deter- mination of 159 Pesticide Residues in Tobacco by Gas Chromatography-Tandem Mass Spectrometry[J].Agricultural and Food Chemistry,2013,23(5):5746-5757.
[9] 杨 飞,边照阳,唐纲岭.LC-MS/MS同时检测烟草中的6种杀菌剂[J].烟草科技,2012,304(11):45-50.
[10] Alexandra B B,Antoine Vauchez,Laure Wiest,et al.Multi-residue analysis of emerging pollutants in sediment using QuEChERS-based extraction followed by LC-MS/MS analysis[J].Analytical and Bioanalytical Chemistry,2014,406:1259-1266.
[11] Tian H Z. Uncertainty Analysis of Chlormequat Residue in Fruits by LC-MS-MS[J].Chromatographia,2011,73:457-462.
[12] 洪文良,吴小毛.敌草胺在植烟土壤中的降解规律[J].贵州农业科学,2012,40(6):201-206.
[13] 沈齐英,沈秋英.农药的使用现状及发展趋势[J].北京石油化工学院学报,2003,3(1):56-60.
[14] Smith S C, Ainsworth C C, Traina S J. Effect of sorption on biodegradation of quinoline[J].Soil Science Society of America Journal,1992,65:737-746.
[15] 华小梅,单正军.我国农药生产、使用状况及其影响因素分析[J].环境科学进展,1996,4(2):33-45.
[16] Hoehl H, Barz W. Metabolism of the insecticide phoxim in plants and cell suspension cultures of soybean[J].Journal of Agricultural and Food Chemistry,1995(4):1052-1056.
(责任编辑: 聂克艳)
Influencing Factors of Degradation of Xinjunan in Soil
JIN Mingjiao, WU Zengxue, ZHONG Lei, PAN Sizhu, HU Deyu*
(StateKeyLaboratoryBreedingBaseofGreenPesticideandAgriculturalBioengineering,MinistryofEducation,CenterforR&DofFineChemicals,GuizhouUniversity,Guiyang,Guizhou550025,China)
To explore the degradation rule of Xinjunan in soils,The degradation of Xinjunan in different soils was investigated under laboratory conditions with governing factors explored. Liquid chromatography coupled with tandem mass spectrometry (LC-MS/MS) was employed to explore the influencing factors such as concentration, whether removing OM, soil types and soil moisture content. Results: The degradation rate of Xinjunan increased with decreasing the drug dose concentration;The degradation rate increased with increasing the content of organic substance. The degradation rate form Shandong and Guangxi Provinces were faster than Guizhou Province. The higher the soil moisture content, the faster the degradation of Xinjunan.
Xinjunan; soil; degradation; LC-MS/MS
2015-12-25; 2016-04-10修回
金明姣(1990-),女,在读硕士,研究方向:农药残留分析。E-mail:jinjiao1218@163.com
*通讯作者:胡德禹(1965-),女,研究员,从事农药残留分析。E-mail:fcc.dyhu@gzu.edu.cn
1001-3601(2016)04-0163-0071-04
S482.2+6; X529
A
