渗透胁迫对小桐子幼苗脯氨酸积累及其代谢途径的影响*
2016-02-26邓凤飞杨双龙龚明
邓凤飞,杨双龙,龚明
(云南师范大学生命科学学院,生物能源持续开发利用教育部工程研究中心,
云南省生物质能与环境生物技术重点实验室,云南 昆明650500)
渗透胁迫对小桐子幼苗脯氨酸积累及其代谢途径的影响*
邓凤飞,杨双龙,龚明
(云南师范大学生命科学学院,生物能源持续开发利用教育部工程研究中心,
云南省生物质能与环境生物技术重点实验室,云南昆明650500)
摘要:植物在渗透胁迫下,积累脯氨酸以降低渗透势是重要的抗逆境调节途径。本研究以聚乙二醇(PEG 6000)不同浓度的溶液模拟渗透胁迫,研究了其对小桐子幼苗脯氨酸积累及其代谢途径的影响。结果表明,PEG 6000处理可显著提高小桐子幼苗的脯氨酸含量及脯氨酸合成代谢关键酶Δ1-吡咯琳-5-羧酸合成酶(P5CS)和鸟氨酸转氨酶(OAT)的活性,而降低了脯氨酸脱氢酶(ProDH)的活性。RT-PCR分析也显示,10 %PEG 6000处理显著上调了P5CS和OAT基因的表达水平,但抑制了ProDH基因的表达,表明渗透胁迫可通过活化脯氨酸合成的两条途径和抑制其降解途径促使小桐子积累大量的脯氨酸。
关键词:小桐子;脯氨酸;渗透胁迫;代谢途径
小桐子(Jatrophacurcas)又名小油桐、麻疯树等,属大戟科(Euphorbiaceae)麻疯树属(Jatropha)重要能源植物,广布于世界热带地区,在中国主要生长于云南、四川、海南等地[1~3]。其所具备的适应范围广、生物产量大、耐贫瘠等特性使之成为绿化荒山、水土保持的先锋树种[2~3]。此外,小桐子种子可入药,也是开发新药的理想资源。特别是其种子含油量高,油质近似柴油,是一种理想的可再生石油植物,受到了广泛的关注[3~6]。小桐子作为热带起源的树种,一般认为其应具有较强的耐旱能力[4~6]。但有不少证据表明,小桐子对渗透胁迫很敏感,干旱和半干旱地区的小桐子生长状况远不如降雨丰富地区[7]。
渗透胁迫是影响植物生长的主要因素之一,是农业生产的主要自然灾害,是植物生长发育过程中最易受到的逆境胁迫,它对植物的伤害表现在:抑制生长、光合作用下降、产生过量的活性氧等[8~9]。植物在渗透胁迫下,通过降低细胞渗透势以适应水分胁迫环境[7~9],其中积累一定量的相容渗透剂(Compatible osmolyte)以降低水势是一种主要途径[8~9]。作为植物细胞内合成的有机渗透调节剂,脯氨酸是分布最广的一种。植物体内脯氨酸的积累通过合成的增加与降解的减少而实现[9~14],其中,Δ1-吡咯琳-5-羧酸合成酶(Δ1-pyrroline-5-carboxylate synthetase,P5CS)、谷氨酸脱氢酶(glutamate dehydrogenase,GDH)与鸟氨酸转氨酶(ornithine aminotransferase,OAT)、精氨酸酶(Arginase)分别是脯氨酸合成中谷氨酸和鸟氨酸途径的限速酶[8,11],而脯氨酸脱氢酶(proline dehydrogenase,ProDH)是脯氨酸降解途径的关键酶[11~14]。
Kumar 等[14]和陈凯、许锁链等[15~16]的研究表明渗透和干旱胁迫可诱导小桐子体内积累大量脯氨酸,但对其具体调控机理还报道较少。本研究通过检测渗透胁迫下小桐子幼苗脯氨酸含量、代谢关键酶活性及基因表达的变化,以初步阐明渗透胁迫诱导小桐子幼苗脯氨酸积累的机理,为下一步小桐子抗渗透胁迫的相关研究奠定基础。
1材料与方法
1.1 材料及培养
小桐子种子采自云南省元谋县,室温避光储存。参照李忠光等[17]的方法用1.5 %(W/V)的硫酸铜溶液消毒30 min,蒸馏水浸种24 h后,播于垫有7层湿滤纸的白磁盘中。26℃下暗萌发7天,将萌发后的种子于1/2 Hogland营养液、26/20 ℃(昼/夜)、16 h的光照〔强度300 μmol/(m2·s)〕、75 %的相对湿度的人工气候培养箱中砂培生长15天。
1.2 PEG模拟渗透胁迫
将上述培养22天的小桐子幼苗置于以1/2 Hogland营养液配制的不同浓度(2 %、4 %、6 %、8 %、10 %、15 %、20 %、25 %)PEG 6000溶液(模拟渗透胁迫环境)中,26℃、16 h的光照 (光照强度同上)、75 %的相对湿度的人工气候箱中胁迫4 天,对照以1/2 Hogland营养液培养,之后测定相关指标。
1.3 测定方法
1.3.1脯氨酸含量及其代谢关键酶活性的测定
脯氨酸含量及其代谢关键酶活性的测定均以小桐子幼苗叶片为材料。脯氨酸含量按Bates 等[18]的酸性茚三酮法测定;P5CS和OAT的活性测定参照杨双龙[19~21]的方法进行,以单位时间内吡咯琳-5-羧酸(pyrroline-5-carboxylate,P5C)的生成量表示;ProDH活性测定参考Sanchez等[22]的方法,以单位时间内NAD+消耗量表示。 蛋白质的测定按照Bradford[23]方法进行,以牛血清蛋白为标准样品。
1.3.2RNA提取和RT-PCR分析
利用两步裂解法[24]分别提取正常培养(对照)与10 % PEG 6000处理的小桐子叶片总RNA,并利用DNase I消化基因组DNA使之得以纯化。然后以随机引物逆转录,利用TransScript Two-Step RT-PCR SuperMix合成第一链cDNA(购自北京全式金生物技术有限公司)。以18S rRNA(GeneBank登录号:AY823528)为内参进行JcP5CS(GenBank登录号:GU358610)、OAT(参照小桐子转录组测序结果CL5177.contig1[25])、ProDH(GenBank登录号:KF879446) 的RT-PCR表达分析(引物序列见表1)。
18S rRNA的扩增条件为:94℃ 5 min→[94℃ 30 s,51℃ 30 s,72℃ 30 s]26→72℃ 10 min;JcP5CS和OAT基因的扩增采用touch-down PCR条件:94℃ 5 min→{94℃ 30 s,[60℃→48℃ 30 s],72℃ 30 s}→[94℃ 30 s,47℃ 30 s,72℃ 30 s]26→ 72℃ 10 min};ProDH基因的扩增条件为,94℃ 5 min→[94℃ 30 s,51℃ 30 s,72℃ 30 s]26→72℃ 10 min。反应完毕后取5 μL体系进行1.2 %的琼脂糖凝胶电泳检测,以18 SrRNA为内参进行各基因表达的差异性分析。

表1 试验中用到的引物
1.4 数据处理
所有实验进行3次独立重复。实验数据采用SPSS13.0进行方差分析。统计结果用Sigmaplot 10.0作图,图中的数据均为平均值±标准误。
2结果与分析
2.1 最佳聚乙二醇浓度的筛选
为了确定适宜的PEG 6000处理浓度,分别用0、2 %、4 %、6 %、8 %、10 %、15 %、20 %及25 %的PEG 6000溶液处理小桐子幼苗4 天,叶片的脯氨酸含量测定结果见图1。
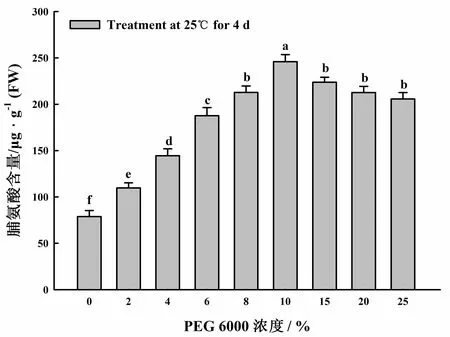
图1 不同浓度PEG 6000处理对小桐子叶片
由图1可知,随着PEG 6000处理浓度的增加,小桐子叶片中脯氨酸含量逐渐升高,处理浓度在10 %和15 %时脯氨酸含量相对较高,与对照相比,脯氨酸含量分别上升了212.1 %(P<0.01)和184.1 %(P<0.01),之后脯氨酸含量逐渐降低,但仍显著高于对照。综合考虑,后续实验选用10 %和15 %的PEG 6000溶液来处理小桐子幼苗并进行脯氨酸代谢关键酶活性的测定。
2.2 10 %和15 % PEG 6000处理对小桐子叶片脯氨酸含量的影响
图2为10 %和15 % PEG 6000处理4天对小桐子幼苗脯氨酸含量变化的影响。由图可知,与对照相比,10 %与15 % PEG 6000处理下小桐子叶片中脯氨酸的积累呈逐步上升趋势。15 % PEG 6000处理下小桐子叶片脯氨酸的含量在0-2天内增加较10 %处理快,2 天以后减缓,而10 % PEG 6000处理下小桐子叶片脯氨酸的含量则一直升高。推测可能是15 % PEG 6000相对胁迫强度较大,对小桐子幼苗造成了一定程度的生理伤害,从而影响了其脯氨酸代谢途径,降低了脯氨酸的积累量。
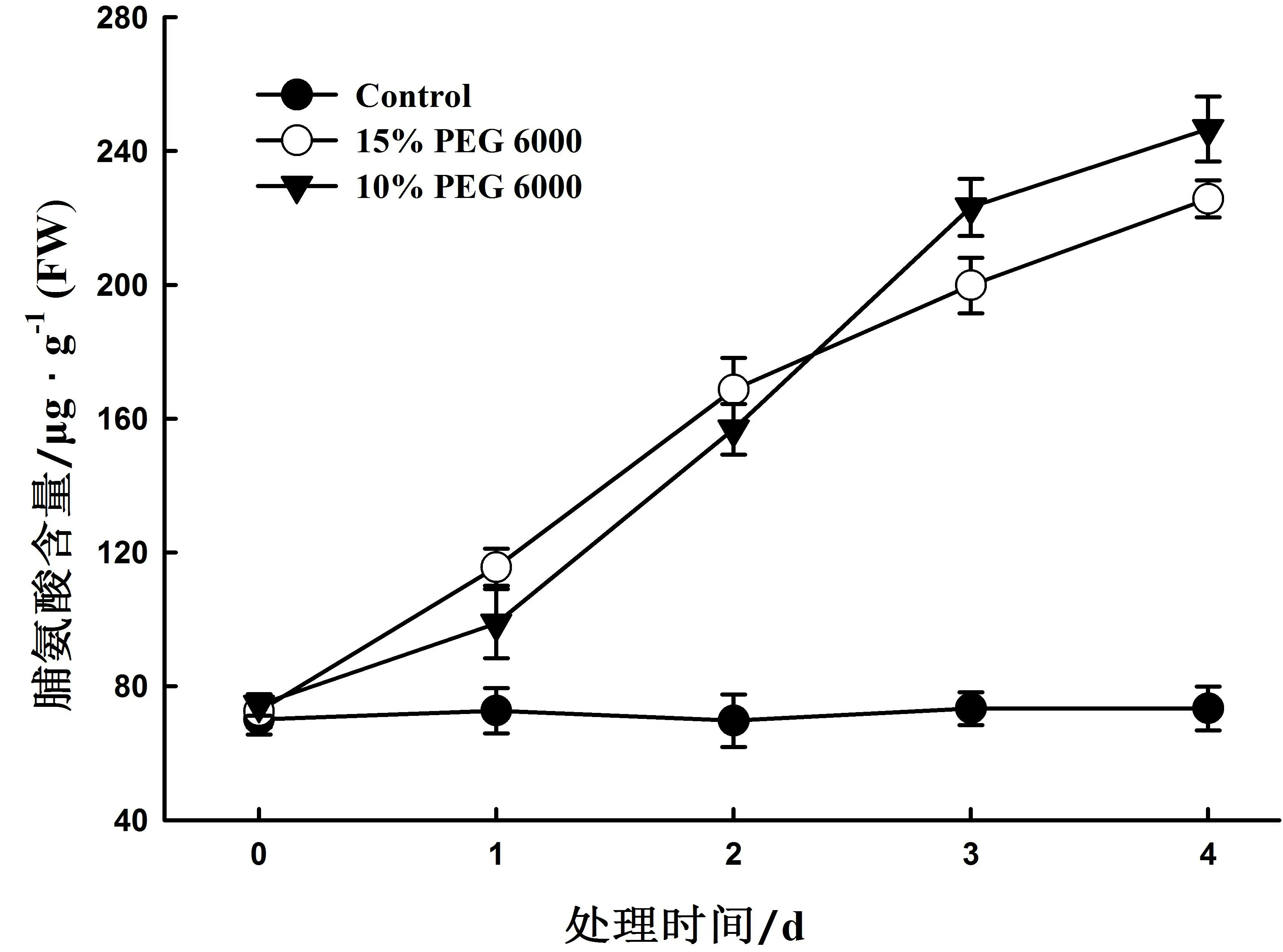
图2 10 %和15 %PEG 6000处理下小桐子叶片
2.3 10 %和15 %PEG 6000处理对小桐子叶片脯氨酸代谢关键酶活性的影响
P5CS和OAT分别是脯氨酸合成的谷氨酸途径和鸟氨酸途径的关键酶[8,11]。图3的结果表明,10 %与15 % PEG 6000处理均可提高P5CS的活性。与对照相比,PEG 6000处理后第4 天小桐子叶片P5CS的活性分别升高了114.3 %(P<0.01)和93.0 %(P<0.01)。在0-2 天,15 % PEG 6000处理,小桐子叶片P5CS活性升高速度较快,3-4 天后其上升幅度明显减缓,而在10 % PEG 6000处理下,P5CS活性却一直保持上升趋势,且超过了15 % PEG 6000处理。因此,随着处理时间的延长,10 % PEG 6000诱发的P5CS活性增强效应更好,这与幼苗中脯氨酸含量的变化趋势基本一致(图2)。
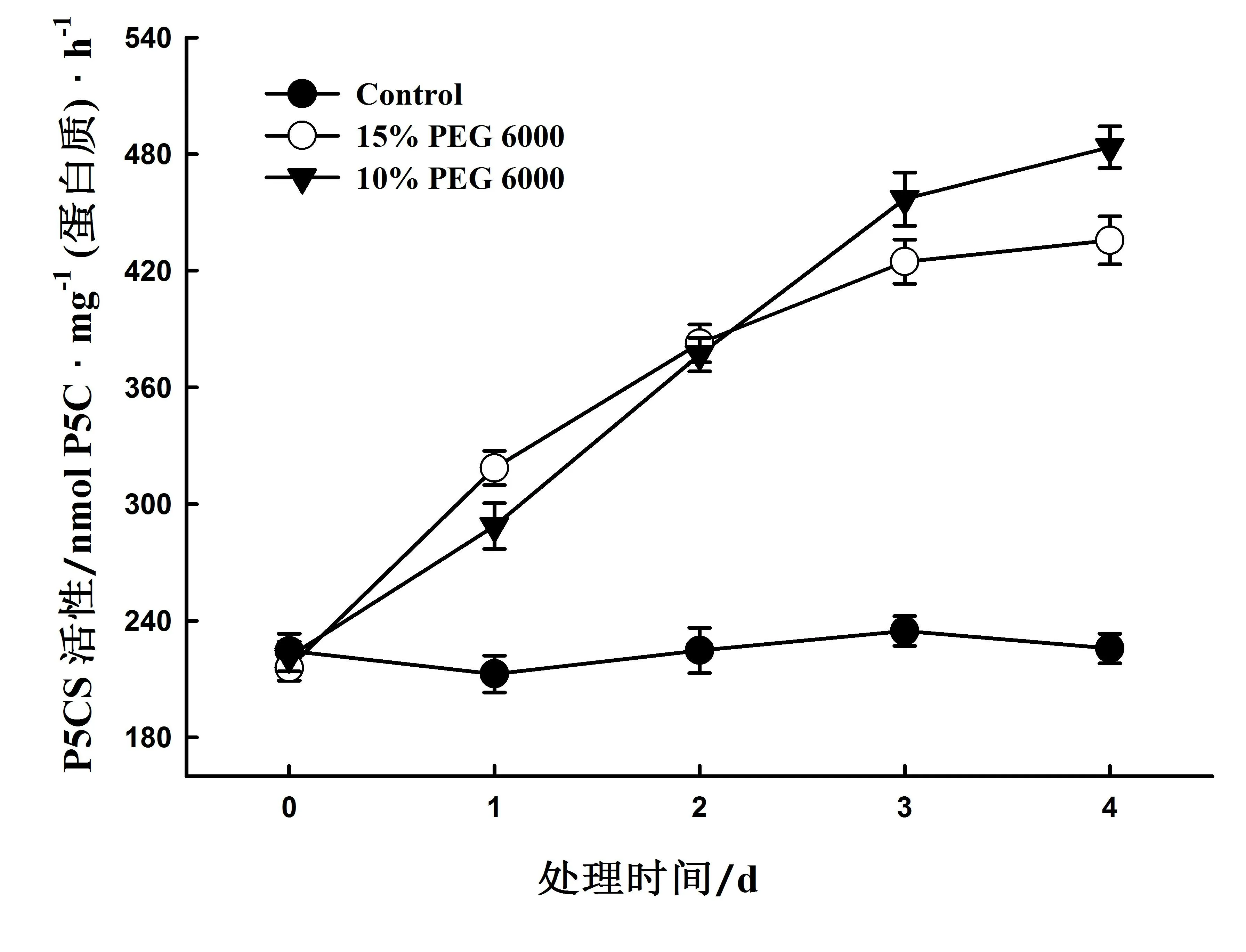
图3 10 %和15 %PEG 6000处理下小桐子叶片
图4显示,10 %与15 % PEG 6000处理均可显著提高OAT酶的活性,且在处理的0-3天,15 %PEG 6000诱发的OAT酶活性增强效应略好于10 % PEG 6000,但第3天以后10 % PEG 6000诱发的OAT酶活性增强效应有超越15 % PEG 6000处理的趋势。

图4 10 %和15 %PEG 6000处理下小桐子叶片
植物体内脯氨酸的积累由合成代谢与分解代谢的综合结果决定,而控制降解途径的关键酶是ProDH[11~14]。10 %与15 % PEG 6000处理均可降低ProDH的活性。在0-2 天,15 % PEG 6000处理下,小桐子叶片ProDH活性下降速度较快,之后3-4天下降幅度减缓,而10 % PEG 6000处理下的幼苗叶片,ProDH活性呈持续下降趋势,并在PEG处理的第2天以后明显低于15 %PEG 6000处理。到了第4 天,小桐子叶片中ProDH的活性分别下降了60.6 %(P<0.01)和50.5 %(P<0.01)(图5)。上述结果表明,10 % PEG 6000处理对小桐子叶片ProDH的抑制效应优于15 % PEG 6000处理(P<0.05)。

图5 10 %和15 % PEG 6000处理下小桐子叶片
2.4 10 %PEG 6000处理下小桐子幼苗脯氨酸代谢关键酶基因的表达差异
综合评价后,我们再以10 % PEG 6000处理小桐子幼苗,通过半定量RT-PCR分析脯氨酸代谢关键酶基因的表达情况,结果表明,P5CS、OAT、ProDH在渗透胁迫下,存在明显的基因表达特异性。P5CS基因的表达表现出上调—下调—上调的的变化趋势,与对照相比,在处理的第2天与第4天表达量上调达到极显著水平;OAT基因的表达呈现持续上调的趋势,到第2天时达到最高表达量,之后又开始缓慢下降,但其表达量仍显著高于对照;而ProDH基因则表现为整体持续下调的变化趋势(图6)。
注:CK为对照 (正常生长材料);1d为10 % PEG 6000 处理第1天;2d为10 % PEG 6000 处理第2天;3d为10 % PEG 6000 处理第3天; 4d为10 % PEG 6000 处理第4天。
图610 %PEG 6000 对小桐子叶片JcP5CS、OAT及ProDH基因表达的影响
Fig.6Effect of 10 % PEG 6000 on the expression ofJcP5CS,OATandProDHgenes in
J.curcasleaves.RT-PCR analysis;BRelative quantities analysis
3讨论
植物在受到干旱、低温、高盐、重金属等非生物胁迫时,都会直接或间接地发生渗透胁迫(水分胁迫)。植物会在短时间内,通过积累如脯氨酸、甜菜碱等渗透调节物质,以增强其对逆境的抵抗能力[26]。脯氨酸作为一种理想的渗透调节物质,因其分子量小、极易溶于水等特性,在植物抗渗透胁迫中发挥重要作用[27]。黄静等[28]通过30 % PEG 6000处理发现,小桐子幼苗脯氨酸含量呈现先上升后下降的变化趋势;另外,许锁链等[16]的研究表明,渗透及干旱胁迫均可诱发小桐子的脯氨酸积累,但其具体机理并不清楚。本研究也表明, 经过10 %与15 % PEG 6000处理可促进小桐子叶片脯氨酸的大量积累(图1~2),与上述报道一致。同时,合成与降解代谢关键酶的活性(P5CS和OAT升高、ProDH下降)与基因表达量(P5CS和OAT上调、ProDH下调)的变化趋势基本一致,其中,以10 % PEG 6000处理诱导的脯氨酸的积累效应最为显著。这些结果表明,渗透胁迫可通过活化脯氨酸的合成和抑制其降解促使小桐子体内积累大量的脯氨酸。
脯氨酸合成的2条途径(谷氨酸途径和鸟氨酸途径)对渗透胁迫下脯氨酸积累的贡献还存在较多的争议[29~30]。本研究结果表明,渗透胁迫可诱发谷氨酸途径关键酶P5CS活性和鸟氨酸途径关键酶OAT活性的大幅上调,但从基因表达变化来看,JcP5CS基因的表达呈一定的波动性,而OAT基因则呈持续高表达状态(图6),表明PEG 6000模拟的渗透胁迫下,两条合成途径在脯氨酸积累中都发挥了重要作用。因此,渗透胁迫诱导的小桐子幼苗脯氨酸积累实际上是脯氨酸合成的谷氨酸和鸟氨酸途径被活化及降解途径被抑制的综合结果(图1~6)。
参考文献:
[1]欧文军,王文泉,李开绵.能源植物小桐子及其发展战略讨论[J].中国农学通报,2008,24(9):496-499.
[2]陈兴祥.能源植物蒿桐的生产与研究现状[J].山东林业科技,2009(3):142-145.
[3]陈钰,魏琴,唐琳,等.麻疯树营养器官和种子的蛋白质组成及对水分和温度胁迫的反应[J].中国油料作物学报,2003,25(4):98-104.
[4]Makkar HPS,Becker K.Jatrophacurcas,a promising crop for the generation of biodiesel and value-added coproducts [J].Eur Lipid Sci Tech,2009,111:773-787.
[5]Carels N.Jatrophacurcas:A Review [J].Adv Bot Res,2009,50:39-86.
[6]Maes WH,Trabucco A,Achten WMJ,etal.Climatic growing conditiongs ofJatrophacurcasL.[J].Biom Bioener,2009,33:1481-1485.
[7]Trovato M,Mattioli R,Costntino P.Multiple roles of proline in improving plant abiotic stress tolerance and development [J].Rendiconti Lincei,2008,19:325-346.
[8]Hsiao TC.Plant response to water stress [J].Ann Rev Plant Physiol,1973,24:519-570.
[9]Lopez R,Aranda I,Gil L.Osmotic adjustment is a significant mechanism of drought resistance inPinuspinasterandPinuscanariensis[J].Invest Agrar:Sist Recur For,2009,18:159-166.
[10]Ashraf M,Foolad MR.Roles of glycine betaine and proline in improving plant abiotic stress resistance [J].Environ Exp Bot,2007,59:206-216.
[11]Kishor PBK,Sangam SA,Mrutha RN,etal.Regulation of proline biosynthesis,degradation,uptake and transport in higher plants:Its implications in plant growth and abiotic stress tolerance [J].Curr Sci,2005,88:424-438.
[12]Delauney AJ,Verma DPS.Proline biosynthesis and osmoregulation in plants [J].Plant J,1993,4:215-213.
[13]Zhao FJ,Cheng S,Liu YL.Ornithine pathway in proline biosynthesis activated by salt stress in barley seedlings [J].Acta Bot Sin,2001,43:36-40.
[14]Kumar A,Sharma S,Mishra S.Influence of arbuscular mycorrhizal (AM) fungi and salinity on seedling growth,solute Accumulation,and mycorrhizal dependency ofJatrophacurcasL.[J].Plant Growth Regul,2010,29:297-306.
[15]Chen K,Gong M.Changes of water Status and different responses of osmoregulants inJatrophacurcasL.seedlings to Air-drought Stress [J].Agricultural Science & Technology,2011,12(3):343-346.
[16]许锁链,李忠光,龚明.外源甜菜碱对PEG 胁迫下小桐子种子萌发和幼苗生长的保护作用[J].种子,2011,30(9):29-33.
[17]李忠光,龚明.不同化学消毒剂对小桐子种子萌发和幼苗生长的影响[J].种子,2011,30(1):4-12.
[18]Bates LS,Waldren RP,Teare ID.Rapid determination of free proline for water-stress studies [J].Plant Soil,1973,39:205-217.
[19]Yang SL,Lan SS,Gong M.Hydrogen peroxide-induced praline and metabolic pathway of its accumulation in maize seedlings [J].Joumal of Plant Physiol,2009,166:1694-1699.
[20]杨双龙,龚明.一氧化氮对玉米幼苗体内脯氨酸积累及其代谢途径的影响[J].植物生理学通讯,2009,45(8):781-784.
[21]杨双龙,龚明.操纵细胞CaM水平对转基因烟草脯氨酸代谢的影响[D].昆明:云南师范大学,2005.
[22]Sanchez E,Lopez-Lefebre LR,Garcia PC,etal.Proline metabolism response to highest nitrogen dosagess in green bean plants [J].Joumal of Plant Physiol,2001,158:593-598.
[23] Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].Anal Biochem,1976,72:248-254.
[24]林莎,罗绍银,林颖,等.从麻疯树胚乳中提取总RNA的快速方法 [J].应用与环境生物学报,2008,14(5):692-694.
[25]Wang HB,Zou ZR,Gong M,etal.Global analysis of transcriptome responses and gene expression profiles to cold stress ofJatrophacurcasL.[J].Plos One,2013,8(12):e82817.
[26]王丽媛,丁国华,黎莉.脯氨酸代谢的研究进展[J].哈尔滨师范大学自然科学学报,2010,26(2):84-89.
[27]焦蓉,刘好宝,刘贯山,等.论脯氨酸积累与植物抗渗透胁迫[J].中国农学通报,2011,27(7):216-211.
[28]黄静,戴晓,彭书明,等.干旱对麻疯树部分生理生化指标及基因表达的影响[J].四川大学学报(自然科学版),2009,46:223-227.
[29] Maes WH,Achten WMJ,Reubens B,etal.Plant-water relationships and growth strategies ofJatrophacurcasL.seedlings under different levels of drought stress[J].Arid Environ,2009,73:877-884.
[30] Kheira AAA,Atta NMM.Response ofJatrophacurcasL.to water deficits:Yield,water use efficiency and oilseed characteristics[J].Biom Bioener,2009,33:1343-1350.
Effect of Osmotic Stress on Proline Accumulation and
Metabolic Pathways of Jatropha curcas Seedlings
DENG Feng-fei,YANG Shuang-long,GONG Ming
(School of Life Sciences under Yunnan Normal University,Engineering Research Center of Sustainable Development and
Utilization of Biomass Energy under Ministry of Education,Kunming Key Laboratory of Biomass Energy and
Environmental Biotechnology of Yunnan Province,Kunming Yunnan 650500,P.R.China)
Abstract:Under osmotic stress,plants could accumulate proline to reduce the osmotic potential,which is an important anti-stress regulatory pathway.The effect of osmotic stress generated by polyethylene glycol (PEG 6000) on proline accumulation and metabolic pathways inJatrophacurcasseedlings was investigated in this study.The results showed that PEG 6000 stress could lead to a significant accumulation of proline,a rapid increase of activities of the key enzymes Δ1-pyrroline-5-carboxylate synthetase (P5CS) and ornithine aminotransferase (OAT) of proline biosynthesis,and a decrease of the activity of the key enzyme proline dehydrogenase (ProDH) of proline degradation.The RT-PCR analysis revealed that 10 % PEG 6000 stress activated the expression ofP5CSandOATgenes,but inhibited the expression ofProDHgene inJ.curcasseedlings,and that means that the osmotic stress-induced proline accumulation in theJ.curcasseedlings might be a combined result of the activation of glutamate pathway and ornithine pathways of proline biosynthesis and inhibition of proline degradation pathway.
Key words:Jatrophacurcas; proline;osmotic stress;metabolic pathway
通讯作者简介:龚明(1963-),男,教授,博士,研究方向为植物逆境生物学。E-mail:gongming63@163.com
作者简介:第一邓凤飞(1992-),女,硕士生,研究方向为植物生物化学与分子生物学。E-mail: dengfengfei163@163.com
基金项目:国家自然科学基金(31260169),国家自然科学基金(31260064)。
*收稿日期:2015-06-25
中图分类号:Q 945.78
文献标识码:A
文章编号:1672-8246(2016)01-0031-06

