六元瓜环对乌纠中黄酮类成分芦丁的缓释性能研究
2016-02-14李春荣孟铁宏
李春荣,孟铁宏
(黔南民族医学高等专科学校公共课教学部,贵州 都匀 558000)
六元瓜环对乌纠中黄酮类成分芦丁的缓释性能研究
李春荣,孟铁宏
(黔南民族医学高等专科学校公共课教学部,贵州 都匀 558000)
为研究六元瓜环对芦丁的溶解度及其缓释性能,利用紫外-可见吸收光谱法研究了六元瓜环与芦丁的相互作用以及pH对其作用的影响。结果表明,六元瓜环与芦丁形成了摩尔比1∶1的主客体包结物,包结平衡常数为3.6×105L/mol。芦丁原药,Q[6]-芦丁包结物在人工胃液(pH=1.2)中60 min内的累计释放度分别为60.19%、46.71%,在人工肠液(pH= 6.8)中的累计释放度分别为73.76%、48.58%,且缓释曲线非常相似。瓜环-芦丁主客体包结物的体外累积释放度明显低于芦丁原药,Q[6]对芦丁均有明显的体外缓释作用。
瓜环;乌纠;芦丁;缓释性;主客体相互作用
苗药乌纠是贵州苗族地区民间传统用药,乌纠中含有丰富的黄酮类化学成分[1]。黄酮类化合物在抑菌、抗炎、抗病毒等方面具有良好的药效,但长期过量服用中药也会造成胃粘膜损坏,肝损坏等[2-3]。瓜环一类具有较大疏水性空腔和亲水性端口的超分子化合物,瓜环对药物的包结作用不仅能提高药物的溶解度,还可以掩盖药物的不适气味[4-5]。瓜环空腔尺寸的大小与药物分子作用时有选择性,可以包结整个药物分子,也可以选择包结药物分子的部分结构或与药物分子发生端口作用[6-9]。瓜环与药物分子的包结作用在药物的控释和缓释、降低药物毒性等方面所表现出的优越性,已经成为当今研究的热点[10-12]。笔者在前期工作中已确定了乌纠中含有黄酮类化合物成分芦丁[13-14]。
本研究通过紫外-可见吸收光谱法考察了六、七、八元瓜环与芦丁的相互作用,以及瓜环Q[6]与芦丁包合物的体外药物缓释性能,以期能够提高乌纠中黄酮类成分芦丁的生物利用度,降低芦丁药物毒性,这对今后构建瓜环Q[n]-苗药体外缓释体系有重要意义。
1 实验部分
1.1 试剂和仪器
六元瓜环由某大学应用化学研究所合成;乌纠采自贵州黔南、黔东南苗族地区,经鉴定为铁角蕨科铁角蕨属植物变异铁角蕨;芦丁标准品外购(批号KB140211);水为超纯水,其他试剂均为分析纯。
Cary100紫外-可见分光光度计,Mettler AE 240电子天平,MP512-01精密pH计,MU5100DUVFR实验室超纯水系统,SHZ-82恒温水浴振荡器。
1.2 实验过程
1)紫外-可见吸收光谱的测定。配制浓度为1.0 mmol/L的芦丁标准品溶液、0.1 mmol/L的Q[6]溶液。固定客体芦丁的含量,改变瓜环的含量,配制成一系列摩尔比为0、0.2、0.4、0.6、0.8、……3.0的瓜环-芦丁溶液。采用Job法固定Q[n]和芦丁的总浓度(c(Q[n])+c(g))为0.04 mmol/L,逐渐改变Q[n]、芦丁的摩尔比,配制成N(Q[n])/(N(Q[n])+N(g))=0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0一系列待测溶液,以纯溶剂为空白,测定紫外吸收光谱。
2)Q[n](n=6、7、8)与芦丁相互作用体系的A-pH曲线。将Q[6]-芦丁溶液用缓冲溶液进行溶解定容,测定当Q[6]与芦丁的摩尔比N(Q[n])/N(g)为1时,一系列不同pH待测液的紫外吸收光谱。固定芦丁的浓度为0.03 mmol/L,配制一系列不同pH的待测溶液。一系列不同pH待测液的紫外吸收光谱。
3)包结物的制备。按N(Q[n])/N(g)=1称取适量的瓜环和芦丁,对Q[6]加适量超纯水超声使其全部溶解,芦丁在65℃超声溶解,将芦丁溶液逐渐加入瓜环溶液中,室温搅拌数小时,蒸除溶剂,得固体淡黄色包结物,红外灯下使其干燥备用。
4)包结物体外药物释放。准确称取6.2 mg的芦丁和含有相同芦丁质量的Q[6]包结物18.1 mg分别置于透析袋内,扎紧袋口后放置于人工模拟肠液((37±0.5)℃,pH=6.8磷酸二氢钾-磷酸氢二钠的缓冲溶液)或人工模拟胃液((37±0.5)℃,pH=1.2的盐酸溶液)中,在恒温震荡器内震荡,分别在5、10、15、20、30、40、50、60 min等不同时间点分别取样1 mL稀释到25 mL容量瓶,同时及时补液1 mL,在357 nm下测定稀释液的紫外吸光度。
2 结果与讨论
2.1 紫外-可见吸收光谱分析
利用紫外-可见吸收光谱,采用摩尔比法和等摩尔连续变换法考察了瓜环Q[6]与芦丁的相互作用,结果分别见图1~图3。
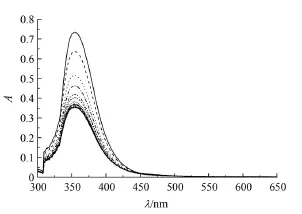
图1 Q[6]-芦丁作用体系的UV-vis吸收光谱Fig 1 UV-vis absorption spectra of interaction systems of Q[6]with rutin
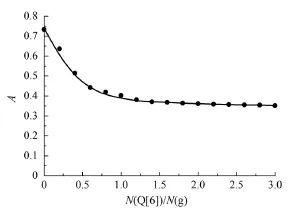
图2 吸光度随N(Q[n])/N(g)的变化Fig 2 Variation of absorbancy with N(Q[n])/N(g)
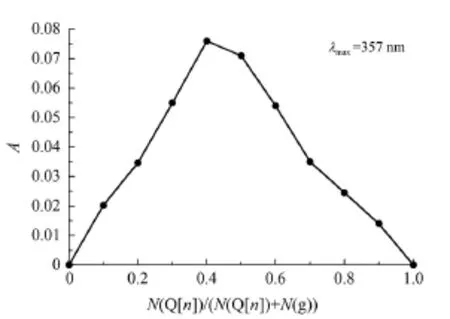
图3 Q[6]与芦丁相互作用的A~N(Q[n])/(N(Q[n])+N(g))变化Fig 3 A~N(Q[n])/(N(Q[n])+N(g))variation of interaction of Q[6]with the rutin
从图1可以看出,芦丁的紫外吸收光谱的最大吸收波长357 nm,Q[6]在此处几乎没有吸收。从图2可以看出,Q[6]与芦丁作用时,随着Q[6]量的增加,最大吸收峰均有微弱的蓝移现象,吸光度不断减弱。当主客体摩尔比接近1:1时,吸光度出现转折点,且随Q[6]含量的增大不再改变。原因Q[6]与芦丁相互作用形成的包结物在最大吸收波长处的吸光度比客体本身的吸光度小。随着Q[6]量的增加,游离客体的含量降低而包结配合物的含量增大。因此,吸光度随Q[6]的增加反而减小,当2者比例是1:1时,相互作用达到平衡,所以此时变化趋于平缓。同样说明二者相互作用形成摩尔比为1:1的包结物。
从图3可以看出,Q[6]与客体相互作用2条切线的交点在0.5左右,Q[6]与芦丁相互作用形成1:1主客体包结物,这和摩尔比法的到的结论是一致的,2种方法相互佐证,并求得包结物的包结平衡常数3.6×105L/mol。
2.2pH对瓜环Q[6]与芦丁相互作用的影响
图4给出了Q[6]与芦丁作用体系在不同pH下的紫外吸光度。
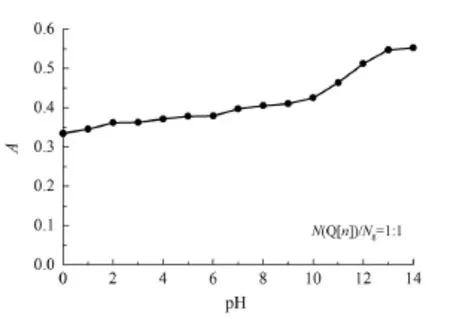
图4 Q[n]-芦丁作用体系的A~pH关系曲线Fig 4 A~pH relation curves of interaction systems of Q[n]with the rutin
从图4可以看出,在酸性与弱碱性条件下(2.0<pH<9.5)其吸收强度变化不大,说明在此条件下瓜环与芦丁作用体系能够以稳定的包结物存在。随着溶液pH的增大,作用体系的紫外吸光度逐渐增强,这可能是在碱性环境中包结物不能稳定存在,芦丁开始脱离瓜环空腔的包结或氢键作用力而造成紫外吸光度的增大,说明在强碱性环境中不利于观察瓜环与芦丁的相互作用情况。
为验证实验结果,图5给出了Q[6]-g在一些代表性的pH条件下的A~N(Q[n])/N(g)曲线。
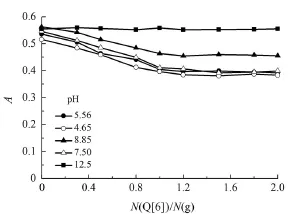
图5 Q[6]-芦丁作用体系在不同pH下的A-N(Q[n])/N(g)关系曲线Fig 5 A-N(Q[n])/N(g)relation curves of interaction systems of Q[6]with the rutin at different pH
从图5可以看出,在pH为12.5的条件下,A~N(Q[n])/N(g)几乎是一条平行于N(Q[n])/N(g)轴的直线,说明在此条件下不能观察到Q[6]与芦丁体系的明显包结作用。而在4.6<pH<8.8时,A-N(Q[n])/N(g)曲线变化幅度虽有所不同,N(Q[n])/N(g)在1:1处出现拐点,此后曲线变化趋于平缓,说明在此酸碱环境内可以观察到Q[6]与芦丁体系的明显主客体包结作用,且N(Q[n])/N(g)的包结比为1:1。
2.3 包结物的体外累积释放度
图6是芦丁与包结物的体外累积释放曲线。
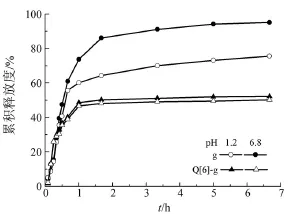
图6 芦丁与包结物的体外累积释放曲线Fig 6 External cumulative releasing curves of the rutin and its inclusion
由图6可可以看出,在人工模拟肠液中(pH= 6.8),芦丁原药、Q[6]-g在60 min内的累积释放度分别达到73.76%、48.58%,而人工模拟胃液(pH=1.2)中,60 min内的累积释放度分别为60.19%、46.71%。60 min之后,累积释放度曲线变化趋于平缓,可能是由于瓜环对没有释放出来的芦丁包结作用较强所导致。包合物的释放度小于芦丁原药,说明Q[n]-芦丁包结后对芦丁有缓释的作用效果。人工模拟肠液(pH=6.8)中,400 min内包结物的累计释放度为52.19%,而人工模拟胃液(pH=1.2)中,400 min内包结物的累计释放度为50.21%。
3 结论
乌纠中含有的黄酮类成分芦丁能够与大环化合物六元瓜环相互作用,利用UV-Vis方法考察了Q[6]对芦丁的包结作用模式以及六元瓜环与芦丁包结物的体外累积释放行为。实验结果表明,Q[6]与芦丁形成了摩尔比1:1的包结物,在人工模拟胃液(pH=1.2)和肠液(pH=6.8)环境中,瓜环与芦丁包结物的累积释放度都明显低于芦丁原药的累积释放度,说明瓜环对芦丁药物具有一定的缓释性。研究结果可为今后开展瓜环对苗药的缓释行为研究提供实验依据。
[1]王玲,何兆荣.药用蕨类植物化学成分研究进展[J].中国野生植物资源,2006,3(10):25-26.
[2]羊波,应茵.黄酮类化合物抗炎作用机制研究进展[J].中国药师,2016(7):1369-1373.
[3]杨刚,陈雪,杨崇甫,等.曲克芦丁原料药在Ames实验中的抗突变作用研究[J].黑龙江医药,2012(5):724-726.
[4]张来新.新型瓜环化合物的合成自组装应用研究的新进展[J].合成材料老化与应用,2015(1):109-112.
[5]任燕,贾波,黄明镜,等.新型药物载体七元瓜环包合物的安全性实验研究[J].辽宁中医杂志,2015,42(10):2014-2016.
[6]胡甫嵩,王萍.羟基六元瓜环与磺胺类药物分子识别作用的紫外光谱研究[J].应用化工,2016,45(3):421-424.
[7]杨春雪,阮贺飞,王真.瓜环[8]与盐酸异丙嗪药物的相互作用研究[J].分析科学学报,2014,30(3):393-396.
[8]曾启华,祝黔江,薛赛凤,等.六、七、八元瓜环与苯胺系列衍生物的相互作用[J].化学学报,2006,64(20):2101-2110.
[9]Liu Y,Ke C F,Zhang H Y,et al.Reversible 2D pseudopolyrotaxanesbasedoncyclodextrinsandcucurbit[6]uril[J].Journal of Organic Chemistry,2007,72(1):280-283.
[10]黄英,马艳辉,王娟.七元瓜环对抗癌药物甲氨蝶呤的溶解性及溶出度的影响研究[J].山地农业生物学报,2013 (1):12-16.
[11]董南,王秀林.七、八元瓜环对抗癌药物苯丁酸氮芥稳定性和溶解度的影响研究[J].化学学报,2011,69(12):1431-1437.
[12]李立凡,林友文,黄智文,等.七、八元瓜环对盐酸雷尼替丁的包合作用及缓释性能[J].高等学校化学学报,2012, 33(2):282-287.
[13]李春荣,孟铁宏,王恒.苗药乌纠不同提取部位的止血活性研究[J].中国民族民间医药杂志,2015,24(11):1-2.
[14]姜艳萍,李春荣,孟铁宏.超声波辅助提取乌纠中总黄酮的工艺研究[J].广州化工,2016,44(15):118-119.
TQ461
ADOI10.3969/j.issn.1006-6829.2016.03.008
贵州省卫生厅校科技联合基金(Gzwkj2012-2-018),黔南州科技计划项目(黔南州科合社字(2015)2号),黔南民族医学高等专科学校基金(QNYZ201510)
2016-05-01
