红曲黄酒传统酿造过程中的细菌菌群结构及其动态变化
2016-02-13贾瑞博潘雨阳胡荣康周文斌蒋雅君郭伟灵朱风风吴林秀饶平凡吕旭聪
贾瑞博,潘雨阳,胡荣康,周文斌,蒋雅君,郭伟灵,朱风风,吴林秀,刘 斌,饶平凡,倪 莉,吕旭聪,*
(1.福建农林大学国家菌草工程技术研究中心,福建 福州 350002; 2.福建农林大学食品科学学院,福建 福州 350002; 3.福州大学生物科学与工程学院食品科技研究所,福建 福州 350108)
红曲黄酒传统酿造过程中的细菌菌群结构及其动态变化
贾瑞博1,2,潘雨阳1,2,胡荣康1,2,周文斌1,2,蒋雅君1,2,郭伟灵1,2,朱风风1,2,吴林秀1,2,刘 斌1,2,饶平凡3,倪 莉3,吕旭聪1,2,3*
(1.福建农林大学国家菌草工程技术研究中心,福建 福州 350002; 2.福建农林大学食品科学学院,福建 福州 350002; 3.福州大学生物科学与工程学院食品科技研究所,福建 福州 350108)
采用变性梯度凝胶电泳(DGGE)技术、克隆文库技术和限制酶切片段长度多态性(RFLP)等相结合的方法,探究了红曲黄酒传统酿造过程中的细菌菌群结构及其动态变化。变性梯度凝胶电泳(DGGE)试验结果表明,在传统酿造过程中的初期阶段的优势菌株包括植物乳杆菌Lactobacillusplantarum、戊糖片球菌Pediococcuspentosaceus和短乳杆菌Lactobacillusbrevis,随着酿造时间的增加,植物乳杆菌将逐渐占据绝对优势;利用限制酶切片段长度多态性(RFLP)技术对16S rDNA文库中的克隆子进行酶切分型,共得到19种RFLP图谱类型,测序鉴定结果与变性梯度凝胶电泳(DGGE)结果相似,但16S rDNA克隆文库分析检测到了戊糖片球菌Pediococcuspentosaceus,该菌未见于变性梯度凝胶电泳(DGGE)结果中。变性梯度凝胶电泳(DGGE)技术、克隆文库技术和限制酶切片段长度多态性(RFLP)等多种方法相结合,有助于更为全面、客观地研究红曲黄酒传统酿造体系中的细菌群落结构及多样性。
红曲黄酒;传统酿造;细菌菌群
黄酒在世界酿造史上独树一帜,与啤酒、葡萄酒并称为世界三大古酒,是中华民族的文化瑰宝,有着5 000多年的悠久历史,享有“国酒”之美誉[1-2]。黄酒是以谷物为原料,用曲酿造而成的,其营养丰富、酒精度低且具有独特的风味和功效而深受广大消费者的喜爱,加上近年来国家大力扶持黄酒产业的发展,其市场需求量逐年稳步上升。红曲黄酒是以糯米为主要原料,添加红曲和药白曲作为糖化发酵剂,经多种微生物酿造而成的一种低度黄酒,以色红、味醇、香浓而著称,不仅具有丰富营养成分,还因添加了红曲进行酿造而具备多种与众不同的生理功效,是中国黄酒中十分有特色的一类黄酒[3-4]。
红曲黄酒传统酿造用曲中含有丰富的霉菌、酵母以及细菌[5], 在红曲黄酒“双边发酵”过程中,微生物参与各种生物化学反应,对红曲黄酒的产量和品质起到至关重要的作用[6-7]。红曲黄酒传统酿造是“群微共酵”的过程,其产量和品质与整个酿造过程中独特的微生物群落结构变化有着紧密的联系。然而,目前有关红曲黄酒中微生物菌群结构及其功能研究较少,且长期以来研究手段单一,未能进一步系统地研究微生物菌群结构与其功能的关系,尤其是酿造过程中菌群结构的动态变化趋势。不能充分分析酿造系统微生物区系的结构和功能,更不用说充分利用微生物菌种资源。
红曲黄酒传统酿造体系是一个复杂的生态系统[8],许多功能微生物可能处于“存活但不能培养”(VBNC)的状态,无法通过传统纯培养技术从菌群中分离获得,使得红曲黄酒独特风味组分的形成途径变成“暗箱”。以分子生物学为基础的免培养微生物分子生态学克服了传统微生物纯培养方法的不足,直接从基因水平上研究复杂体系中微生物菌群结构与功能。为此,本研究采用变性梯度凝胶电泳(DGGE)技术、克隆文库技术和限制酶切片段长度多态性(RFLP)等相结合的免培养微生物分子生态学方法,跟踪红曲黄酒传统酿造过程中细菌菌群结构动态变化,研究结果不仅可以更为深刻地认识红曲黄酒酿造机理,也有利于快速筛选和鉴定出适用于红曲黄酒酿造的细菌菌株。
1 材料与方法
1.1 试验材料
以糯米为原料,以乌衣红曲和药白曲为发酵曲,在酿造工艺实验室按照福州红曲黄酒传统酿造工艺进行酿造[6,9],在3个酒坛中同时进行酿造作为平行试验,在传统酿造的第1、2、3、5、7、10、20、46 d分别从3个酒坛中取酒醪样品20 g进行混合均匀,提取细菌总DNA进行PCR-DGGE分析,取第1、20、46 d的样品进行细菌16S rDNA克隆文库分析。
酵母提取物为OXOID产品; CTAB、N,N′-甲叉丙烯酰胺、TEMED、过硫酸铵、Tris、琼脂糖、氨苄青霉素购自上海生工有限公司;蛋白酶 K、dNTP、IPTG、X-gal、Loading Buffer、胶回收试剂盒为TaKaRa产品;DNA marker为MBI产品;限制性内切酶(Rsa、Msp)为Fermentas公司;用于转化的菌株选用E.coliDH5α为福建农林大学国家菌草工程技术研究中心保存;pMD19-T vector购自TaKaRa公司;引物均由上海生工合成;其余试剂均为国产分析纯试剂。
1.2 细菌DNA提取
采用溶菌酶-蛋白酶K-CTAB法[10]进行样品中细菌总DNA的提取,保存于-20℃备用。
1.3 细菌16S rDNA基因的扩增
细菌基因组16S rDNA的扩增[11]:以提取的细菌基因组DNA为模板,采用细菌16S rDNA通用引物[7]1492R(5′-GGC TAC CTT GTT ACG ACT T-3′)和细菌特异引物27F(5′-AGA GTT TGA TCC TGG CTC AG-3′)进行PCR扩增,PCR产物经质量分数为1.5%的琼脂糖凝胶电泳检测,EB染色,凝胶成像系统观察和拍照。
1.4 细菌16S rDNA-V3区基因的扩增
16S rDNA-V3区基因的扩增:将纯化后的16S rDNA为模板,采用细菌通用引物[8]338f+(5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG GAC TCC TAC-3′)和518r(5′-ATT ACC GCG GCT GCT GG-3′)进行巢式PCR扩增,PCR产物经质量分数为1.5%的琼脂糖凝胶电泳检测,EB染色,凝胶成像系统观察和拍照。
1.5 变性梯度凝胶电泳(DGGE)分析
对PCR产物进行DGGE分析,DGGE变性胶浓度为8%(w/v),变性梯度为40%~60%电泳条件:1×TAE电泳缓冲液,60℃恒温,65 V恒压电泳16 h;EB染色,并用图形分析软件(Quantity One)对凝胶图像进行分析。用Coverage C、Evenness指数(E)、Shannon-Wierner指数(H′)、Simpson指数(D),Margalef指数(d)等指标(表1)来分析细菌多样性。

表1 多样性指标分析说明Table 1 Description on diversity index analysis
1.6 DGGE条带的序列测定
对细菌DGGE图谱较为明显的条带进行割胶后放入EP管中,去离子水重复冲洗3次后加入50 μL去离子水碾碎过夜保存,取上清液作为PCR模板扩增,将纯化后的PCR产物与pMD19-T 载体连接,转化至E.coliDH5α细胞中,通过蓝白筛选,随机挑选白斑进行菌落PCR验证。将经验证的阳性克隆子交由上海生工生物技术公司进行测序;测序结果用DNAMAN软件将16S rDNA-V3 高变区克隆子序列去除载体后,通过NCBI查找比对(BLAST分析),选取克隆子序列在GenBank中找寻最相似收录序列进行比对。
1.7 细菌16S rDNA基因的限制性内切酶酶切(RFLP)
琼脂糖电泳验证成功的PCR样品,分别用限制性内切酶Rsa和Msp进行酶切,在37℃的恒温水浴锅中放置过夜进行反应,酶切产物在2%琼脂糖凝胶上进行电泳;分析克隆子的RFLP谱型,计算每个谱型的出现频率。将具有不同图谱类型的克隆挑出,液体扩培后进行测序,序列在NCBI数据库上进行比对鉴定。
2 结果与分析
2.1 基于DGGE指纹图谱技术的细菌菌群多样性分析
对细菌16S rDNA-V3区PCR产物进行DGGE分析,结果如图1所示。
从克隆鉴定结果(表2)中可以发现,所有序列均可以在GenBank中找到与其序列相似性很高(>98%)的菌株。结合细菌16S rDNA-V3区DGGE图谱中发现,条带1、2和3相较其他条带较亮,可认为是酿造过程中的关键菌株,占有较大比例。经鉴定其分别为植物乳杆菌Lactobacillusplantarum、短乳杆菌Lactobacillusbrevis和戊糖片球菌Pediococcuspentosaceus。在酿造初期(第1~10 d),优势菌株的结构没有发生很大变化,到了酿造中期(第20 d),戊糖片球菌基本检测不到,而植物乳杆菌在酿造体系中的比例升高,到了酿造后期(第46 d),基本上只检测到植物乳杆菌Lactobacillusplantarum。
2.2 基于16S rDNA克隆文库技术的细菌菌群多样性分析
2.2.1 16S rDNA克隆文库的限制性片段长度多态性(RFLP)分析 PCR-RFLP分析采用限制性内切酶MspI(C′CGG)和RsaI(GT’AC)。一共分析了262个克隆子(B1文库,77个;B20文库,115个;B46文库,70个)。B1、B20和B46文库分别获得了15、12和4种RFLP带型,这表明细菌的种类随着酿造时间的推移而在不断减少。B1文库中最丰富的RFLP带型有16个克隆子(占总克隆子数的20.8%) (图2-A),B20文库中最丰富的带型有42个克隆子(占总克隆子数的36.5%) (图2-B),而B46文库中最丰富的带型有47个克隆子(占总克隆子数的67.1%) (图2-C)。可以发现,随着酿造时间的增加,细菌种类不断减少;在每一个酿造时期,酿造体系中都有优势细菌,说明在酿造的不同时期,细菌的分布是不均匀的。

表2 DGGE谱图中相关电泳条带的测序鉴定结果Table 2 DNA sequencing results associated electrophoretic bands of DGGE spectrum
2.2.2 细菌16S rDNA克隆文库种群多样性分析 根据其计算公式,若Coverage C得到的值很大或达到1,则说明库容已经足够。由表3中可知,3个文库的Coverage C都很接近1,说明3个文库的库容均满足要求。从多样性和均匀度指数来看,细菌的多样性水平和均匀度随着酿造的进行呈现不断下降的趋势,酿造初期的细菌种类明显高于酿造后期。这可能是由于在酿造后期,酿造体系中的酒精度不断攀升和营养物质不断减少而造成细菌的多样性不断下降。
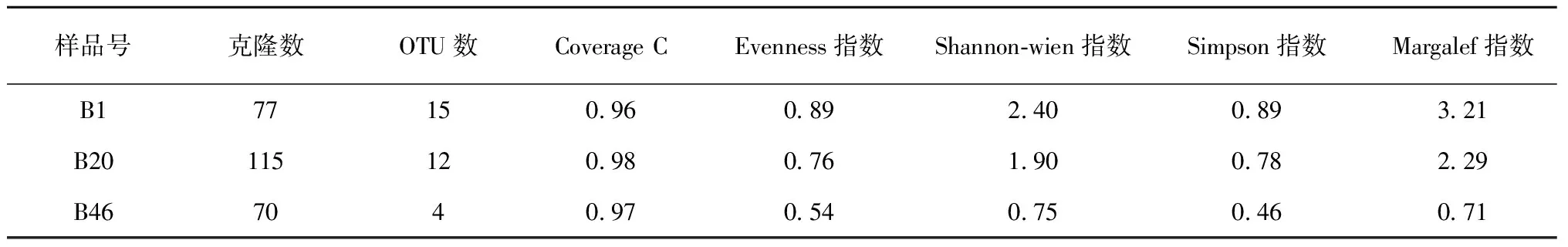
表3 16S rDNA克隆文库种群多样性分析Table 3 Species diversity analysis on 16S rDNA clone libraries
2.2.3 序列比对分析 将3个文库中19种RFLP带型,均挑选1个代表菌株进行了测序,将鉴定结果结合柱状图整理出菌株名及其数量关系,汇总为16S rDNA克隆文库菌株变化趋势表(表4)。
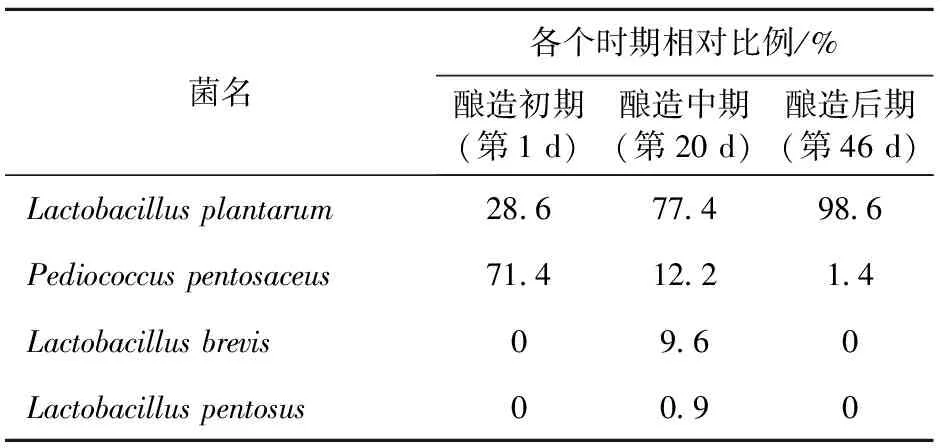
表4 16S rDNA克隆文库中不同细菌的变化趋势Table 4 Composition and dynamic changes of bacteria community as revealed by analysis of 16 s rDNA clone library
从表4中可以看出,植物乳杆菌Lactobacillusplantarum在体系中的相对比例从酿造初期的28.6%上升到酿造后期的98.6%,戊糖片球菌Pediococcuspentosaceus在体系中的相对比例从酿造初期的71.4%下降到1.4%,这与细菌DGGE图谱中的趋势是吻合的。但16S rDNA克隆文库在酿造中期检测到短乳杆菌Lactobacillusbrevis,其相对比例占9.6%,而细菌DGGE图谱中发现在酿造第1 d就检测到了短乳杆菌Lactobacillusbrevis,并占有一定比例;16S rDNA克隆文库在酿造中期还检测到了戊糖乳杆菌Lactobacilluspentosus,这是细菌DGGE图谱中所没有检测到的。造成两种方法结果不同的原因可能是由于:(1)用于细菌DGGE所扩增的16S rDNA-V3区的分辨率不够;(2)使用RFLP方法分析细菌克隆文库,所选用的限制性内切酶在分析相似性较高的序列时,可能无法根据酶切的带型清晰地分辨出序列之间的差异,使得该方法低估了研究体系中的微生物多样性。从这样的结果可以看出,单一的分子生态学方法有一定的局限性,DGGE技术和克隆文库技术的结合使用可以得到红曲黄酒酿造过程中微生物结构更完整的结果。
3 讨论与结论
3.1变性梯度凝胶电泳(DGGE)结果显示,在传统酿造过程中的初期阶段的优势菌株包括植物乳杆菌、戊糖片球菌和短乳杆菌;但随着酿造的进行,植物乳杆菌将逐渐占据绝对优势。利用限制酶切片段长度多态性(RFLP)技术对16S rDNA文库中的克隆子进行酶切分型,共得到19种RFLP图谱类型,通过测序鉴定结果显示16S rDNA克隆文库中包括植物乳杆菌、戊糖片球菌、短乳杆菌和戊糖乳杆菌。其中,戊糖片球菌的数量从酿造第1 d的71.4%下降至第46 d的1.4%,短乳杆菌在第1 d没有检测到,但在第20 d其数量达到13%,在酿造后期同样没有检测到,植物乳杆菌随着酿造过程的进行,其数量从28.6%上升至98.6%,在酿造过程中,乳酸菌除产生乳酸外,还可能以乳酸为底物产生乙酸、琥珀酸、丙酸和丁酸等其他有机酸,这些有机酸在酯化酶的催化作用通过酯化反应生成乳酸乙酯,乙酸乙酯等香气组分,丰富了红曲黄酒的风味成分。陈宝良等[13]对传统香雪酒(绍兴酒中的一种高档品种)发酵过程中的微生物变化规律及作用进行了研究,发现传统香雪酒的发酵过程是曲(酒药和麦曲)的糖化和以多品种、高密度的细菌与酵母协同糖化发酵并行的过程,到中后期是真正意义上的细菌为主的发酵,而酵母菌作用小。据此,在红曲黄酒传统酿造的过程中,可以推测细菌对酒的风味有着很大的贡献,在解析红曲黄酒传统酿造过程细菌菌群结构的基础上,后续研究将进一步探明这些乳酸菌的产香特性,以及乳酸菌与酵母菌之间的相互作用及其对红曲黄酒特征风味物质形成的影响,最终解决导致红曲黄酒传统酿造品质不稳定的瓶颈问题,改进工艺、提升品质。
3.216S rDNA克隆文库分析得到的结果与变性梯度凝胶电泳(DGGE)得到的结果相似,但16S rDNA克隆文库分析检测到了戊糖片球菌,该菌未见于变性梯度凝胶电泳(DGGE)结果中。研究结果说明采用免培养微生物分子生态学方法研究细菌多样性,虽然较传统分离培养方法更为快速和准确,但各个技术也存在的一定局限性和不足。因此,本研究采用DGGE结合文库分析和RFLP等分子生物学方法对样品进行分析,使其相互补充,有利于获得关于红曲黄酒酿造过程中微生物生态更为客观和准确的信息。
[1]陈玉香, 叶汶坤, 何冬萍, 等. 酵母菌对红曲黄酒风味物质形成的影响[J].中国食品学报, 2015, 15(7): 218-223.
[2]陈平. 红曲代谢产物的研究现状和前景[J]. 广西轻工业, 2009,(9): 4-5.
[3]LÜ X C, WENG X, ZHANG W, et al. Microbial diversity of traditional fermentation starters for Hong Qu glutinous rice wine as determined by PCR-mediated DGGE[J]. Food Control, 2012, 28(2):426-434.
[4]吕旭聪, 翁星, 黄若兰,等. 红曲黄酒酿造用曲及传统酿造过程中酵母菌的多样性研究[J]. 中国食品学报, 2012, 12(1):182-190.
[5]李艳, 董振玲, 李佳, 等. PCR-DGGE技术检测羊羔美酒大曲中细菌多样性[J]. 食品科学, 2015,(12): 142-147.
[6]谢广发. 黄酒酿造技术[M].北京:中国轻工业出版社,2010.
[7]汪建国, 沈玉根, 陆伟杰, 等. 我国黄酒研究现状与发展趋势[J]. 中国酿造, 2012, 31(11): 15-20.
[8]毛青钟. 黄酒生产特点的探讨[J]. 酿酒科技, 2005,(1):65-67.
[9]傅金泉. 黄酒生产技术[M].北京:化学工业出版社,2005.
[10]TAE-WOONKIM, JUN-HWALEE, SUNG-EONKIM. Analysis of microbial communities in doenjang, a Korean fermented soybean paste, nested PCR-denaturing gradient gel electrophoresis[J]. International Journal of Food Microbiology,2009, 131: 265-271.
[11]王海舟,张小波. 分子生物学在微生物生态学中的应用[J]. 萍乡高等专科学校学报, 2009, 26(3): 72-74.
[12]刘绍雄, 王明月, 王娟, 等. 基于PCR-DGGE技术的剑湖湿地湖滨带土壤微生物群落结构多样性分析[J]. 农业环境科学学报, 2013,(7): 1405-1412.
[13]陈宝良, 毛青钟. 传统香雪酒发酵过程微生物变化和作用研究[J]. 酿酒, 2010, 37(6): 59-62.
(责任编辑:黄爱萍)
Composition and Dynamic Changes of Bacterial Community During Traditional Hongqu Glutinous Rice Winemaking
JIA Rui-bo1,2,PAN Yu-yang1,2,HU Rong-kang1,2,ZHOU Wen-bin1,2,JIANG Ya-jun1,2,GUO Wei-ling1,2, ZHU Feng-feng1,2,WU Lin-xiu1,2, LIU Bin1,2,RAO Ping-fan3, NI Li3, LÜ Xu-cong1,2,3*
(1.NationalEngineeringResearchCenterofJuncaoTechnology,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China; 2.CollegeofFoodScience,FujianAgricultureandForestryUniversity,Fuzhou,Fujian350002,China; 3.InstituteofFoodScienceandTechnology,CollegeofBiologicalScienceandTechnology,FuzchouUniversity,Fuzhou,Fujian350108)
Composition and dynamic changes of the bacterial community during the traditional Hong Qu glutinous rice winemaking were studied using PCR-denaturing gradient gel electropherisis (DGGE), clone library analysis and restriction fragment length polymorphisms (RFLP). Sequences of 9 bacteria strains were obtained by DGGE spectrogram. Through cloning and sequencing, it was found thatLactobacillusplantarum,PediococcuspentosaceuandLactobacillusbreviswere the dominant bacteria during the initial fermentation stage. The RFLP fingerprints showed that 16S rDNA clone libraries had 19 band patterns. Sequencing of different OTUs revealed thatL.plantarum,P.pentosaceus,L.brevisandLactobacilluspentosuspresented in the wine during the entire process, butL.plantarumprevailed at the end. By using various molecular biology methods simultaneously to examine the microbial community in winemaking, a comprehensive and objective profile was obtained.
hongqu glutinous rice wine; traditional brewing; bacterial community
2016-05-09初稿;2016-09-07修改稿
贾瑞博(1991-),男,硕士生,研究方向:食品生物技术(E-mail:13044599915@163.com) *通讯作者:吕旭聪(1984-),男,助理研究员,博士;研究方向:食品生物技术(E-mail:xucong1154@qq.com)
国家自然科学基金项目(31601466);中国博士后科学基金项目(2016T90591、2015M570549);福建农林大学“校杰出青年科研人才”项目(XJQ201607);福建省自然科学基金项目(2016J01095)
TS 262.4
:A
:1008-0384(2016)11-1238-06
贾瑞博,潘雨阳,胡荣康,等.红曲黄酒传统酿造过程中的细菌菌群结构及其动态变化[J].福建农业学报,2016,31(11):1238-1243.
JIA R-B,PAN Y-Y,HU R-K,et al.Composition and Dynamic Changes of Bacterial Community During Traditional Hongqu Glutinous Rice Winemaking[J].FujianJournalofAgriculturalSciences,2016,31(11):1238-1243.
