板蓝根乙酸乙酯部位体外抗病毒活性研究
2016-01-13何立巍,杨婧妍,董伟等
·实验研究·
板蓝根乙酸乙酯部位体外抗病毒活性研究
何立巍,杨婧妍,董伟,秦莹亚
(南京中医药大学药学院,江苏 南京 210046)
摘要:目的对板蓝根的乙酸乙酯部位各化学组分进行体外抗单纯疱疹病毒Ⅰ型(HSV1)活性研究。方法利用溶剂法和色谱法从板蓝根中提取分离出20个乙酸乙酯组分,利用四甲基偶氮唑盐比色(MTT)法检测这20个组分体外对HSV1病毒的抑制作用,以细胞存活率、治疗指数(TI)和细胞保护率为评价指标,比较各化学组分的体外抗病毒的效果。结果 板蓝根乙酸乙酯8个组分均有明显的抗HSV1病毒作用,对病毒的抑制率均远大于50%。结论 板蓝根乙酸乙酯部位中存在直接抗病毒较强的活性成分,对其结构进行深入研究,将有助于阐明板蓝根抗病毒药效物质基础。
关键词:板蓝根;乙酸乙酯部位;抗病毒;四甲基偶氮唑盐比色法
基金项目:国家自然基金资助项目(No.81073023,No.81073023);国家教育部博士点基金资助项目(No.20093237120015)
作者简介:何立巍,男,副教授,研究生导师,研究方向:中药及天然药物活性成分及物质基础研究,E-mail:he_lw@163.com
中图分类号:R285.5文献标识码:A
Study on antiviral activity ofRadixIsatidisethyl acetate extract in vitro
HELi-wei,YANGJing-yan,DONGWei,QINYing-ya
(CollegeofPharmacy,NanjingUniversityofChineseMedicine,Nanjing210046,China)
Abstract:ObjectiveTo research the antiviral activity against herpes simplex virus type Ⅰ (HSV1) activity of each chemical component of Radix Isatidis extracted with ethyl acetate in vitro.MethodsExtracting and separating 20 components from Radix Isatidis in ethyl acetate using solvent and chromatography methods.Detecting this 20 components inhibition to HSV1 virus in vitro using MTT assay,with cell viability,therapeutic index (TI) and cell protection rate as evaluation indexes,and comparing the antiviral activities of each component in vitro.ResultsEight components of Radix Isatidis had significant anti-viral effect of HSV-1.Inhibition rate to the virus was much greater than 50%.ConclusionThere were strong antiviral of active ingredients in Radix Isatidis.In-depth study of its structure would help to clarify the material basis of antiviral effect of Radix Isatidis.
Key words:RadixIsatidis;Ethyl acetate extract;Antiviral;MTT method
板蓝根是十字花科植物菘蓝IsatisindigoticaFort.的干燥根,具有清热解毒、凉血利咽之功效。药理研究证实,板蓝根提取液对流感病毒、乙型肝炎病毒、单纯疱疹病毒、柯萨奇病毒、肾综合征出血热病毒、巨细胞病毒等均有显著的抑制作用。故临床上广泛用于抗病毒、抗菌,并具有抗肿瘤,增强机体免疫力的功能,抗内毒素作用[1~4]。为了明确板蓝根抗病毒的物质基础,指导其活性成分的分离和纯化,本实验采用细胞病变效应(CPE)法和 MTT 法[5]对板蓝根乙酸乙酯部位的抗病毒活性进行了筛选。
1仪器与材料
1.1实验仪器96孔板(美国Corning公司);Power Wave 340型酶标仪(美国Bio-Teck公司);BC- J80S型CO2培养箱(上海博迅实业有限公司);CKX31SF型显微镜(Olympus);SW-CT-1F型单人双面净化工作台(苏州净化设备有限公司);79-1型磁力加热搅拌器(江苏省金坛医疗仪器厂);SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器(上海申安医疗器械厂);实验室级超纯水器(易普易达);LDZ5-2型低速自动平衡离心机(北京医用离心机厂)。
1.2实验病毒与细胞株人类单纯疱疹病毒Ⅰ型(HSV-Ⅰ)传代2次,以提高病毒毒力,由南京医科大学病毒所提供;非洲绿猴肾(vero)细胞(为HSV型病毒敏感细胞,由南京医科大学病毒所提供),常规培养于含10%FCS的 RPMI 1640生长液中,内含青霉素0.06 mg·mL-1,链霉素0.1 mg·mL-1,NaHCO32 mg·mL-1,37 ℃培养生长成单层,待用。
1.3实验药品与试剂板蓝根药材以95%乙醇10倍量、8倍量提取2次,合并提取液,减压浓缩乙醇至无醇味,分别以石油醚、氯仿、乙酸乙酯、正丁醇萃取,得乙酸乙酯部位12.6 g;取乙酸乙酯部位以硅胶吸附柱色谱进行分离,以石油醚-乙酸乙酯(100∶1~100∶50梯度洗脱),收集各流分,薄层色谱检查,相同化学成分流份合并,得乙酸乙酯各化学组分1~20;各样品用DMSO(二甲基亚砜)溶解,至浓度为200 mg·mL-1,作为供试样品母液。
10%新生小牛血清(中美合资兰州民海生物工程有限公司,批号:20050629), RPMI 1640培养基(美国GIBCO公司), 100TCID50 病毒液(病毒传代培养后由南京中医药大学微生物与免疫教研室配制)。其余化学试剂如石油醚、氯仿、乙酸乙酯、正丁醇等均为分析纯。
2实验方法与结果
2.1细胞的培养与传代非洲绿猴肾(vero)细胞为贴壁生长型细胞,常规复苏后传代培养。Vero细胞在100 mL·L-1胎牛血清的RPMI-1640培养液中,含50 mL·L-1二氧化碳,37 ℃,湿度95%培养箱内密闭单层培养。
2.2药物无毒界限的测定取生长良好的vero细胞,经胰酶消化后,加含10%小牛血清的1640培养基,制备细胞数为2×105·mL-1的悬浮液,加至96孔平底细胞培养板,0.1 mL/孔,37 ℃ 5%CO2温育24 h细胞长成单层,吸弃单层细胞上的培养液。将样品溶液分别稀释为10个浓度液体,分别为:2 000、1 000、500、200、100、40、20、8、4、0.8 μg·mL-1。分别加入各细胞孔中,每孔加入0.2 mL,每一稀释度设立4孔,同时设立2个细胞对照组。37 ℃ 5%CO2温育72 h后每孔加入MTT 20 μL,再放入37 ℃ 5%CO2温育培养箱4 h后,吸弃上清液,每孔加二甲基亚砜(DMSO)200 μL,振荡5~10 min,使颗粒溶解,用酶标免疫检测仪测490 nm处吸光度(OD)的值,计算细胞存活率。细胞存活率=实验孔OD值/细胞对照孔OD值。无明显细胞毒性(存活率大于80%)表现的浓度即为药液的无毒界限[6]。实验结果显示药物的无毒最高浓度如表1。
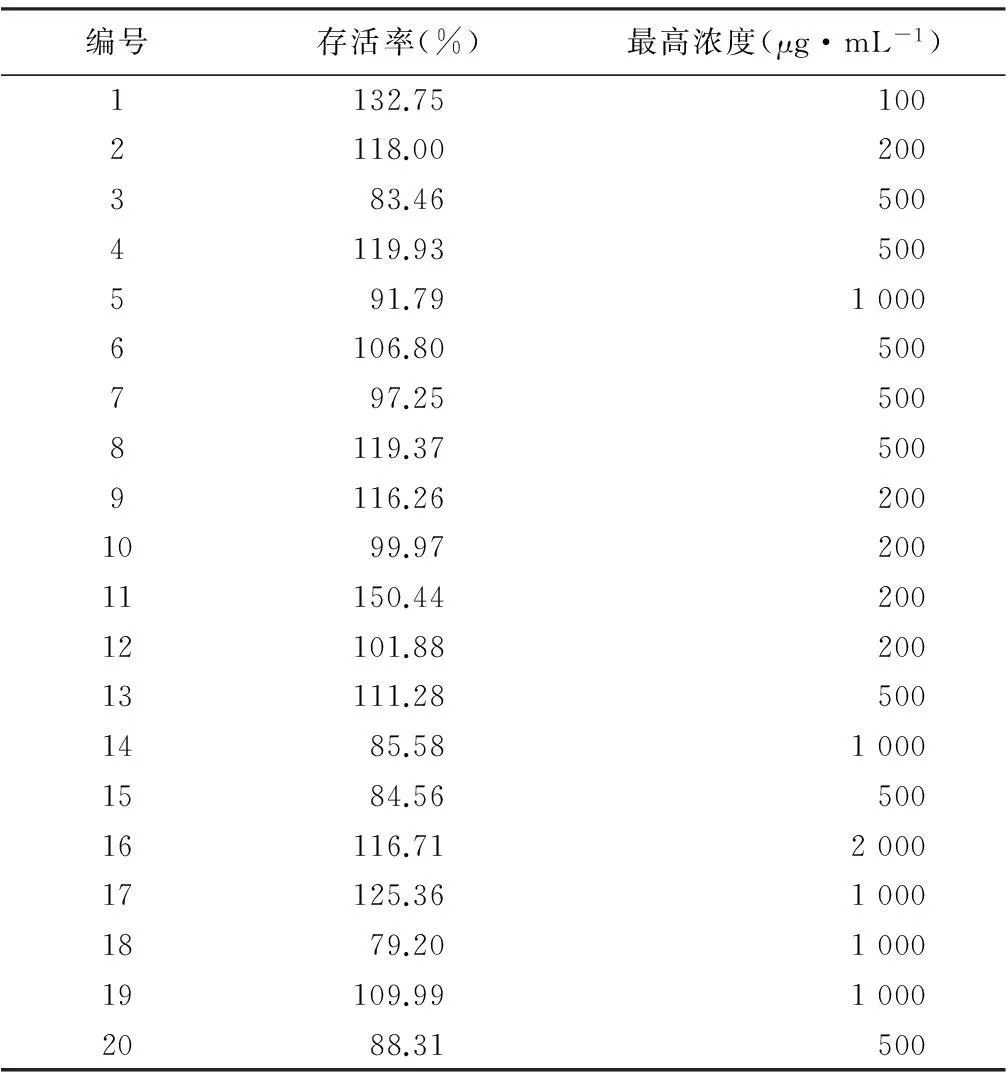
表1 细胞毒性测定(存活率法)
2.3抗病毒活性筛选取生长良好的vero细胞,经胰酶消化后,加含10%小牛血清的1640培养基,制备细胞悬浮液,将细胞加入96孔板制成单层(约4×104/孔),0.1 mL/孔,37 ℃ 5%CO2温育24 h细胞长成单层,吸弃单层细胞上的培养液。加入40 μL/孔的病毒液,细胞组加入40 μL/孔的PBS液,放入CO2孵育箱1 h,使病毒吸附于细胞上。将药液以无毒界限为最高浓度作4个稀释度(如表1)分别加入细胞孔中,每一稀释度设3孔,同时设立病毒对照组、细胞对照组,37 ℃ 5%CO2作用72 h,接着加入MTT,每孔20 μL,37 ℃ 5%CO2作用4 h后弃上清加入DMSO,每孔200 μL,振荡5~10 min,待结晶完全溶解用酶标免疫检测仪测490 nm处OD值,计算细胞保护率。
细胞保护率=(实验孔OD值-病毒对照孔OD值)/(细胞对照孔OD值-病毒对照孔OD值)。
病毒感染细胞3天后,MTT法测细胞保护率,结果显示,随着药物浓度的增高细胞保护率增高。最大保护率大于50%的药物为1、9、13、14、15、16、17、19号,最大保护率大于30%、小于50%的药物为4、5、8号,结果详见表2。
按Reed-Muench方法计算半数毒性浓度(TC50)[2]。TC50=lg-1[lgCm-I(P总-0.5)];其中Cm表示最大浓度,I表示lg(Cm/与Cm相临的浓度),P总表示所有浓度的总抑制率,结果见表3。

表2 各组分对 HSV-1 感染的保护作用(MTT法)

表3 各组分的半数毒性浓度(TC 50)
按Reed-Muench方法计算细胞存活率、药物半数抑制病毒浓度(IC50),lgIC50=lgCm-I[P总-(3-Pm-Pn)/4];以治疗指数(TI)评价药物抗HSV1的效果,其中TI=TC50/IC50,结果见表4。

表4 各组分的半数抑制病毒浓度(IC 50)
3讨论
本实验针对板蓝根乙酸乙酯化学部位,通过柱色谱的方法作了进一步的分离,得到化学成分较为集中的各化学组分(单体或几个单体的活混合物),在对其抗病毒活性筛选研究组中发现,9、16、17、19号组分的抗病毒作用最强,且治疗窗较小,可能为直接抗病毒作用,对这些组分做进一步结构方面的研究,将有可能发现板蓝根新的抗病毒活性成分,并进一步阐明板蓝根抗病毒物质基础。
参考文献:
[1]周黄金,刘干中.中药药理与临床研究进展[M].北京:中国科学技术出版社,1992:357.
[2]许益明,陆平成,王永珍,等.板蓝根多糖促进免疫功能的实验研究[J].中西医结合杂志,1991,11(6):357.
[3]孙深.临床用药大全[M].上海:中国大百科全书出版社上海分社,1995:656.
[4]刘云海.板蓝根抗内毒素作用研究[J].中国药科大学学报,1995,26(5):297.
[5]汤杰,施春阳,徐晗,等.板蓝根抑菌抗炎活性部位的评价[J].中国医院药学杂志,2003,23(6):327-328.
[6]何立巍,李祥,陈建伟,等.板蓝根抗病毒有效部位的筛选[J].中国药房,2008,19(33):2565-2566.
