喉鳞状细胞癌中TIMP3基因启动子区甲基化状态的研究
2016-01-12张笑盈,王新峰,史维晨等
喉鳞状细胞癌中TIMP3基因启动子区甲基化状态的研究
张笑盈王新峰史维晨胡建功
(天津中医药大学第二附属医院病理科天津300150)
[摘要]①目的研究喉鳞状细胞癌(LSCC)中基质金属蛋白酶抑制因子3(TIMP3)基因启动子CpG岛甲基化及其蛋白表达情况。②方法采用改进的甲基化特异性PCR(MSP)和免疫组化SP法检测LSCC组织及相应癌旁正常组织中TIMP3基因的DNA甲基化和蛋白表达情况。③结果LSCC组织中TIMP3基因启动子区CpG岛甲基化发生率显著高于癌旁正常组织(P<0.01);有淋巴结转移的LSCC组织中甲基化率高于无淋巴结转移的LSCC组织(P<0.05);低分化LSCC组织中甲基化发生率高于高、中分化LSCC组织(P均<0.05);52例LSCC组织中TIMP3蛋白的表达率与相应癌旁正常组织的TIMP3蛋白表达率比较有统计学意义(P<0.01);有淋巴结转移的LSCC组织中蛋白表达率低于无淋巴结转移的LSCC组织(P<0.05)。④结论TIMP3基因启动子区CpG岛的异常甲基化导致基因沉默可能是LSCC的发生机制之一,可作为反映LSCC生物学行为的检测指标。
[关键词]喉鳞状细胞癌基质金属蛋白酶抑制因子3DNA甲基化基因表达
[中图分类号]R 76[文献标识码]A
【作者简介】张笑盈(1982-),女,硕士,研究方向:肿瘤病理分子研究。
【通讯作者】胡建功。
Aberrant promoter methylation of TIMP3 gene in laryngeal squamous cell carcinomaZHANGXiaoying,WANGXinfeng,SHIWeichen,etal(PathologyDepartmentofTheSecondAffiliatedHospitalofTianjinUniversityofTraditionalChineseMedicine,Tianjin300150,China)
ABSTRACT[]ObjectiveIt is to observe the methylation status in promoter region of Tissue inhabitor of metalloproteinases 3(TIMP3) gene and the expression of TIMP3 protein in laryngeal squamous cell carcinoma (LSCC).Methods A modified methylation specific PCR (MSP) was used to examine the methylation status in the 5'CpG island of TIMP3 and immunohistochemical SP method was performed to detect TIMP3 protein expression in tumors and corresponding normal adjacent tissues.ResultsTIMP3 gene in tumor specimens,which was significantly higher than that in corresponding normal tissues (P<0.01);Methylation frequencies of LSCC in lymph node metastasis group were higher than that in no lymph node metastasis group (P<0.05);Methylation frequencies of poor differentiation group were higher than those in moderately and well differentiation groups(P<0.05);Positive immunostaining of TIMP3 in tumor tissues was significantly lower than that in matched normal tissues (P<0.01).TIMP3 protein expression of LSCC in lymph node metastasis group was remarkably lower than that in no lymph node metastasis group(P<0.05).ConclusionHypermethylation status in the 5'CpG island of TIMP3 gene-induced gene silencing may be one of the mechanisms underlying the development of LSCC.Hypermethylation of TIMP3 gene can be used as an index reflecting the biological behaviors of LSCC.
[KEYWORDS]Laryngeal squamous cell carcinoma.TIMP3.DNA methylation. Gene expression
恶性肿瘤的浸润和转移是多步骤、多阶段的复杂过程,涉及肿瘤细胞穿过细胞外基质屏障、血管基底膜及穿出血管壁进入宿主微环境的过程。其中基底膜和细胞外降解是其中的必要条件[1]。基质金属蛋白酶家族(MMPs)已被证明可降解基底膜和细胞外基质,而且能够促进肿瘤新生血管的形成,与肿瘤的浸润和转移密切相关[2]。TIMPs是一组能抑制MMPs活性的多功能因子家族。它通过对MMPs的抑制,在正常细胞外基质改建和各种病理过程中发挥重要作用。TIMP3是全功能的MMP抑制剂,它只存在于ECM中,因此对MMP降解活性的抑制比其它TIMP更有针对性。目前,国内外对喉鳞状细胞癌组织中TIMP3基因启动子区CpG岛甲基化状态及蛋白表达的联合研究较少,本研究检测了喉鳞状细胞癌中TIMP3基因启动子区的甲基化状态及蛋白表达情况,探讨其与喉鳞状细胞癌发生发展的关系,以期为喉鳞状细胞癌患者的早期筛查工作及恶性生物学行为的判断提供新的理论参考依据。
1资料与方法
1.1一般资料收集52例喉鳞状细胞癌手术切除的标本。52例患者中男46例,女6例,年龄35~80岁,平均54.2岁。全部患者术前均未经化疗和放疗。每例患者均取喉鳞状细胞癌原发灶及相应切缘黏膜组织,部分标本于-80 ℃低温冰箱保存以提取DNA,部分进行石蜡包埋,常规HE染色(证实切缘黏膜均为正常黏膜组织,并确定标本的组织学类型)。
1.2改进甲基化特异性PCR(MSP)检测采用常规蛋白酶K(Merck公司提供)消化,酚/氯仿抽提法提取癌组织和癌旁正常组织基因组DNA,紫外分光光度计测量DNA含量,所用标本吸光度值均调整为1.8~2.0。每个样本均取5μg DNA用2mol/L NaOH变性处理,于10mmol/L氢醌(Sigma公司提供)和3mol/L亚硫酸氢钠中,在50℃条件下反应16h,然后用Wizard DNA纯化试剂盒(Promega 公司提供)纯化,经亚硫酸氢钠处理的DNA。由于经亚硫酸氢盐处理后,DNA中的C转变为U,而DNA的CpG岛部位发生甲基化后,则不能发生这种改变,据此原理设计相应的甲基化引物检测该基因是否发生甲基化。引物参照文献并由海捷瑞公司合成(见表1)。同一样品DNA 在亚硫酸氢盐修饰前后分别用甲基化和非甲基化引物扩增,如修饰前无任何目的条带扩增而修饰后有目的条带扩增,则亚硫酸氢盐修饰完全。
PCR反应条件为:95℃预变性10min,95℃ 45s,30s退火(各退火温度见表1),72℃ 1min,40个循环,最后72℃延伸10min。每个标本均进行甲基化和非甲基化两种情况的检测。52例标本中随机选取10%的标本进行重复试验。抽取无头颈系统疾病及肿瘤的正常人外周血,EDTA抗凝,提取外周血中有核细胞的DNA经(SssI)甲基化酶处理后作为甲基化分析的阳性对照,未经处理的正常人外周血DNA作为非甲基化的阴性对照,去离子水替代DNA模板的反应体系作为空白对照。

表1 喉鳞状细胞癌中TIMP3基因甲基化引物
1.3免疫组织化学方法检测TIMP3基因表达应用免疫组织化学SP法试剂盒(北京中杉金桥公司产品)检测TIMP3蛋白在LSCC和正常喉黏膜中的表达。石蜡标本常规4μm连续切片,常规脱蜡,梯度乙醇溶液水化。含3%过氧化氢的甲醇溶液封闭内源性过氧化物酶,双蒸水冲洗后,用柠檬酸盐缓冲工作液,高压锅喷气2min进行抗原修复。室温冷却,放以PBS缓冲液冲洗3次;加入10%羊血清后37℃反应45min;封闭非特异性抗原后,倾去血清,不水洗。滴加一抗,浓度按1:100稀释,4℃过夜。
PBS冲洗,5min×3次。滴加生物素标记的二抗工作液,37℃温箱内孵育30min。PBS冲洗,5min×3次。滴加辣根酶标记链酶卵白素工作液,37℃温箱内孵育30min。PBS冲洗,5min×3次。 DAB液显色。苏木素复染,常规梯度酒精脱水、二甲苯透明、中性树胶封片,显微镜下观察。实验设PBS代替一抗为空白对照,作为质量控制标准。TIMP3的阳性染色定位于细胞浆,以胞浆内出现均匀一致的棕黄色颗粒定义为阳性细胞。参照Fromowitz评分标准,随即选取5个高倍视野(×400)计数肿瘤细胞总数和阳性细胞数,得出阳性细胞百分率,当LSCC组织中存在不同分化程度的区域时,选择同一肿瘤组织切片中占优势分化程度的肿瘤区域进行计数统计,阳性细胞率≤25%记为0分,26%~50%为1分,51%~75%为2分,>75%为3分;再按多数阳性细胞呈现的染色强度予以记分:无显色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。将上述两项得分相加:0分判为“-”,1~2分判为“+”,3~4分判为“”,5~6分判为“”。
2结果
2.1LSCC组织中TIMP3基因甲基化状态用甲基化特异性引物(M)扩增,经SssI处理后的外周血DNA,得到预期大小的甲基化扩增片段,用非甲基化特异性引物(U)扩增正常人外周血DNA,得到预期大小的非甲基化扩增片段,而空白对照未得到反向产物,说明所用引物和试剂正确,实验结果可信。甲基化状态有3种情况:①如只有甲基化特异性引物(M)扩增出目的条带而非甲基化特异性引物(U)未扩增出目的条带,此情况为完全甲基化;②如甲基化特异性引物(M)未扩增出目的条带而非甲基化特异性引物(U)扩增出目的条带,此情况为非甲基化;③如甲基化特异性引物而非甲基化特异性引物均扩增出目的条带,此情况为不完全甲基化,结果统计时为甲基化[3]。PCR(MSP)结果发现见图1。52例LSCC组织中TIMP-3基因甲基化发生率为76.9%,而相应正常黏膜仅12例发生甲基化,差异有统计学意义(χ2=26.039,P=0.000);在LSCC中,男性和女性患者甲基化率分别76.1%和66.7%,Ⅰ、Ⅱ期甲基化率为69.2%,III、IV期甲基化率76.9%;<60岁与≥60岁患者LSCC组织中TIMP3基因甲基化率分别为81.2%和75%,LSCC患者性别、TNM分期及年龄的甲基化率比较均无统计学意义(P均>0.05);LSCC患者高、中、低分化癌组织中TIMP3基因甲基化率分别为50%、70.6%和90.5%,有、无淋巴结转移患者LSCC组织中甲基化率分别为59.1%和86.7%,不同分化程度及有无淋巴结转移的LSCC组织中甲基化率比较差异有统计学意义(P均<0.05),见表2。
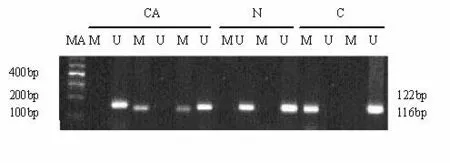
MA:100 bp Maker;CA:LSCC tissue;N:Normal tissue;C:Methylated and Unmethylated positive control
图1LSCC及正常黏膜组织中TIMP3基因的甲基化状态分析
2.2喉鳞状细胞癌组织中TIMP3蛋白表达TIMP3蛋白免疫组织化学染色为细胞浆呈棕黄色颗粒状,以出现均匀完整的胞浆着色定义为正常表达。胞浆表达减少或缺失定义为抑制表达见图2、图3。TIMP3在LSCC组织和癌旁非肿瘤组织中均有表达,TIMP3在LSCC组织中表达强度呈下降趋势,LSCC组织中TIMP3基因的蛋白表达率为34.6%,癌旁非肿瘤组织中TIMP3基因的蛋白表达率为76.9%,二者比较有统计学意义(P<0.01);<60岁与≥60岁患者LSCC组织中TIMP3基因的蛋白表达率分别为31.3%和40%;I、II期与III、IV期组织中TIMP3基因的蛋白表达率分别为48.7%和38.5%,高、中、低分化癌组织中TIMP3基因的蛋白表达率分别为42.9%,41.2%和23.8%,而患者不同年龄、性别、TNM分期、肿瘤分化程度的蛋白表达率比较均无统计学意义(P>0.05);有无淋巴结转移患者LSCC组织中蛋白表达率分别为23.3%和54.5%,二者比较有统计学意义(P<0.05)。
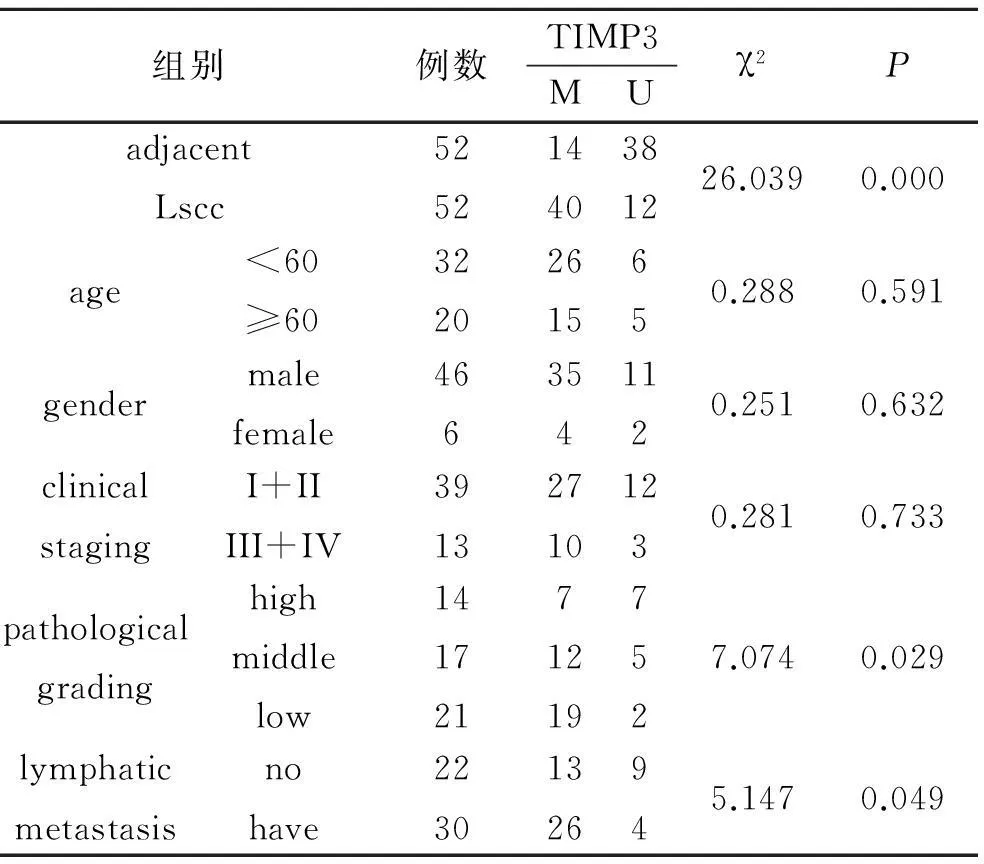
表2 喉鳞状细胞癌患者 TIMP3基因启动子区甲基化情况

图2 癌旁正常黏膜TIMP3蛋白呈阳性表达(×200)
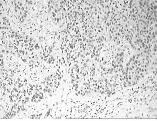
图3 癌组织TIMP3蛋白呈阴性表达(×200)
2.3TIMP3基因启动子甲基化与TIMP3蛋白表达缺失的关系LSCC组织中TIMP3基因甲基化阳性组中,蛋白表达阳性率为42.5%(17/40),TIMP3基因甲基化阴性组蛋白表达阳性率为58.2%(7/12),LSCC组织甲基化阳性与甲基化阴性者RKIP基因蛋白表达阳性率比较无统计学意义(χ2=0.510,P>0.05) 。

表3 喉鳞状细胞癌患者TIMP3基因蛋白表达情况
3讨论
TIMPs家族有4个成员,按照被发现的顺序依次命名为TIMP-1、TIMP-2、TIMP-3和TIMP-4[4]。TIMP-3是家族中最特殊的一个成员,它主要定位结合于组织的细胞外基质层中。TIMP-3是唯一的全功能MMPs抑制因子,能够抑制膜结合的MMPs分子以及跨膜的MMPs分子,此外还抑制多种切割酶活性,例如抑制TNF-a转换酶[TACE(tumor necrosis factor-a-converting enzyme)and ADAM-17(ADAM metallopeptidase domain 17)]参与调控TNF-a介导的炎症[5,6]。TIMP-3还能够抑制细胞表面多种分子及受体的脱落,如L-selectin、syndecansl4、IL-6受体,c-MET和胰岛素样生长因子结合蛋白3、5等[5]。近年来,TIMP-3一直被认为是一个肿瘤抑制因子,它在多种肿瘤组织中表达降低或缺失。
目前已确认,启动子区CpG岛高甲基化是造成与肿瘤发生相关的一些抑癌基因失活,使其转录沉默影响基因正常表达,从而导致肿瘤发生发展的重要分子生物学机制[7];研宄发现,TIMP-3的启动子甲基化导致的表达缺失与多种肿瘤的不良预后相关,例如肾癌、胶质瘤、结肠癌、非小细胞肺癌及脑膜瘤等[8~10]。本研究发现,TIMP3基因在LSCC组织中的甲基化率为76%,显著高于癌旁肿瘤组织的甲基化率24%。因此认为,TIMP3基因的甲基化参与了喉鳞状细胞癌的发生,为了进一步探讨TIMP3基因启动子区甲基化在喉鳞状细胞癌中的作用,笔者仍将TIMP3基因的甲基化率与LSCC患者各临床资料如年龄、性别、有无淋巴结转移、TNM分期、病理学分级联合分析,发现其甲基化率与患者的性别、年龄及TNM分期均无关系。分析原因可能是TIMP3基因甲基化或LSCC的早期发生事件,与LSCC的进程无关。而同时研究发现,TIMP3基因的甲基化率与LSCC的病理分级和有无淋巴结转移有关,说明TIMP3的高甲基化率增加了肿瘤的恶性程度,促进了肿瘤的转移,可能与LSCC的预后有关。因此,TIMP3基因甲基化可以作为LSCC恶性程度评估和判断预后的参考指标。Sun W等人[11]在头颈部肿瘤中的研究发现TIMP-3与头颈部肿瘤的复发有很大关系,但他并没有与患者的各临床资料进行联合分析。
本实验运用免疫组织化学染色法发现LSCC组织中TIMP3 蛋白表达率显著低于癌旁非肿瘤组织,但在LSCC中甲基化与蛋白表达相关性研究发现,喉鳞状细胞癌组织甲基化阳性TIMP-3基因蛋白表达与甲基化阴性TIMP3基因蛋白表达比较无统计学意义(P>0.05)。Jiang-Liu Yu[12]等研究发TIMP-3基因在胃癌中的蛋白表达明显下降,而在癌旁正常组织和对照组正常人中蛋白呈高表达,并且与胃癌的体积大小、组织学分型、淋巴结有无转移、浸润深度、远处转移及临床分期有关;本实验应用免疫组织化学染色法发现,有淋巴结转移的癌组织TIMP3蛋白表达率显著低于无淋巴结转移(P<0.05) ,与文献报道基本一致。
TIMP3从乳腺癌cDNA文库中被克隆出来,主要表达于软骨、胎盘滋养层、各种上皮及妊娠后期的肌肉中,能抑制MMP1、2、3和9的活性,是全功能的MMP抑制剂,对MMP2、MMP9、胶原酶1和基质溶解素的抑制作用相似[13]。TIMP3在多种组织如心脏、脑、肺、肾脏、胎盘和子宫中都有表达[14]。并在许多肿瘤细胞中可见到TIMP3表达的下降和缺失[15~17]。牛桂莲等[18]构建了全长TIMP3cDNA的真核表达载体, 用脂质法转入具有高转移性的肺巨细胞系(BE1)中, 发现转染后的BE1细胞与母系细胞和空载体对照组细胞相比, 体外侵袭力降低, 在裸鼠体内成瘤率降低, 而且转移至肺和淋巴结的能力降低, 表明特异性上调TIMP3基因的表达可以在一定程度上逆转细胞的恶性表型。笔者认为,TIMP3抑制LSCC的侵袭和转移, 除了抑制大多数MMP外, 还在于其参与ECM重塑的调节, 维持ECM的完整性, 而且TIMP3有抗肿瘤血管生成的作用, 这些条件都阻碍了LSCC的侵袭和转移。最近研究发现,TIMP3可以诱导许多细胞凋亡, 包括体外培养的肿瘤细胞, 而TIMP1、TIMP2及合成MMP抑制剂无此作用, 表明TIMP3既可通过抑制MMP的活性又可直接诱导LSCC细胞凋亡, 从而抑制其转移。
但是,从TIMP3基因启动子甲基化与TIMP3蛋白表达缺失的关系研究来看,两者并没有相关性,分析可能与实验方法或样本量有关,有待于今后进一步研究。
参考文献
[1]Murphy G,Reynolds JJ.Hembry RM,et al.Metallopmteinases and cancer invasion and metastasis[J].Int J Cancer,1989,44:757-760
[2]Fang J,Shing Y,Wiederschain D,et al.Matrix metalloproteinase-2 is required for the switch to the angiogenic phenotype in a tumor mode[J].Proc Natl Acad Sci USA,2000,97(8):3884-3889
[3]Glickman JF, Flynn J, Reich NO. Purification and characterization of recombinant baculovirus-expressed mouse DNA methyltransferase[J]. Biochem Biophys Res Commun, 1997, 230(2) : 280 -284
[4]RaVi Kanth W, Naqeshwar Reddy D. Role of matrix metalloproteinases in physiological processes & disease[J]. Indian J Med Res, 2014, 140(5): 585-587
[5]Bruschi F, Pinto B. The significance of matrix metalloproteinases in parasitic infections involving the central nervous system[J]. Pathoqens, 2013, 2(1): 105-129
[6]Gill SE, Gharib SA, Bench EM, et al. Tissue inhibitor of metalloproteinases-3 moderates the proinflammatory status of macrophages[J]. Am J Respir Cell Mol Biol, 2013, 49(5): 768-777
[7]Das SK, Bhutia SK, Sokhi UK, et al. Raf kinase inhibitor RKIP inhibits MDA-9/syntenin-mediated metastasis in melanoma[J]. Cancer Res, 2012, 72( 23) : 6217-6226
[8]Destouches D, Huet E, Sader M,et al. Multivalent pseudopeptides targeting cell surface nucleoproteins inhibit cancer cell invasion through tissue inhibitor of metalloproteinases 3 (TIMP-3) release[J]. J Biol Chem, 2012, 287(52): 43685-43693
[9]Tam KW, Zhang W, Soh J, et al. CDKN2A/p16 inactivation mechanisms and their relationship to smoke exposure and molecular features in non-small-cell lung cancer[J]. J Thorac Oncol, 2013, 8(11): 1378-1388
[10]Lyu T, Jia N, Wang J, et al. Expression and epigenetic regulation of angiogenesis-related factors during dormancy and recurrent growth of ovarian carcinoma[J]. Epiqenetics, 2013, 8(12): 1330-1346
[11]Sun W, Zaboli D, Wang H, et al. Detection of TIMP3 promoter hypermethylation in salivary rinse as an independent predictor of local recurrence-free survival in head and neck cancer[J]. Clin Cancer Res, 2012, 18(4):1082-1091
[12]Jiang-Liu Yu,Ping Lv,Jing Han,et al.Methylated TIMP-3 DNA in Body Fluids Is an Independent Prognostic Factor for Gastric Cancer[J].Arch Pathol Lab Med,2014,138(11):1466-1473
[13]Eng Z, Sun Y, Shu W, et al. Tissue inhibitor of metalloproteinase-3 is a basement membrane-associated protein that is significantly decreased in human colorectal cancer[J]. Dis Colon Rectum, 2001, 44(9): 1290-1296
[14]Simon Kaja, Jill D, Hilgenberg, et al. Detection of novel biomarkers for ovarian cancer with an optical nanotechnology detection system enabling label-free diagnostics[J]. J Biomed Opt, 2012, 17 (8): 081412
[15]Wu BK, Brenner C. Suppression of TET1-dependent DNA demethylation is essential for KRAS-mediated transformation[J]. Cancer Rep, 2014, 9 (5): 1827-1840
[16]YanD, Chen D, Hawse JR, et al. Bovine lactoferricin induces TIMP-3 via the ERK1/2-Sp1 axis in human articular chondrocytes[J]. Gene, 2013,517(1): 12-18
[17]Wanq J, Wanq R, Lu Y, et al. Anatomical analysis on the lateral bone window of the sella turcica: a study on 530 adult dry skull base specimens[J]. Int J Med Sci, 2014, 11(2): 134-141
[18]牛桂莲, 方伟岗, 郑杰. TIMP-3 基因转染抑制人肺癌细胞系侵袭与转移的研究[J]. 中华病理学杂志, 1998, 27(6): 421-424
(2015-07-25收稿)(岳静玲编辑)
