产β-葡萄糖苷酶芽孢杆菌Z-1的筛选、鉴定及其酶学特性研究
2016-01-10李红亚李术娜朱宝成
■王 全 李红亚 李术娜 王 会 朱宝成
(1.河北农业大学生命科学学院,河北保定 071001;2.衡水市农机管理总站,河北衡水 053000)
β-葡萄糖苷酶(β-glucosidase),又称β-D-葡萄糖苷葡萄糖水解酶,别名龙胆二糖酶、纤维二糖酶和苦杏仁苷酶,属于水解酶[1]。它能够水解结合于末端非还原性的β-D-葡萄糖苷键,同时释放出β-D-葡萄糖和相应的配基[2]。
1837年,Liebig等首次在苦杏仁中发现β-葡萄糖苷酶。后来的研究发现,β-葡萄糖苷酶存在于自然界许多植物、昆虫、酵母、曲霉、木霉及细菌体内。它参与生物体的糖代谢,对维持生物体正常生理功能起着重要作用[3]。研究发现,β-葡萄糖苷酶能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖,参与EMP糖酵解途径,是参与双歧杆菌糖代谢的有关酶系之一[4]。
纤维是动物吃进体内的植物无法消化的部分,为不可吸收的多糖类[5-6]。同时它可促进肠道蠕动,降低食物的滞肠时间,促进排便,但牛等动物自身不能产生纤维素酶,不能很好的吸收[7-10]。而在纤维素糖化过程中,β-葡萄糖苷酶的功能是将纤维二糖和纤维寡糖水解形成葡萄糖,动物更能充分地利用葡萄糖,从而促进动物生长。以往文献报道的产β-葡萄糖苷酶菌株多为霉菌,如黑曲霉。但是菌株的产酶活性会随着时间的增长而降低,不利于储存。本试验旨在筛选出高活性的产β-葡萄糖苷酶的芽孢杆菌菌株,并围绕该菌株的产酶活性及酶学特性进行考察,利用其在亲核试剂间催化转移糖苷的作用添加到饲料中,提高饲料消化率和利用率,促进动物营养的消化吸收、提高动物的饲料转化率、防病和促进生长的作用,同时为今后开发安全、稳定、有效的微生态制剂的工业化生产奠定基础。
1 材料与方法
1.1 培养基及配制
LA培养基:950 ml蒸馏水中加入胰蛋白胨10 g、酵母膏5 g、氯化钠10 g、摇匀溶解,定容到1 000 ml,pH值7.0。
LB培养基:LA培养基+Amp。
PDA培养基:称量去皮马铃薯200 g,将马铃薯切成小块,放入锅中,加水1.00 L,煮沸30 min。用纱布滤去马铃薯残渣。将马铃薯滤液放回锅中,加入琼脂20.00 g,加热熔化。加入葡萄糖20.00 g。葡萄糖溶解后,加入适宜的水量以补充加热过程中损失的水分,定容至1.00 L(115℃蒸气灭菌20 min),pH值7.0。
NB培养基:蛋白胨1.0 g、牛肉膏0.30 g、氯化钠0.50 g、蒸馏水100 ml,pH值7.0。
七叶苷分离培养基:LA培养基+1.0 g七叶苷+0.50 g柠檬酸高铁铵(115℃蒸气灭菌20 min)。
发酵培养基:1.0%蛋白胨,0.50%酵母膏,0.50%氯化钠,Mandels微量元素盐溶液(七水合硫酸亚铁5.0 mg/l,一水合硫酸锰1.6 mg/l,七水合硫酸锌1.4 mg/l,氯化钴2.0 mg/l,加200.0 ml蒸馏水溶解pH值调至5.5,定容重1 000 ml),pH值自然。
以上培养基无特殊要求均在121℃,高压蒸汽灭菌20 min。
1.2 芽孢杆菌的筛选
1.2.1 产β-葡萄糖苷酶菌株平板的制作
称取从土壤中取得样品5.0 g于试管中并加入9.0 ml无菌水,在沸水中煮沸5 min,稀释土样,用移液枪分别取10-3、10-5、10-7g/ml稀释度,于七叶苷分离培养基中,37℃恒温平板倒置培养2~3 d。
1.2.2 产β-葡萄糖苷酶菌株的初筛
采用平板画十字的方法用灭菌竹签刮取少量菌株分别点接到依照上述方法制备的LA培养基平板上,37℃倒置培养2~3 d后观察结果。
1.2.3 产β-葡萄糖苷酶菌株的纯化
用灭菌的竹签挑起少量菌株划线于依照上述方法制备的PDA斜面培养基上,37℃培养2~3 d后观察菌的生长情况。
1.2.4 产β-葡萄糖苷酶菌株的复筛
用灭菌的竹签挑起PDA培养基上的少量菌,然后接种于装有50.0 ml发酵培养液的250 ml三角瓶中,37℃、200 r/min摇床振荡培养48 h。将发酵液于4℃、8 000 r/min离心10 min,所得上清液为粗酶液。
液体培养基,37℃、200 r/min摇床振荡培养;平板培养,37℃恒温平板倒置培养。将发酵液于4℃、8 000 r/min离心10 min,所得上清液为粗酶液。
1.2.5 标准曲线的绘制及酶活性测定
葡萄糖标准曲线的绘制:依次吸取10 mg/ml葡萄糖标准贮备溶液0、0.2、0.4、0.6、0.8、1.0 ml置于试管中,补加蒸馏水至1.0 ml,再加入1.0 ml DNS试剂,充分混合后沸水浴5 min,冷却后用蒸馏水稀释至10 ml,在540 nm波长处测定其吸光值[11]。
吸取0.500 ml一定稀释度的样品溶液,加入0.500 ml 0.5%的水杨苷(溶解于0.1 mol/l pH值4.8的醋酸缓冲液中),55℃保温20 min,再加入1.0 ml DNS试剂充分混合后沸水浴5 min,待冷却后用蒸馏水稀释至10 ml,在540 nm波长处测定其吸光值,以加热灭活的酶液按照同样方法处理作为空白。酶活定义为每小时由底物产生1 μmol还原糖(以葡萄糖计)所需的酶量为一个酶活单位(U)[12-13]。
1.3 酶学特性测定
1.3.1 酶最适温度
在35、40、45、50、55、60、65 ℃的不同温度下按常规DNS法测酶活,确定温度对酶活力的影响,然后在4℃和上述各温度下各保温1 h后,在35℃下测酶活,确定稳定性。
1.3.2 酶最适pH值
用 pH 值为 3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0的缓冲液配制水杨苷溶液,测酶活,确定最适pH值。又以不同pH值缓冲液1.500 ml中加0.500 ml粗酶液,在最适温度下保温1 h后,在最适温度下测酶活,以自然状态下的酶活为100%。
1.3.3 反应时间的影响
在最适温度最适pH值下,分别测反应时间为5、10、15、20、25、30、35、40、45、50、55 min下的不同酶活。
1.3.4 金属离子的影响
配制各种金属离子浓度为0.020 mol/l,使其反应终浓度为0.004 mol/l,在最适温度下保温1 h后测酶活,以未加金属离子的酶活为100%。
1.3.5 有机溶剂的影响
在酶用量和底物浓度均相同的反应体系中,添加不同的有机溶剂,使其终浓度为10%、20%、30%、40%、50%、60%,并以未添加有机溶剂为空白对照,在最适温度最适pH值下测酶活。
1.4 16S rDNA鉴定
1.4.1 细菌DNA的制备和扩增
将筛选出的芽孢杆菌接种于NB液体培养基中,37℃振荡培养18 h。取1.5 ml培养液与离心管中,12 000 r/min离心30 s,弃上清液,收集菌体进行DNA的制备和PCR扩增[14-15]。
1.4.2 扩增产物的电泳分析
以1倍TAE缓冲液配制1.0%琼脂糖凝胶。取PCR扩增产物5 μl,加入溴酚蓝指示剂,混匀后加样。100 V电泳30 min,溴化乙锭染色20 min,紫外灯下观察电泳结果[16]。
1.4.3 测序及序列比对
扩增储存鉴定细菌的16S rDNA片段,PCR产物送至上海生工生物工程股份有限公司进行纯化和测序后做Blast分析,并在GenBank(http://www.ncbi.nlm.nih.gov/blast)中比对,获得鉴定结果。
2 结果
2.1 形态特征
试验共筛选得到了15株疑似芽孢杆菌菌株,分别标记Z-1~Z-15,通过复筛得到5株活性较高的菌株分别为Z-1、Z-3、Z-4、Z-8、Z-15,其中活性相对最高的为Z-1。因此Z-1作为目的菌株做后续研究。Z-1的单菌落为圆形,乳白色,边缘整齐,表面有褶皱,隆起,不透明,革兰氏染色为阳性,杆状。
2.2 生理生化鉴定
对Z-1菌株进行生理生化性质测定,结果如表1所示。
经形态学及生理生化试验结果,参考伯杰细菌手册[17]可将Z-1菌株初步定为芽孢杆菌属(Bacillus app.)。
2.3 16S rDNA鉴定
分离菌株基因组DNA进行PCR扩增,PCR产物通过琼脂糖凝胶电泳进行检测(见图1)。由图1可知,分离的芽孢杆菌菌株得到一条清晰的条带,与Marker相比,所获得的扩增片段大小在长度为1 460 bp左右,说明所得PCR产物为目的产物,可以纯化后进行测序。将测得的序列与数据库中已注册的16S rDNA序列用BLAST程序进行序列相似性比较分析。将Genbank中与Z-1菌株相似性较高的8个菌株构建系统进化树,结果见图2和表2。

表1 Z-1菌株的生理生化鉴定
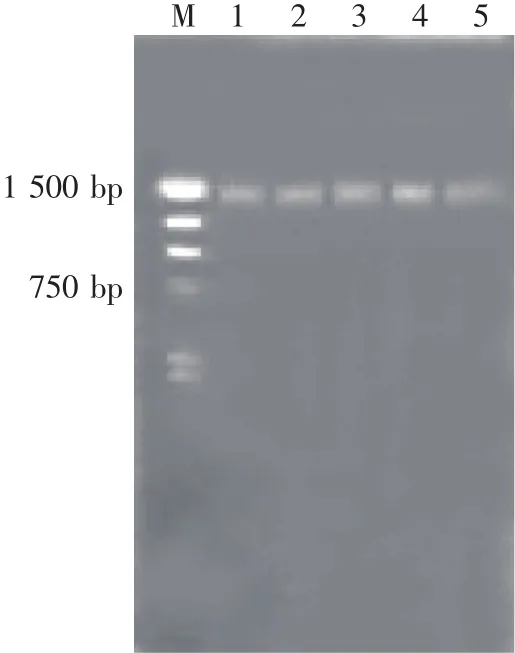
图1 PCR产物电泳图

图2 菌株Z-1的16S rDNA序列系统发育树的构建
供试菌株的16S rDNA序列与芽孢杆菌属的标准菌株同源相似度大部分在98%以上,初步将此菌株归为芽孢杆菌属,同时与标准菌株AB021198(Bacillus subtilis)的同源相似性最高,达99.49%,因此,根据16S rDNA序列相似性分析,鉴定此菌株为枯草芽孢杆菌(Bacillus subtilis)。16S rDNA序列相似度达99.49%。

表2 菌株Z-1与8种标准菌株的相似性比较
2.4 酶的最适温度及其热稳定性
在35~65℃下测定β-葡萄糖苷酶的活性见图3~图4。

图3 温度对β-葡萄糖苷酶活性的影响

图4 β-葡萄糖苷酶的热稳定性
在图3中可以观察出最适温度为50℃附近。在热稳定性的测定中,如图3可以看出,在低于55℃时酶活均在60%以上,且随温度升高酶的热稳定性下降。
2.5 酶的最适pH值及其酸碱稳定性
在pH值为3.0~12.0间测定酶的活性,见图5~图6。

图5 pH值对β-葡萄糖苷酶活性的影响

图6 β-葡萄糖苷酶的pH值稳定性
如图5中,酶的最适pH值在6.0~8.0之间。如图6当pH值达5.0~8.0时酶的稳定性较好均在80%以上,在碱性条件时,随pH值升高酶活降低,表明该菌产的酶不耐碱性。
2.6 反应时间对酶活性的影响
在5~55 min间测定β-葡萄糖苷酶的活性,如图7所示。
如图7中可知最适反应时间为35 min附近,且在35 min后趋于稳定。

图7 反应时间对β-葡萄糖苷酶活性的影响
2.7 金属离子对酶活性的影响(见表3)

表3 金属离子对酶活的影响
不同金属离子对酶活性的影响不同,其中有起激活剂的作用,也有起抑制剂的作用。
如表3中所示,Cu2+、Mn2+、Fe3+、Zn2+均明显地提高酶的活性,有激活作用;Fe2+、K+都明显的降低了酶的活性,起抑制作用。
2.8 有机溶剂对酶活性的影响
在甲醇、丙酮、乙醇、乙酸乙酯4种溶剂中,对酶活性的影响如图8所示。
如图8中所示,甲醇和乙酸乙酯对该酶促进作用影响较大,丙酮抑制作用较大,而乙醇的影响不明显。
3 讨论
目前,国内对黑曲霉中β-葡萄糖苷酶研究较多,但由于采用黑曲霉作为产酶菌株存在食品安全卫生方面的隐患,所以在食品加工中的应用受到限制。现在有研究选用德氏乳杆菌亚种进行β-葡萄糖苷酶的分离和纯化[18],并应用于大豆异黄酮的水解过程中,制备大豆异黄酮苷元。但是德氏乳杆菌以产乳酸为主,产β-葡萄糖苷酶活性较低。本试验从土壤中筛选出1株产β-葡萄糖苷酶高产菌株,进行16S rDNA鉴定,经过同源性比较分析确定为枯草芽孢杆菌,同源性达到99.49%。

图8 有机溶剂对β-葡萄糖苷酶活性的影响
对菌株Z-1进行酶学特性研究表明,Z-1菌株的最适温度在50℃附近,55℃以下时酶活均在60%以上;最适pH值在6~8之间;最佳反应时间在35 min附近;金属离子Cu2+、Mn2+、Fe3+、Zn2+有激活作用,而离子Fe2+、K+起抑制作用;有机溶剂甲醇和乙酸乙酯对该酶促进作用影响较大,丙酮抑制作用较大,而乙醇的影响不明显。本试验筛选出的Z-1菌株为1株芽孢杆菌,利用芽孢杆菌的抗逆性为以后的生产、保存奠定了基础。
4 结论
本试验通过初筛复筛得到了1株活性较高的产β-葡萄糖苷酶的芽孢杆菌菌株。经16S rDNA序列同源性进行比较分析,最终鉴定为枯草芽孢杆菌,为β-葡萄糖苷酶的应用和开发提供更广阔的空间。
