A族链球菌M蛋白相关疫苗的研究进展
2015-12-28关晓菲综述马翠卿审校
袁 婷,关晓菲(综述),马翠卿(审校)
(河北医科大学基础医学院免疫学教研室,河北省重大疾病免疫机制及干预重点实验室,河北石家庄050017)
A族链球菌M蛋白相关疫苗的研究进展
袁 婷,关晓菲(综述),马翠卿*(审校)
(河北医科大学基础医学院免疫学教研室,河北省重大疾病免疫机制及干预重点实验室,河北石家庄050017)
酿脓链球菌;疫苗;综述文献
A族链球菌(group A streptococcus,GAS)也称化脓性链球菌,是最常见的也是致病性最强的革兰阳性菌之一,其可以引起多种感染性疾病如扁桃体炎、急性咽炎、喉炎、风湿热、猩红热及严重的毒性休克综合征。值得关注的是GAS感染后还可以导致严重的变态反应性疾病如风湿性心脏病、急性肾小球肾炎等。国内外从来没有停止过对GAS疫苗的研究,主要聚焦于免疫原性强的M蛋白,现就以M蛋白为基础的疫苗研究进展综述如下。
1 GAS的流行病学
GAS广泛存在于自然界、健康人的咽喉部以及人和动物的粪便中,通过空气、皮肤接触等方式传播。据世界卫生组织报道,全球每年约有517 000例患者死于链球菌感染所致的各种疾病,其中约30%死于链球菌的侵袭性感染,近70%死于链球菌感染后所致的风湿热、风湿性心脏病、急性肾小球肾炎等疾病[1]。我国广东省、吉林省、浙江省、湖北省及重庆市学龄儿童GAS年平均感染率为50%,部分农村地区GAS感染率高达70%~80%,GAS上呼吸道感染导致的风湿性心脏病在5个省市儿童中平均发病率达22/10万[2]。
目前,治疗GAS感染的主要措施为应用抗生素如青霉素、大环内脂类药物,或静脉注射免疫球蛋白。虽然没有报道显示GAS对青霉素有耐药性,但相关研究证实青霉素在GAS咽炎的治疗中失败率达20%~40%[3]。而对大环内酯类敏感的GAS会利用生物膜形成隔离,成为逃避抗生素治疗的机制从而在宿主体内残留[4]。严重的GAS侵袭性感染,如链球菌毒性休克综合征和坏死性筋膜炎,静脉内注射免疫球蛋白以促进调理吞噬作为辅助治疗手段,收到一定的疗效,但免疫球蛋白的弊端是只能提供短期保护。就目前形势来看,GAS感染已成为临床治疗中的棘手问题。所以,对于GAS的有效防治,除了控制传染源外,应用疫苗成为最有效的措施。
2 GAS疫苗中有效成分的选择
关于GAS疫苗的研究是基于链球菌的各种蛋白及成分,如M蛋白、C5a肽酶、外毒素B、A族碳水化合物、链球菌纤连蛋白结合蛋白1(streptococcal fibronectin binding protein 1,Sfb1)、血清不透明因子(serum opacity factor,SOF)和纤连蛋白结合蛋白54(fibronectin binding protein 54,FBP54)等构建并制备的亚单位疫苗,但因各种原因,迄今为止仍然没有安全有效的GAS疫苗供人类使用[5-6]。最近一个时期,对GAS疫苗的研制进入了新时代。通过计算机辅助,利用反向疫苗学、蛋白质组学、生物信息学、全基因测序和DNA微阵列等先进技术,能快速发现并推断毒力因子、表面相关蛋白和可能的候选疫苗。但GAS疫苗的发展仍然面临着挑战性。导致这一现象的原因可归结为3个:①GAS的血清型众多,而它们之间又很少存在交叉,很难制备针对所有流行菌株的疫苗;②缺乏合适有效的动物模型加以评价也是限制疫苗发展的原因之一;③在GAS疫苗应用中,最大的障碍是GAS某些免疫原性强的表面蛋白如M蛋白,与人体组织蛋白存在交叉反应,使得疫苗的应用面临着诱发自身免疫病的风险。20世纪60年代末期,在使用天然的M蛋白制备疫苗试验中发现[7],接种疫苗组较对照组儿童风湿热的发病率明显增加。但是,其他GAS蛋白亚单位疫苗所诱发的免疫应答及预防作用都不及M蛋白,故到目前为止,M蛋白依然是GAS亚单位疫苗研究的重要的备选蛋白,但显然对于GAS疫苗的研究策略有待改善。
3 M蛋白
M蛋白是GAS所有血清型都表达的一个重要致病因子。它是GAS细胞壁的蛋白抗原成分,以二聚体形式存在,由2条多肽链复合成一条α-螺旋卷曲固定在细胞表面,每条多肽链包含多达4个重复区域(记为A~D)。C-端为高度保守区,N-端通常是由一个高变区A区和一个半可变区B区构成(图1)。
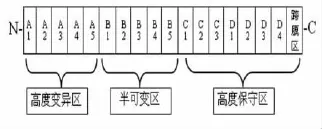
图1 M蛋白结构示意图
M蛋白是GAS抗吞噬作用的主要决定因素。基于M蛋白高变区的抗原特异性(Lancefield血清学分类法),已经确定的M蛋白血清型至少有150种。M蛋白不同区段的抗原异质性使其呈现出不同的功能,M蛋白的N端高变区可结合H因子、H因子样蛋白和C4bp结构,C-端保守区也可结合H因子,这些因子均是经典补体途径的调节因子,有助于抗吞噬作用,故GAS通过M蛋白结合补体调节蛋白以干扰补体介导的调理吞噬作用。另外,M蛋白的许多血清型的B区都可结合纤维蛋白原,同样有助于抗吞噬作用。
4 M蛋白相关疫苗
由于M蛋白有较好的免疫原性和免疫保护性,可刺激机体产生保护性抗体,成为了疫苗研究的重点。M蛋白的抗原决定簇与人体多种组织抗原存在交叉性,包括心脏、骨骼肌球蛋白、原肌球蛋白、层黏连蛋白和角蛋白等[8]。研究[9]发现,M蛋白的调理表位与自身免疫性表位是分隔开的,大多数组织的交叉性表位被定位在B区、A-B侧翼区或B-C侧翼区,而在A区和C区中存在着与人体组织交叉反应同时又可以诱导机体产生调理性抗体的表位。据此,利用基因重组技术,M蛋白相关疫苗的研究有3个策略:①以多种血清型M蛋白N-端可变区片段为基础制备多价多肽疫苗;②以M蛋白C-端保守区保护性表位为基础制备多价多肽疫苗;③M蛋白融合其他蛋白的多肽疫苗。
4.1 基于M蛋白N-端的相关疫苗 M蛋白N-端可变区具有能够激发产生最大杀菌活性抗体的表位,并且几乎没有与人体组织蛋白发生交叉反应的表位,所以对于该种疫苗的研究备受追捧。Kotloff等[10]成功重组构建了含有M24、M1、M3、M5、M6和M19蛋白血清型N-端片段的基因序列,该疫苗的动物实验显示,免疫血清中含有相应GAS血清型的调理性抗体,表明该抗体在大多情况下是针对M蛋白保护性抗原表位所产生的。该种疫苗的Ⅰ期试验结果显示6价M蛋白血清型片段所诱导的抗体滴度显著增加,同时未检测到该抗体与人体组织存在交叉反应。在此基础上,由美国ID Biomedical Corporation公司研制出了26价多肽疫苗[11],采用明矾佐剂免疫家兔,可产生特异性血清IgG抗体,在临床Ⅰ期试验中观察到该疫苗具有良好的免疫原性及显示出良好的安全性。美国2000-2004年5 400例GAS侵袭性感染病例中,分离出的79%的血清型与该26价疫苗一致[12],提示该疫苗所包含的表位广泛分布于该地区流行的链球菌菌株表面,揭示了该疫苗具有应用于该地区临床的可能性。近日,Dale等[13]基于北美和欧洲时下流行的GAS血清型成功制备出30价疫苗,用此疫苗免疫家兔可得到能调理该30种血清型的抗血清。然而该疫苗的30种血清型仅能覆盖马里和南非GAS感染血清型中的40%和59%。由此可见,该种疫苗制备方法也存在弊端,M蛋白血清型众多,不可能构建一种疫苗可包含所有血清型,这就要求根据某一地区、某一时段GAS的流行趋势选取相应血清型设计疫苗,而该种疫苗只能对当地GAS感染有效,而且一旦流行菌株发生变化或出现新的菌株则保护效果大大降低。
4.2 基于M蛋白C-端的相关疫苗 到目前为止,已经有多种方法针对M蛋白C-端保守区保护性表位制备相关GAS疫苗。第1种方法是合成了4个涵盖M6蛋白C-端重复区的重叠肽。使用该多肽滴鼻免疫Swiss CD1小鼠后,再用同源M6和异源M14 GAS分离株分别鼻内攻击小鼠[14],结果显示GAS咽部定植均显著减少。第2种方法是合成了M5蛋白C-端重复区的2种多肽。通过动物实验的主动免疫和被动免疫发现[15],针对M5多肽的血清IgG水平升高,但却无法在体外诱导调理吞噬作用。第3种方法是通过识别M5蛋白C-端重复区内的T、B细胞表位,构建了长度为55个氨基酸的序列(StreptInCor)。对BALB/c小鼠皮下接种,StreptInCor和完全弗氏佐剂/不完全弗氏佐剂共同给予,结果发现可以诱导高滴度的血清IgG[16]。第4种方法是从M5蛋白C-端筛选出一段20个氨基酸的多肽(P145),并通过实验衍生出2个序列,即含有M蛋白保守的B细胞表位及不与人体发生交叉反应的T细胞表位,分别命名为J8和J14。研究证明,J8和J14可以诱导小鼠血清特异性Ig G和Ig A[17]水平增高。第5种方法是基于M蛋白C-端重复区序列制备活疫苗。首先对CD1小鼠鼻内免疫接种表达M6蛋白C-端重复序列的牛痘病毒,再进行同源M6和异源M14 GAS分离株的鼻内攻击,结果显示可显著减少GAS咽部定植。乳酸乳球菌是一种肠道共生菌群,也被用来作为活疫苗的载体,携带M6蛋白C-端重复区编码的基因序列,对CD1小鼠行鼻内免疫接种该活疫苗后,导致唾液Ig A和血清IgG水平增高[18]。
4.3 M蛋白融合其他蛋白的多肽疫苗 FbaA(an Fn-binding protein expressed on the surface of GAS)是2001年发现的GAS表面的一种相关蛋白,具有较好的免疫原性,可诱发与M蛋白相当的保护性免疫应答,且Fba A蛋白在不同的GAS血清型中有很高的同源性。将纯化的Fba A蛋白和M蛋白分别皮下免疫小鼠,2组的血清Ig G水平相似且Fba A免疫组的保护效果仅次于M蛋白免疫组,差异无统计学意义[19-20]。近期该课题组,利用噬菌体肽库及单克隆抗体技术筛选出7个Fba A优势表位,通过PCR技术将该表位同中国南方地区流行的4个GAS血清型的M蛋白相融合,构建出含有7个Fba A优势表位和5个M蛋白片段的GAS疫苗(F7M5)。其中包括的5个M蛋白片段分别来自M1、M3、M6、M18的N端和C端的共同保守序列J14,将此多肽疫苗免疫小鼠,结果显示小鼠血清Ig G水平相较单纯应用上述5个血清型的多肽疫苗显著升高。攻毒试验显示F7M5蛋白免疫组的保护率明显高于其他对照组。表明该种融合疫苗诱导了较高的抗体水平和较好的保护率[21]。
5 展 望
在过去的几十年里,对GAS疫苗的研究取得了很大进展,研究者除了研究以M蛋白为基础的疫苗外,还把目光投到其他可能蛋白上,如C5a肽酶[22]、精氨酸脱亚胺酶[23]、链球菌分泌酯酶[24]、链球菌血红素蛋白受体[25]等,但目前仍没有安全有效的商用疫苗问世。总之,GAS疫苗研制中的一些影响因素需要综合考虑,包括GAS血清型的地理分布差异、该抗原包含自身免疫表位的可能性、人类疫苗佐剂的选择、设计合理有效的实验动物模型等。就我国GAS疫苗研究领域而言,GAS相关流行病学资料的不足也是影响疫苗研发制备的因素。
[1] Bisno AL,Rubio FA,Cleary PP,et al.Prospects for a group A streptococcal vaccine:rationale,feasibility,and obstacles--report of a National Institute of Allergy and Infectious Diseases Workshop[J].Clin Infect Dis,2005,41(8):1150-1156.
[2] 饶栩栩,黄震东,岑润超,等.我国风湿性心脏病的流行现状[J].中华心血管病杂志,1998,26(2):98-100.
[3] Pichichero ME,Casey JR.Systematic review of factors contributing to penicillin treatment failure in Streptococcus pyogenes pharyngitis[J].Otolaryngol Head Neck Surg,2007,137(6):851-857.
[4] Baldassarri L,Creti R,Recchia S,et al.Therapeutic failures of antibiotics used to treat macrolide-susceptible Streptococcus pyogenes infections may be due to biofilm formation[J].J Clin Microbiol,2006,44(8):2721-2727.
[5] Courtney HS,Hasty DL,Dale JB.Serum opacity factor(SOF)of Streptococcus pyogenes evokes antibodies that opsonize homologous and heterologous SOF-positive serotypes of group A streptococci[J].Infect Immun,2003,71(1):5097-5103.
[6] Mcarthur J,Medina E,Mueller A,et al.Intranasal vaccination with the streptococcal fibronectin binding protein 1 Sfb1 fails to prevent growth and dissemination of Streptococcus pyogenes in a murine skin infection model[J].Infect Immun,2004,72(12):7342-7345.
[7] Massell BF,Honikman LH,Amezcua J.Rheumatic fever following streptococcal vaccination.Report of three cases[J].JAMA,1969,207(6):1115-1119.
[8] Cunningham MW.Autoimmunity and molecular mimicry in the pathogenesis of post-streptococcal heart disease[J].Front Biosci,2003,8:533-543.
[9] Samanidou VF,Nika MK,Papadoyannis IN.HPLC as a tool in medicinal chemistry for the monitoring of tricyclic antidepressants in biofluids[J].Mini Rev Med Chem,2008,8(3):256-275.
[10] Kotloff KL,Corretti M,Palmer K,et al.Safety and immunogenicity of a recombinant multivalent group A streptococcal vaccine in healthy adults.PhaseⅠtrial[J].JAMA,2004,292(6):709-715.
[11] Mcneil SA,Halperin SA,Langley JM,et al.Safety and immunogenicity of 26-valent group a streptococcus vaccine in healthy adult volunteers[J].Clin Infect Dis,2005,41(8):1114-1122.
[12] O′Loughlin RE,Roberson A,Cieslak PR,et al.The epidemiology of invasive group A streptococcal infection and potential vaccine implications:United States,2000-2004[J].Clin Infect Dis,2007,45(7):853-862.
[13] Dale JB,Penfound TA,Chiang EY,et al.New 30-valent M protein-based vaccine evokes cross-opsonic antibodies against non-vaccine serotypes of group A streptococci[J].Vaccine,2011,29(46):8175-8178.
[14] Bessen D,Fischetti VA.Influence of intranasal immunization with synthetic peptides corresponding to conserved epitopes of M protein on mucosal colonization by group A streptococci[J].Infect Immun,1988,56(10):2666-2672.
[15] Bronze MS,Courtney HS,Dale JB.Epitopes of group A streptococcal M protein that evoke cross-protective local immune responses[J].J Immunol,1992,148(3):888-893.
[16] Guilherme L,Postol E,Freschi De Barros S,et al.A vaccine against S.pyogenes:design and experimental immune response[J].Methods,2009,49(4):316-321.
[17] Batzloff MR,Hartas J,Zeng W,et al.Intranasal vaccination with a lipopeptide containing a conformationally constrained conserved minimal peptide,a universal T cell epitope,and a self-adjuvanting lipid protects mice from group A streptococcus challenge and reduces throat colonization[J].J Infect Dis,2006,194(3):325-330.
[18] Mannam P,Jones KF,Geller BL.Mucosal vaccine made from live,recombinant Lactococcus lactis protects mice against pharyngeal infection with Streptococcus pyogenes[J].Infect Immun,2004,72(6):3444-3450.
[19] Ma CQ,Li Ch,Wang XR,et al.Similar Ability of Fba A with M Protein to elicit protective immunity against group a streptococcus challenge in mice[J].Cell Mol Immunol,2009,6(1):73-77.
[20] 李彩虹,马翠卿,王锦,等.A族链球菌表面新发现蛋白Fba真核表达质粒的构建及其诱导的免疫应答[J].中国免疫学杂志,2007,23(9):835-838.
[21] Ma C,Liu Z,Li W,et al.Fba A-and M protein-based multiepitope vaccine elicits strong protective immune responses against group A streptococcus in mouse model[J].Microbes Infect,2014,16(5):409-418.
[22] Park HS,Cleary PP.Active and passive intranasal immunizations with streptococcal surface protein C5a peptidase prevent infection of murine nasal mucosa-associated lymphoid tissue,a functional homologue of human tonsils[J].Infect Immun,2005,73(12):7878-7886.
[23] HEnningham A,Chiarot E,Gillen CM,et al.Conserved anchorless surface proteins as group A streptococcal vaccine candidates[J].Mol Med(Berl),2012,90(10):1197-1207.
[24] Liu M,Zhu H,Li J,et al.Group A Streptococcus secreted esterase hydrolyzes platelet-activating factor to impede neutrophil recruitment and facilitate innate immune evasion[J].PLoS Pathog,2012,8(4):e1002624.
[25] Huang YS,Fisher M,Nasrawi Z,et al.Defense from the group A streptococcus by active and passive vaccination with the streptococcal hemoprotein receptor[J].J Infect Dis,2011,203(11):1595-1601.
(本文编辑:赵丽洁)
R378.12
A
1007-3205(2015)01-0103-05
2014-05-15;
2014-07-11
国家自然科学基金资助项目(30901350);河北省自然基金资助项目(H2012206076)
袁婷(1988-),女,河北廊坊人,河北医科大学基础医学院医学硕士研究生,从事感染免疫研究。
*通讯作者。E-mail:macuiqing@sina.com
10.3969/j.issn.1007-3205.2015.01.041
