反应条件对配体交换法制备纳米粒子的影响及其在比色检测中的应用
2015-12-25杨冬
杨 冬
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
反应条件对配体交换法制备纳米粒子的影响及其在比色检测中的应用
杨冬
(陕西科技大学 化学与化工学院, 陕西 西安710021)
摘要:纳米粒子具有极高的比表面积、过剩的表面自由能,极易相互靠近产生团聚,对纳米粒子进行表面修饰及生物功能化是其在生物医药领域应用的前提条件.利用Au-S间的强亲合性,可在CTAB-Fe3O4/Au纳米粒子表面发生配体交换反应,制备MUA-Fe3O4/Au纳米粒子,而配体交换反应条件对表面修饰效果可产生直接影响.本文对比了两种不同反应条件制备的MUA-Fe3O4/Au纳米粒子的胶体分散稳定性,并在表面偶联兔IgG,构建得到了两种免疫探针,且在液相体系中检测对应的羊抗兔IgG抗体.结果表明,长时(24 h)水浴超声反应可以得到更好的配体交换效果,且在比色检测中具有更高的灵敏度和更快的检测速度.
关键词:配体交换法; 分散稳定性; 比色检测; 金磁纳米微粒
0引言
贵金属纳米粒子,尤其金、银纳米粒子,其富集的表面等离子体与光辐射共振时,会产生强的光吸收和散射,被称为表面等离子体共振(Localized Surface Plasmon Resonance, LSPR)现象[1].基于这种LSPR现象,可将标记有生物分子的贵金属纳米粒子用于液相体系中靶标物的检测,即比色检测.将纳米粒子用于生物标记前,要求纳米粒子必须具有良好的水分散稳定性及适于下游应用的表面特性,因此对纳米粒子表面进行修饰是生物医药领域应用的前提[2].
配体交换法是指用与纳米粒子表面亲合作用更强的配体分子取代表面原有吸附分子,从而为纳米粒子提供新的表面基团或更好的分散稳定性的方法.该种方法具有灵活、便利的特点.由于Au-S的强亲合力,基于配体交换,巯基化分子已被广泛用于Au纳米粒子的表面修饰及表面功能化[3].
金磁纳米微粒(以下简称“金磁微粒”)是指具有金壳磁性核心的复合纳米粒子,由于兼具纳米金的独特光学性质及磁性粒子在外加磁场中的磁响应性,因而在多个领域诸如磁性分离与纯化、生物传感、免疫检测及磁导靶等中的应用具有潜在可能性[4].由于金磁纳米微粒的复杂表面特性及高表面能,在生物标记过程中易产生团聚,进而发生沉降,限制了更深层次的应用.在前期工作中,本研究已经采用配体交换法得到了分散稳定性良好的金磁微粒.本文则通过实验和理论相结合方法,分析了配体交换法的反应条件对纳米粒子的分散稳定性的影响,并将制备的纳米粒子应用于液相体系中蛋白质分子的比色检测.
1实验部分
1.1试剂与仪器
(1)主要试剂:碳二亚胺(EDC,Sigma-Aldrich);CTAB-Fe3O4/Au纳米粒子(实验室自制);巯基化十一烷酸(MUA,Sigma-Aldrich);兔IgG(RIgG,杰一生物技术有限公司);羊抗兔IgG(GAR-IgG,杰一生物技术有限公司);羊抗鼠IgG(GAM-IgG,杰一生物技术有限公司).
(2)主要仪器:磁力搅拌器(德国IKA);超声波清洗机(宁波新芝技术有限公司);透射电子显微镜(TEM H600型,日本日立);紫外可见分光光度计(UV-Vis UV-2550型,日本岛津);激光动态光散射仪(DLS ZS-nano型,英国Malvern);X射线光电子能谱(XPS ESCAPH1600型,美国Physical Electronics);移液器(德国Eppendorf).
1.2配体交换法制备MUA-Fe3O4/Au纳米粒子
MUA溶液的配制:准确称取0.436 0 g的MUA,置于100 mL烧杯中,加入50 mL乙醇溶解,将溶液转至100 mL容量瓶中,用乙醇清洗烧杯三次后将乙醇倒入容量瓶中,最后定容至100 mL,室温下放置备用,现用现配.
方法1:取1 mL的CTAB-Fe3O4/Au纳米粒子溶液(2.5 mg/mL),加入100μL、200μL及300μL的MUA溶液(20 mM)超声并搅拌24 h.
方法2:取1 mL的CTAB-Fe3O4/Au纳米粒子溶液(2.5 mg/mL),加入100μL、200μL及300μL的MUA溶液(20 mM),60 ℃水浴超声30 min,冷却至室温再超声反应3 h.
反应结束后,磁性分离去上清,洗涤三次,除去多余的MUA分子,以1 mmol/L的MUA溶液重悬,并避光保存.
1.3表面特性及稳定性表征
将纳米粒子溶液过夜干燥,制得粉末状样品,采用XPS分析,表征纳米粒子表面元素组成及元素价态,用以判断配体交换反应所得纳米粒子的表面组成.
将上述两种方法制备得到的纳米粒子,包括MUA1-Fe3O4/Au纳米粒子和MUA2-Fe3O4/Au纳米粒子等,分别加入2 mL的溶液中,包括有超纯水、NaCl溶液(I=20 mmol/L,pH 7.0)及PB×1(pH 7.2)缓冲液等,静置过夜后,采用UV-Vis光谱扫描其特征峰位的变化,以确定其稳定性及表面特性.
1.4比色检测研究
将1 mg的纳米粒子加入1×PB缓冲液中平衡,加入20μL的EDC (5 mg/mL,现用现配)溶液活化20 min,加入RIgG反应1 h.为防止非特异性作用的发生,偶联反应结束后,以封闭缓冲液反应1 h,然后进行磁性分离,弃去上清,洗涤两次,将偶联得到的免疫探针重悬1×PB缓冲液(含有1% 的BSA),于4 ℃保存备用.取反应前抗体溶液,及反应后磁分得到的上清液和第一次的洗涤液,分别测定其蛋白含量,计算偶联率.
将标记RIgG的免疫探针加入到含有对应抗体GAR-IgG的系列溶液中,其浓度为10~100 nmol/L,于37 ℃摇床温育30 min,观察溶液颜色,并以UV-Vis测定其LSPR峰位的变化,确定检测灵敏度.为检测特异性,可在对照组实验中加入GAM-IgG,同样地观察溶液颜色及检测LSPR峰位的变化.
2结果与讨论
2.1形貌表征和表面特性分析
配体交换法进行表面修饰的原理可参考前期研究工作.采用表面活性剂CTAB预分散的纳米粒子具有单纯的Fe3O4@Au核壳结构[5],如图1(a)所示,其DLS分析如图1(b)所示,其平均水合粒径为32 nm,表面电荷量为22.5±4 mV.

(a)TEM照片
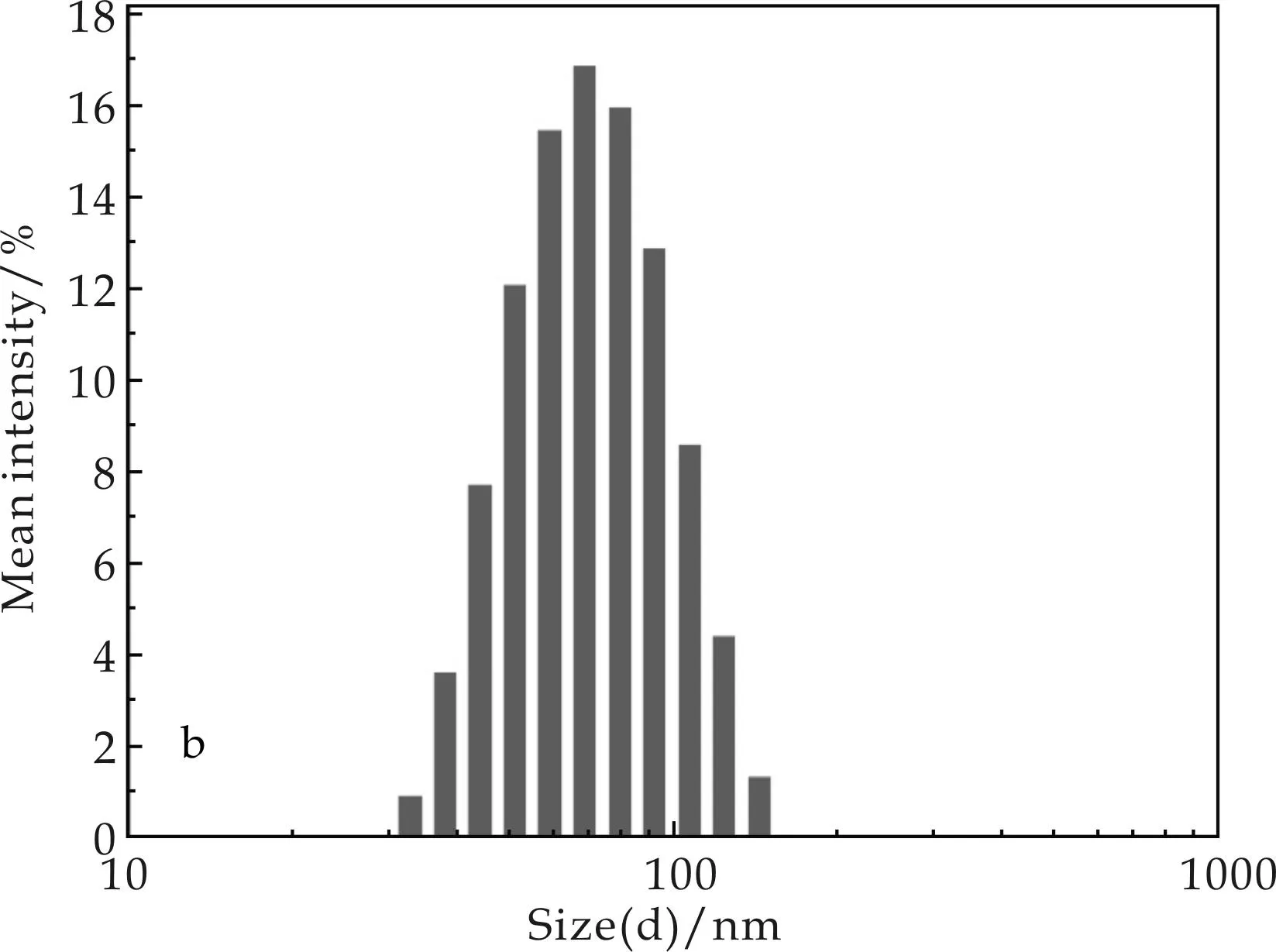
(b)粒径分布图图1 CTAB-Fe3O4/Au纳米粒子的表征结果
CTAB对Au纳米粒子和Au纳米棒的稳定机理已经得到比较广泛地认可[6].即CTAB在负电荷表面的Au纳米粒子和Au纳米棒表面形成双层结构,这是因为CTAB具有C16的疏水碳链以及带有正电荷的亲水极性头,而Au纳米粒子和Au纳米棒表面带有负电荷,所以极性头与材料表面直接通过静电作用结合,疏水链段重叠,将另一层CTAB分子的极性头指向溶液,从而起到了很好的稳定作用.

(a)UV-Vis吸收光谱
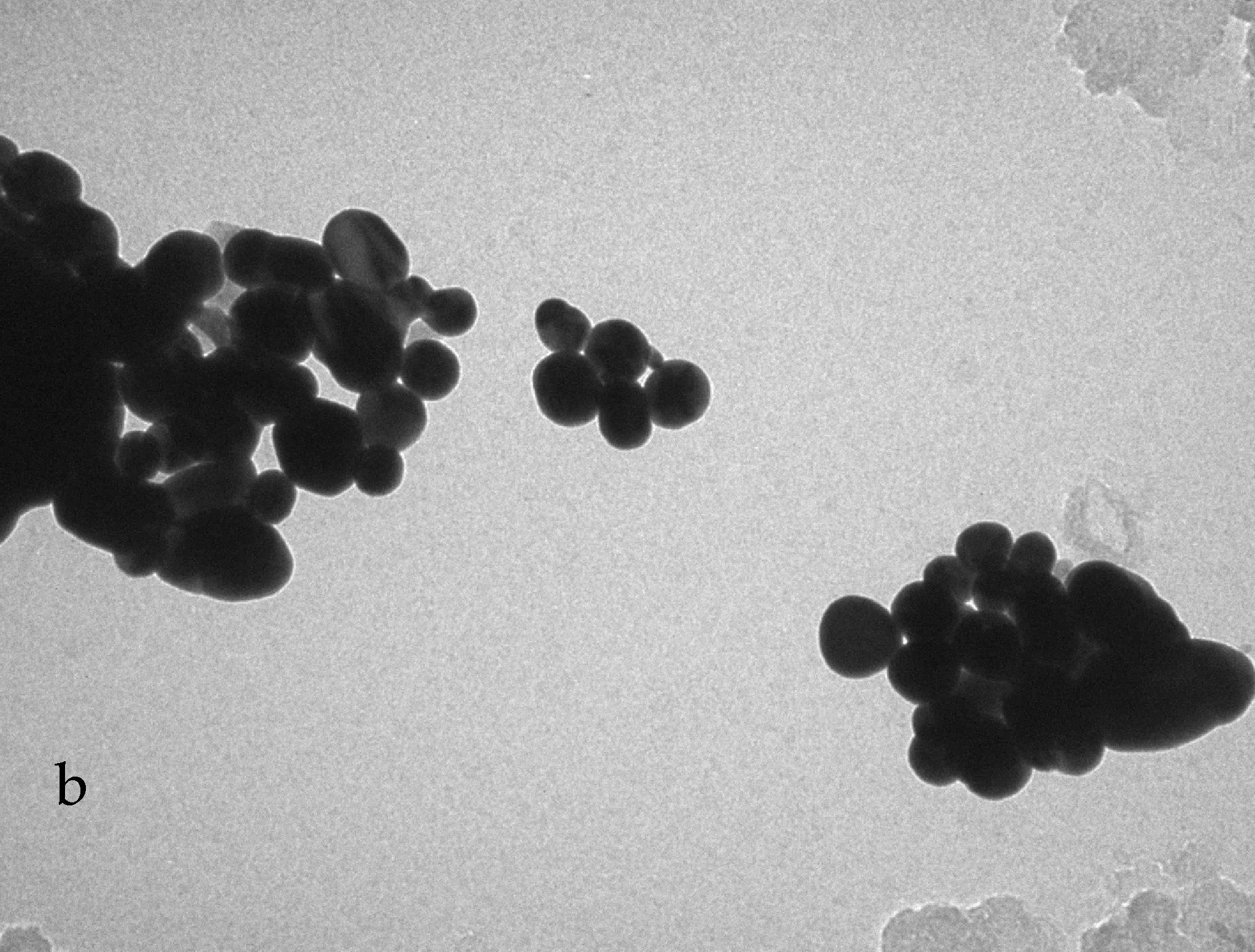
(b)洗涤三次后的TEM照片图2 CTAB-Fe3O4/Au纳米粒子受洗涤作用的影响
由于复合微粒的表面Au壳的存在,CTAB-Fe3O4/Au纳米粒子的LSPR特征峰位于532 nm处(如图2所示),其峰位不但与纳米粒子的分散性有关,还与纳米粒子表面的状态有直接关系.但这种以表面活性剂修饰得到的纳米粒子并不能满足后续应用的要求.当遇到多次洗涤(n≥3)时,CTAB易从纳米粒子表面被洗脱,这是因为CTAB在核壳Fe3O4/Au纳米粒子表面的吸附与溶液中游离的CTAB分子处于动态平衡[7],当溶液中的游离CTAB大大减少时,吸附于纳米粒子表面的CTAB就会发生脱附,重新进入溶液中,以建立新的相平衡状态,从而导致了纳米粒子表面CTAB的吸附量下降、表面荷电量下降、静电斥力受到破坏,进而引起纳米粒子的团聚.在洗涤过程中,用UV-Vis扫描CTAB-Fe3O4/Au纳米粒子的可见吸收光谱可知,随着洗涤次数的增加,会表现出峰强下降(如图2所示).当洗涤次数超过三次时,峰强急剧下降,其峰位也会红移向长波方向,这表明纳米粒子的稳定性下降及单分散纳米粒子数目的减少,即团聚体的产生.
生物及医药领域适用的纳米粒子,往往需要在生理缓冲液中保持良好的分散性及稳定性.巯基化试剂可与Au形成牢固的结合作用.为引入合适的生物分子偶联位点,巯基化试剂除含有S的一端可与Au表面产生更强的作用力外,另一端往往为功能化基团,其便于后续生物分子的引入.因此,可采用配体交换法对CTAB-Fe3O4/Au纳米粒子进行表面修饰,以增加纳米粒子的稳定性及引入合适的生物偶联位点,从而探索反应条件对配体交换效果的影响,以制备出最适用于液相体系比色检测用的金磁复合微粒.
巯基化十一烷酸(MUA)用于配体交换反应常见报道[8,9],其配体交换的反应条件选定为两种:第一种方法是长时的水浴超声,而第二种方法为短时高温超声后再常温下反应3 h.图3所示为两种反应条件下制备的MUA-Fe3O4/Au纳米粒子的TEM照片,其复合微粒呈球状,分散性良好,平均粒径为42 nm.

(a)方法1

(b)方法2图3 两种配体交换法制备的MUA-Fe3O4/Au纳米粒子的TEM照片
配体交换反应中,针对MUA的用量进行了优化.在1 mL反应体系中分别加入100μL、200μL及300μL的MUA溶液(20 mmol/L).反应结束后,用UV-Vis光谱扫描(如图4所示).结果表明,在两种反应条件下,当CTAB-Fe3O4/Au纳米粒子中加入200μL的MUA时,其光强最大且特征峰位最小,可得到最佳的反应产物.
相对于方法2制备得到的MUA2-Fe3O4/Au纳米粒子,方法1的反应产物中出现了少量的黑色沉淀,且MUA1-Fe3O4/Au纳米粒子的吸收峰强度显著减少,其特征峰峰位却并未产生明显的红移.这表明长时水浴超声会导致一部分纳米粒子出现团聚,但未团聚的纳米粒子在溶液中依然具有良好的分散稳定性.

(a)方法1
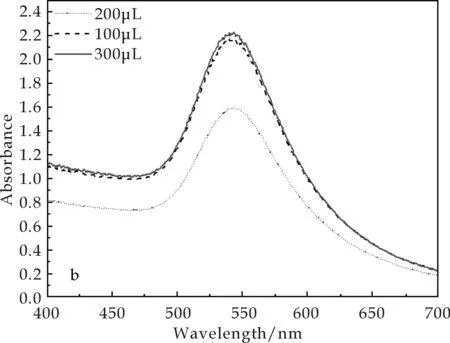
(b)方法2图4 不同MUA溶液加入量制备得到的MUA-Fe3O4/Au纳米粒子的UV-Vis光谱
为表征MUA与纳米粒子表面发生的相互作用,可将制备的MUA-Fe3O4/Au纳米粒子溶液置于外加磁场中,磁性分离去除上清,再重悬于水溶液中,重复洗涤过程三次;将固体纳米粒子过夜干燥,采用XPS来分析纳米粒子表面的特征基团及表面元素价态含量.
如图5所示,配体交换反应后,MUA-Fe3O4/Au纳米粒子的XPS图谱上出现了S2p谱峰(162.0 eV),表明在纳米粒子表面的确有巯基吸附,且形成Au-S键,产生了化学吸附;N1s峰(402.05 eV)在MUA-Fe3O4/Au纳米粒子的XPS谱图上并没有消失,只是显著减弱,说明这种配体交换反应是部分交换.针对S2p与N1s元素分析的结果表明, MUA1-Fe3O4/Au纳米粒子的S∶N=53∶47,而MUA2-Fe3O4/Au纳米粒子的S∶N=37∶43,其配体交换的程度不相同.
如图6所示,将制备的MUA-Fe3O4/Au纳米粒子加入中性缓冲液及盐溶液静置过夜后,采用UV-Vis扫描光谱,观察其光吸收强度及特征峰位的变化.从图6可以看出,配体交换后的纳米粒子在缓冲液中可以保持良好的分散稳定性,但分散于盐溶液中,出现了光强大幅减小,峰形展宽且特征峰位红移的现象,这表明纳米粒子已经产生了团聚.因此,配体交换得到的纳米粒子仅适用于缓冲液分散体系,这对于后续生物分子在缓冲体系中的偶联是十分有利的.

图5 配体交换前后CTAB-Fe3O4/Au纳米粒子与MUA-Fe3O4/Au纳米粒子的XPS图谱

图6 MUA-Fe3O4/Au纳米粒子分散于不同溶液中的UV-Vis光谱
2.2MUA-Fe3O4/Au纳米粒子在比色检测中的应用
MUA-Fe3O4/Au纳米粒子表面具有的羧基为后续生物功能化提供了偶联位点,通过EDC作为连接子,可将蛋白质、抗体及胺基化分子偶联在金磁微粒的表面,构建适用于蛋白质分子检测用的MUA-Fe3O4/Au纳米探针.
如图7所示,MUA1-Fe3O4/Au纳米粒子在偶联抗体IgG前后,其平均粒径从87 nm增大到106 nm;MUA2-Fe3O4/Au纳米粒子的粒径从86 nm 增大到101 nm.两种方法制备的纳米粒子粒径相差不大,而偶联后的粒径却出现了5 nm的差异,这与其偶联量的差异有关.
以Lowry法来进行蛋白质定量[10],对比偶联前后溶液的上清中的蛋白质含量的变化,即可得到偶联率.其计算方法为:

偶联量=偶联率×mprotein
其中:Apre、Apost、Awash分别为偶联前、偶联后及清洗液上清中的蛋白质定量的光吸收度;mprotein为加入蛋白质的质量.

(a)方法1

(b)方法2图7 两种方法制备的MUA-Fe3O4/Au纳米粒子的粒径分布图
计算结果表明,MUA1-Fe3O4/Au纳米粒子偶联兔IgG的偶联量可以达到58μg/mg粒子,而相同条件下,MUA2-Fe3O4/Au纳米粒子为34μg/mg粒子,兔IgG的平均分子量为160 KDa,是纳米级的大分子.因此,偶联后粒径的增大与兔IgG在表面上的偶联差异是相符的[11-13].
MUA-Fe3O4/Au-兔IgG探针的免疫活性,可通过在液相中与对应的抗体,即羊抗兔IgG(GAR-IgG)发生反应,而引起探针溶液颜色的变化或出现特征峰位移动而得到印证[14,15].在液相中,羊抗兔IgG分子与所有抗体类似,具有Y型结构,Y型的两个顶点是对应抗原的结合区域.当标记于Fe3O4/Au纳米粒子表面上的羊抗兔IgG分子遇到抗原兔IgG时,由于抗原抗体作用,每个兔IgG分子会特异性地结合两个羊抗兔IgG-金磁免疫探针,得到微粒-抗体-二抗-抗体-微粒的交联产物,由于抗体分子也介于纳米尺度,从而Fe3O4/Au纳米粒子得以靠近、团聚、产生LSPR变化,或者溶液的颜色由酒红色转变为蓝紫色.当溶液中不含有对应的抗原时,如含有BSA或者鼠IgG时,无法形成交联产物,Fe3O4/Au纳米粒子无法靠近,不会产生LSPR变化,其溶液的颜色也会保持酒红色不变.

(a)MUA1-Fe3O4/Au-RIgG探针
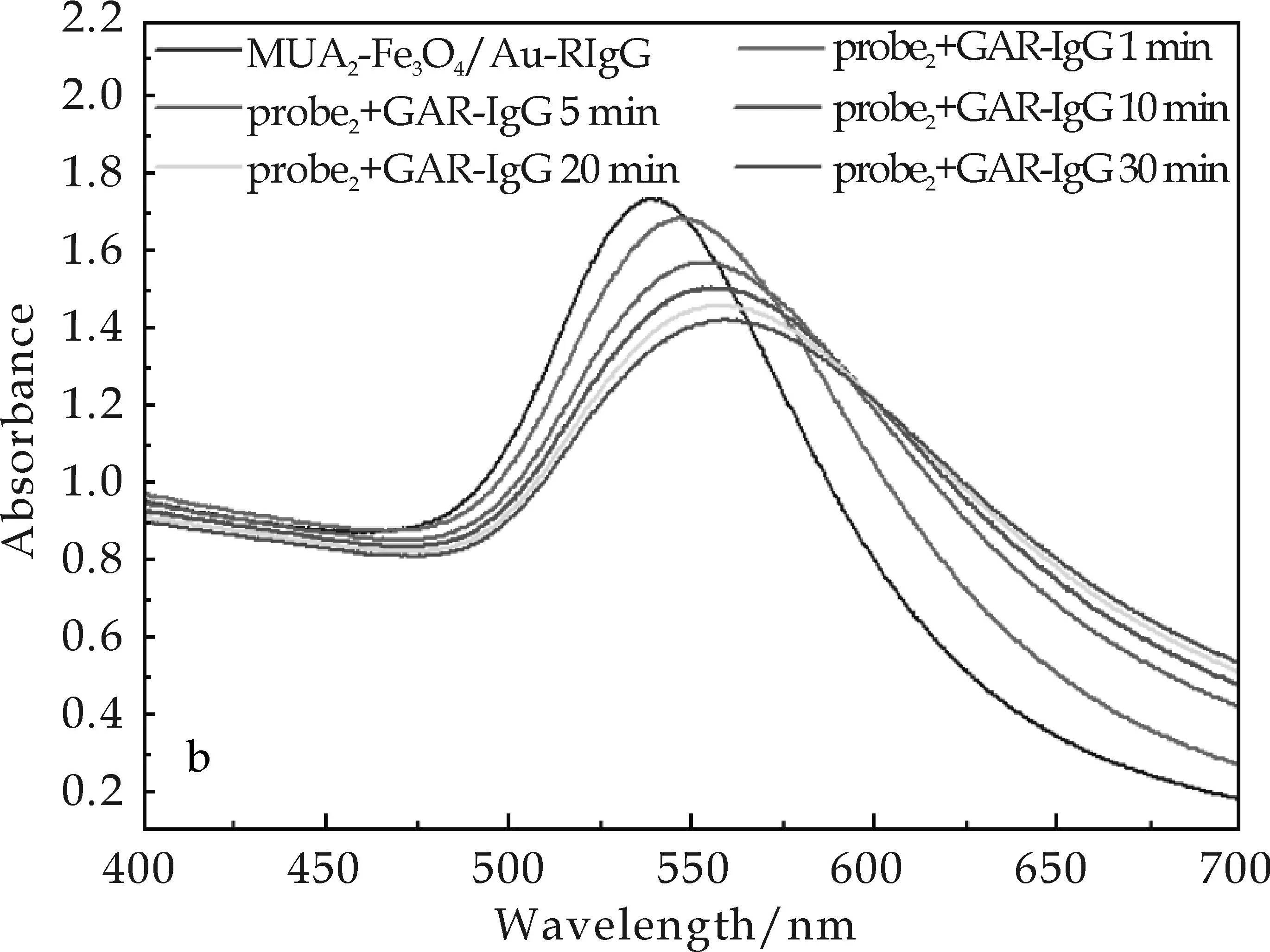
(b)MUA2-Fe3O4/Au-RIgG探针图8 用于靶抗体GAR-IgG检测时扫描的系列UV-Vis光谱
Fe3O4/Au纳米粒子构建的免疫探针实现比色检测的反应灵敏度,可采用特征峰位的移动来判断.如图8所示,MUA1-Fe3O4/Au-兔IgG免疫探针与50 nmol/L的二抗羊抗兔IgG作用30 min,其特征峰位红移33 nm;而在相同的反应条件下,使用MUA2-Fe3O4/Au-兔IgG免疫探针时,其红移量为23 nm.可见,MUA1-Fe3O4/Au-RIgG免疫探针与抗原反应时表现出了更灵敏的反应[16,17].
为进一步证实这种LSPR峰位的移动的确来自于探针与待测物间的特异性交联反应,可在反应时设立的对照实验中,将另一种二抗羊抗鼠IgG(Goat Anti-mouse IgG,GAM-IgG)及牛血清蛋白(BSA)作为待检测物,分别与MUA1-Fe3O4/Au-兔IgG免疫探针及MUA2-Fe3O4/Au-兔IgG免疫探针发生作用.恒温反应30 min后,两种探针的特征峰未出现红移(如图9所示,为GAM-IgG作待测物时的检测结果),这表明两种抗体探针虽然具有不同的检测灵敏度,但与待测物的反应均是高度特异性的.
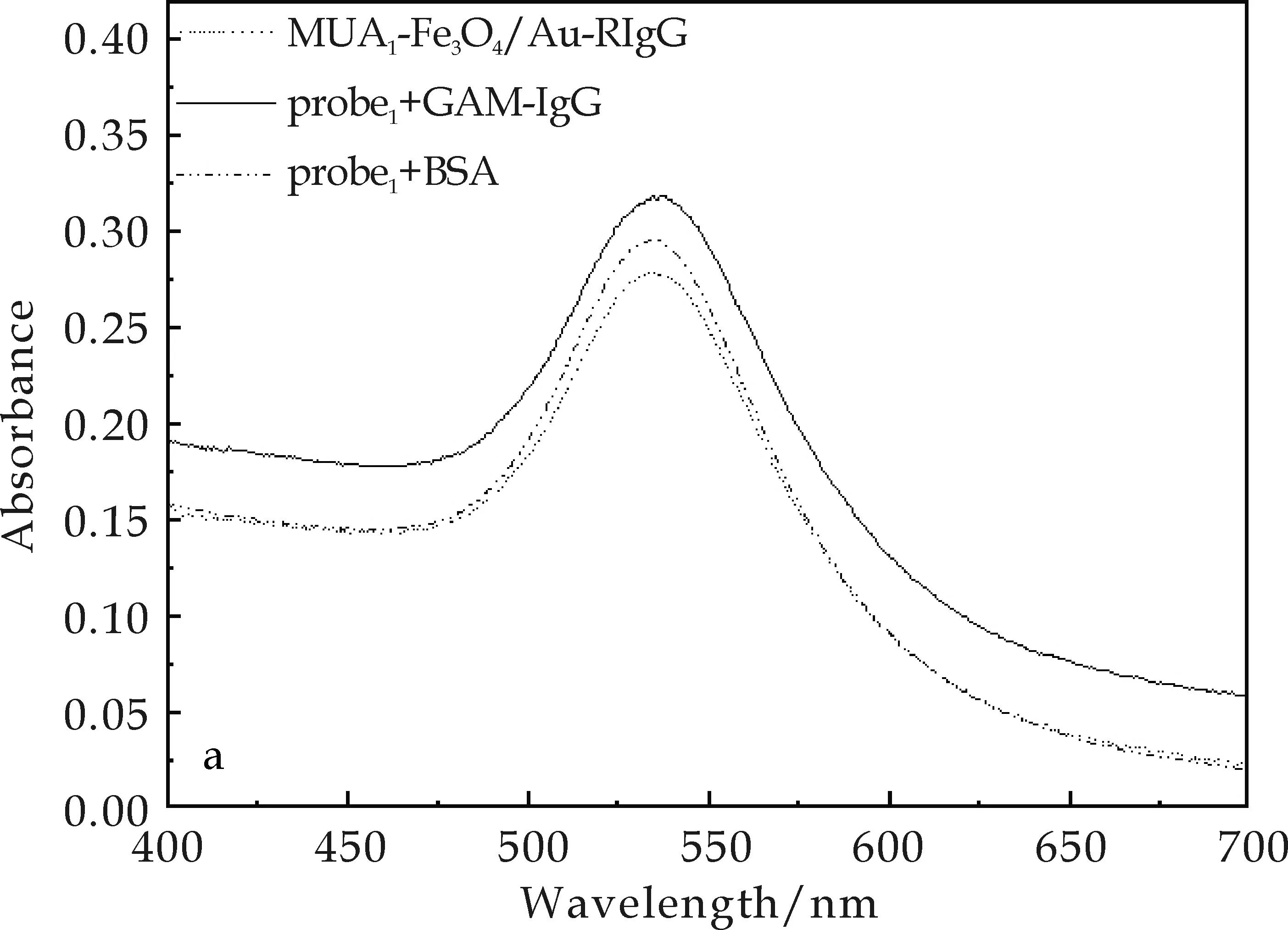
(a)MUA1-Fe3O4/Au-RIgG探针
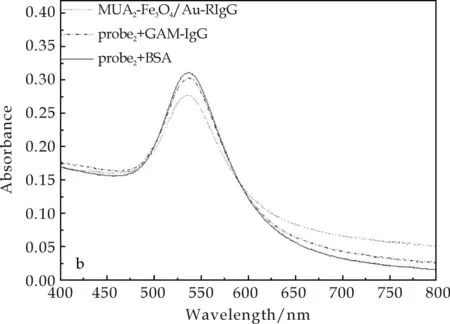
(b)MUA2-Fe3O4/Au-RIgG探针图9 用于特异性检测的UV-Vis光谱
3结论
配体分子MUA的引入,不但可以为纳米粒子提供偶联过程中的分散稳定性,而且表面羧基是后续生物分子偶联所需的功能化基团.由于金磁微粒的复杂表面特性,在进行配体交换反应时需要提供更多的能量及更长的反应时间.反应条件的不同导致了表面配体含量差异,24 h的水浴超声所得的纳米粒子表面可偶联更多的抗体分子,从而在后续靶抗体检测中得到了良好的检测特异性、更高的检测灵敏度及更快的检测速度.
参考文献
[1] Roy S,Dixit C K,Gandhiraman R,et al.Protein integrated,functionally active silver nanoplanar structures for enhanced SPR[J].The Journal of Physical Chemistry C,2013,117(6):3 078-3 083.
[2] Sperling R A,Parak W J.Surface modification,functionalization and bioconjugation of colloidal inorganic nanoparticles[J].Philosophical Transactions of the Royal Society A: Mathematical,Physical and Engineering Sciences,2010,368(1915):1 333-1 383.
[3] You H,Wang W,Yang S.A universal rule for organic ligand exchange[J].ACS Applied Materials & Interfaces.,2014,6(21):19 035-19 040.
[4] Chaffin E A,Bhana S,O Connor R T,et al.Impact of core dielectric properties on the localized surface plasmonic spectra of gold-coated magnetic core-shell nanoparticles[J].The Journal of Physical Chemistry B,2014,118(49):14 076-14 084.
[5] 杨冬,马建中,高敏,等.金磁纳米微粒表面蛋白偶联率的测定[J].陕西科技大学学报(自然科学版),2014,32(5):86-90.
[6] Smith D K,Miller N R,Korgel B A.Iodide in CTAB prevents gold nanorod Formation[J].Langmuir,2009,25(16):9 518-9 524.
[7] Smith D K,Korgel B A.The importance of the CTAB surfactant on the colloidal seed-mediated synthesis of gold nanorods[J].Langmuir,2008,24(3):644-649.
[8] Wijaya A,Hamad Schifferli K.Ligand customization and DNA functionalization of gold nanorods via round-trip phase transfer ligand exchange[J].Langmuir,2008,24(18):9 966-9 969.
[9] Saha A,Basiruddin S K,Pradhan N,et al.Ligand exchange approach in deriving magnetic-fluorescent and magnetic-plasmonic hybrid nanoparticle[J].Langmuir,2010,26(6):4 351-4 356.
[10] Winters A L,Minchin F R.Modification of the lowry assay to measure proteins and phenols in covalently bound complexes[J].Analytical Biochemistry,2005,346(1):43-48.
[11] Yuan W,Li C M.Direct modulation of localized surface plasmon coupling of Au nanoparticles on solid substrates via weak polyelectrolyte-mediated layer-by-layer self-assembly[J].Langmuir,2009,25(13):7 578-7 585.
[12] Liu X,Dai Q,Austin L,et al.A one-step homogeneous immunoassay for cancer biomarker detection using gold nanoparticle probes coupled with dynamic light scattering[J].Journal of the American Chemical Society,2008,130(9):2 780-2 782.
[13] Kaur K,Forrest J A.Influence of particle size on the binding activity of proteins adsorbed[J].Langmuir,2012,28:2 736-2 744.
[14] Yang D,Ma J, Gao M.Suppression of composite nanoparticle aggregation through steric stabilization and ligand exchange for colorimetric protein detection[J].RSC Advances,2013,3(25):9 681-9 686.
[15] Jiang T,Liu R,Huang X,et al.Colorimetric screening of bacterial enzyme activity and inhibition based on the aggregation of gold nanoparticles[J].Chemical Communication,2009(15):1 972-1 974.
[16] Yang D,Ma J,Peng M,et al.Building nano SPR biosensor systems based on gold magnetic composite nanoparticles[J].Journal of Nanoscience and Nanotechnology,2013,13:5 485-5 492.
[17] Liu J M,Li F M,Lin L P,et al.A colorimetric probe for online analysis of sulfide based on the red shifts of longitudinal surface plasmon resonance absorption resulting from the stripping of gold nanorods[J].Analytica Chimica Acta,2011,708:130-133
Effect of reaction condition on nanoparticles modified by
ligand exchange and application of nanoparticle
in colorimetric protein detection
YANG Dong
(College of Chemistry and Chemical Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Abstract:Because of high specific surface energy,particles with dimensions on the order of 10~100 nm are prone to form aggregations due to the ionic instability under physiological conditions,and hence specific surface modification is necessary.By Au-S bonding,we explored 11-mercaptoundecanoic acid (MUA) as ligand to partially exchange with cetyltrimethylammonium bromide (CTAB) absorbed on Fe3O4/Au surface,leading to an enhanced colloidal stability due to the electrostatic repulsion.However, reaction conditions directly effect on results of ligand exchange.Here we synthesize two kinds of MUA-Fe3O4/Au NPs under different reaction conditions.Based on the comparative investigations performed in this work,we conjugate rabbit IgG onto the surface of two kinds of particles to construct immunoassay probes.These two probes were then applied to detect target goat anti-rabbit IgG in solution based on LSPR property of gold magnetic nanoparticles.The results show that the probe synthesized by long time ultrasonic reaction revealed a higher sensitivity and faster detection speed.
Key words:ligand exchange; dispersion and stabilization; colorimetric detection; gold magnetic nanoparticles
中图分类号:O65
文献标志码:A
文章编号:1000-5811(2015)05-0082-07
作者简介:杨冬(1979-),女,河南郾城人,副教授,博士,研究方向:纳米生物化学分析方法
基金项目:国家自然科学基金青年项目(21505089); 陕西科技大学博士科研启动基金项目(BJ15-17)
收稿日期:*2015-05-06
